La lactosa es un disacárido presente en la leche de los mamíferos que supone la mayor fuente de hidratos de carbono durante la lactancia. Se sintetiza por acción de la lactosa sintetasa a partir de la glucosa en la glándula mamaria, y está formada por una molécula de glucosa y otra de galactosa unidas por un enlace β-1,4. La lactosa de la dieta se hidroliza a galactosa y glucosa por acción de una disacaridasa, la lactasa-floricina hidrolasa (LPH), una β-galactosidasa de 150kDa sintetizada en los enterocitos a partir de una proteína precursora de 220kDa tras un complejo proceso genético de trascripción, traducción y maduración. La LPH se ubica únicamente en el borde en cepillo (microvilli) de los enterocitos apicales de las vellosidades, lo que demuestra que sólo está presente en los enterocitos maduros, que migran desde las criptas con un ritmo de apoptosis de 48h. Su máxima expresión se encuentra en el yeyuno y el íleon proximal. Es una enzima multifuncional ya que participa en la hidrólisis, además de la lactosa, de otros sustratos como la lactosilceramina, la celobiosa y la cetroliosa. Existen otras dos β-galactosidasas localizadas en las lisozimas del citoplasma de los enterocitos, cuya función es desconocida ya que la membrana de la mucosa es prácticamente impermeable al paso de los disacáridos intactos.
En los animales, la actividad de la LPH es muy baja antes de nacer y aumenta espectacularmente en el momento del parto, permanece elevada hasta el momento del destete y en ese momento desciende a un 10 % de su actividad, permaneciendo así el resto de la vida. Este declive está causado por una interrupción en el complejo proceso genético responsable de la síntesis de LPH. Durante milenios, el ser humano, tras el destete, al igual que el resto de los mamíferos, ya no ingería más productos lácteos, y posteriormente, en esta época prehistórica, se limitaba a una alimentación a base de plantas, cereales salvajes, frutas y productos de la caza. Fue después, tras la revolución mesoneolítica, cuando el ser humano entra en la fase de producción con la agricultura y la ganadería, y comienza a ingerir productos lácteos después del destete, gracias al desarrollo de la “industria láctea” (granjas), cuyo origen se sabe que se dio en el Próximo Oriente en el quinto milenio a. de C. Filogenéticamente, lo normal sería que la especie humana dejase de tolerar la lactosa a partir del destete, al igual que todos los mamíferos; sin embargo, vemos que unos individuos son tolerantes a la lactosa y otros intolerantes a lo largo de toda su vida.
Fue en 1963 cuando se informó por primera vez de la clínica de la hipolactasia “tipo adulto”1. La prevalencia notificada de la intolerancia es elevada, con una variación geográfica amplia: el 10 % en países del norte de Europa, el 25 % en Estados Unidos, alrededor del 50 % en el área mediterránea y centro Europa, y superior al 70 % en Asia y África. En 2002, Enattah et al2 identificaron el polimorfismo C/T-13910 del gen de la lactasa mediante estudio genético molecular. La correspondencia homocigota en los alelos de las bases pirimidínicas citosina/citosina (C/C en la secuencia de nucleótidos de posición 13910) sería lo “normal” y su presencia estaría unida a la no persistencia de lactasa, y muy unida al fenotipo de intolerantes. Una alteración en la secuencia 13910, con sustitución en uno o en los dos alelos de la citosina por la timina, daría lugar a las secuencias de nucleótidos C/T y T/T y estaría ligada a la persistencia de lactasa y la correspondiente tolerancia del sustrato. Similar, aunque no en perfecta asociación, se ha encontrado recientemente para el polimorfismo G/A-22018 del mismo gen. La secuencia del nucleótido 22018 con guanina/guanina (G/G) pertenecería a los homocigotos, mientras que su sustitución por adenina, con secuencias G/A y A/A, daría lugar a sujetos lactasa-persistentes3. Se ha calculado que un coeficiente de selección sobre una mutación inicial de 0,03, actuando sobre un período de siete milenios, sería suficiente para justificar la alta frecuencia de individuos capaces de digerir la lactosa con un polimorfismo C/T-13910. No se conoce la implicación y correlación exactas de estos hallazgos. La edad de manifestación de la intolerancia en los C/C-13910 varía tremendamente según los estudios (rango entre 2 y 20 años) dependiendo en parte de la metodología empleada para el diagnóstico y de la etnia estudiada, lo que crea una cierta discordancia entre el genotipo determinado precozmente y la manifestación clínica del fenotipo4–6. El hallazgo de grupos africanos altamente tolerantes, pero con el genotipo C/C-13910, nos obliga a ser prudentes en la interpretación de los hallazgos del genotipo7, y muchos autores creen que se trata de marcadores de un posible fenotipo que se desarrollará en algún momento de la vida, pero que no son los responsables de la expresión o no de la lactasa8. Nuestros estudios mediante el test del hidrógeno espirado (Breath H2Test) demuestran una prevalencia de intolerancia a la lactosa en niños de 10 años del 13 %, y del 38 % en adultos de más de 40 años9, prevalencia similar a la notificada por otros estudios4,6. En niños y adolescentes estudiados en nuestro país se ha encontrado una distribución polimórfica del 72,4 % para C/C, del 21,6% para C/T y del 6 % para T/T4. Como vemos, la cifra del 72 % para homocigotos lactosa-no persistentes no se relaciona con el fenotipo de intolerantes en época adulta, cuya cifra se sitúa alrededor del 40 %.
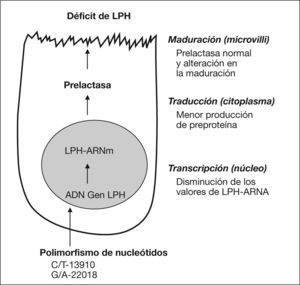
En este declive se han implicado diferentes alteraciones en las vías moleculares de la producción de LPH: una reducción del ácido ribonucleico mensajero (ARNm) responsable de la síntesis de la LPH (LPH-ARNm), o bien, en la síntesis de proteína precursora de la LPH (alteración en la transcripción), un enlentecimiento en la producción de LPH (alteración en la traducción) y una disminución del número de enterocitos fabricantes (alteración en la maduración) (fig. 1). En muestras de mucosa intestinal estudiadas, la LPH-ARNm se correlaciona con los valores de actividad de lactasa; no obstante, en un cierto número de sujetos se han evidenciado valores elevados de LPH-ARNm y valores bajos de actividad. Muestras tomadas de un mismo intestino y de una misma vellosidad pueden diferenciarse en los valores de lactasa y de LPH-ARNm. Estas heterogeneidades se han observado según el grupo étnico estudiado, lo que podría conllevar la teoría de que en un grupo se ve afectada la transcripción y en otros la traducción o incluso la maduración10.
La prueba utilizada más ampliamente en la actualidad para valorar la absorción de lactosa es el test del hidrógeno espirado. Los resultados obtenidos estarán en función de la cantidad de sustrato empleado. La cantidad empleada de 2g de lactosa/kg en solución acuosa al 20 % (máximo, 50g) para la antigua prueba de sobrecarga de lactosa, y posterior determinación de glucemia establecida por Littman 1965, se ha continuado manteniendo por parte de algunos autores. Consideramos que dicha cantidad es excesiva, pues equivale a la ingesta de aproximadamente 1l de leche, y además en condiciones no fisiológicas, dado que no está en unión con los otros nutrientes de la leche. Por ello creemos, al igual que otros autores, que es más razonable hacer lo que hemos llamado “sobrecarga fisiológica de lactosa” con un vaso de leche de 250ml (10,5g de lactosa), que es la cantidad que habitualmente se ingiere y se debe tolerar. Debería establecerse un consenso acerca de la metodología que hay que emplear para el estudio de estos sujetos y tener datos fiables de prevalencia. Nuestros datos refieren una frecuencia de malabsorción de lactosa en niños con sospecha de intolerancia del 32,5 % tras la prueba con 2g/kg de lactosa, disminuyendo al 13,7 % tras la sobrecarga fisiológica, con 250ml de leche9. Datos similares han sido referidos por otros autores, que, a su vez, los estudian con sobrecarga de 250ml de yogur, con un descenso de la frecuencia al 3,8 %. En dicho estudio se refiere una sintomatología clínica del 54 % con 2g, del 18 % con leche y del 0 % con yogur11.
La microbiota intestinal es un complejo ecosistema compuesto por multitud de bacterias con capacidad metabólica extremadamente variada, que puede producir efectos beneficiosos o perjudiciales, y que está implicada e influirá no solamente en el resultado del test, sino también en las manifestaciones clínicas. La fisiopatología de los síntomas que se producen en la intolerancia reside en la presencia de lactosa no hidrolizada en la luz intestinal. La lactosa es una sustancia osmóticamente muy activa que ocasiona la secreción de líquidos y electrólitos a la luz intestinal hasta que se alcanza el equilibrio osmótico. La mayor parte de la lactosa no absorbida es hidrolizada por determinadas bacterias intestinales del colon a moléculas de hidratos de carbono más pequeños y otros productos fermentativos, entre los cuales se incluyen los
ácidos orgánicos de cadena corta, los ácidos butírico, propiónico y acético, el ácido láctico y grandes cantidades de H2, que a su vez difundirá a través de la mucosa del colon y se eliminará por la respiración. La intolerancia a la lactosa es un complejo sintomático que puede resultar de la malabsorción de la lactosa, pero esta malabsorción no necesariamente conlleva intolerancia. Estudios in vitro han demostrado que la cantidad de 10,5g de lactosa (un vaso de leche) puede llegar a producir 120mmol de ácidos orgánicos, lo cual permitiría producir 2.600ml de CO2 y casi 4l de H2. El metano no está implicado en el proceso de malabsorción de la lactosa, y su producción depende de una flora metagénica independiente12. El H2, debido a su gran capacidad de difusión, es absorbido en un 15-20 %, y el pH ideal del colon para la formación de H2 y su absorción de 7,2, y lógicamente la microbiota del colon, desempeña un papel importante en este punto.
Una vez efectuada la prueba diagnóstica “fisiológicamente”, debemos encontrar “el umbral de tolerancia” clínica para cada individuo con el fin de aportar aquellos alimentos lácteos ricos en calcio y con poca cantidad de lactosa. Debemos evitar la hipotética osteopenia en estos sujetos realizando dietas drásticas con supresión absoluta de lácteos. Hemos de recordar que suele quedar un remanente del 10% de actividad lactásica8. Actualmente se dispone de leches de vaca sin lactosa o con baja concentración (> 0,7g lactosa/100ml) que suelen tolerarse perfectamente, así como el queso, que sólo contiene trazas de lactosa. En el caso del yogur, hemos de añadir el efecto beneficioso de la β-galactosidasa producida por las bacterias endógenas del producto, Streptococcus thermophilus y Lactobacillus bulgaricus. Dichas bacterias internalizan la lactosa mediante sistemas fosfotransferasas en forma de lactosa-6-fosfato, que por la acción de la fosfo-β-galactosidasa, se transforma en glucosa y galactosa fosfato. La glucosa activada en forma de UDP-glucosa y la UDP-galactosa se utilizan en la producción de polisacáridos extracelulares que actúan como excelente sustrato para el crecimiento de las bifidobacterias y lactobacilos. Deben evitarse las mal llamadas “leches de soja líquidas”, bebidas de almendra, arroz y avena, por los riesgos nutricionales que comportan13.
Datos microbiológicos han demostrado que la ingesta durante 6 semanas de leche fermentada con Lactobacillus casei y S. thermophilus evidenciaba un cambio de la flora entre las 6 y las 12 semanas, con un aumento de la flora fecal en Lactobacillus, una disminución de bacilos gramnegativos aerobios y de bacteroides14. En nuestra experiencia, pacientes con intolerancia a la lactosa han pasado a ser más tolerantes tras el estímulo durante 6 meses de productos con fermentos lácticos. Si bien existen publicaciones que apuntan a una posible inducción de la LPH en función del estímulo con el sustrato lactosa, otros autores lo dudan y están a favor de la teoría de que la LPH no es inducible y, de hecho, tampoco desaparece aunque no se consuma lactosa. Los beneficios en la tolerancia estarían más bien asociados a un cambio en la macrobiota del colon14,15.
Reflexionando sobre lo expuesto, para definir esta entidad en la que se presenta un declive de la lactasa, en mi opinión no se deberían incluir los términos “intolerancia” (puede no estar presente), “tipo adulto” (se da en la infancia), “presentación tardía” (se da precozmente), “ausencia de lactasa” (el déficit no es absoluto), y emplear el de “hipolactasia genética”, o bien, por qué no, el de “lactasapenia”.