Identificar factores de riesgo asociados con el desarrollo de infecciones nosocomiales en pacientes pediátricos asistidos con oxigenación por membrana extracorpórea (ECMO).
Pacientes y métodosSe han revisado de forma retrospectiva los pacientes que han recibido asistencia en ECMO de enero de 2011 a diciembre de 2014. Se han recogido datos demográficos, sobre la asistencia y sobre las infecciones que aparecen durante dicha asistencia.
ResultadosEn este periodo hubo 50 asistencias en ECMO. Veinte pacientes tuvieron 23 episodios de infección, de los que 16 fueron bacteriemias, siendo el microorganismo más frecuente el estafilococo coagulasa negativo (habiendo 2 casos de candidemia). En cuanto a los grupos de edad, el lugar y el tipo de canulación, la presencia de coagulopatía grave y la realización de intervenciones quirúrgicas durante la asistencia, ninguno de estos factores resultó un factor de riesgo de infección estadísticamente significativo. La duración media de soporte en ECMO fue significativamente mayor en los pacientes que tuvieron alguna infección (8,91 vs. 5,96 días; p=0,039). No hubo diferencias significativas en cuanto a la estancia en la Unidad de Cuidados Intensivos Pediátricos ni en cuanto a la supervivencia.
ConclusionesLa incidencia de infección durante ECMO es muy alta y los pacientes que tienen una infección están asistidos un tiempo significativamente mayor, por lo que se deben instaurar medidas para prevenir la aparición de estas infecciones e intentar minimizar el tiempo de asistencia en ECMO.
To identify risk factors associated with infectious complications acquired by paediatric patients during extracorporeal life support (ECLS).
Patients and methodsPatients under ECLS from January 2011 to December 2014 have been retrospectively reviewed and data on demographics, care and infectious complications were collected.
ResultsThere were 50 ECLS assistances in the study period, of which 20 patients had 23 infectious complications: 16 were bloodstream infections, with coagulase negative staphylococci being the predominant isolate (there were 2 cases of candidaemia). Age, site of cannulation procedure, cannulation site, severe coagulopathy, and surgical interventions during assistance were analysed as risk factors for infectious complications, but no significant differences were found. ECLS duration was significantly longer in patients with infectious complications (8.91 vs 5.91 days; P=.039). There were no significant differences as regards Paediatric Intensive Care Unit (PICU) stay, or in survival.
ConclusionsInfectious complications during ECLS are very common, and ECLS duration is significantly longer in patients with infections. Measures should be put in place to prevent infectious complications and reduce time on ECLS.
La oxigenación por membrana extracorpórea (ECMO) es una técnica usada en pacientes críticos, tanto en edad neonatal como en niños y adultos, con un fallo cardiaco o pulmonar reversible1. La aparición de complicaciones infecciosas está asociada a unos peores resultados en pacientes asistidos en ECMO2,3. Los pacientes en ECMO son especialmente susceptibles de padecer infecciones nosocomiales, ya que, además de estar críticamente enfermos, reciben múltiples técnicas y procedimientos invasivos (catéteres venosos centrales y arteriales, intubación endotraqueal, sondaje urinario, drenajes abdominales y torácicos, etc.)4,5. Por otro lado, el propio circuito de ECMO puede suponer múltiples puntos de entrada para microorganismos patógenos.
Varios estudios describen las infecciones nosocomiales en ECMO3,6. La mayor duración de la asistencia en ECMO6,7, una situación más crítica previa al inicio de la misma2,7, procedimientos invasivos durante la asistencia en ECMO5, tórax abierto5 y las complicaciones durante la ECMO6,8 son factores de riesgo conocidos para el desarrollo de infecciones nosocomiales. En el registro de la Extracorporeal Life Support Organization (ELSO) (1998-2008) se describe un 11,7% de infecciones (equivale a 15,4 infecciones por cada 1.000 días de ECMO; adultos 30,6/1.000d; pediátricos 20,8/1.000d; neonatal 10,1/1.000d), siendo este porcentaje de 6,1% para aquellos pacientes que recibieron asistencia en ECMO durante menos de 7 días y de un 30,3% en aquellos que la recibieron durante más de 14 días3.
El objetivo de este estudio es analizar retrospectivamente a los pacientes que han sido asistidos en ECMO en una unidad de cuidados intensivos pediátricos de un hospital terciario, para describir las infecciones asociadas, identificar los factores de riesgo para desarrollar complicaciones infecciosas y determinar las posibles áreas de mejora.
Pacientes y métodosPara este estudio se han revisado retrospectivamente las historias clínicas de los pacientes que han recibido asistencia en ECMO entre el 1 de enero de 2011 y el 31 de diciembre de 2014, recogiéndose datos demográficos, de la asistencia (indicación, tipo, tipo de canulación, lugar de canulación, procedimientos durante ECMO, transfusión de hemoderivados, duración de ECMO) y de las infecciones que aparecen durante dicha asistencia (tipo de infección, microorganismo causal, tiempo de ECMO a la que aparece), además de los días de estancia en la Unidad de Cuidados Intensivos Pediátricos (UCIP) y la supervivencia.
Se han incluido todos los pacientes asistidos en ECMO durante este periodo que tuvieran entre 0 y 16 años. Se han excluido las infecciones existentes previamente a la asistencia en ECMO o que motivan dicha asistencia y las infecciones que aparecen después de retirada la asistencia, que pudieran no ser secundarias a dicha asistencia.
El diagnóstico de cada tipo de infección nosocomial se ha realizado con base en los criterios diagnósticos de las guías CDC9. En nuestro centro realizamos cultivos de rutina cada 48h.
Durante el periodo de estudio, la profilaxis antibiótica realizada en los pacientes asistidos en ECMO fue de vancomicina y gentamicina durante 48h.
Las variables continuas se han comparado usando el análisis de la varianza y las variables cualitativas se han comparado con la prueba de chi cuadrado (χ2) o el test exacto de Fisher. Los resultados son expresados en porcentajes y valores de p (p<0,05 fue considerada significativa). El análisis estadístico de los resultados se ha realizado con el paquete estadístico IBM SPSS, versión 19.0.
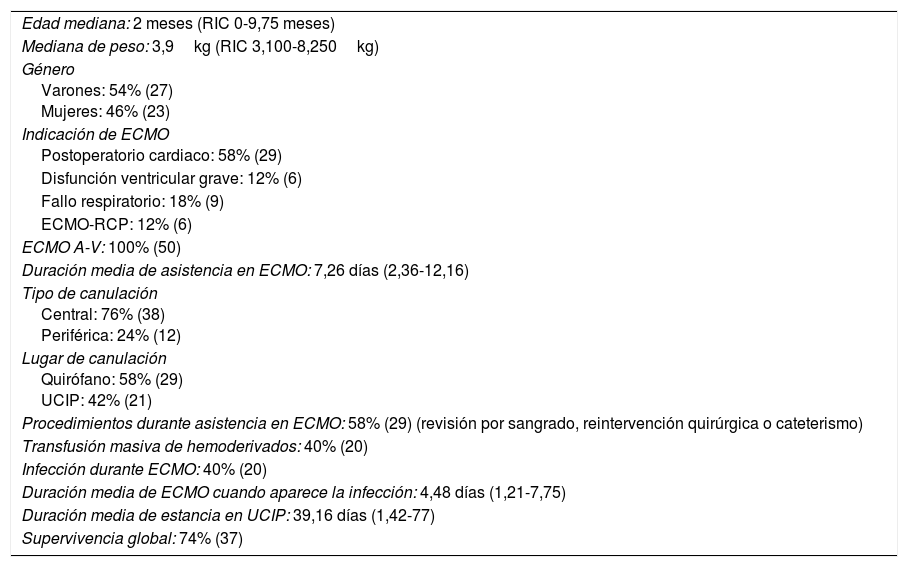
ResultadosDurante el periodo de estudio 50 pacientes requirieron asistencia en ECMO en nuestra unidad. En la tabla 1 se muestran en detalle el resumen de los datos demográficos, la indicación de asistencia en ECMO y datos sobre esta asistencia.
Resumen de las características demográficas y de la asistencia en ECMO
| Edad mediana: 2 meses (RIC 0-9,75 meses) |
| Mediana de peso: 3,9kg (RIC 3,100-8,250kg) |
| Género Varones: 54% (27) Mujeres: 46% (23) |
| Indicación de ECMO Postoperatorio cardiaco: 58% (29) |
| Disfunción ventricular grave: 12% (6) |
| Fallo respiratorio: 18% (9) |
| ECMO-RCP: 12% (6) |
| ECMO A-V: 100% (50) |
| Duración media de asistencia en ECMO: 7,26 días (2,36-12,16) |
| Tipo de canulación Central: 76% (38) Periférica: 24% (12) |
| Lugar de canulación Quirófano: 58% (29) UCIP: 42% (21) |
| Procedimientos durante asistencia en ECMO: 58% (29) (revisión por sangrado, reintervención quirúrgica o cateterismo) |
| Transfusión masiva de hemoderivados: 40% (20) |
| Infección durante ECMO: 40% (20) |
| Duración media de ECMO cuando aparece la infección: 4,48 días (1,21-7,75) |
| Duración media de estancia en UCIP: 39,16 días (1,42-77) |
| Supervivencia global: 74% (37) |
Durante este periodo, 20 pacientes (40%) tuvieron al menos una infección (3 pacientes tuvieron 2 infecciones), y la duración media de asistencia en ECMO cuando aparece la infección fue de 4,48 días (1,21-7,75). Hubo 23 episodios de infección (16 bacteriemias, 4 infecciones de orina, una neumonía asociada a ventilación mecánica y 2 mediastinitis). Analizándose los valores de PCR y PCT durante las primeras 48h tras la presencia de infección, se vio que los valores más altos de PCR fueron a las 48h (con una media de 12mg/dl; 2,4-21,6) y los de PCT fueron durante las primeras 12h (con una media de 10ng/ml; 0-23). En la tabla 2 se especifican los microorganismos causantes de cada infección. Analizando los microorganismos causantes de infección en los pacientes en ECMO encontramos que en nuestra muestra, de forma global, los grampositivos son más frecuentes (40%); después, los gramnegativos (35%), seguidos de los hongos (25%). El estafilococo coagulasa negativo sería el agente causal más frecuente (produciendo 6 de las 23 infecciones), seguido de diversas enterobacterias (5 de 23 infecciones) y Candida sp. (5 de 23 infecciones).
Microorganismos productores de infección
| Bacteriemias | |||||
|---|---|---|---|---|---|
| Grampositivos | Gramnegativos | Hongos | |||
| Estafilococo coagulasa negativo | 5 | Stenotrophomonas maltophilia | 1 | Candida albicans | 1 |
| Enterococcus faecium | 1 | Klebsiella pneumoniae | 1 | Candida parapsilosis | 1 |
| Streptococcus viridans | 1 | Serratia marcescens | 1 | ||
| Granulicatella adiacens | 1 | Pseudomonas aeruginosa | 2 | ||
| Enterobacter cloacae | 1 | ||||
| Infecciones de orina | |||||
|---|---|---|---|---|---|
| Grampositivos | Gramnegativos | Hongos | |||
| Escherichia coli | 1 | Candida albicans | 2 | ||
| Candida sake | 1 | ||||
| Neumonías asociadas a ventilación mecánica | |||||
|---|---|---|---|---|---|
| Grampositivos | Gramnegativos | Hongos | |||
| Serratia marcescens | 1 | ||||
| Mediastinitis | |||||
|---|---|---|---|---|---|
| Grampositivos | Gramnegativos | Hongos | |||
| Estafilococos coagulasa negativo | 1 | Trichosporon inkin | 1 | ||
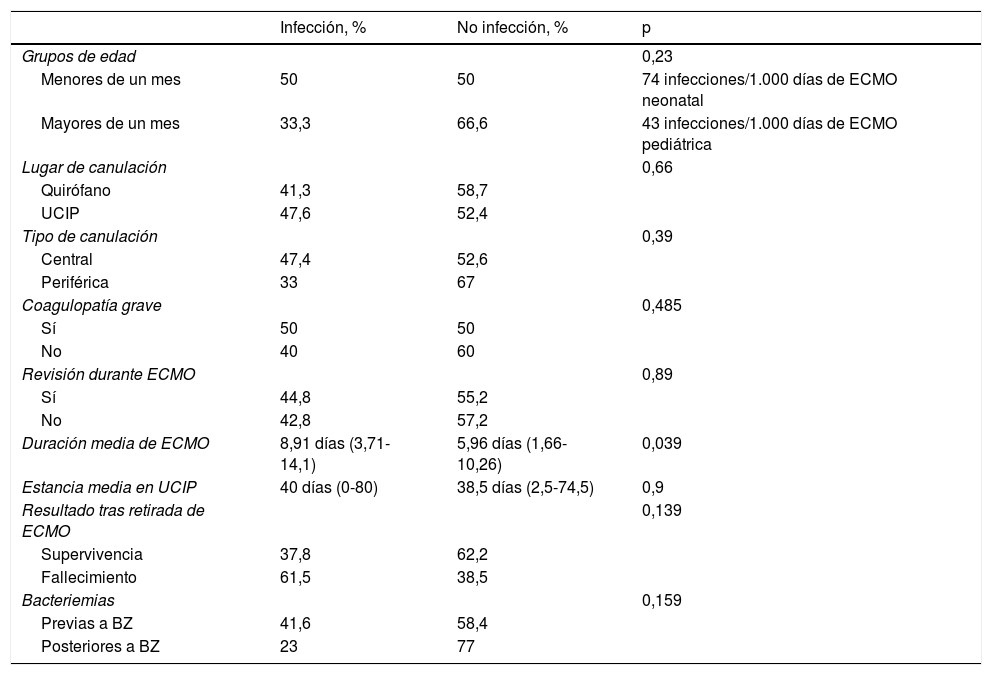
Se analizaron distintas variables buscando si determinadas características se asocian con un mayor riesgo de aparición de infección. Se comparó el porcentaje de infección por grupos de edad (neonatos y mayores de un mes), por el lugar donde se realizó la canulación (en quirófano o en la UCIP), por el tipo de canulación (central o periférica), en función de si el paciente sufrió una coagulopatía grave (con necesidad de transfusiones múltiples) o si precisó algún tipo de intervención durante la asistencia (revisión quirúrgica por sangrado, reintervención quirúrgica, realización de cateterismo). El porcentaje de infección fue algo mayor en los pacientes menores de un mes, cuando la canulación se realizó en la UCIP, en canulación central, si el paciente sufrió una coagulopatía grave y si hubo que hacer alguna intervención durante la asistencia, pero ninguna de estas diferencias resultó estadísticamente significativa. Por otro lado, se comparó la diferencia de tiempo de asistencia en ECMO, la estancia media en UCIP y la supervivencia tras la retirada de ECMO entre pacientes que sufrieron alguna infección durante la asistencia y los que no. Los pacientes que presentaron alguna infección estuvieron asistidos durante más tiempo en ECMO (diferencia estadísticamente significativa, p=0,039) y la supervivencia fue menor, aunque sin alcanzar significación estadística. La estancia media en UCIP fue similar en ambos grupos. En nuestra unidad se instauró el programa de Bacteriemia zero en diciembre de 2012, siendo 24 de las asistencias del estudio previas al inicio y 26, posteriores. El porcentaje de bacteriemias disminuyó tras la implementación de este paquete de medidas (aunque la diferencia no resultó estadísticamente significativa). En la tabla 3 se muestran en detalle los porcentajes y valores de p de estos resultados.
Descripción de variables en función de la aparición de infección
| Infección, % | No infección, % | p | |
|---|---|---|---|
| Grupos de edad | 0,23 | ||
| Menores de un mes | 50 | 50 | 74 infecciones/1.000 días de ECMO neonatal |
| Mayores de un mes | 33,3 | 66,6 | 43 infecciones/1.000 días de ECMO pediátrica |
| Lugar de canulación | 0,66 | ||
| Quirófano | 41,3 | 58,7 | |
| UCIP | 47,6 | 52,4 | |
| Tipo de canulación | 0,39 | ||
| Central | 47,4 | 52,6 | |
| Periférica | 33 | 67 | |
| Coagulopatía grave | 0,485 | ||
| Sí | 50 | 50 | |
| No | 40 | 60 | |
| Revisión durante ECMO | 0,89 | ||
| Sí | 44,8 | 55,2 | |
| No | 42,8 | 57,2 | |
| Duración media de ECMO | 8,91 días (3,71-14,1) | 5,96 días (1,66-10,26) | 0,039 |
| Estancia media en UCIP | 40 días (0-80) | 38,5 días (2,5-74,5) | 0,9 |
| Resultado tras retirada de ECMO | 0,139 | ||
| Supervivencia | 37,8 | 62,2 | |
| Fallecimiento | 61,5 | 38,5 | |
| Bacteriemias | 0,159 | ||
| Previas a BZ | 41,6 | 58,4 | |
| Posteriores a BZ | 23 | 77 |
Las infecciones nosocomiales son una complicación frecuente de los pacientes en ECMO. La incidencia de infección publicada varía ampliamente según los estudios, desde el 8,5% de un estudio realizado por Hsu et al. en Taiwán, en pacientes adultos que requieren asistencia en ECMO por cualquier causa4, hasta el 64% publicado en un estudio realizado por Schmidt et al. en París, en pacientes adultos con un shock cardiogénico que requieren asistencia con ECMO venoarterial2. En el último análisis del registro de la ELSO se describe una incidencia global de un 11,7% de infecciones, siendo más frecuente la aparición de infecciones en pacientes pediátricos y en adultos que en neonatos3. En nuestro estudio, la incidencia de infección es muy alta (de un 40%, siendo la incidencia en población neonatal de un 50% y en población pediátrica de un 33,3%), por lo que es esencial instaurar medidas de mejora.
Las bacteriemias y las neumonías asociadas a ventilación mecánica son las infecciones que aparecen con mayor frecuencia cuando un paciente está asistido en ECMO, según lo publicado en la literatura7,8. En nuestra serie, las infecciones que aparecen con más frecuencia son las bacteriemias (70% de las infecciones).
El estafilococo coagulasa negativo sería el agente causal más frecuente, seguido de diversas enterobacterias y Candida sp., coincidiendo esto con lo publicado en la literatura, como vemos en el registro de la ELSO publicado en 2011, que muestra que el estafilococo coagulasa negativo es el agente causal más frecuente (16% de las infecciones), seguido de Candida (con un 12,7% de las infecciones)3, o en un artículo publicado por el grupo de Aubron et al. de Melbourne en 2013, que muestra las enterobacterias como el agente causal más frecuente de forma global (16 de 46 infecciones) y Candida como causa más frecuente de bacteriemia (9/24)7.
En este estudio vemos que los pacientes que tienen una infección están asistidos un tiempo significativamente mayor que los que no la tienen (8,91 días [3,71-14,1] frente a los 5,96 días [1,66-10,26] de los pacientes que no tuvieron infección; p=0,039), coincidiendo con lo publicado en otros artículos, como el de Schmidt et al., que concluye que la aparición de complicaciones infecciosas supone un mayor tiempo de asistencia en ECMO (16±17 días en los pacientes que tienen alguna infección frente a 8±5 días en los pacientes que no la tienen; p<0,0001)2, o el análisis que realizan Adam et al. del registro de la ELSO, en el que concluyen que la mayor duración de la asistencia es un factor de riesgo para infección en todos los grupos de edad (en neonatos el tiempo medio de asistencia es de 10,61±7,27 días para los que tienen infección frente a 6,66±4,96 días para los que no la tienen; p<0,001); en población pediátrica los tiempos serían de 13,38±10,55 días y 7,16±6,75 días (p<0,001)6. Se puede concluir que los pacientes que tienen alguna infección están asistidos un tiempo significativamente mayor o que la mayor duración de la asistencia en ECMO está relacionada con una incidencia más alta de complicaciones infecciosas.
Analizando otras variables, como la incidencia de infección en canulaciones centrales y periféricas, en nuestro estudio no encontramos diferencias estadísticamente significativas. En la literatura hay estudios que analizan las diferencias entre canulación central y periférica en cuanto a incidencia de sangrado, necesidad de reintervenciones o resultados10, pero solo hemos encontrado un estudio que analice esta variable de forma concreta en cuanto a la incidencia de infección, el de Schmidt et al., en el que tampoco encuentran diferencias significativas, aunque, al igual que en nuestra serie, existe una mayor tendencia a infección en la canulación central (los pacientes con canulación central tienen una incidencia de infección del 65% frente al 45% de la periférica; p=0,71)2.
Los pacientes que fallecen tras la retirada de ECMO tienen un mayor porcentaje de infecciones (61,5 frente al 37,8% en los pacientes que sobreviven), aunque las diferencias no son estadísticamente significativas. Los datos publicados por distintos grupos difieren. El estudio realizado por el grupo de Melbourne, con 139 pacientes, concluye que aunque la aparición de infecciones en ECMO aumenta los días de ingreso en la UCIP, no incrementa la mortalidad7, y a la misma conclusión llega el grupo de Coffin et al. de Filadelfia con un estudio de 80 neonatos que requieren asistencia en ECMO11. Sin embargo, el registro de la ELSO publicado en 2011, donde se analizan los datos de 20.741 asistencias, refiere una mortalidad del 57,6% en los pacientes que tienen alguna infección frente al 41,5% en los que no la tienen (p<0,001)3.
Es muy importante reconocer de forma precoz la aparición de una complicación infecciosa, lo cual es difícil ya que los síntomas y signos de infección son difíciles de interpretar en pacientes en ECMO. Puede haber hipotensión, coagulopatía, trombocitopenia, elevación de reactantes de fase aguda y variaciones en la temperatura, sin que impliquen la existencia de una infección12. La administración de antibióticos profilácticos y la realización de cultivos seriados pueden ser útiles en estos pacientes. En el estudio retrospectivo de Kaczala et al., donde se realizan cultivos diarios rutinarios, sin administrar antibióticos profilácticos, se detecta con dichos cultivos un 22,6% de infecciones. Concluyen que sería más beneficioso realizar cultivos diarios que administrar profilaxis antibiótica a todos los pacientes, para evitar aumentar las resistencias antibióticas13. En otro estudio, de Elerian et al., de la Universidad de Texas, con 4 centros de ECMO neonatal, administran antibióticos profilácticos, además de realizar cultivos rutinarios diarios, y concluyen que en pacientes en los que no sospechemos infección los cultivos rutinarios no estarían indicados y solo aumentarían el coste14. En nuestro centro hemos revisado las indicaciones de profilaxis antibiótica, no encontrando protocolos específicos de las indicaciones en ECMO (ni en cuanto a los antibióticos a utilizar ni en cuanto al tiempo)15,16, concluyendo que la profilaxis se mantenga 24h como en el resto de los pacientes tras cirugía cardiaca y con la misma antibioterapia, y posteriormente se vigilen estrechamente los signos de infección.
Este estudio cuenta con algunas limitaciones. En primer lugar, se trata de un estudio retrospectivo, por lo que en ocasiones es difícil concluir en qué casos se dio verdadera importancia a un cultivo positivo como causante de infección o en cuáles se mantuvieron los antibióticos más por precaución al tratarse de pacientes graves. Por otro lado, muchos cultivos fueron recogidos cuando el paciente ya estaba con antibióticos, lo que pudo ser la causa de su negatividad, y en algunos casos los antibióticos se pudieron mantener por alta sospecha de infección a pesar de que los cultivos fueran negativos. Por estas razones es difícil saber si la incidencia de infección puede estar infra o sobreestimada. Además, en este estudio están excluidas las infecciones ya presentes antes de la asistencia en ECMO, sin poder analizar cómo pudo influir el que esos pacientes siguieran un tratamiento antibiótico previo a la hora de desarrollar menos infecciones o de tener más riesgo de infecciones fúngicas. Por otra parte, es un estudio con una muestra pequeña, lo que probablemente justifica que muchos resultados no sean estadísticamente significativos, siendo más difícil establecer qué cambios se pueden implementar en la práctica para reducir las infecciones nosocomiales en estos pacientes.
La incidencia de infección durante ECMO es muy alta y, de las variables estudiadas en este estudio, la única que se relaciona significativamente con una mayor incidencia de infección es la mayor duración del soporte en ECMO, por lo que se debe optimizar la situación del paciente para poder retirar lo antes posible este soporte. En estos pacientes es especialmente importante cumplir de forma estricta las medidas de bacteriemia, neumonía y resistencia cero para evitar la aparición de infecciones, así como hacer un especial hincapié en que cualquier intervención que hagan sobre el paciente otros especialistas (cardiólogos, cirujanos cardiacos, radiólogos, etc.) sea con las medidas de asepsia adecuadas y cuando sea necesario, de forma estéril (manipulación de cánulas, revisión de sangrado mediastínico, etc.). Para la concienciación de todo el personal implicado en el cuidado de estos pacientes, se deberían hacer cursos periódicos de lavado de manos, así como recordatorios de los programas zero y reuniones periódicas sobre los datos de incidencia de infección en la unidad.
Dada la importancia de las infecciones nosocomiales en los pacientes asistidos en ECMO y la dificultad para el diagnóstico de las mismas, es muy importante que ante un empeoramiento (clínico o analítico), recojamos cultivos y comencemos de forma precoz antibioterapia en espera de confirmación de la infección. Al no existir protocolos ni actuaciones comunes en cuanto al uso de la profilaxis antibiótica en estos pacientes y a la realización de cultivos rutinarios, hacen falta más estudios prospectivos, idealmente multicéntricos, para concluir cuál es la práctica más adecuada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo fue presentado previamente en el XXX Congreso de la Sociedad Española de Cuidados Intensivos Pediátricos, celebrado del 7 al 9 de mayo de 2015.