La incidencia de las reacciones adversas a medicamentos en pediatría se ha establecido recientemente en 15,1 reacciones por 1.000 niños. Representa un 2% de las admisiones de un hospital pediátrico, similares a las del paciente adulto, y de ellas solo un pequeño porcentaje (menos del 8%) cursan con afectación hepática, que puede ir desde un ligero aumento de las transaminasas hasta una hepatitis fulminante. El objetivo de este estudio ha sido determinar la importancia (frecuencia, formas de presentación, gravedad y cronificación) de la hepatotoxicidad por fármacos o remedios naturales en la población pediátrica.
Pacientes y métodoSe han incluido a todos los pacientes pediátricos, neonatos y niños en los que se ha sospechado una reacción hepatotóxica, remitidos de 8 hospitales españoles participantes. Para el análisis de la causalidad de cada caso se aplica la escala de Council for International Organizations of Medical. Sciences (CIOMS).
Resultados y conclusionesSe estudian un total de 36 reacciones hepatotóxicas en 33 niños. Los grupos farmacológicos involucrados con mayor frecuencia fueron los antitinfecciosos (71%). Amoxicilina-clavulánico fue el fármaco individual responsable del mayor número de casos (31,4%). Se concluye que el registro de hepatopatías asociadas a medicamentos ha demostrado ser un instrumento útil para la creación de una red activa de especialistas motivados en la detección y comunicación de incidencias de hepatopatía tóxica, aumentando las garantías de certeza diagnóstica.
The incidence of adverse drug reactions in children has recently been established at 15.1 reactions per 1000 children. This represents 2% of admissions to a paediatric hospital, and is similar to adult patients. Only a small percentage (less than 8%) may have liver involvement, which can range from a slight increase in transaminases to fulminant hepatitis. The aim of this study was to determine the importance (frequency, types of presentation, severity and chronicity) of hepatotoxicity by drugs or natural remedies in the paediatric population.
Patients and methodAll paediatric patients, neonates and children who had suspected hepatotoxic reactions notified by the eight participating Spanish hospitals. The Council for International Organizations of Medical Sciences (CIOMS) scale was used for the analysis of causality in each case.
Results and conclusionsWe studied a total of 36 hepatotoxic reactions in 33 children. The drug classes most frequently involved were antimicrobials (71%). Amoxicillin-clavulanate was the individual drug responsible for the greatest number of cases (31.4%). We conclude that the registration of drugs associated with liver disease has proved a useful tool for creating an active network of motivated specialists in detecting and reporting incidents of toxic liver disease, ensuring increasing diagnostic accuracy.
Los pediatras, farmacólogos clínicos, agencias reguladoras e industria farmacéutica reconocen la necesidad de evaluar adecuadamente los fármacos que van a ser utilizados en la infancia para controlar la seguridad, eficacia y calidad de los mismos. Sin embargo, es llamativa la escasa información, con validez científica, sobre la que se sustentan actualmente muchas de las prescripciones1. Precisamente los pediatras necesitan en su ejercicio diario asegurar una mínima toxicidad farmacológica y que al mismo tiempo el niño no se vea privado de los posibles beneficios de los medicamentos que pueda necesitar2. Estudios recientes, que analizan las prescripciones realizadas en centros hospitalarios, ponen de manifiesto la magnitud del empleo de fármacos sin indicación en ficha técnica para su uso en pediatría (generalmente debido a la ausencia de alternativas terapéuticas registradas) o su empleo de una forma distinta a la contemplada en la licencia de comercialización: empleo de dosis diferentes a las recomendadas, en distintos grupos de edad, por vías diversas o para una indicación no aprobada, que llega a alcanzar cifras de un 90% en neonatos ingresados en unidades de cuidados intensivos3.
El vacío existente sobre datos de eficacia y seguridad de muchos fármacos en el niño causa cierta preocupación acerca del proceso de registro de fármacos y el establecimiento de sus indicaciones en pediatría. Además, las decisiones sobre el registro de medicamentos, a pesar de la tendencia a la armonización, difieren de un país a otro, tanto para fármacos antiguos como para los nuevos1,4.
La incidencia de las reacciones adversas a medicamentos en pediatría se ha establecido recientemente en 15,1 reacciones por 1.000 niños5. Representa un 2% de las admisiones de un hospital pediátrico, similares a las del paciente adulto, y de ellas solo un pequeño porcentaje (menos del 8%) cursan con afectación hepática1,6, que puede ir desde un ligero aumento de las transaminasas hasta una hepatitis fulminante1.
En la literatura médica existen escasas referencias bibliográficas a este problema de salud y casi todas referidas a casos anecdóticos o pequeñas series7–11. Recientemente se ha descrito una serie de 30 niños entre 2-18 años que han sufrido algún episodio de hepatotoxicidad12.
La disponibilidad de marcadores moleculares de toxicidad hepática aplicables a la práctica clínica parece aún lejana. Por ello, el diagnóstico de hepatotoxicidad continúa siendo un desafío para el clínico13,14.
El objetivo principal de este estudio ha sido determinar la importancia (frecuencia, formas de presentación, gravedad y cronificación) de la hepatotoxicidad por fármacos o remedios naturales en la población pediátrica. Por otra parte, se estableció como objetivo secundario la creación de un registro de hepatotoxicidad en la edad pediátrica y un grupo de trabajo para crear una red activa de especialistas motivados en la detección y comunicación de incidencias de hepatopatías tóxicas con el fin de promover una «cultura fármaco-epidemiológica».
Material y métodosPara ello, se ha llevado a cabo un estudio observacional prospectivo desde enero de 2008 hasta diciembre de 2011 en el que han participado 8 hospitales españoles.
Sujetos de estudiose han incluido a todos los pacientes pediátricos, neonatos y niños en los que se ha sospechado una reacción hepatotóxica, remitidos de cualquier hospital integrante del estudio; se han admitido pacientes remitidos de otros hospitales.
Criterios de inclusiónla señal de alerta que ha hecho sospechar toxicidad hepática medicamentosa ha sido una de las siguientes:
- 1.
2 NxLSN (límite superior de la normalidad) de ALT.
- 2.
2 NxLSN de bilirrubina conjugada.
- 3.
Elevación de ALT, de bilirrubina total y fostatasa alcalina (simultáneamente) siendo al menos uno de ellos 2xLSN.
Basta la existencia de una de ellas para generar la sospecha.
Criterios de exclusión: se han excluido aquellos pacientes que, a pesar de cumplir los criterios de causalidad, tenían una enfermedad hepática concomitante (viral, alcohólica, metabólica, de depósito o autoinmume).
En cada paciente se recogen en protocolo estructurado y codificado los siguientes datos: (tabla 1)15.
- 1.
Variables demográficas del paciente, características del tratamiento al que se imputa la reacción, medicación concominante y curso del episodio.
- 2.
Variables de laboratorio durante la reacción, hasta la eventual resolución y cada 6 meses desde el inicio, datos histológicos si procede y finalmente parámetros para excluir causas alternativas de hepatotopatía.
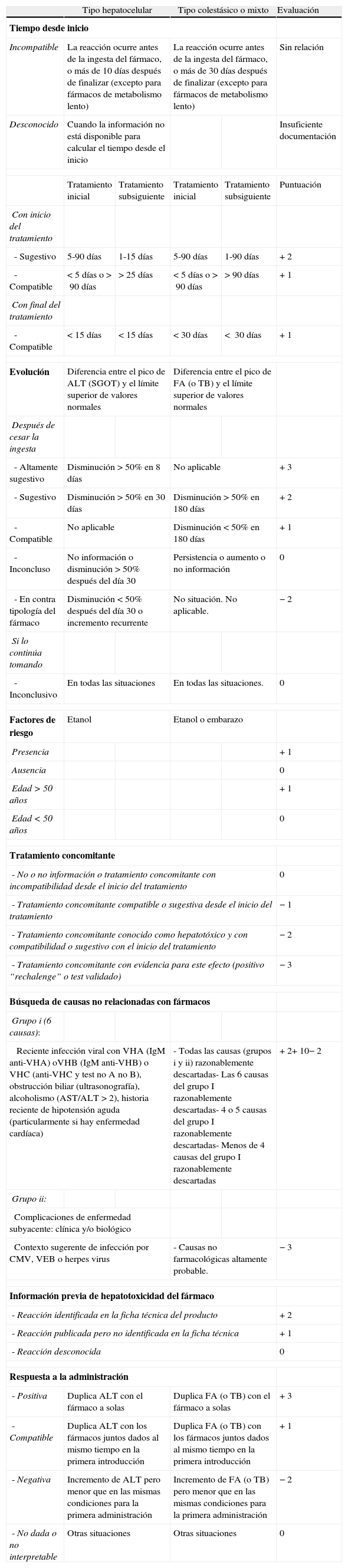
Para el análisis de la causalidad de cada caso se aplica la escala de Council for International Organizations of Medical. Sciences (CIOMS)16 (tabla 2). Según la puntuación total obtenida, cada caso se incluía en una de las siguientes categorías de sospecha: definida o altamente probable, probable, posible, improbable y excluida.
Evaluación de la causalidad de un fármaco en daño hepático agudo. Escala de CIOMS
| Tipo hepatocelular | Tipo colestásico o mixto | Evaluación | |||
| Tiempo desde inicio | |||||
| Incompatible | La reacción ocurre antes de la ingesta del fármaco, o más de 10 días después de finalizar (excepto para fármacos de metabolismo lento) | La reacción ocurre antes de la ingesta del fármaco, o más de 30 días después de finalizar (excepto para fármacos de metabolismo lento) | Sin relación | ||
| Desconocido | Cuando la información no está disponible para calcular el tiempo desde el inicio | Insuficiente documentación | |||
| Tratamiento inicial | Tratamiento subsiguiente | Tratamiento inicial | Tratamiento subsiguiente | Puntuación | |
| Con inicio del tratamiento | |||||
| - Sugestivo | 5-90 días | 1-15 días | 5-90 días | 1-90 días | + 2 |
| - Compatible | <5 días o>90 días | >25 días | <5 días o>90 días | >90 días | + 1 |
| Con final del tratamiento | |||||
| - Compatible | < 15 días | <15 días | <30 días | < 30 días | + 1 |
| Evolución | Diferencia entre el pico de ALT (SGOT) y el límite superior de valores normales | Diferencia entre el pico de FA (o TB) y el límite superior de valores normales | |||
| Después de cesar la ingesta | |||||
| - Altamente sugestivo | Disminución>50% en 8 días | No aplicable | + 3 | ||
| - Sugestivo | Disminución>50% en 30 días | Disminución>50% en 180 días | + 2 | ||
| - Compatible | No aplicable | Disminución<50% en 180 días | + 1 | ||
| - Inconcluso | No información o disminución>50% después del día 30 | Persistencia o aumento o no información | 0 | ||
| - En contra tipología del fármaco | Disminución<50% después del día 30 o incremento recurrente | No situación. No aplicable. | − 2 | ||
| Si lo continúa tomando | |||||
| - Inconclusivo | En todas las situaciones | En todas las situaciones. | 0 | ||
| Factores de riesgo | Etanol | Etanol o embarazo | |||
| Presencia | + 1 | ||||
| Ausencia | 0 | ||||
| Edad>50 años | + 1 | ||||
| Edad<50 años | 0 | ||||
| Tratamiento concomitante | |||||
| - No o no información o tratamiento concomitante con incompatibilidad desde el inicio del tratamiento | 0 | ||||
| - Tratamiento concomitante compatible o sugestiva desde el inicio del tratamiento | − 1 | ||||
| - Tratamiento concomitante conocido como hepatotóxico y con compatibilidad o sugestivo con el inicio del tratamiento | − 2 | ||||
| - Tratamiento concomitante con evidencia para este efecto (positivo “rechalenge” o test validado) | − 3 | ||||
| Búsqueda de causas no relacionadas con fármacos | |||||
| Grupo i (6 causas): | |||||
| Reciente infección viral con VHA (IgM anti-VHA) oVHB (IgM anti-VHB) o VHC (anti-VHC y test no A no B), obstrucción biliar (ultrasonografía), alcoholismo (AST/ALT>2), historia reciente de hipotensión aguda (particularmente si hay enfermedad cardíaca) | - Todas las causas (grupos i y ii) razonablemente descartadas- Las 6 causas del grupo I razonablemente descartadas- 4 o 5 causas del grupo I razonablemente descartadas- Menos de 4 causas del grupo I razonablemente descartadas | + 2+ 10− 2 | |||
| Grupo ii: | |||||
| Complicaciones de enfermedad subyacente: clínica y/o biológico | |||||
| Contexto sugerente de infección por CMV, VEB o herpes virus | - Causas no farmacológicas altamente probable. | − 3 | |||
| Información previa de hepatotoxicidad del fármaco | |||||
| - Reacción identificada en la ficha técnica del producto | + 2 | ||||
| - Reacción publicada pero no identificada en la ficha técnica | + 1 | ||||
| - Reacción desconocida | 0 | ||||
| Respuesta a la administración | |||||
| - Positiva | Duplica ALT con el fármaco a solas | Duplica FA (o TB) con el fármaco a solas | + 3 | ||
| - Compatible | Duplica ALT con los fármacos juntos dados al mismo tiempo en la primera introducción | Duplica FA (o TB) con los fármacos juntos dados al mismo tiempo en la primera introducción | + 1 | ||
| - Negativa | Incremento de ALT pero menor que en las mismas condiciones para la primera administración | Incremento de FA (o TB) pero menor que en las mismas condiciones para la primera administración | − 2 | ||
| - No dada o no interpretable | Otras situaciones | Otras situaciones | 0 | ||
ALT:alanino-aminotransferasa; CIOMS:Council for International organizations of medical sciences.
El tipo de lesión hepática se ha clasificado según los criterios acordados en la Conferencia Internacional de Consenso celebrada en 199017 en: hepatocelular, colestásica o mixta. Se evalúa el tiempo de resolución completa, tras la supresión del tratamiento, o la evolución a la cronicidad.
En todos los casos se ha solicitado el consentimiento informado para la inclusión de los pacientes en el estudio.
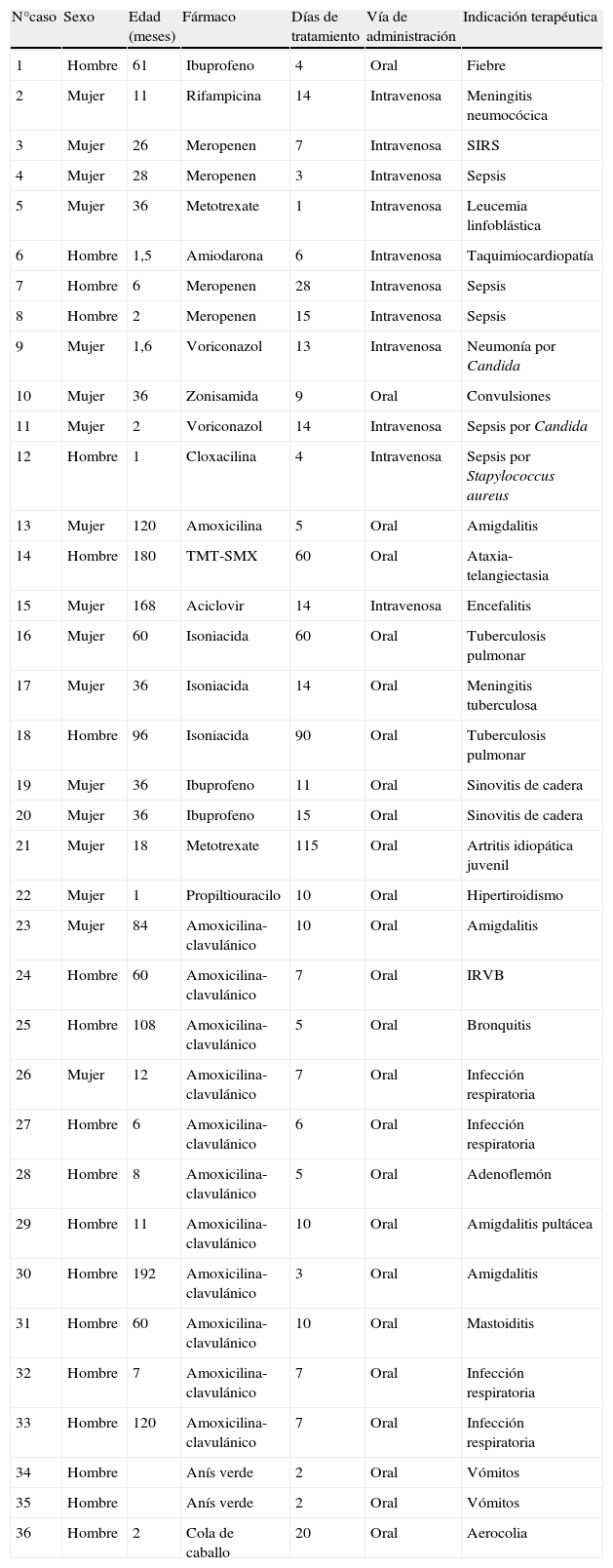
ResultadosDurante el periodo de estudio se han recibido un total de 46 casos de los que se han excluido 10 al haberse encontrado otra causa (inmunológica, viral o metabólica) que explicaba la alteración de enzimas hepáticas. Han quedado incluidos un total de 33 niños y 36 reacciones hepatotóxicas. Las características generales de la población de estudio, el fármaco implicado, la vía de administración y la indicación terapéutica aparecen en la tabla 3. Hubo una distribución similar de casos entre ambos sexos y la edad media fue de 61±108,36 meses.
Características generales de la población de estudio
| N°caso | Sexo | Edad (meses) | Fármaco | Días de tratamiento | Vía de administración | Indicación terapéutica |
| 1 | Hombre | 61 | Ibuprofeno | 4 | Oral | Fiebre |
| 2 | Mujer | 11 | Rifampicina | 14 | Intravenosa | Meningitis neumocócica |
| 3 | Mujer | 26 | Meropenen | 7 | Intravenosa | SIRS |
| 4 | Mujer | 28 | Meropenen | 3 | Intravenosa | Sepsis |
| 5 | Mujer | 36 | Metotrexate | 1 | Intravenosa | Leucemia linfoblástica |
| 6 | Hombre | 1,5 | Amiodarona | 6 | Intravenosa | Taquimiocardiopatía |
| 7 | Hombre | 6 | Meropenen | 28 | Intravenosa | Sepsis |
| 8 | Hombre | 2 | Meropenen | 15 | Intravenosa | Sepsis |
| 9 | Mujer | 1,6 | Voriconazol | 13 | Intravenosa | Neumonía por Candida |
| 10 | Mujer | 36 | Zonisamida | 9 | Oral | Convulsiones |
| 11 | Mujer | 2 | Voriconazol | 14 | Intravenosa | Sepsis por Candida |
| 12 | Hombre | 1 | Cloxacilina | 4 | Intravenosa | Sepsis por Stapylococcus aureus |
| 13 | Mujer | 120 | Amoxicilina | 5 | Oral | Amigdalitis |
| 14 | Hombre | 180 | TMT-SMX | 60 | Oral | Ataxia-telangiectasia |
| 15 | Mujer | 168 | Aciclovir | 14 | Intravenosa | Encefalitis |
| 16 | Mujer | 60 | Isoniacida | 60 | Oral | Tuberculosis pulmonar |
| 17 | Mujer | 36 | Isoniacida | 14 | Oral | Meningitis tuberculosa |
| 18 | Hombre | 96 | Isoniacida | 90 | Oral | Tuberculosis pulmonar |
| 19 | Mujer | 36 | Ibuprofeno | 11 | Oral | Sinovitis de cadera |
| 20 | Mujer | 36 | Ibuprofeno | 15 | Oral | Sinovitis de cadera |
| 21 | Mujer | 18 | Metotrexate | 115 | Oral | Artritis idiopática juvenil |
| 22 | Mujer | 1 | Propiltiouracilo | 10 | Oral | Hipertiroidismo |
| 23 | Mujer | 84 | Amoxicilina-clavulánico | 10 | Oral | Amigdalitis |
| 24 | Hombre | 60 | Amoxicilina-clavulánico | 7 | Oral | IRVB |
| 25 | Hombre | 108 | Amoxicilina-clavulánico | 5 | Oral | Bronquitis |
| 26 | Mujer | 12 | Amoxicilina-clavulánico | 7 | Oral | Infección respiratoria |
| 27 | Hombre | 6 | Amoxicilina-clavulánico | 6 | Oral | Infección respiratoria |
| 28 | Hombre | 8 | Amoxicilina-clavulánico | 5 | Oral | Adenoflemón |
| 29 | Hombre | 11 | Amoxicilina-clavulánico | 10 | Oral | Amigdalitis pultácea |
| 30 | Hombre | 192 | Amoxicilina-clavulánico | 3 | Oral | Amigdalitis |
| 31 | Hombre | 60 | Amoxicilina-clavulánico | 10 | Oral | Mastoiditis |
| 32 | Hombre | 7 | Amoxicilina-clavulánico | 7 | Oral | Infección respiratoria |
| 33 | Hombre | 120 | Amoxicilina-clavulánico | 7 | Oral | Infección respiratoria |
| 34 | Hombre | Anís verde | 2 | Oral | Vómitos | |
| 35 | Hombre | Anís verde | 2 | Oral | Vómitos | |
| 36 | Hombre | 2 | Cola de caballo | 20 | Oral | Aerocolia |
La recuperación fue la regla y únicamente un paciente evolucionó a fallo hepático fulminante y muerte.
Los grupos farmacológicos involucrados con mayor frecuencia fueron los antiinfecciosos (71%). Amoxicilina-clavulánico fue el fármaco individual responsable del mayor número de casos (31,4%).
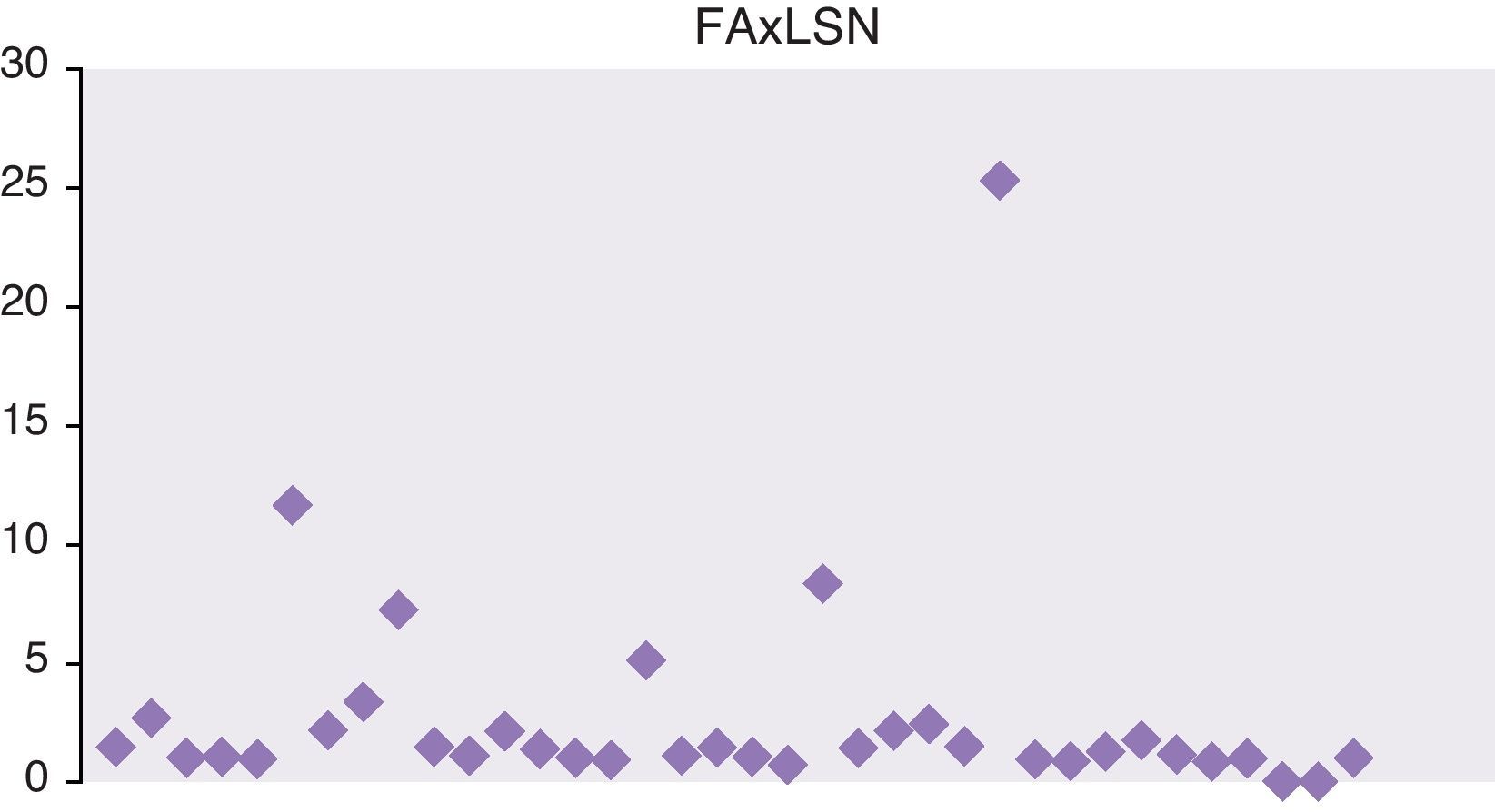
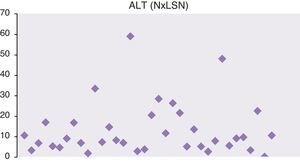
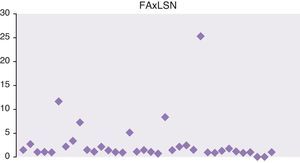
En las figuras 1 y 2 se representan las cifras máximas de GPT y fosfatasa alcalina de toda la serie.
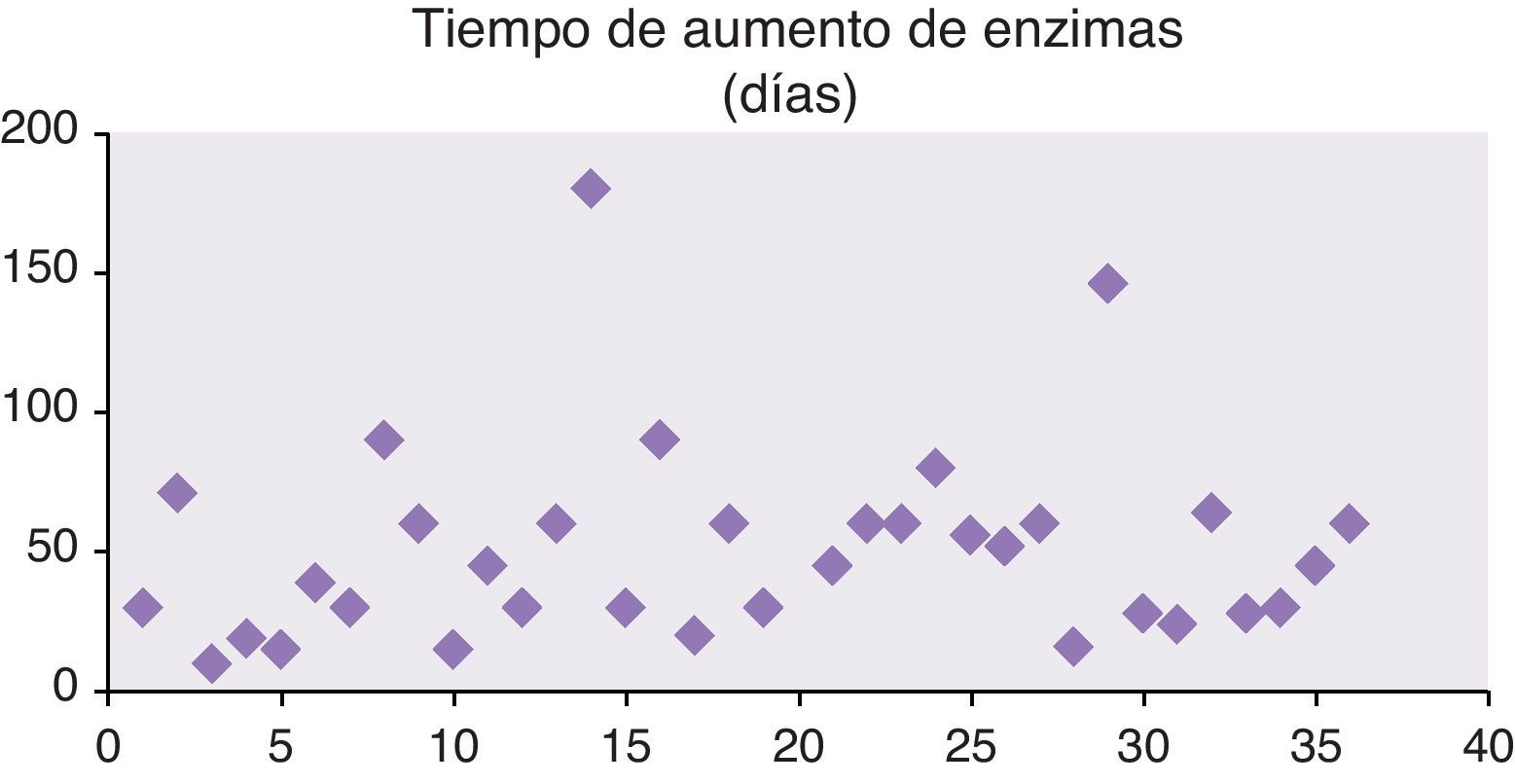
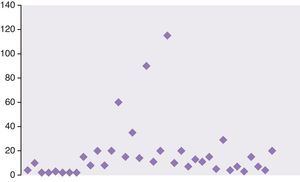
Los días desde que se había ingerido el fármaco hasta que se detecto el aumento de enzimas hepáticas presentaron una media de 17,4±23,64 (2-115) (fig. 3).
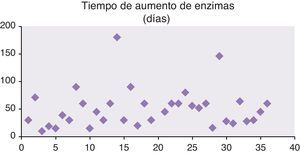
La elevación de las enzimas hepáticas se mantuvo durante una media de 40,79±35,7 (10-180) días (mediana de 45 días) (fig. 4).
La evaluación de causalidad por la escala de CIOMS determinó que el 48,5% de los casos eran definidos o altamente probables, 34% probables y 17% posibles.
Tipo de daño hepatotóxicoSe estableció que en 20 niños (55,5%) la lesión fue de tipo hepatotóxica, en 7 (19,4%) colestásica y en 9 (25%) mixta.
Etiología de la hepatotoxicidadTodos los casos analizados presentaron un mecanismo idiosíncrásico atendiendo al tipo de reacción. El tipo de indiosincrasia fue metabólica en el 94% de la serie. Solo 2 niños presentaron elevación de la cifra total de eosinófilos, quedando establecida una idiosincrasia por hipersensibilidad. Los fármacos implicados en la idiosincrasia por hipersensibilidad fueron isoniacida y amoxicilina-clavulánico.
Gravedad de la hepatotoxicidadEn un caso la forma de presentación fue de hepatitis fulminante con fallecimiento del paciente postrasplante hepático. El fármaco implicado fue isoniacida. Dos casos fueron definidos como grave (pacientes con ictericia y tiempo de protrombina<50%) relacionados con voriconazol y amoxicilina-clavulánico; el resto de los casos (91,6%) fueron clasificados como no graves (pacientes que no cumplen criterios de daño grave)
ReexposiciónExistió reexposición accidental en 3 pacientes (anís verde, meropenen e ibuprofeno). En estos 3 enfermos la reacción fue de tipo hepatotóxico. Es de destacar que la elevación de enzimas hepáticas fue más importante en el segundo episodio y que apareció de modo más precoz.
La manifestación clínica más frecuente, y que en la mayoría de las ocasiones determinó la consulta y la realización de analítica, fueron los vómitos. El 80% de los niños se encontraban asintomáticos a los 7 días del inicio del cuadro.
DiscusionLa mayoría de las hepatopatías de la infancia son de causa viral, y no tóxico-medicamentosas15. En teoría, el hígado de los niños está más protegido que el de los adultos a la lesión tóxica: presenta mayor cantidad de glutatión (una de las principales moléculas para conjugar tóxicos e inactivarlos) así como una «hipertrofia» de ciertas vías metabólicas (como la sulfatación) que intentan compensar el déficit fisiológico de ciertas vías aún inmaduras (como la glucuronoconjugación). Sin embargo, esta circunstancia, en principio favorable, puede actuar como arma de doble filo: la ausencia de ciertas vías metabólicas detoxificadoras (que se expresan con el desarrollo), así como la existencia de ciertas vías aberrantes (de carácter compensatorio frente a las inmaduras) hacen que, o bien no se detoxifiquen todos los fármacos o bien que se generen metabolitos extraños y únicos en la infancia (tal es el caso de la transformación de la teofilina en cafeína en el recién nacido, que solo acontece en este periodo de la vida)15,18.
Pese a las diferencias teóricas entre el funcionamiento hepático del niño con respecto al adulto, hemos encontrado que los agentes antibacterianos ocupan los primeros lugares en la lista de grupos terapéuticos incriminados en hepatotoxicidad, como ha sido publicado recientemente en adultos19–22. En estas amplias series de casos, amoxicilina/ácido-clavulánico fue también en términos absolutos la molécula involucrada en un mayor número de incidencias.
Muy pocos de los fármacos comercializados (siendo el paracetamol y el ácido acetilsalicílico los ejemplos más representativos) son capaces de producir lesión hepática dependiente de la dosis, y por ello se les denomina hepatotoxinas intrínsecas. La inmensa mayoría de los fármacos en uso originan reacciones hepatotóxicas de carácter impredecible y en sujetos que reciben dosis terapéuticas23. Este tipo de reacciones son consideradas como idiosincrásicas, es decir dependen de la singularidad única e intransferible del huésped y se cree que son el resultado de la interrelación entre factores derivados de la toxicidad potencial del propio fármaco, factores ambientales y factores genéticos14,24. En nuestra serie todos los niños presentaron toxicidad idiosincrásica. Los avances en la comprensión de la patogenia de las lesiones hepáticas tóxicas impredecibles han sido escasos por la inexistencia de modelos animales fiables, y los pocos estudios realizados en seres humanos, hasta el momento actual, han sido hechos en adultos. Por este motivo creemos que los datos aportados suponen una aproximación importante a la toxicidad idiosincrásica en niños y una base para futuras investigaciones.
Está descrito en adultos que la toxicidad hepática puede presentarse con manifestaciones clínicas cuya intensidad puede oscilar desde elevaciones asintomáticas de las enzimas hepáticas hasta insuficiencia hepática fulminante20. La forma de presentación más común es un cuadro clínico que simula la hepatitis viral aguda, con ictericia, náuseas, astenia y malestar o dolor abdominal. La presentación clínica más frecuente que hemos encontrado en la población pediátrica ha sido un episodio inespecífico de dispepsia gastrointestinal que solo en 2 ocasiones se ha acompañado de ictericia.
En la práctica clínica habitual, la atribución de causalidad de un medicamento se basa en la sospecha de hepatotoxicidad, junto con la pertinente exclusión de causas específicas, seguidos de la minuciosa búsqueda de exposición a tóxicos, una secuencia temporal compatible y el análisis del potencial hepatotóxico de los agentes identificados25,26. En las series publicadas en pacientes adultos, en la mayoría de los casos, la imputabilidad del medicamento es particularmente difícil debido a que hay un retraso considerable entre su interrupción y la aparición de la enfermedad hepática. Los casos que describimos no han presentado un importante retraso en la aparición de la elevación de las enzimas hepáticas con respecto a la administración del medicamento. Pensamos que en el momento actual, debido a la escasa sensibilización con respecto a este problema de salud en la población pediátrica no estamos detectando reacciones tóxicas alejadas en el tiempo de la administración del fármaco y, posiblemente, estas reacciones están siendo atribuidas a hepatitis virales inespecíficas.
Entre los criterios indicadores de hepatotoxicidad se encuentran la identificación de manifestaciones de hipersensibilidad, y la demostración de una rápida mejoría clínico-biológica tras la retirada de los fármacos (dechallenge). El patrón oro para el diagnóstico de hepatotoxicidad es la demostración de una recrudescencia de las alteraciones clínico-biológicas tras la reexposición al agente causal (rechallenge)27. Sin embargo, por razones éticas tal práctica no está justificada, salvo en circunstancias excepcionales. En nuestra serie la mejoría clínico-biológica ha sido evidente tras un periodo muy breve (todos los niños se encontraban asintomáticos a la semana del episodio y con las enzimas hepáticas en descenso). Ha existido reexposición accidental al fármaco en 3 ocasiones. Los 3 han evolucionado en el segundo episodio con un aumento mucho más importantes de enzimas hepáticas que en la primera exposición a pesar de que la evolución ha sido benigna. Estas 3 reexposiciones se podrían haber evitado con un análisis cuidadoso del primer episodio en el que se hubiera tenido en cuenta la posibilidad de hepatotoxicidad, infravalorada en la población pediátrica. A este hecho contribuye un error conceptual común: la creencia de que el diagnóstico de enfermedad hepática tóxica requiere confirmación mediante una biopsia hepática, cuando en realidad no existen manifestaciones histológicas que puedan ser consideradas absolutamente específicas de hepatotoxicidad12,28.
Las escalas diagnósticas para la evaluación de causalidad proporcionan un enfoque diagnóstico homogéneo y, usualmente, una categoría de probabilidad basada en una puntuación numérica. En la actualidad se utilizan 2 escalas o algoritmos diagnósticos para la evaluación de causalidad en hepatotoxicidad: la escala de CIOMS/RUCAM16 y la escala de María y Victorino25–29, también denominada escala diagnóstica clínica. Ambas escalas proporcionan un sistema de puntuación para 6 apartados en la estrategia de decisión. Las respuestas corresponden a valores ponderados que se suman para proporcionar una puntuación total. Dichas puntuaciones son trasladadas a categorías de sospecha. No existe validación de ninguna de ellas en la población pediátrica. Hemos utilizado la primera, pues ha demostrado una mayor consistencia con el juicio hecho por clínicos en hepatotoxicidad en adultos25,26. Creemos que serán necesarios nuevos estudios en pediatría, más amplios, para comparar la utilidad de ambas escalas diagnósticas.
El pediatra puede, ante el desarrollo de hepatotoxicidad, actuar en forma preventiva y curativa. La principal acción es no indicar fármacos innecesarios. Se estima que aproximadamente la mitad de los fármacos suministrados a los pacientes no tienen una indicación sólida con suficiente justificación científica. Si definitivamente se tiene que emplear un fármaco, en el futuro, el conocimiento del papel genético nos proporcionará una información valiosísima para la prevención de muchas de las toxicidades vistas en nuestros días; pero sin disponer de esta información en este momento de nuestra historia contemporánea, el clínico, antes de formular una medicación debe realizar una historia clínica exhaustiva que en especial indague sobre los antecedentes personales y familiares de hepatotoxicidad, y tener en cuenta los factores de riesgo asociados al desarrollo de esta (ambientales, mórbidos e intrínsecos del fármaco) para evitar al máximo su presentación o al menos detectarla lo más pronto posible.
El método seguido en este estudio, que podría calificarse de registro intensivo selectivo, facilita la notificación de las sospechas de hepatotoxicidad, puede mantenerse de forma permanente al no sobrecargar el trabajo diario de los médicos, y permite aproximar el número de reacciones adversas medicamentosas (RAM) hepatotóxicas detectadas a su incidencia real. Por otra parte, el método de la notificación voluntaria tiene la ventaja de su simplicidad; se acompaña, no obstante, del gran inconveniente de la infranotificacion. Conviene recordar que ambos métodos persiguen objetivos diferentes: el del presente estudio es conocer la incidencia real aproximada de las RAM hepatotóxicas en el área de influencia de los hospitales que actualmente colaboran en el registro, mientras que la notificación voluntaria pretende detectar las RAM graves e infrecuentes en la población general.
La principal limitación de nuestro método es que no detecta las RAM hepáticas poco significativas clínicamente en los servicios no diana y en la asistencia extrahopitalaria. Por el contrario, detecta todas las RAM hepatotóxicas de carácter grave-moderado que se producen en el medio que se implante y todas las generadas en los servicios diana sea cual sea su gravedad.
Es mucho lo que en la actualidad desconocemos de las RAM hepatotóxicas en niños pero creemos que los avances futuros en esta materia requerirán un mayor conocimiento de los factores genéticos y ambientales que hacen a un individuo único en su respuesta anormal a un fármaco. Es esperable que puedan desarrollarse modelos animales válidos para avanzar en la comprensión de la lesión hepática tóxica. Las investigaciones en las bases genéticas de la hepatotoxicidad idiosincrásica requerirán la identificación de un amplio número de sujetos afectos y el uso de ADN-tecas para la caracterización de polimorfismos en un único nucleótido, que diferencien a esta población de los sujetos expuestos que no desarrollan toxicidad.
Por todo ello creemos importante seguir completando esta base de datos con información rigurosa y prospectiva; muchos de los estudios actuales no aportan información suficiente para la catalogación de las reacciones30 para proporcionar una perspectiva real del problema en la práctica clínica.En conclusión, el registro de hepatopatías asociadas a medicamentos ha demostrado ser un instrumento útil para la creación de una red activa de especialistas motivados en la detección y comunicación de incidencias de hepatopatía tóxica, creando una «cultura fármaco-epidemiológica». La evaluación rigurosa de dichos casos ha posibilitado una mayor calidad y rigor de la información, aumentando las garantías de certeza diagnóstica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosA todos los miembros del grupo del proyecto «Estudio piloto de hepatopatías asociadas a fármacos en pediatría»: Dr. J. Romero (H. Universitario Virgen de las Nieves de Granada), E. Monteruel (H. de Cruces de Barakaldo), Dr. Andrade (H.U de Málaga), Dra. I. Lucena (H. clínico de Málaga), Dr. I. Ibarra (H. Reina Sofia de Córdoba), Dr. F. Martinón (HCU de Santiago) y Dra. J. del Castillo (HGU Gregorio Marañón de Madrid).
Este estudio ha sido realizado dentro del proyecto denominado «Estudio piloto de hepatopatías asociadas a farmacos en pediatria» (ref ec08/00116) subvencionado por el ISCIII en el marco del plan nacional de I-D-I correspondiente al subprograma de proyectos de investigación clínica no comercial con medicamentos de uso humano. Este trabajo está realizado dentro del CIBERehd (CB06/04/0044).