Sr. Editor:
Aspergillus spp., es el microorganismo que con más frecuencia produce infección fúngica invasora en los pacientes sometidos a trasplante de progenitores hematopoyéticos1. Más de un 70 % de los pacientes con aspergilosis pulmonar invasora (API) están diagnosticados de leucemia aguda. Los episodios de hemoptisis autolimitada debidos a invasión vascular fúngica, son frecuentes durante la fase de neutropenia. Sin embargo la hemoptisis masiva y fatal, de excepcional aparición, aparece generalmente durante la fase de recuperación medular2. Presentamos el caso de una niña de 12 años, diagnosticada de leucemia mieloblástica aguda refractaria al tratamiento convencional que desarrolló una API durante el tratamiento con quimioterapia.
Niña de 9 años diagnosticada de leucemia aguda mieloblástica, subtipo M0 de la FAB. Inicia quimioterapia de inducción (citarabina, idarrubicina y etopósido) según protocolo alemán BFM-98. Presenta mala respuesta a la quimioterapia con 40 % de blastos en el aspirado de médula ósea del día +15. Índice de galactomanano en suero positivo en el día +14 (2,4) y en el día +18 (0,96), sin evidencia de infección en las pruebas complementarias realizadas. Se inicia, la segunda inducción (citarabina y mitoxantrone) persistiendo neutropenia severa desde el inicio del tratamiento. Como complicaciones infecciosas de los dos primeros ciclos presenta: neutropenia febril tratada con antibióticos de amplio espectro y anfotericina B liposomal. Bacteriemia por Staphylococcus coagulasa negativo y sepsis por Staphylococcus auricularis, que precisó soporte con inotrópicos. Determinaciones seriadas de galactomanano negativas (2 por semana), excepto las ya mencionadas previas.
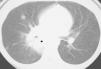
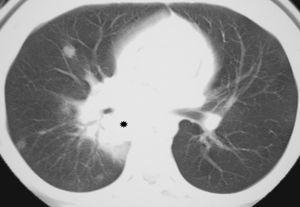
Treinta días tras la segunda inducción, persisten blastos en médula ósea, motivo por el que se administra un primer ciclo de quimioterapia de rescate IDAFLAG (idarrubicina, fludarabina y citarabina). Durante todo el ingreso se realizan repetidas tomografías computarizadas (TC) de tórax que son normales. Ante la persistencia de la fiebre y 62 días de neutropenia severa desde el inicio del tratamiento, se realiza una nueva TC de tórax, apreciándose lesiones compatibles con infección fúngica (fig. 1). Ante la sospecha de API, se sustituye la anfotericina B liposomal por la asociación voriconazol + caspofungina. Tres días después de la aparición de las lesiones en la TC, las determinaciones seriadas de galactomanano se positivizan (índice > 7). Ante la persistencia de la neutropenia prolongada, se decide realizar transfusión de granulocitos recuperándose la cifra normal de neutrófilos tras las mismas. A pesar de ello, persisten picos febriles diarios. Se realiza una nueva TC (20 días después de la primera) en la que se observa empeoramiento de las lesiones compatibles con API, con cavitación de la lesión y fístula bronquial. Se realiza fibrobroncoscopia, biopsia transbronquial y lavado broncoalveolar en el que se aísla y cultiva Aspergillus sp. En el aspirado de médula ósea no se aprecian blastos. Ante la aceptable respuesta de la enfermedad a la quimioterapia de rescate y la alta probabilidad de recaída de la enfermedad, se decide continuar con tratamiento quimioterápico, a pesar de la API. La paciente recibe un segundo ciclo de quimioterapia de rescate (IDAFLAG con 50 % de la dosis de citarabina e idarrubicina). Cuatro días tras finalizar el ciclo de quimioterapia, presentando un estado general aceptable, presenta hemoptisis masiva de aparición brusca, falleciendo por parada cardiorrespiratoria a pesar de reanimación cardiopulmonar avanzada.
Figura 1.En la tomografía computarizada de tórax con ventana de pulmón se visualiza una masa hiliar derecha (asterisco), que rodea al bronquio principal, presenta broncograma aéreo y unos límites mal definidos en vidrio deslustrado (el equivalente al signo del halo). También se aprecian varios nódulos pulmonares mal definidos. Dado el contexto clínico de la paciente todo ello es compatible con aspergilosis pulmonar angioinvasiva.
La aspergilosis pulmonar invasiva es la infección fúngica invasora más frecuente en los pacientes con neoplasias hematológicas. La incidencia estimada es del 5 al 25 %3. El cuadro clínico es inespecífico y consiste en fiebre persistente, tos, dolor torácico de tipo pleurítico y disnea. Las radiografías de tórax son generalmente normales en las fases iniciales, si bien la TC de tórax de alta resolución ha demostrado detectar precozmente la infección4. En cuanto a la determinación del galactomanano, diferentes estudios han demostrado que sus niveles séricos están estrechamente relacionados con la carga fúngica existente y la respuesta al tratamiento5. Es un test diagnóstico que presenta una excelente sensibilidad y especificidad en los adultos. En el campo pediátrico, se han descrito falsos positivos, que se relacionan con la administración de ciertos antibióticos y alimentos5,6. En nuestra paciente, llama la atención la existencia de dos determinaciones de galactomanano en suero positivas al inicio del período de la neutropenia, sin evidencia de infección clínica o radiológica. Posteriormente, el índice se negativizó, probablemente en relación con el tratamiento con anfotericina B durante el episodio de neutropenia febril. Cuando resultó nuevamente positivo, existía evidencia clínica y radiológica de aspergilosis. Los hemocultivos son negativos en casi la totalidad de los pacientes con API y los cultivos de esputo no son rentables en pacientes inmunodeprimidos. El diagnóstico definitivo normalmente se establece mediante estudio anatomopatológico y cultivo del tejido afectado3.
Los episodios de hemoptisis autolimitada se describen hasta en el 58 % de los pacientes adultos con API3. La hemoptisis masiva es poco frecuente y si aparece, lo hace durante el período de recuperación medular. Es en esta fase, con la recuperación de la cifra de neutrófilos y la migración de los mismos hacia las regiones afectadas por Aspergillus, cuando se produce una respuesta inflamatoria local que produce un incremento en la permeabilidad vascular y favorece la invasión de los vasos sanguíneos por Aspergillus, provocando una eventual hemoptisis masiva2,3.
La mortalidad global de los pacientes con API oscila según las series entre el 70 y el 100 % de los pacientes. El diagnóstico y tratamiento precoz con antifúngicos sistémicos, así como la respuesta al tratamiento de la enfermedad, son factores asociados con una evolución favorable7.
En la actualidad el tratamiento de elección de la API es el voriconazol7,8. Como alternativas, las formulaciones lipídicas de anfotericina B, el itraconazol y la caspofungina, se han mostrado eficaces en el tratamiento de esta infección3,4. El interés de un tratamiento combinado, surge de los pobres resultados obtenidos con los diferentes antifúngicos utilizados en monoterapia. En un estudio reciente, la administración de terapia combinada con caspofungina y voriconazol como tratamiento de rescate en los pacientes que no habían respondido al tratamiento inicial, demostró mejores resultados que el tratamiento en monoterapia con voriconazol9.
Para algunos autores, la presencia de hemoptisis autolimitada, el hallazgo de cavitación pulmonar o la presencia de una lesión cercana al mediastino en la TC constituyen potenciales indicaciones de cirugía precoz debido al mayor riesgo de hemoptisis fatal. Se han descrito numerosos casos de pacientes tratados satisfactoriamente mediante combinación de tratamiento quirúrgico y antifúngicos8,10. Las tasas de curación con el tratamiento combinado (cirugía y antifúngicos) oscilan entre el 64 y el 95 % de los pacientes.
En resumen, la hemoptisis masiva es una complicación fatal poco frecuente en los pacientes con API. El diagnóstico de leucemia mieloblástica aguda (especialmente durante la primera inducción) y la fase de recuperación medular tras la quimioterapia constituyen los principales factores de riesgo. Un diagnóstico precoz, con la realización seriada de pruebas diagnósticas, así como un tratamiento enérgico y eventualmente quirúrgico del proceso, son fundamentales para la supervivencia de estos pacientes.
Correspondencia: Dr. A. Lassaletta.
Servicio de Hemato-Oncología Pediátrica.
Hospital Universitario Niño Jesús.
Avda. Menéndez Pelayo, 65. 28009 Madrid. España.
Correo electrónico: alassaletta.hnjs@salud.madrid.org