La enfermedad de la sustancia blanca evanescente es una enfermedad genética de herencia autosómica recesiva que afecta a la sustancia blanca cerebral. Existen varios fenotipos que difieren en la gravedad y la edad de inicio. Clásicamente, se caracteriza por la aparición de ataxia, espasticidad y un deterioro motor progresivo con exacerbaciones desencadenadas por procesos febriles y traumatismos craneales leves.
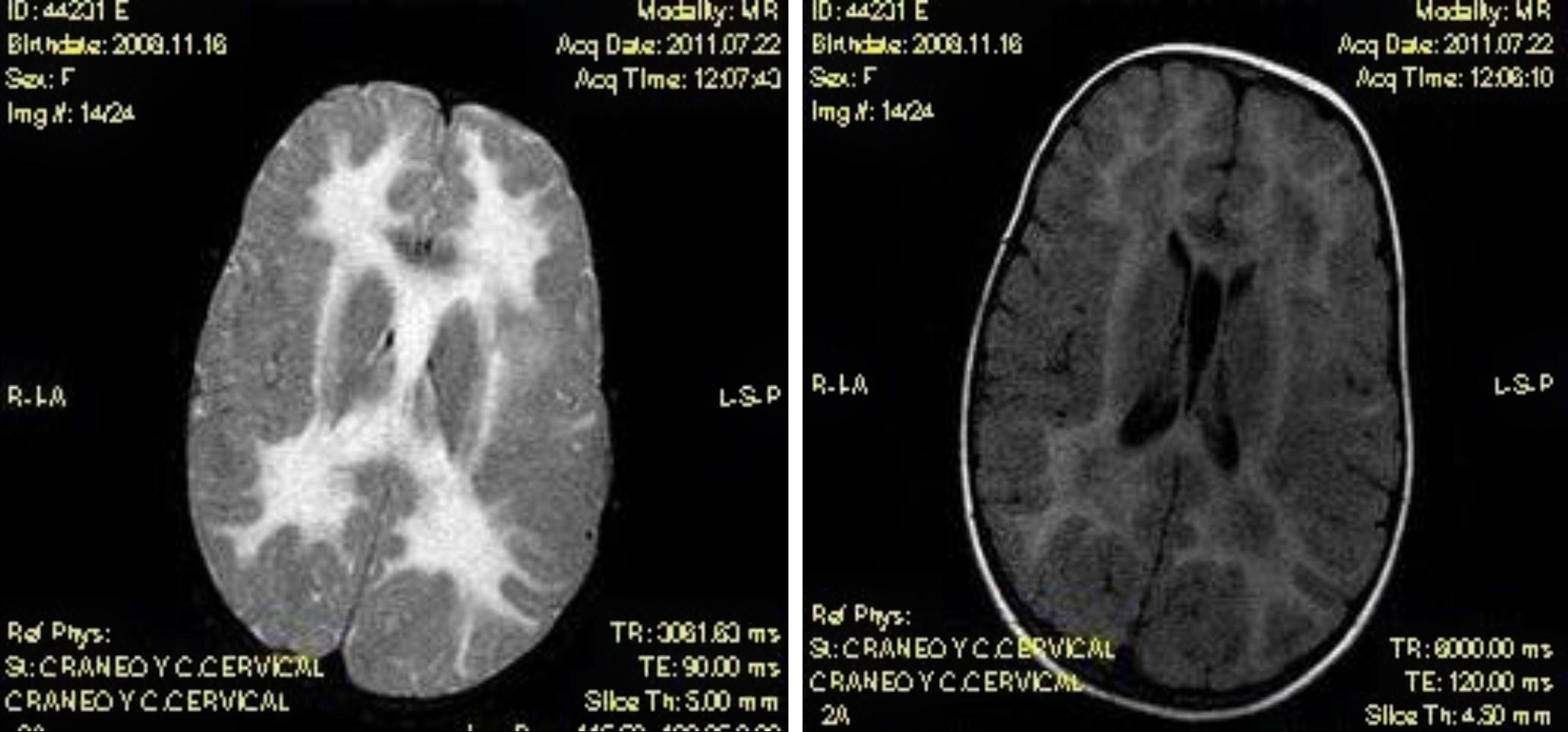
Niña de 2,5 años, que tras traumatismo craneal leve, presentó marcha atáxica, hemiparesia izquierda y reflejos osteotendinosos exaltados. En la resonancia magnética cerebral se observó afectación difusa y simétrica de la sustancia blanca cerebral, con hiposeñal en T1 e hiperseñal en T2, y FLAIR. Se sospechó enfermedad de la sustancia blanca evanescente que se confirmó en el estudio genético al encontrar 2 mutaciones consideradas patogénicas, en el gen EIF2B5, una de ellas no descrita previamente.
La hemiparesia debe incluirse entre las manifestaciones clínicas de la enfermedad de la sustancia blanca evanescente. El diagnóstico precoz puede ayudar a evitar infecciones y traumatismos, así como a realizar un adecuado consejo genético a las familias. Nuestro caso aporta además la identificación de una nueva mutación en el gen EIF2B5 (p.Gly132Ala en la posición 395), no descrita previamente, cuyas características sugieren que es patogénica con elevada probabilidad, por lo que estimamos que debería ser considerada entre las mutaciones del complejo EIF2B responsables de la enfermedad.
Vanishing white matter disease is a genetic disorder of autosomal recessive inheritance that affects the brain white matter There are various phenotypes that differ in severity and age at onset. Usually, it is characterized by ataxia, spasticity and a progressive motor decline with exacerbations triggered by fever and mild head traumas.
The patient was a 2.5 year-old girl who developed unstable gait, left hemiparesis and increased tendon reflexes following a mild head trauma. Brain MRI showed diffuse and symmetric white matter abnormalities with decreased signal on T1 and increased signal on T2 and FLAIR sequences. Vanishing White Matter disease was suspected. The diagnosis was confirmed by genetic molecular testing that showed 2 mutations in EIF2B5 gene. Both mutations were considered pathogenic, although one had not been previously described.
Hemiparesis must be included among clinical features of vanishing white matter disease. Early diagnosis can help to avoid infections and traumas and allows families to be genetically counselled. Our case contributes with the identification of a new mutation in EIF2B5 gene (p.Gly132Ala in position 395), not previously described. Its characteristics suggest a high probability of being pathogenic. We believe that it should be considered among the complex EIF2B mutations responsible for the disease.
La ataxia infantil con hipomielinización central es un trastorno descrito por primera vez en 1992 por Schiffman et al.1 y posteriormente denominado por Van der Knaap enfermedad de la sustancia blanca evanescente (ESBE).2 Se trata de una enfermedad de la sustancia blanca de causa genética y herencia autosómica recesiva. En el 90% de los casos se encuentran mutaciones en alguno de los 5 genes (EIF2B1, EIF2B2, EIF2B3, EIF2B4 y EIF2B5) que codifican las 5 subunidades del complejo EIF2B (eukaryotic translation factor 2B). Existen diferentes formas de presentación y severidad, según el momento de inicio: forma prenatal o congénita, caracterizada por una grave encefalopatía; formas subagudas: infantil (aquella que aparece en menores de un año), primera infancia (de inicio entre 1-5 años, que es la forma más frecuente), y adulta. La clínica consiste en la aparición aguda, ante un mínimo traumatismo craneal o síndrome febril, de un cuadro cerebelo-espástico caracterizado por ataxia, espasticidad y reflejos tendinosos exaltados, sin afectación del sistema nervioso periférico2. En las semanas siguientes, puede haber mejoría, generalmente solo parcial, apareciendo posteriormente un deterioro motor progresivo que se exacerba ante traumatismos craneales leves o cuadros febriles. Se han descrito también exacerbaciones por situaciones de estrés físico o emocional y temperaturas extremas3,4. Durante la evolución de la enfermedad pueden aparecer crisis epilépticas, atrofia del nervio óptico y signos de compromiso troncoencefálico. Las funciones cognitivas suelen están preservadas hasta estadios finales. La velocidad de progresión de la enfermedad es variable. La muerte frecuentemente ocurre durante la primera década de la vida, aunque se han descrito casos de comienzo tardío en niños mayores de 10 años, con una progresión lenta de la enfermedad.
En las pruebas de neuroimagen se observa afectación de la sustancia blanca cerebral, siendo de gran utilidad para el diagnóstico diferencial con otras leucoencefalopatías el algoritmo diagnóstico propuesto por Schiffmann et al.5. En la ESBE se encuentra una afectación difusa y simétrica de la sustancia blanca, con características de hiposeñal en secuencias potenciadas en T1 e hiperseñal en secuencias potenciadas en T2 y FLAIR6. Puede observarse también, en ocasiones, una cierta degeneración quística a nivel de lóbulo frontal y occipital.
El diagnóstico de la ESBE se realiza por sus características clínicas y de neuroimagen, no habiéndose identificado ningún marcador bioquímico. El estudio genético aporta el diagnóstico de confirmación al identificar mutaciones en alguno de los 5 genes que codifican el complejo EIF2B. Este complejo está implicado en la regulación del inicio de la traducción celular y su función es controlada mediante una serie de cinasas que se activan ante situaciones de estrés celular, lo que podría explicar las reagudizaciones de la enfermedad que tienen lugar durante cuadros febriles y traumatismos craneales, al producirse la activación del EIF2B mutado7,8.
Actualmente, no existe ningún tratamiento específico para esta enfermedad, pero son importantes una adecuada rehabilitación para lograr la mayor recuperación clínica tras las exacerbaciones, la correcta vacunación, la antibioterapia ante infecciones, los antipiréticos durante cuadro febril y evitar traumatismos craneales, así como la exposición a personas que cursen procesos febriles3.
Caso clínicoDescribimos el caso de una niña de 2 años y medio, con desarrollo psicomotor previo normal, que consultó en el servicio de urgencias por presentar marcha inestable tras un traumatismo craneal leve. A la exploración, presentaba un buen estado general, ausencia de dismorfias, peso, talla y perímetro craneal en percentiles adecuados, auscultación cardiorrespiratoria normal y abdomen sin megalias. Desde el punto de vista neurológico, se encontraba consciente, orientada, colaboradora durante la exploración, con pares craneales normales, pupilas isocóricas y normorreactivas, marcha muy inestable con aumento de la base de sustentación, reflejos osteotendinosos exaltados y hemiparesia izquierda. Se realizó una tomografía computarizada craneal en la que se objetivó una hipodensidad de la sustancia blanca periventricular y, posteriormente, una RMN cerebral que mostró una afectación difusa y simétrica de la sustancia blanca cerebral con características de hiposeñal en T1 e hiperseñal en T2 y FLAIR. En FLAIR se observaba además el inicio de formaciones quísticas en los lóbulos frontales y occipitales (fig. 1). El cuadro clínico y las alteraciones en la RMN cerebral hicieron sospechar una ESBE. Se solicitó un estudio genético, que confirmó el diagnóstico al encontrar 2 mutaciones consideradas patogénicas en el gen EIF2B5 (p.Leu106Phe, CMO13533, de tipo missense en el exón 2, y p.Gly132Ala en el exón 3), ambas en heterocigosis, siendo la paciente, por tanto, un homocigoto compuesto. Se realizó un estudio genético de los progenitores, siendo el padre portador en heterocigosis de la mutación p.Leu106Phe, y la madre p.Gly132Ala. En las semanas siguientes, con la ayuda de la fisioterapia, se observó una rápida mejoría de la hemiparesia, que se resolvió por completo. La ataxia, en cambio, mejoró solo parcialmente. Dos meses más tarde, la niña presentó nuevo traumatismo craneal leve, reapareciendo la clínica anteriormente descrita.
DiscusiónLa ESBE, también conocida como ataxia infantil con hipomielinización central, es una leucoencefalopatía de causa genética que se transmite por herencia autosómica recesiva. Es un trastorno crónico y progresivo que cursa con ataxia, espasticidad y, en ocasiones, atrofia óptica. Suele iniciarse en la infancia, en niños con un desarrollo psicomotor previo normal, provocando deterioro neurológico progresivo que se exacerba durante cuadros febriles y traumatismos craneales, tal y como ocurrió en nuestro caso.
Cabe destacar que en nuestra paciente, la ataxia se asoció a una manifestación inusual, la hemiparesia, descrita únicamente en otros 2 casos. En el año 2004, Fogli et al.7 publicaron el caso de un varón que presentó hemiplejía junto con ataxia durante la progresión de la enfermedad, quedando con una hemiparesia moderada residual. Posteriormente, en 2006, Ramaswamy et al.4 informaron el caso de un paciente que comenzó a los 18 meses de edad con ataxia y hemiparesia. Una semana más tarde logró una recuperación completa, pero la misma clínica reapareció en las exacerbaciones de la enfermedad4. En nuestra paciente, la recuperación clínica de la hemiparesia fue completa, mientras que en el caso de la ataxia fue solo parcial, reagudizándose ambas a los 2 meses, al sufrir accidentalmente otro traumatismo craneal leve.
El diagnóstico de ESBE puede confirmarse en la mayoría de los casos mediante el estudio genético, al identificar mutaciones de alguno de los 5 genes que forman el complejo EIF2B responsable de la enfermedad. En nuestra paciente, se hallaron 2 mutaciones en el gen EIF2B5, una de ellas ya conocida como causante de la enfermedad (p.Leu106Phe, CMO 13533, de tipo missense en el exón 2) y otra, p.Gly132Ala en la posición 395 (c.395 G>C) del exón 3 del gen EIF2B5, presente en heterocigosis, no descrita previamente en la bibliografía ni en las bases de datos http://www.hgmd.cf.ac.uk/ac/search.php, Gencards y Uniprot como relacionada con la enfermedad ni como una variante frecuente en la población. Esta nueva mutación de tipo missense supone el cambio en el codón 132 de un aminoácido glicina por otro, alanina. Al tratarse de un aminoácido de pequeño tamaño y sin polaridad que es sustituido por otro pequeño e hidrofóbico, se consideró la mutación como probablemente patogénica. Para predecir el efecto patológico o no del cambio aminoacídico, se introdujo esta variación genética en varios programas informáticos (Polyphen-2, SNP&Go, IN SILICO, MutPred y AlignGVGD) que realizan comparaciones de la estructura proteica para diferentes especies teniendo en cuenta parámetros como la función molecular, los componentes celulares y el grado de conservación evolutiva de los aminoácidos modificados, entre otros, para predecir la patogenicidad de la mutación, considerándose en todos ellos de alto riesgo de ser causante de la enfermedad (tabla 1). Al ser la primera vez que se describe esta mutación, desconocemos si esta puede tener relación con la inusual aparición de hemiparesia en nuestra paciente.
Resultados obtenidos por los programas informáticos Polyphen-2, SNP&Go, IN SILICO, MutPred y AlignGVGD para determinar la patogenicidad de una mutación
| Mutación: p.Gly132Ala | Resultado de diversos estudios para determinar la patogenicidad de la mutación |
| Polyphen-2 | Probablemente patológica al 99,4%. Sensibilidad 42%, especificidad 97% |
| SNP&GO | Riesgo alto de efecto patológico y ser causante de enfermedad |
| AlingGVGD | Riesgo muy elevado de que sea patológica |
| MutPred | Riesgo del 93,5% de que sea una mutación deletérea |
| In Silico | Según las características bioquímicas, probabilidad muy alta de ser una mutación patológica y causante de la enfermedad |
En resumen, la hemiparesia debe incluirse entre las manifestaciones clínicas de la ESBE, tanto en el comienzo como en las reagudizaciones. Una adecuada rehabilitación puede ayudar a conseguir mayor recuperación clínica, a pesar de lo cual el curso de la enfermedad es crónico y progresivo. El diagnóstico precoz puede ayudar a evitar infecciones y traumatismos, así como a realizar un adecuado consejo genético a las familias. Por otro lado, nuestro caso aporta la identificación de una nueva mutación en el gen EIFB5 (p.Gly132Ala en la posición 395), no descrita previamente, cuyas características sugieren que es patogénica, con muy elevada probabilidad. Consideramos, por tanto, que debe ser considerada entre las mutaciones del complejo EIF2B responsables de la enfermedad.
AutoríaLos autores son responsables de la investigación.Los autores han participado en su concepto y diseño, análisis e interpretación de los datos, escritura y corrección del manuscrito, y aprueban el texto final que ha sido enviado a Anales de Pediatría.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.