La toxoplasmosis congénita es la consecuencia de la transmisión fetal por vía transplacentaria de Toxoplasma gondii tras la primoinfección materna. El riesgo de infección fetal es bajo en infecciones en el primer trimestre y va aumentando con la edad gestacional, mientras que la gravedad de la infección disminuye con esta. El diagnóstico de infección materna se realiza mediante la demostración de seroconversión o ante la presencia de IgM positiva con anticuerpos IgG de baja avidez. Las gestantes con infección demostrada deben recibir espiramicina para intentar evitar su transmisión al feto. El diagnóstico de infección fetal se realiza mediante reacción en cadena de la polimerasa (PCR) en líquido amniótico obtenido a partir de la semana 18 de gestación. Si esta prueba resulta positiva, debe iniciarse tratamiento a la embarazada con pirimetamina, sulfadiazina y ácido folínico. La mayoría de los niños infectados nacen asintomáticos pero hasta el 80% desarrolla secuelas visuales o neurológicas durante su infancia y adolescencia. El diagnóstico neonatal es complicado porque los anticuerpos IgM e IgA y la PCR en sangre y líquido cefalorraquídeo pueden ser falsamente negativos. En estos casos, el diagnóstico puede realizarse mediante la constatación de un ascenso significativo de los anticuerpos IgG o la persistencia de los mismos después del año de vida. El tratamiento neonatal con pirimetamina y sulfadiazina disminuye la posibilidad de secuelas a largo plazo.
La toxoplasmosis congénita es una enfermedad prevenible mediante el cribado pregestacional y la adopción de medidas de profilaxis primaria en las gestantes seronegativas.
Congenital toxoplasmosis is the result of transplacental fetal infection by Toxoplasma gondii after the primary maternal infection. The severity of the disease depends on the gestational age at transmission. First trimester infections are more severe, but less frequent, than third trimester infections. Acute maternal infection is diagnosed by seroconversion or by the detection of IgM antibodies and a low IgG avidity test. In these cases, spiramycin should be initiated to prevent transmission to the fetus. For identification of fetal infection, polymerase chain reaction (PCR) testing of amniotic fluid after 18 weeks gestation should be performed. If fetal infection is confirmed, the mothers should be treated with pyrimethamine, sulfadiazine and folinic acid. Most infants infected in utero are born with no obvious signs of toxoplasmosis, but up to 80% developed learning and visual disabilities later in life. Neonatal diagnosis with IgM/IgA antibodies or blood/cerebrospinal fluid PCR may be difficult because false-negative results frequently occur. In these cases diagnosis is possible by demonstrating a rise in IgG titers during follow-up or by the detection of antibodies beyond one year of age. Early treatment with pyrimethamine and sulfadiazine may improve the ophthalmologic and neurological outcome. Congenital toxoplasmosis is a preventable disease. Pre-pregnancy screening and appropriate counseling regarding prevention measures in seronegative women may prevent fetal infection.
La toxoplasmosis congénita (TC) es una enfermedad poco frecuente. Sin embargo, sus graves consecuencias en algunos niños hacen que sea motivo de interés y preocupación por parte de obstetras y pediatras. Este Consenso presenta un estado resumido del diagnóstico y el tratamiento de la toxoplasmosis en la mujer embarazada y el recién nacido (RN) con la intención de ofrecer a los médicos responsables una información actualizada para optimizar su orientación clínico-terapéutica.
La incidencia de la toxoplasmosis gestacional y congénita varía mucho de unos países a otros e incluso de unas regiones a otras dentro del propio país. En España, existe poca información en este sentido, siendo más habituales los estudios de prevalencia que de incidencia. La seroprevalencia de toxoplasmosis en mujeres embarazadas en los últimos años en nuestro país está entre el 11 y el 28%, cifra que varía según el territorio y el año de estudio1,2, mientras que la incidencia de toxoplasmosis gestacional es del 1,9‰2. Esta baja incidencia es la causa principal de que no exista un control reglado de la mujer embarazada, siendo este más una decisión personal del médico que una recomendación de las sociedades médicas o de las autoridades sanitarias3. Aunque un documento de estas características no puede definirse en este sentido, sí, por lo menos, permite a aquellos profesionales afectados por esta problemática encontrar suficiente información como para hacer más fácil su actuación médica.
Diagnóstico microbiológico de la toxoplasmosis. Serología, reacción en cadena de la polimerasa y aislamientoEl diagnóstico de la toxoplasmosis es muy complejo, siendo difícil en muchos casos diferenciar la infección aguda o activa de la crónica.
El diagnóstico microbiológico se basa principalmente en métodos indirectos, como los serológicos, pero también en métodos de detección directa del parásito. En muchos casos, es necesario combinar diferentes métodos para conseguir la adecuada evaluación diagnóstica.
Diagnóstico inmunológico o serológicoSe fundamenta en la detección de anticuerpos específicos frente a Toxoplasma gondii (tabla 1). Sin embargo, la interpretación de estos no siempre resulta fácil.
- –
IgG. Aparece entre la 1.a- 2.a semana postinfección, se incrementa hasta la 6.a-8.a semana y persiste positiva durante toda la vida. Su detección solo indica exposición al parásito. Su estudio es de especial interés para el cribado de la infección en la gestante. La IgG se transmite por vía transplacentaria al RN. Para diferenciar las IgG transmitidas de la madre al hijo de las sintetizadas por este, resulta prometedora la técnica de Western blot realizada con el suero del niño y de la madre en paralelo4, aunque esta técnica se realiza en pocos laboratorios por su complejidad y su alto coste.
- –
IgM. Se hace positiva en la 1.a semana postinfección, elevándose los títulos después rápidamente hasta alcanzar el máximo en el primer mes. Comienza a descender a los 2 o 3 meses y desaparece posteriormente de manera muy variable en cada caso, permaneciendo positiva en ocasiones durante varios años5. Por lo tanto, la presencia de IgM en la gestante solo sirve de orientación sobre la posibilidad de una infección reciente y debe confirmarse con otras técnicas diagnósticas. En cambio, su presencia en el RN sí es determinante pues, al no atravesar la barrera placentaria, indica infección congénita. No obstante, se han descrito falsos positivos por «contaminación» con sangre de la madre, por rotura de la barrera placentaria, por el proceso de la extracción de la sangre del cordón o por falta de especificidad de la técnica utilizada6. Por otro lado, se ha observado la ausencia de IgM en aproximadamente el 25-30% de los RN infectados5,7 debido a la inmadurez del sistema inmunitario o a la baja sensibilidad de las técnicas utilizadas.
- –
IgA. Presenta una dinámica similar a la IgM. También puede persistir más de un año, por lo que su positividad en la gestante, al igual que la IgM, es informativa y no diagnóstica. Sí es diagnóstica en el RN, aunque, al igual que la IgM, también puede ser falsamente negativa en un 25-30% de los infectados.
- –
IgE. Se eleva rápidamente después de la infección aguda y desaparece antes de los 4 meses, permaneciendo detectable durante un corto y variable espacio de tiempo, por lo que no siempre es de utilidad diagnóstica6.
- –
IgG-avidez. Se basa en el incremento de la afinidad funcional (avidez) o fuerza de enlace entre la IgG específica y el antígeno. Esta fuerza se incrementa a lo largo de la infección, siendo los anticuerpos de baja avidez los originados en la fase temprana y los anticuerpos de alta avidez los producidos posteriormente. Un índice de alta avidez indica una infección en la que han transcurrido al menos 3 o 4 meses, mientras que una baja avidez señala una infección reciente, inferior a 3 meses. Sin embargo, se han descrito casos en los que se ha detectado baja avidez hasta un año o más tras la primoinfección7.
Diagnóstico indirecto de la toxoplasmosis congénita
| Diagnóstico | Anticuerpo | Diagnóstico prenatal (gestante) | Diagnóstico posnatal | Comentario |
| Serológico | IgG | Negativa: mujer en riesgo Positiva: protegidaPrimoinfección: si hay seroconversión o incremento de 3 veces el título de IgG entre 2 extracciones en 3-4 semanas | Escaso valor. Los Ac maternos pueden persistir hasta los 12 mesesEl tto. puede retrasar o anular la síntesis de Ac | Western-blot: esta técnica permite diferenciar los anticuerpos de la madre de los del recién nacido |
| IgG avidezÍndice de avidez:alta ≥ 30%,baja ≤ 20%,indeterminada entre: 20-30% | Alta avidez: infección antigua (> 3-4 meses)Baja avidez: infección reciente (< 3-4 meses) aunque en algunos casos se detectan hasta > 1 añoIndeterminada: no valorable | Sin interés diagnóstico | Los rangos del índice pueden variar según los criterios de la técnica empleada | |
| IgM | De escaso valor en la gestante, porque puede persistir positiva durante años | Su presencia confirma el diagnósticoPresente solo en el 75% de niños infectados | La S y E varía según los diferentes test comerciales | |
| IgA | Puede persistir más de 1 añoDuración e intensidad variable según respuesta de individuo | Su presencia confirma el diagnósticoPresente solo en el 75% de niños infectados | Detección informativa en combinación con el resto de Ig | |
| IgE | Alta E, baja SDuración e intensidad variable | – | Escasa utilidad diagnóstica |
Ac: anticuerpos; E: especificidad; S: sensibilidad.
Existen diversas técnicas (reacción en cadena de la polimerasa [PCR] convencional, PCR a tiempo real) que emplean diferentes secuencias a amplificar y métodos de tratamiento de las muestras8 (tabla 2). En los estudios realizados de técnicas de PCR aplicadas en diversas muestras, la especificidad y valor predictivo positivo (VPP) están próximos al 99-100%9-12.
Diagnóstico directo de la toxoplasmosis congénita
| Diagnóstico | Técnica | Muestra | Detección | Diagnóstico embarazada | Diagnóstico recién nacido | Comentario |
| Molecular | PCR | LA, LCR, sangre, orina, placenta, tejidos y muestras oculares | ADN de T. gondii | LA tomado > 18 semanas de gestaciónE 99-100%, S 60-80%Valor limitado en sangre por corta parasitemia | Sangre, LCR y orinaÚtil pero con S variableEs una técnica complementaria a la serología | Detecta parásitos vivos y muertos |
| Aislamiento | Cultivos celulares | Similar a la PCR | Trofozoítos intra y extracelulares | Poco utilizada | Poco utilizada | Específica. S inferior a la S de la PCR y a la de la inoculaciónDetecta parásitos vivos Resultado: 3 a 30 días |
| Inoculación al ratón | Similar a la PCR | Similar a los cultivos | Principalmente en LA | Aplicaciones similares a PCR | Específica. Sensibilidad próxima a la de PCR, mayor que el cultivoDetecta parásitos vivosResultados: 4-6 semanas | |
| Histológico | Tinciones, IFD, inmunohistoquímica, microscopia electrónica | Placenta, tejidos fetales | Trofozoítos y quistes | En estudio anatomopatológico de lesiones o muestras | En estudio anatomopatológico de lesiones o muestras | Rápido pero poco sensible |
Ac: anticuerpos; E: especificidad; Ig: inmunoglobulina; LA: líquido amniótico; LCR: líquido cefalorraquídeo; RN: recién nacido; S: sensibilidad.
En el diagnóstico prenatal la muestra de elección es el líquido amniótico. Esta muestra se debe tomar 4 semanas después de la fecha estimada de infección y siempre a partir de las 18 semanas de gestación13.
La PCR en el líquido amniótico presenta una sensibilidad entre el 65 y 92% y una especificidad próxima al 100%10-12,14. Parece que la sensibilidad del procedimiento varía en función de la edad gestacional de infección materna, con una sensibilidad máxima cuando la infección se produce entre las 17 y las 21 semanas10. El valor predictivo negativo (VPN) en las pacientes que han adquirido la infección en el primer trimestre es alto, debido a la baja transmisión del parásito a esta edad gestacional. Un resultado positivo indica infección congénita, pero un resultado negativo no puede descartarla. No obstante, la sensibilidad de la PCR en el líquido amniótico parece superior a la que se obtiene en sangre, orina o LCR en el RN, por lo que debe ofrecerse siempre ante la sospecha de infección materna en cualquier trimestre11. La técnica de PCR a tiempo real permite la cuantificación de la carga parasitaria. Una carga elevada parece estar relacionada con una infección fetal precoz y también, como factor independiente, con la gravedad de la infección15. Existen pocos estudios de PCR en sangre de cordón, encontrando una baja sensibilidad (16%), pero la positividad permite el tratamiento temprano14.
En el momento del nacimiento se puede realizar el estudio de PCR en preparado de placenta. La especificidad de una PCR positiva en placenta con respecto a la posibilidad de infección del RN es del 97%. Esto indica que en algunos casos la placenta está infectada, pero el feto aún no lo está. La sensibilidad varía entre el 50% en el primer trimestre y el 87% en el tercer trimestre16. El estudio anatomopatológico de la placenta es poco rentable por su falta de especificidad, por lo que se desaconseja17.
La PCR en sangre, orina y LCR en el diagnóstico posnatal se puede realizar como complemento del estudio serológico del RN con sospecha de infección cuando no se detectan IgM o IgA específicas5,9,18. Esta técnica presenta buena especificidad, por lo que un resultado positivo confirma la infección. Sin embargo, la sensibilidad es más baja, por lo que un resultado negativo no excluye la infección y en estos casos siempre se debe realizar un seguimiento serológico. El análisis simultáneo de los 3 tipos de muestras permite incrementar la sensibilidad18.
Técnicas de aislamiento del parásitoSe realizan mediante inoculación intraperitoneal en animales (ratón) o en cultivos celulares5. Es un diagnóstico de confirmación y referencia, pero la sensibilidad y el VPN varían mucho según las condiciones de la muestra, conservación, carga parasitaria y virulencia de la cepa (tabla 2).
Diagnóstico de la infección en la embarazada y el fetoDiagnóstico de la infección en la embarazada y cribado prenatalLa toxoplasmosis es una infección habitualmente asintomática en la mujer embarazada inmunocompetente, aunque ocasionalmente puede presentar un cuadro inespecífico de malestar general, febrícula y adenopatías generalizadas13,19. Por ello, la mayoría de las infecciones maternas se diagnostican a partir del cribado serológico gestacional. El cribado es también la única manera de diagnosticar a todos los niños con TC, ya que la mayoría de las infecciones son asintomáticas al nacimiento y no presentan alteraciones ecográficas prenatales.
El beneficio de cribar de forma universal a las gestantes es controvertido y la aplicación del cribado es variable en los distintos países europeos3,20. El último Documento de Consenso de la Sociedad Española de Ginecología y Obstetricia21 considera que el cribado prenatal de la toxoplasmosis no cumple los criterios necesarios para ser aplicado rutinariamente, aunque en la práctica clínica se solicita de forma trimestral a la mayoría de las gestantes seronegativas.
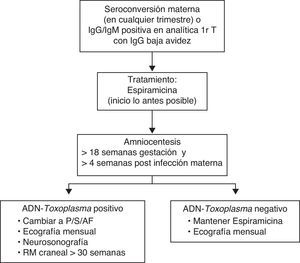
El diagnóstico definitivo de infección materna es la demostración de seroconversión de la IgG durante el embarazo o el aumento por 3 o más de los títulos de IgG entre 2 extracciones separadas 3-4 semanas. El resultado de una IgG positiva con IgM también positiva en la analítica del primer trimestre hace sospechar una infección reciente, pero dada la larga duración de la IgM, no indica con seguridad que la infección haya tenido lugar durante la gestación. Los anticuerpos IgM pueden persistir positivos durante más de un año después de la infección aguda y una IgM positiva durante el embarazo representa una infección reciente únicamente en un 40% de los casos22. Por lo tanto, antes de decidir cualquier conducta, se recomienda repetir la IgM en un laboratorio de referencia, siendo indispensable realizar también un estudio de avidez de la IgG. La presencia de una IgG de elevada avidez o avidez intermedia en el primer trimestre del embarazo permitirá descartar con toda seguridad la infección en el periodo gestacional. A diferencia de lo que sucede con otras infecciones, como el citomegalovirus (CMV), es excepcional que las infecciones por T. gondii en el periodo pregestacional representen un riesgo de transmisión para el feto20. En cambio, la presencia de una IgM positiva con IgG de baja avidez hace que la infección gestacional sea probable, por lo que debe iniciarse tratamiento y programar un estudio diagnóstico fetal en líquido amniótico23 (fig. 1). A pesar de sus limitaciones, se ha visto que una correcta interpretación de la serología disminuye los tratamientos innecesarios, la ansiedad materna e incluso las interrupciones de la gestación13,22.
Diagnóstico de la infección en el fetoEl riesgo de infección fetal es directamente proporcional al trimestre en que se produce la infección materna: inferior al 15% en el primer trimestre (1% en las primeras 6 semanas), entre el 20 y el 50% en el segundo trimestre, y entre el 55 y el 80% en el tercer trimestre (80% a las 40 semanas)19,24-26. En cambio, la frecuencia de las secuelas y la gravedad de las mismas son inversamente proporcionales al trimestre de la infección materna. Una infección en el primer trimestre puede producir abortos y lesiones cerebrales u oculares graves (tabla 3). Las infecciones sintomáticas al nacimiento provienen sobre todo de infecciones adquiridas antes de las 24 semanas, excepto la afectación ocular, que también se puede producir en infecciones adquiridas durante el tercer trimestre19,25.
Riesgo de transmisión y afectación fetal en función de la edad gestacional de la infección maternaa
| Edad gestacional | Transmisión vertical | Afectación fetal | Tipo de afectación |
| < 14 semanas | < 10% | 60% | Puede ser grave. Lesiones intracraneales y oculares |
| 14-28 semanas | 15-55% | 25% | En general, no es grave. Sobre todo lesiones oculares |
| > 28 semanas | 55-80% | 15% | Excepcional afectación intracraneal. Lesiones oculares |
Ante la sospecha o la evidencia de una infección materna, debe realizarse el diagnóstico de infección fetal (fig. 1). El líquido amniótico es el medio biológico más útil para realizar técnicas diagnósticas y la amniocentesis ha desplazado a la cordocentesis.
Diagnóstico de afectación fetalEstá indicado realizar un seguimiento ecográfico detallado, para detectar las posibles anomalías ecográficas compatibles con afectación fetal, a todas las pacientes con sospecha o diagnóstico confirmado de infección materna durante el embarazo. Se ha visto que existe una buena correlación entre la gravedad de las lesiones ecográficas y el pronóstico neonatal27. La ventriculomegalia y las calcificaciones intracraneales (nódulos hiperecoicos) son las anomalías ecográficas más frecuentes. Los nódulos hiperecoicos aislados no se correlacionan necesariamente con un mal pronóstico neurológico, pero parecen incrementar el riesgo de coriorretinitis28. Las infecciones fetales muy graves pueden dar lugar a lesiones destructivas del parénquima cerebral27. Las lesiones extracraneales son menos frecuentes e incluyen ascitis, hidropesía, hepatoesplenomegalia, calcificaciones intrahepáticas y engrosamiento placentario.
En casos de seroconversión materna y PCR negativa en el líquido amniótico, se recomienda un seguimiento ecográfico mensual de la embarazada debido a la posibilidad de un falso negativo de la PCR. En casos de infección fetal confirmada en el líquido amniótico, el seguimiento ecográfico debe ser realizado por ecografistas experimentados e incluir una neurosonografía mensual y una resonancia magnética (RM) intracraneal a partir de las 30 semanas29.
La detección del parásito en el líquido amniótico confirma la transmisión de la infección, pero no es sinónimo de afectación fetal. Hay que tener en cuenta y explicar a la paciente que el riesgo de afectación fetal está relacionado con el trimestre de la infección y que la ecografía tiene una capacidad diagnóstica elevada para la detección de anomalías, excepto las oculares. Los marcadores ecográficos pueden aparecer de forma tardía, pero la ausencia de anomalías ecográficas al final de la gestación es tranquilizadora sobre la posibilidad de infección neurológica grave al nacimiento. La mayoría de los protocolos y la opinión de los expertos recomiendan ofrecer la interrupción de la gestación únicamente cuando aparecen anomalías ecográficas13,30-32. No obstante, en los casos de infección fetal antes de las 14 semanas, confirmada en líquido amniótico a partir de las 18 semanas, y en ausencia de anomalías ecográficas en el momento del diagnóstico, la paciente debe ser informada sobre los riesgos fetales y puede decidir la posibilidad de una interrupción legal de la gestación. La información se debería dar de forma preferente en un centro de referencia con experiencia. Para facilitar la opción de un seguimiento dirigido, la paciente debe ser informada de que en casos de afectación fetal grave existe la posibilidad de una interrupción legal tardía, ya sea en nuestro país o en otros países de la Unión Europea.
Prevención y tratamiento de la infección en la embarazadaPrevención de la toxoplasmosis en la gestante no inmuneSe indicarán unos consejos profilácticos a toda mujer embarazada que presente una serología IgG negativa (gestante no inmune) en la primera visita del embarazo.
- 1.
Consumir únicamente carne cocinada a más de 66°C (bien hecha) o carne congelada en cámara frigorífica (el parásito se destruye a –20°C en 24h).
- 2.
Lavar las frutas y las verduras, fundamentalmente aquellas que puedan estar ensuciadas por restos de tierra.
- 3.
Lavarse las manos después de haber tocado carne cruda o verduras.
- 4.
Evitar el contacto con gatos desconocidos. Si se posee gato, manipular el animal con guantes, desinfectando sus utensilios con agua hirviendo o lejía.
- 5.
Si se realizan labores de jardinería o similares, protegerse las manos con guantes.
- 6.
No consumir embutido, fundamentalmente casero.
El tratamiento prenatal de la toxoplasmosis persigue 2 objetivos: disminuir el riesgo de infección fetal y disminuir las secuelas de los fetos infectados.
Tratamiento de la infección por toxoplasmosis en la embarazada
| Fármaco | Dosis | Indicaciones | Comentarios |
| Espiramicina | 1 g/8 h vo hasta el parto | Disminuir el riesgo de infección fetal | Se recomienda continuar con el tratamiento hasta el final del embarazo, aunque puede considerarse su suspensión en mujeres con infección probable y PCR en líquido amniótico negativa |
| Pirimetamina | 50 mg/día vo hasta el parto | Disminuir las secuelas de fetos infectados | Teratógeno. No utilizar antes de las 18 semanasDepresión de médula óseaAñadir ácido folínico 10-15 mg/día vo. Hemograma semanal |
| Sulfadiacina | 2 g/12 h vo hasta el parto | Disminuir las secuelas de fetos infectados | Depresión de médula óseaAñadir ácido folínico 10-15 mg/día vo. Hemograma semanal |
La espiramicina ha sido el tratamiento correcto para la disminución del riesgo de infección fetal durante las últimas décadas. Sin embargo, su eficacia es difícil de evaluar, ya que depende de las semanas de gestación en el momento de la infección materna y de si el feto ya está infectado al iniciar el tratamiento33. Una extensa revisión sobre la efectividad de la espiramicina en 1,438 madres tratadas concluye que la transmisión vertical es menor cuando se inicia el tratamiento en las 3 semanas siguientes a la seroconversión, en comparación con el inicio del tratamiento pasadas 8 o más semanas25. De cualquier forma, se sigue recomendando el tratamiento con espiramicina siempre que exista una sospecha serológica razonable de infección materna durante el embarazo. La dosis recomendada es de 1 g/8 h por vía oral fuera de las comidas13,34. Clásicamente se ha recomendado que el tratamiento con espiramicina se mantenga hasta el final de la gestación, aunque el estudio del líquido amniótico sea negativo, por la posibilidad de que el Toxoplasma pueda permanecer en la placenta hasta el final del embarazo a pesar del tratamiento. No obstante, recomendaciones recientes sugieren que en casos con resultado negativo en el líquido amniótico obtenido por encima de la 18.ª semana de gestación y una vez completadas por lo menos 4 semanas de tratamiento, se puede valorar suspender la espiramicina28, lo cual podría estar especialmente indicado en gestantes con diagnóstico de infección probable.
El tratamiento para disminuir las secuelas en los fetos infectados es más controvertido, ya que depende de la edad gestacional en el momento de la infección, así como de un diagnóstico precoz de la misma. Aunque no hay estudios que demuestren una disminución de las lesiones intracraneales ni de la coriorretinitis posnatal a pesar del inicio precoz del tratamiento, sí se ha demostrado una reducción de las secuelas neurológicas graves y de la muerte posnatal de los RN con TC cuyas madres fueron tratadas en el embarazo25,35-37. A pesar de que la mayoría de los estudios no demuestran una mayor efectividad cuándo se usa la combinación de pirimetamina-sulfadiacina sobre espiramicina sola, se sigue recomendando la combinación, ya que la espiramicina atraviesa en menor cantidad la placenta, obteniéndose unos niveles insuficientes en sangre fetal para tratar la infección34. La pirimetamina ha demostrado ser teratógeno en estudios con animales, por lo que no debe administrarse antes de las 18 semanas de gestación13. Por otra parte, la sulfadiazina puede causar fallo renal agudo reversible. Por tanto, debido a la potencial toxicidad de estos fármacos, su uso durante el embarazo debería restringirse únicamente a aquellas gestantes con confirmación de infección fetal en el líquido amniótico19,25.
Existen 2 regímenes de administración de pirimetamina y sulfadiazina13,34,38:
- 1.
Administrar 3 semanas seguidas pirimetamina (50mg/día vía oral) junto con sulfadiazina (4g/día divididos en 2 a 4 dosis por vía oral) alternando con 3 semanas de espiramicina (1g/8 h por vía oral) hasta el parto.
- 2.
Administrar de forma continua pirimetamina y sulfadiazina hasta el parto.
A cualquiera de estas 2 pautas debe añadirse ácido folínico en dosis de 10 a 15mg/día. Deben realizarse hemogramas frecuentes con recuento de eritrocitos, leucocitos y plaquetas. Si se objetivan alteraciones en el hemograma, se hará una pauta terapéutica discontinua de días alternos.
A las mujeres con infección fetal demostrada y alergia a la pirimetamina, puede administrárseles trimetoprim-sulfametoxazol, suspendiendo también en este caso la sulfadiazina, aunque es poco conocida su eficacia y seguridad intraútero38. En las gestantes alérgicas a las sulfamidas, aunque no hay pautas de tratamiento establecidas, una posibilidad sería combinar la pirimetamina y el acido folínico con azitromicina (500mg/24h) o con clindamicina (300mg/8h), que han mostrado ser parcialmente eficaces frente a T. gondii.
Diagnóstico neonatalEl diagnóstico de la TC en el RN comienza por una correcta recogida de datos de la toxoplasmosis gestacional. Con los datos del embarazo se puede establecer la semana en que ocurrió la infección materna y valorar así el riesgo y el pronóstico de la infección fetal.
Sintomatología de la toxoplasmosis en el recién nacidoLos signos y síntomas de la TC son muchos y muy variados, pero nunca específicos (tabla 5)17,19,39.
Clínica de la toxoplasmosis congénitaa
| Clínica en enfermedad neurológica | Clínica en enfermedad generalizada |
| Coriorretinitis (94%) | Esplenomegalia (90%) |
| Alteraciones en el líquido cefalorraquídeo (55%) | Alteraciones del líquido cefalorraquídeo (84%) |
| Calcificaciones encefálicas (50%) | Ictericia (80%) |
| Convulsiones (50%) | Anemia (77%) |
| Anemia (50%) | Fiebre (77%) |
| Hidrocefalia (29%) | Hepatomegalia (77%) |
| Ictericia (28%) | Linfoadenopatías (68%) |
| Esplenomegalia (21%) | Coriorretinitis (66%) |
| Linfoadenopatías (17%) | Neumonitis (41%) |
| Microcefalia (13%) | Exantema (25%) |
| Cataratas (5%) | Eosinofilia (18%) |
| Eosinofilia (4%) | Hidrocefalia/microcefalia (0%) |
| Microftalmía (2%) | Microftalmía (0%) |
Frecuencia de presentación entre paréntesis.
También hay que considerar que la TC mantiene una clínica semejante con otras infecciones congénitas, especialmente con el CMV.
Por su frecuencia y las características las lesiones coriorretinianas y las encefálicas, son las más típicas y, también, las más graves, por lo que son las que más debe buscar el pediatra.
Exploraciones complementariasAl RN con TC confirmada o probable deben realizarse estudios analíticos, de imagen y de microbiología.
- 1.
Hemograma y bioquímica completa con función hepática. La analítica carece de especificidad y solo es útil para determinar el grado y la extensión de la enfermedad.
- 2.
Fondo de ojo (es muy aconsejable que sea realizado por un oftalmólogo habituado a niños).
- 3.
Estudio de imagen: ecografía cerebral transfontanelar o RM cerebral. Una ecografía cerebral realizada por una persona experta puede obviar la RM17. Los hallazgos de neuroimagen más característicos son las calcificaciones y la hidrocefalia.
- 4.
Estudio citoquímico del LCR.
- 5.
Estudio microbiológico.
- –
Obligado: IgM e IgG en la primera semana de vida. Si está disponible, realizar también IgA.
- –
Recomendado: PCR en sangre, LCR y orina.
- –
Opcional: estudio de PCR en placenta.
- –
Según la sintomatología encontrada y el resultado de las pruebas diagnósticas realizadas, se puede clasificar la situación del RN en los siguientes apartados40.
A. Recién nacido con TC. El niño debe recibir tratamiento en todos los casos.
Se considera infectado en las siguientes situaciones:
- 1.
Niño sintomático con IgM y/o IgA positivas. Se considera sintomático cuando tiene cualquiera de estos datos: clínica característica, estudio de imagen compatible, estudio oftalmológico positivo, hiperproteinorraquia. Se debe descartar infección por CMV, virus de la coriomeningitis linfocitaria, virus herpes simple (VHS), virus varicela-zóster, sífilis y tuberculosis19.
- 2.
Niño sintomático con IgM e IgA negativas (descartar igualmente las infecciones anteriores):
- –
Con historia de toxoplasmosis gestacional.
- –
Sin historia gestacional o confusa, pero con PCR positiva en sangre, orina o LCR, o PCR positiva en placenta.
- –
- 3.
RN asintomático pero con historia de toxoplasmosis gestacional y cualquiera de las siguientes:
- –
IgM/IgA positiva en sangre al nacimiento.
- –
PCR en sangre, orina o LCR positiva al nacimiento.
- –
PCR positiva en placenta.
- –
Historia de PCR positiva en líquido amniótico.
- –
Se aconseja un seguimiento de los anticuerpos IgG, IgM e IgA. Si las IgG se hacen negativas, suspender el tratamiento y confirmar la negatividad de IgG en al menos 2 controles separados 4-6 semanas. Si la IgG se positiviza de nuevo, reiniciar el tratamiento hasta completar 12 meses. No hay acuerdo en estos casos si se debe considerar el tiempo de administración anterior o iniciar de cero41. Si la IgG persiste negativa, se considera un falso diagnóstico.
B. Recién nacido con TC dudosa:
- 1.
Con antecedentes de infección gestacional confirmada pero asintomático al nacimiento y con IgM, IgA y PCR negativas. En este caso es importante valorar el momento de la infección gestacional mediante los datos aportados por la madre o el obstetra.
- –
Infección gestacional en el primer trimestre. El niño no necesita seguimiento, ya que la infección fetal en este trimestre es muy poco probable y, si se produce, suele ser acompañada de sintomatología.
- –
Infección gestacional en el segundo trimestre. Seguimiento de la IgG sin tratamiento. La TC en este caso suele ser sintomática, aunque hay ya casos asintomáticos.
- •
Si la IgG se hace negativa, dar de alta.
- •
Si persiste positiva > 6 meses o no hay un descenso significativo en cada control serológico mensual, realizar de nuevo un fondo de ojo. No es preciso realizar la punción lumbar. Si hay alteraciones, iniciar tratamiento. Si es normal, repetir IgG mensualmente. Si la IgG mantiene un descenso continuado, esperar hasta que se haga negativa para dar de alta. Si no desciende en 2-4 meses, repetir fondo de ojo al tiempo que se inicia tratamiento. Se valorará individualizadamente ecografía cerebral transfontanelar o resonancia magnética.
- •
- –
Infección gestacional en el tercer trimestre. Los casos asintomáticos de TC son muy frecuentes en este periodo gestacional. Hacer seguimiento de IgG pero con tratamiento completo. Si la IgG se hace negativa, retirar el tratamiento y confirmar la negatividad de IgG en al menos 2 controles separados 4-6 semanas. Si la IgG se positiviza, reiniciar el tratamiento hasta completar 12 meses.
- –
- 2.
RN con síntomas característicos, pero con IgM, IgA y PCR negativas sin datos de la gestación o estos son dudosos. Deben descartarse otras infecciones. Se debe iniciar tratamiento con seguimiento de la IgG. La IgG de transferencia materna suele hacerse negativa antes de los 6 meses19, aunque puede persistir hasta un año42. Si la IgG se hace negativa, actuar como en la situación anterior.
La mayoría de las fuentes consultadas no dudan en recomendar el tratamiento a los neonatos con TC confirmada. Sin embargo, hay que destacar que a día de hoy no se dispone de ningún estudio controlado que determine su eficacia, los fármacos más adecuados y sus dosis, así como la duración óptima del mismo19,43,44.
Estudios de cohortes con un seguimiento prolongado sugieren que aquellos niños que recibieron tratamiento durante 12-24 meses tienen menos secuelas y menor riesgo de coriorretinitis en comparación con los controles históricos no tratados o tratados durante menos de 4 semanas45-47. Sin embargo, otros autores opinan que al menos para la coriorretinitis ni el tratamiento prenatal ni el posnatal influyen significativamente en el riesgo de presentar recaídas a lo largo de la vida25,48,49.
La práctica totalidad de los autores coinciden con la pauta de tratamiento, siendo la duración del mismo más discutida. Mientras que en Estados Unidos50 y Francia51 la duración establecida por sus sociedades científicas es de 12 meses, en Dinamarca52 es de 3 meses. La mayor duración del tratamiento se ha asociado a un menor índice de secuelas. Los tratamientos más cortos tienen la ventaja de reducir la toxicidad farmacológica43.
Indicaciones del tratamiento según la valoración del recién nacidoA. Recién nacido con TC:
- 1.
Sintomático.
- –
Pirimetamina: 12 meses, 6 meses diaria y 6 meses días alternos.
- –
Sulfadiazina: 12 meses diaria.
- –
Ácido folínico: 12 meses, 3 días por semana.
- –
Corticoides: 1-2 meses si coriorretinitis o proteinorraquia.
- –
- 2.
Asintomático. pirimetamina + sulfadiazina+ ácido folínico 12 meses: pirimetamina diaria entre 2-6 meses. Completar hasta 12 meses en días alternos.
B. Recién nacido con TC dudosa. Si se inicia tratamiento, este será igual que en la situación A2.
FármacosLos fármacos disponibles para el tratamiento de la toxoplasmosis son subóptimos, pues solo inhiben el crecimiento del parásito cuando está en la fase activa de su ciclo vital (taquizoíto), no siendo útiles frente a la forma quística o latente del parásito (bradizoítos). La dosis y los intervalos de dosificación de los diferentes fármacos se muestran en la tabla 6.
Tratamiento de la toxoplasmosis congénita
| Características de la infección | Tratamiento | Dosis | Duración |
| Infección congénita sintomática | PSAF | Inicio: 1 mg/kg/12 h, durante 48 hPosteriormente:1 mg/kg/día, hasta los 6 mesesDel mes 6 al 12: 1 mg/kg lunes-miércoles y viernes. Dosis máxima: 25mg.100 mg/kg/día, repartido en 2 dosis5-10 mg/3 días por semana | 12 meses12 meses12 meses y 1 semana |
| Infección congénita sintomática con afectación LCR o coriorretinitis activa con alt. visióna | P + S + AFCorticoides | Igual que en apartado anterior1 mg/kg/día, repartido 2 veces al día | Igual que en apartado anterior.Hasta normalización LCR o reducción inflamación de la retina |
| Infección congénita asintomática | P + S + AFb | Igual que en el primer apartado. En esta situación a partir del 2-6 mes puede pasarse a administrar dosis de pirimetamina a días alternos hasta el mes 12 | 12 meses |
| Infección dudosa | P + S + AF | Igual que en el primer apartado | Se mantendrá hasta descartar la infección (seguimiento de IgG). De confirmarse la pauta se mantendrá durante 12 meses |
AF: ácido folínico; P: pirimetamina; S: sulfadiazina.
– Pirimetamina. Los principales efectos secundarios son los hematológicos, especialmente neutropenia, habiéndose descrito casos de supresión medular y anemia aplásica. Otros efectos menos comunes son rash, síntomas gastrointestinales, urticaria y trombocitosis. Un efecto raro, pero que puede conducir a un diagnóstico equivocado de fenilcetonuria, es la posible hiperfenilalaninemia que causa el tratamiento con pirimetamina.
Con el fin de evitar sobredosificación, se recomienda la preparación de solución oral a partir del principio activo, con fórmula magistral con concentración 2mg/ml de pirimetamina. Debe indicarse a la familia que el número de mililitros a administrar es la mitad del peso, repartido cada 12 h los primeros 2 días y una única dosis al día, posteriormente. Si no se puede dar en solución, debe hacerse una preparación galénica en farmacia con unidosis en cápsulas o sobrecitos según el peso del niño, hasta que este alcance un peso proporcional a la partición del comprimido.
– Sulfadiazina. La sulfadiazina es la sulfamida más activa frente a T. gondii. Tiene actividad sinérgica con la pirimetamina. Es excretada por el riñón, por lo que precisa de ajuste de dosis en los pacientes con insuficiencia renal. Debe evitarse en pacientes con déficit de 6-glucosa-fosfato-dehidrogenasa (G6FD), sustituyéndose por clindamicina. Interacciona con los anticonvulsivantes, prolongando la vida media de fenitoína, y su administración concomitante con clonazepam, carbamacepina, zidovudina y trimetoprim-sulfametoxazol aumentan su toxicidad medular. Los efectos secundarios más comunes son rash, cristaluria, anemia y toxicidad medular. No se dispone de presentación en solución oral de sulfadiazina y esta deberá ser preparada, siendo estable durante 7 días. Se recomienda la preparación en solución a una concentración de 100mg/ml y la cantidad del fármaco que se debe administrar es la mitad del peso del paciente, 2 veces al día.
– Acido folínico. Se utiliza para evitar la toxicidad de la pirimetamina. No tiene actividad frente a Toxoplasma pero disminuye la toxicidad de la pirimetamina, ya que puede ser transformado por las células humanas en ácido fólico, mientras que por el parásito no. La dosis es de 5-10mg 3 veces por semana y hasta una semana después de suspender la pirimetamina.
– Clindamicina. Se dispone de poca experiencia en el tratamiento de la TC. La dosis de clindamicina sería de 25-30mg/kg/día repartida en 4 dosis.
– Espiramicina. Su utilización queda reservada a la prevención de la transmisión vertical.
Pauta de tratamientoLa pauta de elección es pirimetamina + sulfadiazina + ácido folínico. Solo en caso de alergia a la sulfadiazina, esta será sustituida por clindamicina.
En casos en que no puedan utilizarse pirimetamina y sulfadiazina, y solo de forma excepcional, algunos autores recomiendan espiramicina a dosis de 100mg/kg/día, repartida en 2 dosis53.
La administración de corticoides (prednisona, 1mg/kg/día repartido en 2 dosis) se recomienda en caso de hiperproteinorraquia marcada (proteínas en LCR >1 g/dl) o si el paciente presenta coriorretinitis activa. El tratamiento se mantendrá hasta la normalización del LCR (control de LCR en un mes) o hasta que desaparezcan los signos de actividad en la coriorretinitis.
Diagnóstico fuera del periodo neonatalLa ausencia de sintomatología al nacimiento y la interpretación incorrecta de la serología en el embarazo y el RN pueden dificultar el diagnóstico neonatal de la TC. A pesar de la aparente benignidad de la infección, los niños no diagnosticados pueden desarrollar secuelas, principalmente coriorretinitis54. El riesgo de coriorretinitis en niños no tratados supera el 70%55, reduciéndose al 20-30% en niños que reciben tratamiento adecuado durante 1 año56. Casi la mitad de las nuevas lesiones aparecen en niños mayores de 10 años55. Por tanto, la TC debe considerarse como una posibilidad diagnóstica en niños o adolescentes con síntomas oculares (ceguera, estrabismo, nistagmo, cataratas) o neurológicos (convulsiones, retraso psicomotor, microcefalia)19. En estos casos, si se demuestra coriorretinitis o las pruebas de neuroimagen son compatibles (calcificaciones o hidrocefalia), se debe realizar serología frente a Toxoplasma. La ausencia de anticuerpos IgG excluye la TC. En caso de presencia de anticuerpos IgG, debemos distinguir 2 situaciones, el lactante menor de un año y el niño mayor de un año.
Niño menor de un añoPor las características epidemiológicas de nuestro país, la toxoplasmosis en un niño menor de un año debe considerarse siempre una infección congénita. Podemos definir como caso de TC confirmada aquel que cumpla al menos uno de los criterios definidos en la tabla 757-65. En los casos en los que solo se disponga de un único control serológico con anticuerpos IgG positivos e IgM negativos, podemos considerar la toxoplasmosis como probable cuando exista una historia gestacional positiva o dudosa y el niño presente coriorretinitis o pruebas de neuroimagen compatibles. En esta situación, debemos realizar seguimiento de los anticuerpos IgG para confirmar la infección.
Criterios de diagnóstico retrospectivo de toxoplasmosis congénita en el lactante menor de un año (cualquiera de los siguientes)
| 1. Detección de T. gondii en tejidos o fluidos corporales por PCR, inoculación a ratón, cultivo celular o inmunocitoquímica |
| 2. Anticuerpos específicos IgM, IgA o IgE positivos |
| 3. Elevación significativa del título de Ac IgG específicos dentro de los primeros 12 meses de vida |
| 4. Persistencia de Ac IgG específicos después de los 12 meses de vida |
| 5. Presencia de Ac IgG específicos del niño diferenciados de los de la madre por técnica de Western blot (de disponibilidad limitada en la actualidad) |
| 6. Detección positiva de PCR para Toxoplasma o Ac IgM o IgA positivos en sangre seca almacenada de pruebas metabólicas (baja sensibilidad) |
| 7. Pruebas positivas en los test de interferón gamma tras la estimulación con Ag. específicos de T. gondii (en fase experimental) |
PCR: reacción en cadena de polimerasa.
El diagnóstico retrospectivo suele plantearse ante una coriorretinitis por Toxoplasma, que puede resultar de una infección aguda adquirida o de la reactivación de una infección congénita. La presencia de IgM/IgA, IgG de baja avidez o la demostración de seroconversión son diagnósticas de infección adquirida63. No obstante, si el diagnóstico oftalmológico es claro, la diferenciación entre las 2 entidades no tiene valor práctico, ya que ambas tienen el mismo tratamiento.
En niños con clínica oftalmológica o neurológica tardía que presenten anticuerpos IgG positivos y pruebas de neuroimagen compatibles, puede ser útil determinar la IgM, IgA o la PCR para Toxoplasma en las muestras de sangre seca neonatales almacenadas en papel de filtro (Guthrie card)60,61,64 y utilizadas para la prueba del talón en el RN, que permitirían identificar entre un 70-80% de los casos de TC, en caso de un almacenaje adecuado a temperatura de 4°C o inferior60.
Diagnóstico de la coriorretinitisLa toxoplasmosis debe ser el primer diagnóstico diferencial ante cualquier lesión de coriorretinitis que se detecte en la infancia y la adolescencia39. Puede presentarse de manera síntomática —generalmente con estrabismo o alteraciones de la agudeza o campo visual— o ser un hallazgo casual durante una revisión oftalmológica indicada por otra enfermedad66. En el primer caso, la lesión suele estar en fase de actividad y habitualmente situada en la mácula, mientras que en el segundo caso la lesión suele ser cicatricial y periférica.
La coriorretinitis toxoplásmica congénita y adquirida son clínicamente indistinguibles67-70. Sin embargo, la coriorretinitis congénita suele ser más grave, más frecuentemente bilateral, y con mayor riesgo de afectación macular y de recurrencias68.
El diagnóstico es fundamentalmente oftalmológico —aunque nunca es patognomónico y requiere de la experiencia del oftalmólogo— pues la serología aporta poca ayuda. La IgG positiva no confirma la enfermedad, aunque su negatividad sí la excluye. La IgM y la IgA son frecuentemente negativas en la coriorretinitis congénita, a no ser que el diagnóstico se realice precozmente, preferente en el primer año de vida. El diagnóstico diferencial debe hacerse con la coriorretinitis por CMV, virus de la coriomeningitis linfocitaria, VHS, virus varicela-zóster, toxocara, sífilis y tuberculosis66.
En casos de formas atípicas, en donde pueden surgir dudas en el diagnóstico oftalmológico70, pueden ser de utilidad la PCR en humor acuoso y vítreo, y el coeficiente de Goldmann-Witmer basado en la comparación de los niveles de anticuerpos específicos en el humor acuoso y en suero. Ambos test juntos alcanzan una sensibilidad del 80% que podría elevarse hasta un 85%, con una especificidad del 93%, si se suma el test inmunoblot, que nos permitiría determinar las diferencias cualitativas de los anticuerpos en el fluido ocular y en el suero71,72.
Tratamiento de los niños diagnosticados fuera del periodo neonatalNiño menor de un añoNo hay evidencia sobre la eficacia del tratamiento iniciado fuera del periodo neonatal. El grupo de trabajo recomienda que en niños sintomáticos diagnosticados retrospectivamente en el primer año de vida, el tratamiento se realice con los mismos fármacos y dosis recomendadas para el periodo neonatal, prolongándose durante un año. En los niños infectados asintomáticos su utilidad es más dudosa. Si el niño es muy pequeño (< 4 meses) se recomienda tratamiento durante un año. En el lactante > 4 meses en el que excluyamos cuidadosamente la coriorretinitis, y sin alteración en las pruebas de neuroimagen, el riesgo de coriorretinitis tardía es más bajo36, por lo que pueden utilizarse pautas de tratamiento más cortas, de 3 o 4 meses.
Niño mayor de un añoEl tratamiento de los niños diagnosticados después del año de vida es más controvertido. No hay ninguna evidencia sobre su beneficio en el paciente asintomático, por lo que en estos niños se aconseja no tratar e iniciar un seguimiento neurológico y oftalmológico a largo plazo. El grupo de trabajo recomienda el tratamiento de los niños sintomáticos mayores de un año para intentar disminuir las secuelas a largo plazo, si bien, ante la falta de evidencia, la duración total del tratamiento puede reducirse a 3 o 4 meses para disminuir su toxicidad.
Tratamiento de la coriorretinitisEn caso de coriorretinitis activa, el tratamiento aceptado es pirimetamina, sulfadiazina y ácido folínico a las dosis estándar hasta 2 semanas después de que el enfermo no tenga signos inflamatorios en la retina73. Sin embargo, este tratamiento se puede prolongar más tiempo cuando existan recaídas o la lesión sea de gran tamaño. Debe añadirse siempre prednisona a dosis de 1mg/kg/día durante las 4 primeras semanas. Como fármacos alternativos en caso de alergia o intolerancia, puede utilizarse la combinación pirimetamina-clindamicina o trimetoprim-sulfametoxazol73,74.
En las lesiones retinianas periféricas sin signos inflamatorios diagnosticadas durante un examen casual de fondo de ojo, el tratamiento es muy discutible. Extrapolando la alta frecuencia de recaídas y la posibilidad de afectación macular, el grupo de trabajo recomienda una pauta de tratamiento habitual sin corticoides durante 3 o 4 meses para evitar recidivas.
Los episodios de coriorretinitis recurrente deben tratarse con la misma pauta que el primero. En caso de recurrencias múltiples, especialmente en niños mayores, puede usarse tratamiento profiláctico con trimetoprim-sulfametoxazol 3 días por semana, que en un estudio en adultos disminuyó la tasa de recurrencias de un 23 a un 6% durante un periodo de seguimiento de 2 años75.
Seguimiento del niño con toxoplasmosis congénitaEl seguimiento del niño con TC debe ser multidisciplinar y prolongarse hasta pasada la pubertad.
Seguimiento clínico general y analíticoSe recomienda un seguimiento clínico muy estrecho con especial atención a los incrementos excesivos del perímetro craneal, desarrollo psicomotor, fijación de la mirada y aparición de estrabismo o nistagmo. En los niños que reciban tratamiento, hay que ajustar semanalmente la dosis al peso41 y vigilar la aparición de toxicidad hematológica, cutánea y renal.
Respecto a los controles analíticos, se solicitarán:
- –
Hemograma cada 7-10 días en el primer mes, hasta que se estabilice la cifra de neutrófilos. Posteriormente, cada 2-3 semanas hasta que se administre la pirimetamina a días alternos (habitualmente a los 6 meses) y luego mensual hasta finalizar el tratamiento.
- –
Bioquímica hepática y renal, y sedimento de orina una vez al mes y siempre en caso de sospecha de hepatitis, rash o afectación renal.
- 1.
Neutropenia:
- –
Neutrófilos entre 1,000-1,500 cél/μl. No se debe aumentar la dosis de pirimetamina, es decir, no ajustar la dosis por peso corporal hasta que los neutrófilos aumenten.
- –
Neutrófilos entre 500-1,000 cél/μl. Se debe subir el ácido folínico al doble de la dosis (máximo 15mg, 3 veces por semana) y disminuir la dosis de pirimetamina a la mitad o administrarla 3 veces en la semana hasta que los neutrófilos suban por encima de 1,000 cél/μl.
- –
Neutrófilos < 500 cél/μl. Se debe suspender la pirimetamina y dejar pautado el ácido folínico a dosis máximas hasta la recuperación de la cifra de neutrófilos. Si no hay subida de neutrófilos en una semana, debe suspenderse también la sulfadiazina. Si aparece fiebre, las cifras bajan por debajo de 100 cél/μl, o no se recuperan 5 días después de la suspensión de todo el tratamiento, debe administrarse factor estimulante de colonias a dosis de 5μg/kg/día, de forma subcutánea.
Las suspensiones temporales del tratamiento no precisan medicación sustitutiva. En caso de neutropenias repetidas, puede administrarse pirimetamina 3 veces por semana y, si persiste, cambiar sulfadiazina por clindamicina. El uso de espiramicina o cotrimoxazol solo debe considerarse en caso de neutropenias refractarias prolongadas, hasta la recuperación de la cifra de neutrófilos, ya que no hay estudios que avalen su eficacia en el tratamiento de la infección congénita en el RN.
- –
- 2.
Pancitopenia. Debe suspenderse toda la medicación, dejando el ácido folínico a la dosis máxima y valorar todos los posibles factores coadyuvantes, especialmente infecciones u otros fármacos. En caso de persistencia deben descartarse causas asociadas y valorar biopsia de médula ósea.
- 3.
Anemia hemolítica. Puede aparecer con el uso de sulfadiazina en pacientes con déficit de G6PD. Si se conoce esta deficiencia, debe emplearse clindamicina en lugar de sulfadiazina76.
- 4.
Rash medicamentoso. Los fármacos más comúnmente implicados son la sulfadiazina y la clindamicina, aunque también se ha descrito en el caso de la pirimetamina. En caso de toxicidad cutánea, estos fármacos deben ser suspendidos.
- 5.
Toxicidad renal. Puede aparecer nefrotoxicidad por depósito de cristales de sulfadiazina en los túbulos renales. Es importante asegurar una buena hidratación de estos pacientes durante el tratamiento y controlarlos con sedimentos y función renal mensual76. En caso de cristaluria, debe suspenderse la sulfadiazina y monitorizar al paciente hasta la desaparición de la misma. Tras la corrección podría reintroducirse a mitad de dosis y en caso de recidiva sustituirla por clindamicina. En caso de microalbuminuria, proteinuria o hematuria franca, debe suspenderse definitivamente43.
Debe realizarse fondo de ojo al nacimiento y luego cada 3 meses hasta los 18 meses, y posteriormente cada 6-12 meses hasta que el niño sea capaz de referir cambios en la visión43-45. Después, se realizará anualmente hasta el inicio de la pubertad, en donde nuevamente se recomiendan controles cada 6 meses debido al riesgo elevado de reactivaciones en este periodo45,55. En caso de aparición de coriorretinitis, los controles iniciales deben ser establecidos por el oftalmólogo78 y posteriormente, cuando la lesión haya cicatrizado, se recomiendan controles bianuales por el mayor riesgo de recidiva.
Seguimiento auditivoLos niños con TC tienen más riesgo de hipoacusia neurosensorial. Se debe realizar una evaluación auditiva con potenciales evocados auditivos al nacimiento y al año de vida. En niños con alteración neurológica u ocular, deben repetirse anualmente hasta que el niño pueda referir alteraciones auditivas19,76.
Seguimiento neurológicoAl nacimiento se realizará exploración neurológica y oftalmológica, punción lumbar y ecografía cerebral. Si presenta alteraciones debe realizarse una resonancia magnética cerebral. En cada visita se realizará exploración neurológica y control del desarrollo psicomotor y el perímetro craneal. Si se detectan nuevas alteraciones se valorará repetir la prueba de imagen.
Seguimiento serológicoEn niños asintomáticos sin confirmación microbiológica al nacimiento debe realizarse seguimiento serológico (IgG e IgM) cada 2-3 meses hasta demostrar si el paciente está infectado o no. Por lo general, los anticuerpos en niños no infectados se negativizan entre los 6 y los 9 meses, aunque pueden persistir hasta el año19,43,79. Hay que tener en cuenta que el tratamiento puede disminuir, o incluso negativizar transitoriamente la síntesis de anticuerpos19,76, por lo que en pacientes tratados en los que se ha negativizado la serología se recomienda repetirla al mes y a los 3 meses tras su suspensión antes de considerarlos no infectados76.
Todos los niños deben tener una serología realizada después del año de vida. La presencia de anticuerpos IgG a esta edad confirma la infección congénita. En niños infectados que han recibido un tratamiento correcto puede producirse una positivización de la IgM o un ascenso de la IgG en los meses posteriores a la suspensión del tratamiento. Este ascenso no es bien interpretado por la literatura científica, aunque se recomienda no volver a tratar79, pero controlar más frecuentemente el fondo de ojo19.
Recomendaciones del Grupo de TrabajoLa metodología empleada se ha basado en las recomendaciones de elaboración de guías basadas en la evidencia, con adaptación del modelo sugerido por la Infectious Disease Society of America80. La asignación de los grados de evidencia de las recomendaciones se ha clasificado en 3 grupos para la fuerza de la recomendación (A: buena; B: moderada; C: pobre) y según la calidad de la evidencia (I: existencia de buenos estudios aleatorizados controlados; II: otros estudios publicados; III: opinión de expertos).
Diagnóstico y tratamiento en el embarazo- 1.
El diagnóstico de la TC en el RN debe comenzar por una buena historia gestacional.
- 2.
El cribado serológico en el embarazo es la única manera de identificar a todos los RN con infección congénita (AII).
- 3.
Las gestantes seronegativas deben adoptar medidas de profilaxis primaria para evitar la infección (AII).
- 4.
El diagnóstico definitivo de infección materna se realiza por seroconversión o incremento por tres o más del título de IgG entre dos extracciones separadas 3-4 semanas, siendo considerado caso probable la presencia de IgM positiva con anticuerpos IgG de baja avidez. La IgM sola no es un buen marcador de infección aguda por su larga duración.
- 5.
Las gestantes con infección demostrada o probable deben recibir espiramicina para intentar evitar la infección fetal (BII).
- 6.
La eficacia de la espiramicina es más elevada si se administra en las primeras 3 semanas tras la infección materna y disminuye si han transcurrido más de 8 semanas (BII).
- 7.
El diagnóstico de infección fetal se realiza mediante PCR en líquido amniótico obtenido a partir de la semana 18 de gestación. Una PCR positiva en líquido amniótico confirma la infección fetal, pero no la afectación fetal.
- 8.
La ecografía y la resonancia fetales permiten el diagnóstico de las lesiones cerebrales y extracerebrales en los niños con infección sintomática, pero no de la coriorretinitis.
- 9.
El tratamiento de las mujeres con infección fetal demostrada debe realizarse con pirimetamina, sulfadiazina y ácido folínico a partir de la semana 18 de gestación (BIII).
- 10.
El tratamiento prenatal disminuye las secuelas neurológicas graves y la muerte posnatal, aunque no se ha probado su beneficio en la prevención de la coriorretinitis (BII).
- 1.
Debe estudiarse a todos los niños con historia de toxoplasmosis gestacional o con síntomas propios de la enfermedad al nacimiento.
- 2.
El estudio básico debe incluir analítica completa, serología IgG, IgM e IgA, fondo de ojo, LCR y ecografía cerebral. El estudio puede ampliarse con PCR en sangre, orina y LCR, potenciales auditivos y RM cerebral.
- 3.
Para considerar que el RN está infectado se deben valorar la historia gestacional previa, la clínica, los estudios complementarios y los anticuerpos IgM e IgA. La PCR es diagnóstica cuando es positiva, pero no excluye la infección si es negativa, por lo que tiene un valor de apoyo.
- 4.
La IgG en el neonato carece de valor diagnóstico, ya que aparece por transferencia materna, y solo su estabilización o aumento en los meses posteriores confirma la infección.
- 5.
El diagnóstico retrospectivo de la infección en el lactante puede hacerse mediante PCR o anticuerpos IgM/IgA en sangre seca de pruebas metabólicas, si bien estas pruebas pueden presentar baja sensibilidad.
- 1.
El tratamiento de elección en los niños con infección confirmada es la combinación de pirimetamina, sulfadiazina y ácido folínico durante 1 año (CII).
- 2.
En niños con clínica, la pirimetamina debe darse diaria durante los 6 primeros meses y luego en días alternos. En niños asintomáticos o con TC dudosa, se puede dar alterna a partir del 2 mes. La sulfadiazina se dará diaria y el ácido folínico, 3 días por semana (CIII).
- 3.
El uso de corticoides en pautas cortas de 4 a 6 semanas debe restringirse a los casos con hiperproteinorraquia o coriorretinitis activa (CIII).
- 4.
El tratamiento puede disminuir o incluso negativizar transitoriamente la síntesis de anticuerpos, por lo que en pacientes tratados que han negativizado la IgG se recomienda repetirla al mes y a los 3 meses tras su suspensión antes de considerarlos no infectados (AII).
- 5.
En los lactantes sintomáticos menores de un año diagnosticados de manera retrospectiva, se recomienda que el tratamiento se realice con los mismos fármacos y duración que en el periodo neonatal (CIII).
- 6.
El tratamiento de la coriorretinitis activa del niño mayor es pirimetamina, sulfadiazina, ácido folínico y prednisona (CIII).
- 7.
En las lesiones retinianas periféricas sin signos inflamatorios diagnosticadas durante un examen casual de fondo de ojo se recomienda dar una pauta de tratamiento habitual sin corticoides durante 3 o 4 meses para evitar recidivas (CIII).
- 8.
Durante el tratamiento se aconseja un seguimiento clínico muy estrecho, ajustando frecuentemente las dosis al peso corporal y realizando controles analíticos seriados para detectar precozmente efectos secundarios de la medicación, especialmente la neutropenia.
- 9.
El tratamiento de la TC disminuye el riesgo de secuelas, pero no las elimina, por lo que debe realizarse un seguimiento oftalmológico y neurológico estricto de todos los niños hasta la edad adulta (BII).
Los autores F. Baquero-Artigao y F. del Castillo Martín son los coordinadores del documento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Ana Alarcón Allen, Servicio de Neonatología, Hospital Universitari Sant Joan de Déu, Esplugues de Llobregat, Barcelona; Fernando Baquero-Artigao, Unidad de Enfermedades Infecciosas, Hospital Infantil La Paz, Madrid; Sylvia Caballero Martín, Servicio de Neonatología, Hospital Universitario Gregorio Marañón, Madrid; José Antonio Couceiro Gianzo, Unidad de Infectología, Servicio de Pediatría, Complexo Hospitalario de Pontevedra; Fernando del Castillo Martín, Unidad de Enfermedades Infecciosas, Hospital Infantil La Paz, Madrid; María de la Calle Fernández-Miranda, Unidad de Tocología de Alto Riesgo, Servicio de Obstetricia y Ginecología, Hospital La Paz, Madrid; Anna Goncé Mellgren, Servicio de Medicina Maternofetal, Institut Clínic de Ginecologia, Obstetrícia i Neonatologia, Hospital Clínic, Barcelona; Maria Isabel González-Tomé, Sección de Inmunodeficiencias y Niños Pequeños, Servicio de Pediatría, Hospital 12 de Octubre, Madrid; Concepció Figueras Nadal, Unidad de Patología Infecciosa e Inmunodeficiencias de Pediatría, Hospital Materno-Infantil Vall d’Hebron, Barcelona; Claudia Fortuny Guasch, Unidad de Infecciones, Servicio de Pediatría, Hospital Universitari Sant Joan de Déu, Esplugues de Llobregat, Barcelona; Isabel Fuentes Corripio, Servicio de Parasitología, Centro Nacional de Microbiología, Instituto de Salud Carlos III, Majadahonda, Madrid; Isabel García Bermejo, Servicio de Microbiología, Hospital Universitario de Getafe, Madrid; Dolores Montero Vega, Servicio de Microbiología, Hospital La Paz, Madrid; Maria José Muñoz Vilches, Unidad de Medicina Tropical, Hospital de Poniente, El Ejido, Almería; Olaf Neth, Unidad de Enfermedades Infecciosas e Inmunopatología, UGC Pediatría, Hospital Infantil Universitario Virgen del Rocío, Sevilla; Antoni Noguera Julián, Unidad de Infecciones, Servicio de Pediatria, Hospital Universitari Sant Joan de Déu, Esplugues de Llobregat, Barcelona; Félix Omeñaca Teres, Servicio de Neonatología, Hospital La Paz, Madrid; José Tomás Ramos Amador, Servicio de Pediatría, Hospital Universitario de Getafe, Madrid; Javier Vilas González, Sección de Neonatología, Servicio de Pediatría, Complexo Hospitalario de Pontevedra.