Las anomalías de la diferenciación sexual (ADS) engloban un amplio espectro de discordancias entre los criterios cromosómico, gonadal y fenotípico (genital) que definen la diferenciación sexual; actualmente, se aboga por la denominación de «desarrollo sexual diferente» (DSD). Su origen es congénito; se clasifican en función de los cromosomas sexuales presentes en el cariotipo; las causas genéticas conocidas son muy diversas y heterogéneas, aunque algunos casos pueden ser secundarios a factores maternos o medioambientales. Su diagnóstico y tratamiento requieren siempre una atención médica y psicosocial multidisciplinar. El diagnóstico etiológico precisa la interacción entre las exploraciones clínicas, bioquímicas (hormonales), genéticas, de imagen y, eventualmente, quirúrgicas. El tratamiento debe abordar la asignación de género, la posible necesidad de tratamiento hormonal substitutivo (suprarrenal si hay insuficiencia suprarrenal y con esteroides sexuales si hay insuficiencia gonadal a partir de la edad puberal), la necesidad de intervenciones quirúrgicas sobre las estructuras genitales (actualmente se tiende a diferirlas) y/o sobre las gónadas (en función de los riesgos de malignización), la necesidad de apoyo psicosocial y, finalmente, una adecuada programación de la transición a la atención médica en las especialidades de adultos. Las asociaciones de personas afectadas tienen un papel fundamental en el apoyo a familias y la interacción con los medios profesionales y sociales. La utilización de Registros y la colaboración entre profesionales en Grupos de Trabajo de sociedades médicas nacionales e internacionales es fundamental para avanzar en mejorar los medios diagnósticos y terapéuticos que precisan los DSD.
Disorders of Sex Development (DSD) include a wide range of anomalies among the chromosomal, gonadal, and phenotypic (genital) characteristics that define sexual differentiation. At present, a definition as Different Sexual Development (DSD) is currently preferred. They originate in the pre-natal stage, are classified according to the sex chromosomes present in the karyotype. The known genetic causes are numerous and heterogeneous, although, in some cases, they may be secondary to maternal factors and/or exposure to endocrine-disrupting chemicals (EDCs). The diagnosis and treatment of DSD always requires multidisciplinary medical and psychosocial care. An aetiological diagnosis needs the interaction of clinical, biochemical (hormonal), genetic, imaging and, sometimes, surgical examinations. The treatment should deal with sex assignment, the possible need for hormone replacement therapy (adrenal if adrenal function is impaired, and with sex steroids from pubertal age if gonadal function is impaired), as well as the need for surgery on genital structures (currently deferred when possible) and/or on gonads (depending on the risk of malignancy), the need of psychosocial support and, finally, an adequate organisation of the transition to adult medical specialties. Patient Support Groups have a fundamental role in the support of families, as well as the interaction with professional and social media. The use of Registries and the collaboration between professionals in Working Groups of national and international medical societies are crucial for improving the diagnostic and therapeutic tools required for the care of patients with DSD.
Las anomalías de la diferenciación sexual (ADS) engloban un amplio espectro de discordancias entre los criterios cromosómico, gonadal y fenotípico (genital) que definen la diferenciación sexual1. Se denominaron según los criterios del Consenso de Chicago del 20061,2 «trastornos o anomalías del desarrollo sexual», aunque se mantuvo el de «estados intersexuales» (tabla 1). Pese a ello, la constatación progresiva de rechazo hacia esta nueva terminología médica ha provocado un replanteamiento progresivo, de modo que actualmente se aboga por el de «desarrollo sexual diferente» (DSD)3.
Clasificación de las anomalías de la diferenciación sexual (ADS/DSD)
| Alteraciones cromosómicas | |
| 47,XXY: Síndrome de Klinefelter y variantes | |
| 45,X0 y mosaicos 45,X0 / 46,XX: Síndrome de Turner y variantes | |
| 45,X0 / 46,XY: Disgenesia gonadal mixta | |
| 46,XX / 46,XY: ADS/DSD ovotesticular, quimerismo | |
| 47,XYY | |
| Cariotipo 46,XY | |
| Anomalías en el desarrollo gonadal | Disgenesia gonadal 46,XY (completa o parcial) (SRY, SOX9, NR5A1, WT1, DHH, etc.) |
| 46,XY ovotesticular | |
| Síndrome de regresión testicular (incluye la anorquia y el síndrome de fuga testicular) | |
| Anomalías en el desarrollo genital por alteración en la síntesis o en la acción hormonal | Alteraciones de la síntesis de andrógenos |
| Mutaciones del receptor de LH (hipoplasia o aplasia de células de Leydig; LHCGR) | |
| Síndrome Smith-Lemli-Opitz (déficit de 7-dehidrocolesterol reductasa: DHCR7) | |
| Defectos en la síntesis de testosterona | |
| Hiperplasia suprarrenal lipoidea congénita (StAR) | |
| Deficiencia de colesterol desmolasa (CYP11A1) | |
| Deficiencia de 3β-hidroxiesteroide deshidrogenasa (HDS3B2) | |
| Deficiencia de 17α--hidroxilasa / 17-20 liasa (CYP17A1) | |
| Deficiencia P450 oxidorreductasa (POR) | |
| Deficiencia de citocromo b5 (CYB5) | |
| Deficiencia de 17β-hidroxiesteroide deshidrogenasa (HDS17B3) | |
| Deficiencia de 5α-reductasa tipo 2 (SRD5A2) | |
| Alteraciones en la acción de los andrógenos | |
| Insensibilidad a los andrógenos (AR; total o parcial=CAIS o PAIS) | |
| Fármacos y moduladores ambientales | |
| Alteraciones en la síntesis o acción de la hormona antimülleriana | |
| Síndrome de los conductos de Müller persistentes (AMH / AMHR2) | |
| Otros | Síndromes malformativos con alteraciones del desarrollo genital masculino (por ejemplo: anomalías cloacales, síndrome de Aarskog, síndrome de Robinow, etc.) |
| Retraso de crecimiento intrauterino severo y precoz | |
| Hipospadias aislado (CXorf6 o MAMLD1) | |
| Hipogonadismo hipogonadotropo congénito | |
| Criptorquidismo (INSL3, RXFP2 [o INSL3R o GREAT]) | |
| Cariotipo 46,XX | |
| Anomalías en el desarrollo gonadal | Disgenesia gonadal 46,XX |
| 46,XX ovotesticular | |
| ADS/DSD testicular 46,XX (SRY, dup SOX9, RSPO1) o varón 46,XX | |
| Anomalías en el desarrollo genital por exceso de andrógenos | Producción fetal |
| Deficiencia de 21-hidroxilasa (CPY21A2) | |
| Deficiencia de 11-β-hidroxilasa (CYP11B1) | |
| Deficiencia P450 oxidorreductasa (POR) | |
| Deficiencia de citocromo b5 (CYB5) | |
| Deficiencia de 3-β-hidroxiesteroide deshidrogenasa (HSD3B2) | |
| Mutaciones del receptor de glucocorticoides (NR3C1) | |
| Producción fetoplacentaria | |
| Deficiencia de aromatasa placentaria y fetal (CYP19A1) | |
| Deficiencia P450 oxidorreductasa (POR) | |
| Tumores fetales o placentarios productores de andrógenos | |
| Producción materna | |
| Fármacos androgénicos | |
| Tumores maternos virilizantes (por ejemplo, luteomas, tumor de Krukenberg) | |
| Otros | Síndromes malformativos |
| Hipoplasia/agenesia de estructuras müllerianas (síndrome de Rokitansky-Hauser tipo I y tipo II - MURCS) | |
| Anomalías uterinas (por ejemplo, MODY 5) | |
| Atresia vaginal | |
| Adherencias de labios vaginales | |
Fuente: Lee et al.2.
La diferenciación sexual durante la vida fetal implica una serie de procesos en cuya determinación y regulación intervienen numerosos genes, proteínas y hormonas. La primera etapa del desarrollo gonadal y genital es común a ambos sexos y abarca las primeras 6 semanas posfecundación; en ella, el embrión es pluripotencial. A partir de la 7.a semana comienza la diferenciación gonadal regulada por multitud de genes, entre los cuales la presencia del gen SRY en el cromosoma Y es determinante para el desarrollo del testículo. La diferenciación genital (interna y externa) es regulada por el efecto, en el varón, de las hormonas sintetizadas por el testículo (testosterona y hormona antimülleriana) o, en la mujer, por la ausencia de dichas hormonas. Cualquier alteración, de origen medioambiental o genético, que afecte a cualquiera de estos niveles determina el desarrollo inadecuado de gónadas (disgenesia gonadal), de genitales internos (ausentes o que no deberían estar presentes) y/o externos (insuficientemente o excesivamente virilizados). Tales manifestaciones serían detectables al nacimiento en forma de ambigüedad genital o discordancia entre el genotipo y el fenotipo sexuales, en la pubertad en forma de retraso puberal, amenorrea o virilización insuficiente o excesiva y, más tarde, como infertilidad o menopausia precoz, sin olvidar que pueden asociar anomalías a otros niveles o poner en peligro la vida cuando se asocian a una insuficiencia suprarrenal. Su atención es también crítica en el lactante cuando se necesita una asignación de género. Por todo ello, estas entidades siempre requieren de una atención médica y psicosocial multidisciplinar.
Exceptuando el caso del hipospadias como malformación genital aislada, la forma no clásica de la hiperplasia suprarrenal congénita (HSC) y las anomalías en los cromosomas sexuales, su frecuencia es inferior a 1/2.000, por lo que se clasifican entre las llamadas «enfermedades raras».
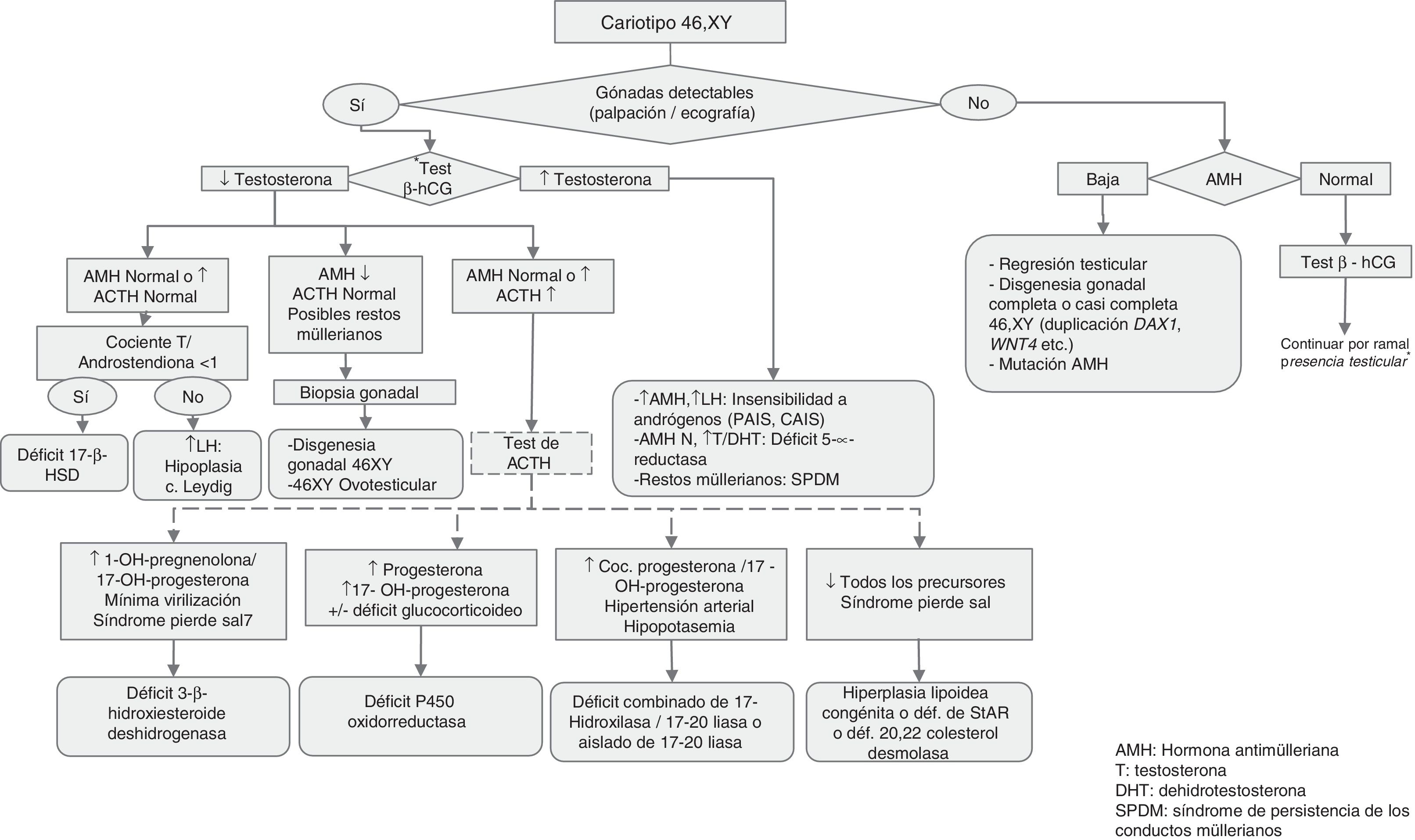
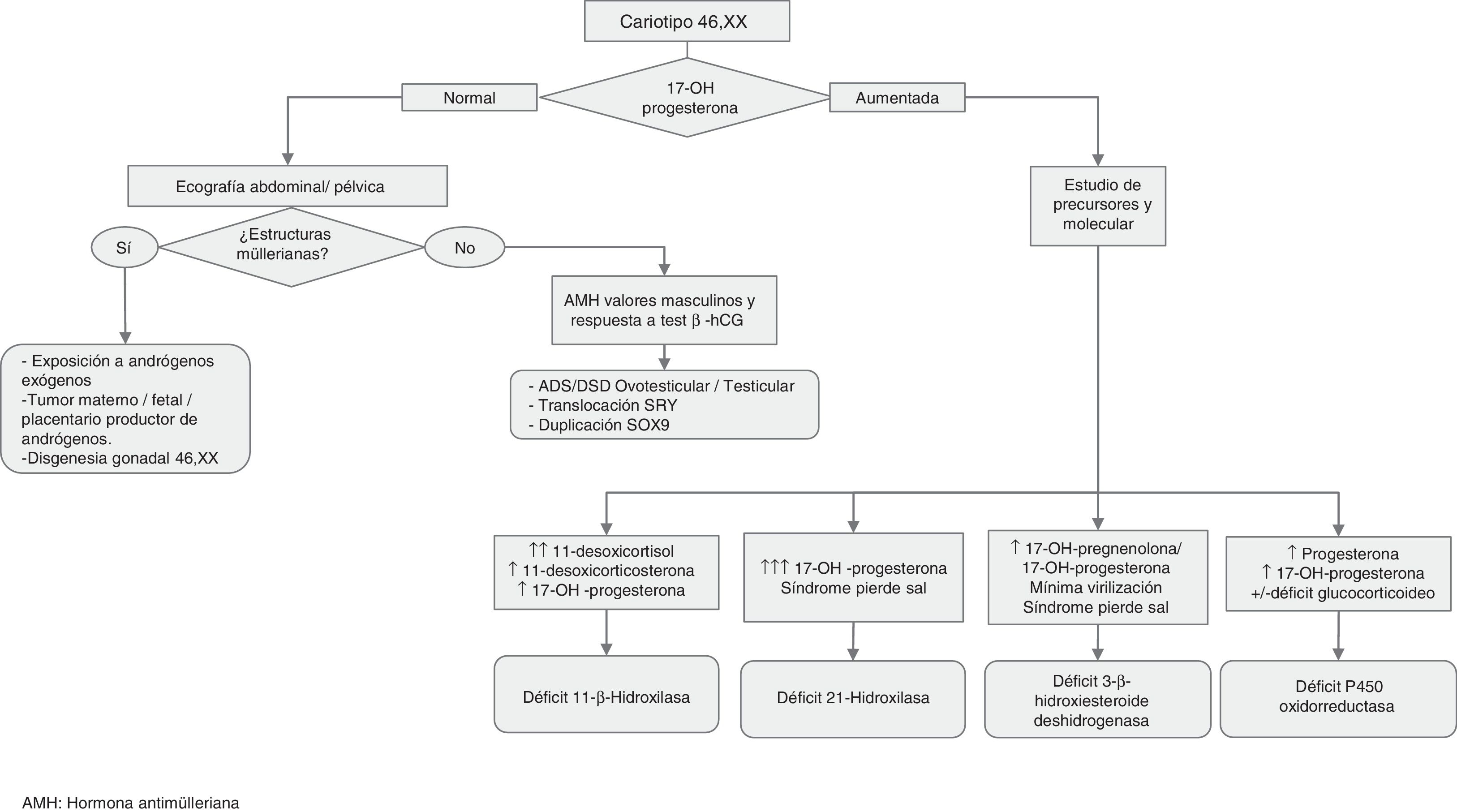
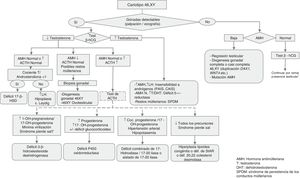
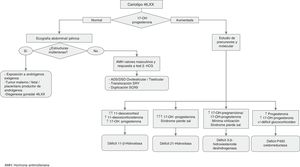
Procedimientos diagnósticos ante la ambigüedad genital o sospecha de ADS/DSD (figs. 1 y 2)Además de la ambigüedad genital en la época neonatal, otras manifestaciones clínicas sugerentes de ADS/DSD son:
- 1.
Genitales masculinos con hipospadias proximal (escrotal), micropene, criptorquidia bilateral, atrofia testicular y/o hipospadias distal o medio junto con criptorquidia unilateral.
- 2.
Genitales femeninos con masa en región inguinal/labios mayores y/o hipertrofia de clítoris y fusión labial posterior.
El procedimiento diagnóstico ante cualquier sospecha de ADS/DSD es el que sigue, aunque algunas de las pruebas complementarias mencionadas son exclusivas del neonato con ambigüedad genital. Tal como se ha indicado anteriormente, el diagnóstico precisa un equipo multidisciplinar.
1.o. Anamnesis y exploración físicaAntecedentes personales- •
Historia de consanguinidad.
- •
Posible exposición prenatal a andrógenos, antiandrógenos o a otros fármacos.
- •
Virilización materna en el embarazo.
Antecedentes familiares de hipospadias, infertilidad, amenorrea o menopausia precoz, de pérdida salina o de muertes infantiles inexplicadas.
Exploración físicaEs necesario realizar una cuidadosa inspección y palpación de los genitales:
- •
Valorar el grado de virilización/masculinización: existen dos escalas que pueden utilizarse indistintamente.
- –
En la niña (XX), aunque también útil de forma genérica en cualquier otra fórmula cromosómica o cuando aún no se dispone de cariotipo, mediante la escala de Prader, que se encuentra en la p. 9 del documento «Guía de actuación en las anomalías de la diferenciación sexual (ADS) / desarrollo sexual diferente (DSD)»4, a partir de ahora: Guía-ADS/DSD4.
- –
En el varón (XY), mediante la escala de grado de masculinización (en la p. 10 de la Guía-ADS/DSD)4.
- –
- •
Palpación de gónada a lo largo del trayecto inguinal (desde el pliegue labio-escrotal hasta el abdomen).
- •
Deben recogerse datos como el estado de hidratación y la presión arterial. La ictericia mantenida acompañada de episodios recurrentes de hipoglucemia debe evocar la posibilidad de un hipopituitarismo con deficiencia de GH y cortisol, además de gonadotropinas.
- •
Por último, también hay que descartar posibles rasgos dismórficos asociados, ya que las malformaciones genitales pueden formar parte de síndromes malformativos.
Son, básicamente, tres:
Cariotipo (sangre periférica)Imprescindible durante la orientación diagnóstica pues permite incluir al paciente en uno de los tres grandes apartados de la clasificación de ADS/DSD (tabla 1). Puede ampliarse el estudio con la detección de marcadores Y (SRY) y X (DX1) mediante FISH.
Estudio hormonal a partir de las 48 horas de vida5- •
17-hidroxiprogesterona. Permite el cribado de la HSC por déficit de 21-hidroxilasa que constituye la causa más frecuente de ADS/DSD 46,XX. Debe determinarse en todos los recién nacidos con criptorquidia bilateral o con genitales ambiguos6.
- •
Deshidroepiandrosterona (DHEA), progesterona y, si es factible, 17-hidroxipregnenolona y 11-desoxicortisol. Permiten diagnosticar otros tipos menos comunes de HSC y diversas enzimopatías.
- •
Testosterona, FSH y LH. La medición de las concentraciones basales plasmáticas de testosterona y sus precursores, en pacientes ADS/DSD 46,XY, resulta de interés durante el primer año de la vida, antes de las 36 horas de vida y durante la minipubertad, entre los 15 y los 90 días de vida (tiempo ampliable hasta los 6 meses de edad durante el descenso de los niveles de testosterona). En esta segunda muestra se determinarán también las gonadotropinas LH y FSH.
- •
Cortisol y ACTH basales. Imprescindibles en el diagnóstico de panhipopituitarismo y de las enzimopatías que afectan también la esteroidogénesis suprarrenal.
- •
Hormona antimülleriana (AMH) e inhibina B. La determinación de las concentraciones séricas de AMH y/o de inhibina B permite valorar la función de las células de Sertoli7,8.
- •
Esteroides en orina: la medición en orina de los cocientes entre metabolitos de precursores y esteroides posteriores al posible déficit enzimático permite demostrar el déficit de forma más específica y sensible que con los esteroides en sangre9.
Importante para determinar la presencia de gónadas, útero y/o vagina. La identificación de estas estructuras, sobre todo de las gónadas, no siempre es fácil, por lo que su no detección no siempre significa ausencia de las mismas.
3.o. Exploraciones complementarias de 2o nivelCuando la etiología no está aclarada, o como ampliación del estudio ante una determinada sospecha diagnóstica:
- •
Prueba de estímulo con β-hCG (test corto de β-hCG): sirve para valorar la funcionalidad del testículo mediante la respuesta de las células de Leydig sintetizando testosterona, así como sus precursores y el metabolito dihidrotestosterona7,10.
- •
Indicaciones, protocolo e interpretación en las pp. 13-14 de la Guía-ADS/DSD4.
- •
Test de ACTH:
- •
Indicaciones y protocolo en la p. 14 de la Guía-ADS/DSD4.
- •
Estudio ampliado de imagen indicado por cirujano/urólogo, como genitografía, uretrografía retrógrada o cistoscopia/vaginoscopia. La resonancia magnética está indicada como alternativa a la laparoscopia cuando no se visualizan gónadas en la ecografía.
- •
Puede ser necesario la visualización laparoscópica con biopsia gonadal para el diagnóstico de una posible disgenesia testicular en el varón XY.
- •
Estudio molecular: el cariotipo realizado, los antecedentes, la clínica y las exploraciones bioquímicas y de imagen pueden orientar el diagnóstico etiológico. Cuando se detectan anomalías en los cromosomas sexuales, la causa queda clarificada. Sin embargo, cuando el cariotipo es 46,XX o 46,XY puede ser que el conjunto de datos oriente hacia una causa monogénica, en cuyo caso será lógico pasar a analizar el gen candidato. Esta orientación diagnóstica se puede conseguir siguiendo los algoritmos diagnósticos contenidos en las figuras 1 y 2, así como las tablas 1-4.
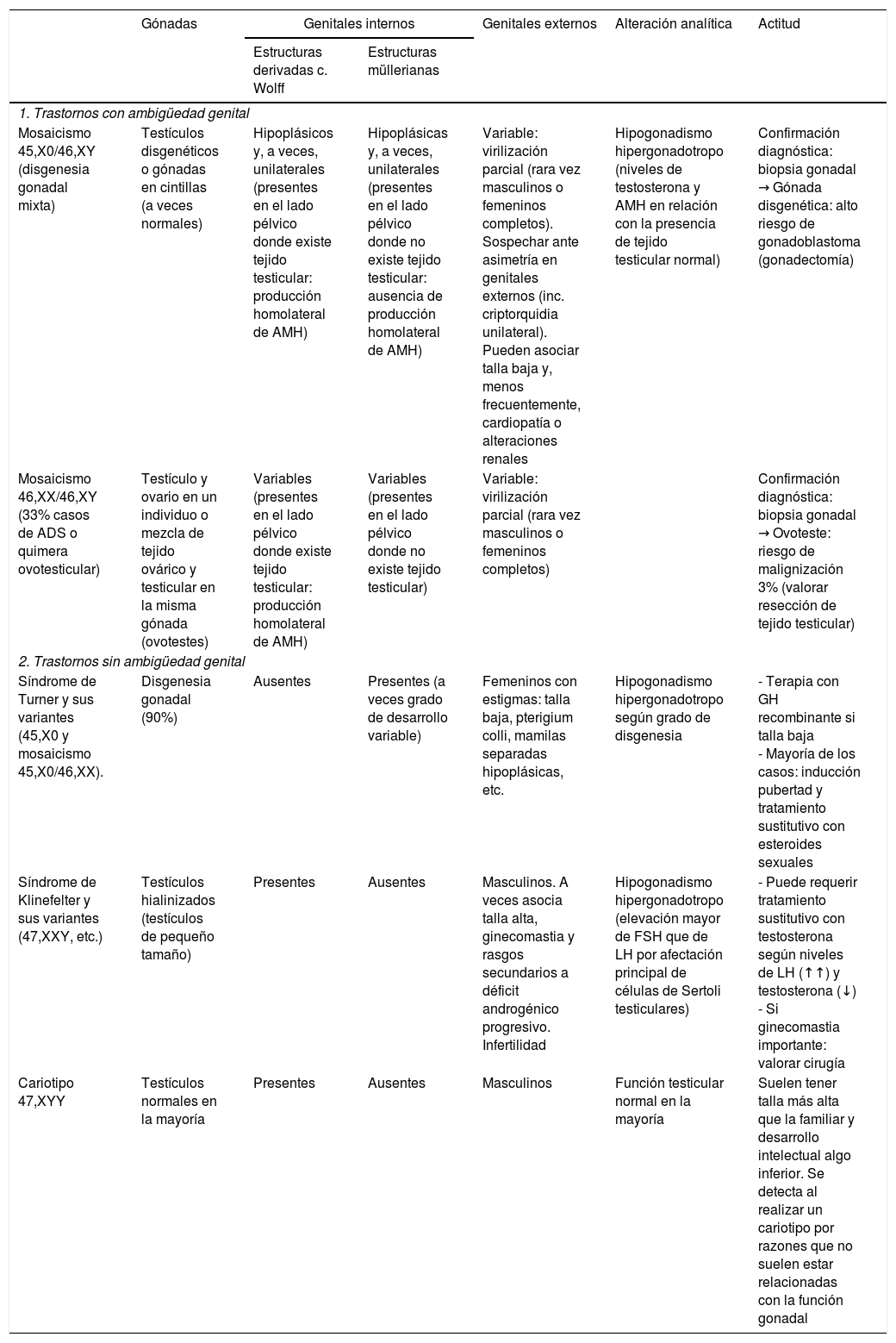
Tabla 2.ADS/DSD con alteraciones cromosómicas
Gónadas Genitales internos Genitales externos Alteración analítica Actitud Estructuras derivadas c. Wolff Estructuras müllerianas 1. Trastornos con ambigüedad genital Mosaicismo 45,X0/46,XY (disgenesia gonadal mixta) Testículos disgenéticos o gónadas en cintillas (a veces normales) Hipoplásicos y, a veces, unilaterales (presentes en el lado pélvico donde existe tejido testicular: producción homolateral de AMH) Hipoplásicas y, a veces, unilaterales (presentes en el lado pélvico donde no existe tejido testicular: ausencia de producción homolateral de AMH) Variable: virilización parcial (rara vez masculinos o femeninos completos). Sospechar ante asimetría en genitales externos (inc. criptorquidia unilateral). Pueden asociar talla baja y, menos frecuentemente, cardiopatía o alteraciones renales Hipogonadismo hipergonadotropo (niveles de testosterona y AMH en relación con la presencia de tejido testicular normal) Confirmación diagnóstica: biopsia gonadal → Gónada disgenética: alto riesgo de gonadoblastoma (gonadectomía) Mosaicismo 46,XX/46,XY (33% casos de ADS o quimera ovotesticular) Testículo y ovario en un individuo o mezcla de tejido ovárico y testicular en la misma gónada (ovotestes) Variables (presentes en el lado pélvico donde existe tejido testicular: producción homolateral de AMH) Variables (presentes en el lado pélvico donde no existe tejido testicular) Variable: virilización parcial (rara vez masculinos o femeninos completos) Confirmación diagnóstica: biopsia gonadal → Ovoteste: riesgo de malignización 3% (valorar resección de tejido testicular) 2. Trastornos sin ambigüedad genital Síndrome de Turner y sus variantes (45,X0 y mosaicismo 45,X0/46,XX). Disgenesia gonadal (90%) Ausentes Presentes (a veces grado de desarrollo variable) Femeninos con estigmas: talla baja, pterigium colli, mamilas separadas hipoplásicas, etc. Hipogonadismo hipergonadotropo según grado de disgenesia - Terapia con GH recombinante si talla baja
- Mayoría de los casos: inducción pubertad y tratamiento sustitutivo con esteroides sexualesSíndrome de Klinefelter y sus variantes (47,XXY, etc.) Testículos hialinizados (testículos de pequeño tamaño) Presentes Ausentes Masculinos. A veces asocia talla alta, ginecomastia y rasgos secundarios a déficit androgénico progresivo. Infertilidad Hipogonadismo hipergonadotropo (elevación mayor de FSH que de LH por afectación principal de células de Sertoli testiculares) - Puede requerir tratamiento sustitutivo con testosterona según niveles de LH (↑↑) y testosterona (↓)
- Si ginecomastia importante: valorar cirugíaCariotipo 47,XYY Testículos normales en la mayoría Presentes Ausentes Masculinos Función testicular normal en la mayoría Suelen tener talla más alta que la familiar y desarrollo intelectual algo inferior. Se detecta al realizar un cariotipo por razones que no suelen estar relacionadas con la función gonadal Tabla 3.ADS/DSD con cariotipo 46,XY
Gónadas Genitales internos Genitales externos Alteración analítica Actitud Estructuras derivadas c. Wolff Estructuras müllerianas 1. Anomalías del desarrollo gonadal (disgenesia testicular) Disgenesia gonadal 46XY parcial o completa (Sd. Swyer) Presentes (disgenéticas) - Forma parcial: presentes (hipoplásicas)
- Forma completa: ausentes- Forma parcial: ausentes
- Forma completa: presentes. Según mutación, puede asociar diversos fenotiposa- Forma parcial: virilización parcial (variable)
- Forma completa: femenino↓Testosterona
(basal y/o test β-hCG)
↓AMH- Prueba imagen (ecografía): localización gonadal
- Confirmación diagnóstica: biopsia gonadal y estudio molecular de genes de diferenciación gonadal (SRY, WT1, etc.a)46XY ovotesticular (7% casos ADS/DSD o quimera ovotesticular) Presente (disgenéticas con mezcla de tejido ovárico y testicular en la misma gónada) Presentes (+/− hipoplásicas) Ausentes Variable: virilización parcial (rara vez femeninos o masculinos completos) - Prueba imagen (ecografía): localización gonadal
- Confirmación diagnóstica: biopsia gonadalSíndrome de regresión testicular (pérdida de función/tejido testicular en el desarrollo temprano) Anorquia Presentes (+/− hipoplásicas) Ausentes (o presentes si fue muy precoz) Variable: virilización parcial (si fue muy precoz: femeninos) - Prueba imagen (ecografía): no localización gonadal
- Confirmación diagnóstica: laparoscopia. Estudio molecular de genes de diferenciación gonadal (SRY, WT1, etc.)Síndrome de fuga testicular (pérdida de función/tejido testicular en el desarrollo tardío) Anorquia Presentes Ausentes Masculino 2. Trastornos con respuesta o síntesis anormal de andrógenos 2.1. Respuesta escasa o nula de testosterona tras test de β-hCG 2.1.1. Defectos enzimáticos en la síntesis de testosterona Deficiencia de 17-β-hidroxiesteroide-deshidrogenasa Testículos Presentes (normales) Ausentes (vagina ciega en algunos casos como deficiencia StAR, 20-22 colesterol desmolasa, POR y Smith-Lemli-Opitz) Femenino o ambigüedad genital. Muy raramente masculino
En pubertad: síntomas de virilizaciónTest β-hCG:
↓Testosterona
AMH N o ↑
ACTH N
T/Androstendiona <1No indicado realización test ACTH
Confirmación diagnóstica: estudio genético-molecular gen HSD17B3 (9q22)Deficiencia de 3-β-hidroxiesteroide deshidrogenasab Masculino con subvirilización variable Test β-hCG:
↓Testosterona
AMH N o ↑
↑ACTHTest ACTH:
↑17-OH-pregnenolona/17-OH-progesterona
Síndrome pierde sal
Confirmación diagnóstica: estudio genético-molecular gen HSD3B2 (1p13.1)Deficiencia combinada de 17-α-hidroxilasa/17-20 liasab o deficiencia aislada de liasa Presentes (normales o hipoplásicos) Femenino o ambigüedad genital (estos últimos habituales en la deficiencia POR y citocromo b5) Test ACTH:
↑ Coc. progesterona /17-OH-progesterona
HTA
Hipopotasemia
En deficiencia aislada: solo ↑ progesterona y coc. 17-OH-progesterona / androstendiona
Confirmación diagnóstica: estudio genético-molecular gen CYP17A1 (10q24.3)Hiperplasia adrenal lipoidea congénita (deficiencia de la proteína StAR) y déficit 20-22 colesterol desmolasab Test ACTH:
↓Todos los esteroides suprarrenales y gonadales
Ecografia: en la def. proteína StAR grandes suprarrenales por acúmulo de lípidos
Confirmación diagnóstica: estudio genético-molecular gen StAR (8p11.2) y CYP11A1 (15q24.1)Deficiencia P450 oxidorreductasa (POR)b Test ACTH:
↑ Progesterona
↑17-OH-progesterona
+/− déficit glucocorticoideo
Confirmación diagnóstica: estudio genético-molecular gen POR (7q11.2)Deficiencia de citocromo b5 Testículos Presentes (normales o hipoplásicos) Ausentes (vagina ciega en algunos casos como deficiencia StAR, 20-22 colesterol desmolasa, POR y Smith-Lemli-Opitz) Femenino o ambigüedad genital (estos últimos habituales en la deficiencia POR y citocromo b5) Test β-hCG:
↓Testosterona
AMH N o ↑
↑ACTHMetahemoglobinemia
Test β-hCG: ↑ Coc. progesterona y 17-OH-progesterona / androstendiona
Confirmación diagnóstica: estudio genético-molecular gen CYB5A (18q22.3)Deficiencia vía alternativa o trasera de la esteroidogénesis Test ACTH: normal
Test β-hCG:
Testosterona N↓
DHT↓↓
Confirmación diagnóstica: estudio genético-molecular genes AKR1C2 y AKR1C4Síndrome de Smith-Lemli-Opitzb Virilización escasa con fenotipo peculiar (facies tosca, retraso psicomotor, anomalias cardiacas y viscerales) ↑7-dehidrocolesterol
Confirmación diagnóstica: estudio genético-molecular gen DHCR7 (11q13.4)2.2 Respuesta normal o aumentada de testosterona tras test de β-hCG Gónadas Genitales internos Genitales externos Alteración analítica Actitud Estructuras derivadas c. Wolff Estructuras müllerianas Déficit de 5-alfa-reductasa tipo 2 Testículos Presentes
Vagina hipoplásicaAusentes Virilización variable Testosterona N
AMH N
Tras β-hCG: Testosterona/DHT >30Diagnóstico: estudio genético-molecular gen SDR5A2 (2p23) Insensibilidad a los andrógenos (formas parciales [PAIS] y completas [CASI] o síndrome de Morris) Testículos - Formas parciales (PAIS): +/− hipoplásicos
- Formas completas (CAIS): ausentesAusentes
Casos excepcionales con útero atrófico- Formas parciales (PAIS): variable
- Forma completa (CAIS): femenino con escaso vello androgénicoTestosterona ↑ o N
AMH ↑ o N
LH ↑ o NDiagnóstico: estudio genético-molecular (AR; Xq12) 3. Anomalías en la síntesis o en la acción de la hormona antimülleriana Síndrome de los conductos de Müller persistentes (anomalía de hormona antimülleriana [AMH] o de su receptor AMHR2) Testículos (criptorquidia bilateral con/sin hernia inguinal) Presentes Presentes Masculinos Testosterona N
AMH ↓ (mutación AMH) o N (mutación AMHR2)Diagnóstico: estudio genético-molecular gen AMH (19p13.3) o AMHR2 (12q13.13) según niveles AMH 4. Malformativo (extrofia vesical, VACTERL/VATER, etc.), crecimiento intrauterino retardado extremo (falta de estímulo de células de Leydig durante primeras 15 semanas por β-hCH placentaria como sustituto de LH), etc. aFenotipos asociados a mutaciones: WT1 (anomalías renales, tumor de Wilms, tumores gonadales), SF1 (NR5A1: insuficiencia suprarrenal e hipogonadismo hipogonadotropo parcial, solo cuando la afectación es bialélica), SOX9 (displasia campomélica), CBX2 (presencia de ovarios y restos müllerianos), DHH (neuropatía minifascicular), del 9p24.3 (DMRT1 y DMRT2: retraso mental), del Xq13.3 (ATRX): retraso mental, talasemia), ARX (lisencefalia, epilepsia), TSPYL1 (síndrome de SIDDT: muerte súbita infantil), DAX1dup (disgenesia total o parcial), EMX (retardo mental, riñón único), FGFR2 (craniosinostosis), GATA4 (cardiopatía congénita), HHAT (talla baja, condrodisplasia, hipertrofia muscular, miopía, discreto retardo mental, MAMLD1 (hipospadias), MAP3K1, WNT4dup, WWOXdel; FOG2/ZFPM2 (cardiopatía congénita?)
Tabla 4.ADS/DSD con cariotipo 46,XX
Gónadas Genitales internos Genitales externos Alteración analítica Actitud Estructuras derivadas c. Wolff Estructuras müllerianas 1. Anomalías del desarrollo gonadal (disgenesia ovárica) Disgenesia gonadal 46,XX Presentes (disgenéticas) Ausentes Presentes Femeninos Hipogonadismo hipergonadotropo (↓estradiol, ↑FSH y LH) Confirmación diagnóstica: biopsia gonadal→ gónada disgenética, y estudio molecular de genes de diferenciación gonadal (dup. SOX9, RSPO1a, WNT4, etc.b) 46,XX ovotesticular (33% de casos ADS/DSD ovotesticular) Presentes (disgenéticas con mezcla de tejido ovárico y testicular en la misma gónada) Variable (generalmente ausentes) Variable: presentes en la mayoría, con diferente grado de desarrollo Variable: ambiguo, femenino o masculino Hipogonadismo hipergonadotropo
AMH valores en rango masculinos (en relación con la presencia de tejido testicular funcionante)
Test β- hCG: aumento de testosterona postestimulación (en relación con la presencia de tejido testicular funcionante)Diagnóstico: estudio genético-molecular:
- Mayoría de los casos: etiología desconocida
- Gen SRY (Yp11.2) negativo en la mayoría; en 10-15% casos: translocación SRY al X o a un autosoma (SRY+)
- Ocasionalmente: duplicación SOX9 (17q24), mutación gen RSPO1a (1p34.3) o WNT4 (1p36.12)
Confirmación diagnóstica: biopsia gonadal → Ovoteste: riesgo malignización 3% (valorar resección de tejido testicular)46,XX testicular (varón XX o Sd. de De la Chapelle) Testículos (atrofia testicular) Presentes Ausentes - Masculino normal (85% casos)
- Hipospadias o leve ambigüedad genital (15% casos)Hipogonadismo hipergonadotropo (↓testosterona, ↑FSH y LH) Diagnóstico: solo estudio genético-molecular (80% translocación gen SRY desde cromosoma Y paterno al X materno (SRY+); ocasionalmente duplicación SOX9) 2. Exceso de andrógenos Gónadas Genitales internos Genitales externos Alteración analítica Actitud Estructuras derivadas c. Wolff Estructuras müllerianas 2.1. Hiperplasia suprarrenal congénita (cursan con insuficiencia suprarrenal) Deficiencia de 21-hidroxilasa Presentes (ovarios) Desarrollo escaso o nulo Presentes Genitales ambiguos (forma clásica o virilizante simple). Rara vez pene sin hipospadias ↑↑17-OH-Progesterona
La forma clásica: pérdida salina con hiponatremia, hiperpotasemia e hipotensión (primeras semanas de vida)Diagnóstico: estudio genético-molecular gen CYP21A2 (6p21.3) Deficiencia de 11-β-hidroxilasa ↑17-OH-Progesterona
↑11-desoxicorticosterona (actividad mineralocorticoide), ↑11-desoxicortisol
HTA
No pérdida salinaDiagnóstico: estudio genético-molecular gen CYP11B1 (8q21) Deficiencia P450 oxidorreductasa Variable (desde genitales ambiguos a femenino normal) ↑17-OH-Progesterona
↑Testosterona ↑Progesterona ↑Corticosterona
+/− Déficit glucocorticoideoDiagnóstico: estudio genético-molecular gen POR (7q11.2) Deficiencia de 3-β-hidroxiesteroide deshidrogenasa Genitales externos femeninos con nula o leve virilización (clitoromegalia) ↑17-OH-Progesterona
↑17-OH-Pregnenolona
Síndrome pierde salDiagnóstico: estudio genético-molecular gen HSD3B2 (1p13.1) 2.2. Hiperandrogenismo gestacional Exposición a andrógenos maternos o progestágenos sintéticos (fármacos, tumores maternos virilizantes, deficiencia de aromatasa feto-placentaria, tumores fetales o placentarios productores de andrógenos) Presentes (ovarios) Desarrollo escaso o nulo Presentes Grado variable de virilización ↑Testosterona +/− precursores androgénicos Diagnóstico: anamnesis y analítica periparto en madre y recién nacido
Estudio genético-molecular si sospecha de deficiencia de aromatasa: gen CYP19A1 (15q21.2)2.3. Mutaciones del receptor de glucocorticoides Exposición a andrógenos maternos o progestágenos sintéticos (fármacos, tumores maternos virilizantes, deficiencia de aromatasa feto-placentaria, tumores fetales o placentarios productores de andrógenos) Presentes (ovarios) Ausentes Presentes Grado variable de virilización ↑ACTH y ↑Cortisol con signos insuficiencia adrenal
↑Precursores androgénicos
↑TestosteronaDiagnóstico: estudio genético-molecular gen NR3C1 (5q31.3) bOtros genes cuyas mutaciones se asocian a disgenesia ovárica, quimera ovotesticular o DSD testicular con cariotipo 46,XX son: BMP15, FGF9dup, FOXL2 (blefarofimosis, ptosis y síndrome epicanto inverso), NR5A1 (disgenesia ovárica, quimera ovotesticular o DSD testicular en el caso de la mutación Arg92Trp), SOX3dup
Las diversas técnicas moleculares van encaminadas a buscar alteraciones moleculares de diversos tipos:
- –
Detección de variaciones patogénicas en la secuencia de un gen: la técnica clásica de secuenciación tipo Sanger se utilizará cuando exista un claro gen candidato (por ejemplo, CYP21A2 en el déficit de 21-hidroxilasa o AR en la insensibilidad a los andrógenos, etc.). Sin embargo, debido a la gran cantidad de genes candidatos implicados en las ADS/DSD, muchos laboratorios utilizan técnicas de secuenciación masiva (NGS) que permiten la secuenciación simultánea de un número variable de genes; mediante este procedimiento se puede acelerar, con un menor coste, la posibilidad de detectar la causa genética.
- –
Detección de alteraciones en la cantidad génica: unas cuantas formas de ADS/DSD son debidas a alteraciones en el número de copias de algunos genes (aumento de copias y también deleciones de alelos o de locus cromosómicos). Su detección se realiza mediante técnicas como MLPA (multiple ligation-dependent probe amplification) o array-CGH (comparative genomic hybridization)11.
- –
Por último, cuando no existe un claro gen candidato y/o el/los panel/es de genes candidatos proporcionan resultados normales, o en el marco de estudios orientados a la detección de nuevos genes candidatos, se analizarán el exoma completo (whole exome sequencing [WES]) o el genoma completo. Estas técnicas proporcionan mucha información y se deben utilizar en el marco de estrictos protocolos técnicos y éticos, en el que debe participar el equipo multidisciplinar que deberá contribuir a la interpretación de los resultados.
Las tablas 2-4 resumen los diversos tipos de DSD clasificados según el cariotipo, el fenotipo, los genitales internos y externos, las alteraciones bioquímicas detectables y la actitud diagnóstica requerida.
Actitud terapéuticaAsignación de géneroLa asignación de género es una decisión compleja y crítica en el tratamiento de las ADS/DSD. Son los padres, asesorados por un equipo multidisciplinar (pediatras endocrinólogos, cirujanos, urólogos pediátricos, ginecólogos, neonatólogos, genetistas, psicólogos, asistentes sociales, etc.), quienes tomarán esta decisión. Es fundamental que se realice en centros de referencia con experiencia en el manejo de ADS/DSD, teniendo en cuenta, entre otros, factores culturales y religiosos de los distintos colectivos, las implicaciones de esta decisión en la vida adulta de las personas (disforia de género, gonadectomía, insatisfacción con la apariencia de los genitales, etc.).
El abordaje clásico ha abogado por una cirugía precoz orientada a unos genitales externos cosméticamente normales y a la extirpación gonadal acorde con el género escogido. Recientemente, sin embargo, se tiende a apostar por diferir la cirugía electiva para que el paciente participe en la toma de decisiones, tanto del sexo asignado como del tipo de cirugía. Para las familias que deseen esta última opción y puedan asumir el retraso de la cirugía en ADS/DSD, es imprescindible realizar protocolos de cuidados no quirúrgicos que permitan a los padres y pacientes enfrentarse a la presión social de tener un bebé con genitales atípicos.
En la actualidad, los criterios vigentes de asignación de género se fundamentan en (1) los resultados psicosexuales en adultos con diagnóstico etiológico; (2) la fertilidad potencial; (3) las opciones quirúrgicas, y (4) la necesidad de tratamiento hormonal sustitutivo en la pubertad.
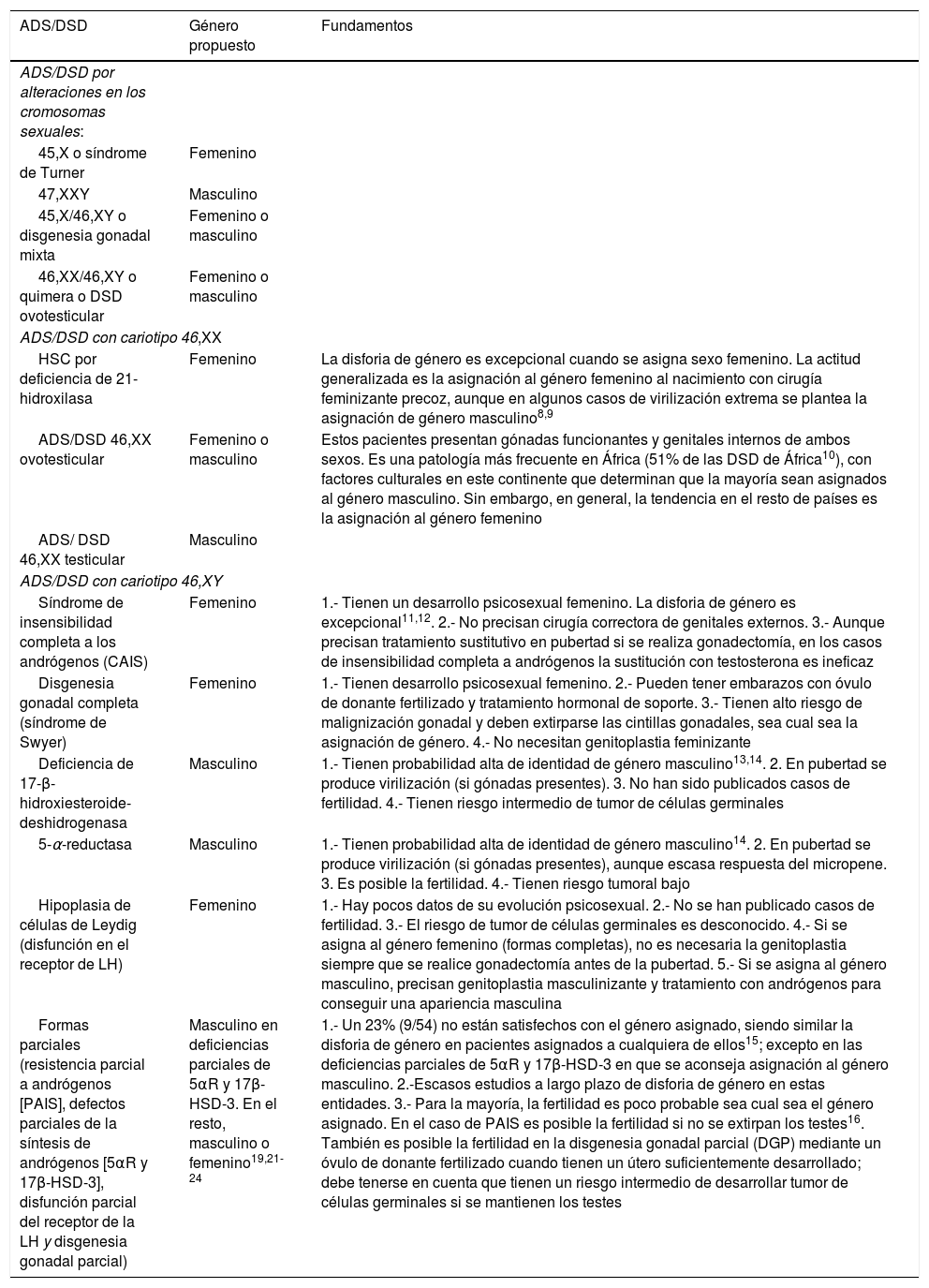
De forma resumida, y atendiendo a la Clasificación del Consenso de Chicago de 20061,2, las recomendaciones actuales de asignación de género quedan resumidas en la tabla 512-24.
Recomendaciones de asignación de género en ADS/DSD
| ADS/DSD | Género propuesto | Fundamentos |
|---|---|---|
| ADS/DSD por alteraciones en los cromosomas sexuales: | ||
| 45,X o síndrome de Turner | Femenino | |
| 47,XXY | Masculino | |
| 45,X/46,XY o disgenesia gonadal mixta | Femenino o masculino | |
| 46,XX/46,XY o quimera o DSD ovotesticular | Femenino o masculino | |
| ADS/DSD con cariotipo 46,XX | ||
| HSC por deficiencia de 21-hidroxilasa | Femenino | La disforia de género es excepcional cuando se asigna sexo femenino. La actitud generalizada es la asignación al género femenino al nacimiento con cirugía feminizante precoz, aunque en algunos casos de virilización extrema se plantea la asignación de género masculino8,9 |
| ADS/DSD 46,XX ovotesticular | Femenino o masculino | Estos pacientes presentan gónadas funcionantes y genitales internos de ambos sexos. Es una patología más frecuente en África (51% de las DSD de África10), con factores culturales en este continente que determinan que la mayoría sean asignados al género masculino. Sin embargo, en general, la tendencia en el resto de países es la asignación al género femenino |
| ADS/ DSD 46,XX testicular | Masculino | |
| ADS/DSD con cariotipo 46,XY | ||
| Síndrome de insensibilidad completa a los andrógenos (CAIS) | Femenino | 1.- Tienen un desarrollo psicosexual femenino. La disforia de género es excepcional11,12. 2.- No precisan cirugía correctora de genitales externos. 3.- Aunque precisan tratamiento sustitutivo en pubertad si se realiza gonadectomía, en los casos de insensibilidad completa a andrógenos la sustitución con testosterona es ineficaz |
| Disgenesia gonadal completa (síndrome de Swyer) | Femenino | 1.- Tienen desarrollo psicosexual femenino. 2.- Pueden tener embarazos con óvulo de donante fertilizado y tratamiento hormonal de soporte. 3.- Tienen alto riesgo de malignización gonadal y deben extirparse las cintillas gonadales, sea cual sea la asignación de género. 4.- No necesitan genitoplastia feminizante |
| Deficiencia de 17-β-hidroxiesteroide-deshidrogenasa | Masculino | 1.- Tienen probabilidad alta de identidad de género masculino13,14. 2. En pubertad se produce virilización (si gónadas presentes). 3. No han sido publicados casos de fertilidad. 4.- Tienen riesgo intermedio de tumor de células germinales |
| 5-α-reductasa | Masculino | 1.- Tienen probabilidad alta de identidad de género masculino14. 2. En pubertad se produce virilización (si gónadas presentes), aunque escasa respuesta del micropene. 3. Es posible la fertilidad. 4.- Tienen riesgo tumoral bajo |
| Hipoplasia de células de Leydig (disfunción en el receptor de LH) | Femenino | 1.- Hay pocos datos de su evolución psicosexual. 2.- No se han publicado casos de fertilidad. 3.- El riesgo de tumor de células germinales es desconocido. 4.- Si se asigna al género femenino (formas completas), no es necesaria la genitoplastia siempre que se realice gonadectomía antes de la pubertad. 5.- Si se asigna al género masculino, precisan genitoplastia masculinizante y tratamiento con andrógenos para conseguir una apariencia masculina |
| Formas parciales (resistencia parcial a andrógenos [PAIS], defectos parciales de la síntesis de andrógenos [5αR y 17β-HSD-3], disfunción parcial del receptor de la LH y disgenesia gonadal parcial) | Masculino en deficiencias parciales de 5αR y 17β-HSD-3. En el resto, masculino o femenino19,21-24 | 1.- Un 23% (9/54) no están satisfechos con el género asignado, siendo similar la disforia de género en pacientes asignados a cualquiera de ellos15; excepto en las deficiencias parciales de 5αR y 17β-HSD-3 en que se aconseja asignación al género masculino. 2.-Escasos estudios a largo plazo de disforia de género en estas entidades. 3.- Para la mayoría, la fertilidad es poco probable sea cual sea el género asignado. En el caso de PAIS es posible la fertilidad si no se extirpan los testes16. También es posible la fertilidad en la disgenesia gonadal parcial (DGP) mediante un óvulo de donante fertilizado cuando tienen un útero suficientemente desarrollado; debe tenerse en cuenta que tienen un riesgo intermedio de desarrollar tumor de células germinales si se mantienen los testes |
Los casos que asocian déficit adrenal (glucocorticoideo ± mineralocorticoideo) requieren de terapia sustitutiva de inmediato con hidrocortisona6. En lo que respecta a la terapia sustitutiva con esteroides sexuales para la inducción puberal, no existe un acuerdo generalizado acerca del mejor momento para iniciarla, de las dosis iniciales ni tampoco del ritmo de aumento de las mismas. La mayoría de los grupos destacan la necesidad de iniciar el tratamiento farmacológico con una dosis baja y continuar con un aumento progresivo de la misma, pero con diferencias en cuanto a la edad del inicio y a la dosificación en los primeros años. Se acepta inducir el desarrollo puberal alrededor de los 11 años de edad ósea en las niñas y de los 12 años en los niños e incrementarlo lentamente.
La Guía-ADS/DSD4 contiene en las pp. 35 y 37 (tablas 6 y 7) la propuesta más generalizada para el tratamiento sustitutivo con esteroides sexuales durante la pubertad. También contiene consideraciones terapéuticas detalladas sobre (1) el tratamiento con andrógenos en el niño prepuberal, con el fin de estimular el crecimiento del pene; (2) el síndrome de Klinefelter; (3) el síndrome de Turner; (4) el síndrome de insensibilidad completa a los andrógenos (CAIS); (5) el síndrome de insensibilidad parcial a los andrógenos (PAIS); (6) la deficiencia de 5-alfa-reductasa; (7) la deficiencia de 17β-hidroxiesteroide deshidrogenasa; (8) la disgenesia gonadal 46,XX; (9) la disgenesia gonadal completa 46,XY; (10) la disgenesia gonadal parcial 46,XY, y (11) el síndrome de persistencia de los conductos müllerianos.
Tratamiento quirúrgicoEl tratamiento quirúrgico de las ADS/DSD supone con frecuencia un cambio irreversible en el fenotipo del paciente1. Su indicación debe realizarse de forma conjunta, la familia con el equipo multidisciplinar que le asesorará. Si es posible debe participar el paciente en la toma de decisiones. Por este motivo, en los últimos años se ha observado una tendencia a diferir la cirugía hasta una edad en la que el paciente pueda participar25,26. Cuando la cirugía se realice en edades tempranas de la vida deben evitarse procedimientos mutilantes o irreversibles.
Por último, existe un consenso unánime en que estas intervenciones solo deben ser practicadas por cirujanos especializados en centros con elevada experiencia.
La Guía-ADS/DSD4 detalla las diferentes intervenciones quirúrgicas que pueden realizarse en ADS/DSD, según las edades y géneros, con relación al tubérculo genital (pp. 40 y 41), la vaginoplastia (pp. 41 y 42), las mamas (p. 48), los restos müllerianos (p. 48), la orquidopexia (p. 47) y la criopreservación de gónadas.
La gonadectomía profiláctica es una decisión compleja. Debe individualizarse teniendo en consideración los riesgos/beneficios de la misma, valorando: (1) el género asignado, si es diferente al sexo gonadal; (2) el riesgo de malignización de la gónada, y (3) la función gonadal (tanto hormonal como su potencial fertilidad)27.
El riesgo de tumor gonadal según la clasificación de ADS/DSD está detallado en la Guía-ADS/DSD4, en las pp. 43-47.
No hay un consenso universal en relación con la gonadectomía, aunque sí hay acuerdo en que se debería considerar en gónadas disgenéticas o displásicas, especialmente cuando son intraabdominales28.
Transición clínica a adultosLa necesidad de garantizar una atención continuada a lo largo del paso de los servicios pediátricos a los de adultos ha sido puesta de manifiesto en varias especialidades pediátricas, y los pacientes con ADS/DSD son especialmente vulnerables en esta etapa29.
Existen guías publicadas para preparar la transición del paciente con algunas ADS/DSD, como el síndrome de Turner30,31, el síndrome de Klinefelter32,33 o la HSC34,35.
Algunas de las características de la transición en las ADS/DSD, en general, son:
- •
Exploraciones genitales: en mujeres con ADS/DSD, la exploración vaginal debe contemplarse en algún momento durante su seguimiento. Las mujeres no necesariamente precisan de elongación vaginal, y por lo tanto deben guiar la decisión de si desean o no tener relaciones con penetración, y cuándo empezar a tenerlas29.
- •
Gonadectomía y riesgo de malignización: en los pacientes con ADS/DSD con riesgo de malignización gonadal, este debe ser conocido por el paciente y requiere de seguimiento en la etapa adulta36.
- •
Problemas psicológicos: varios estudios han puesto de manifiesto la abrumadora necesidad de apoyo psicológico en los pacientes con ADS/DSD durante la adolescencia, que muy probablemente se extiende hasta la etapa adulta37,38.
- •
Información diagnóstica: la información detallada acerca del diagnóstico a menudo se ofrece al paciente en esta etapa próxima a la transición39. Dentro del pronóstico, deben discutirse la fertilidad potencial y las posibilidades de tener hijos mediante distintas técnicas de reproducción asistida. El mejor conocimiento de su condición permite al adolescente o joven adulto recurrir a grupos de apoyo o a las redes sociales para obtener apoyo adicional.
Se puede consultar una propuesta de transición clínica al Servicio de adultos para pacientes con ADS/DSD en la Guía-ADS/DSD4, en las pp. 51-52.
RegistrosLos profesionales multidisciplinares no consiguen conocer la causa en el 40-50% de los casos de ADS/DSD, sobre todo en aquellos portadores de un cariotipo 46,XY. Ante tal diversidad, complejidad y necesidad de investigar causas desconocidas, los profesionales necesitan compartir conocimientos, dicho de otro modo, información almacenada en Registros40.
Están activos, y a nuestro alcance, dos Registros de DSD, uno en España y otro internacional:
- •
El Registro Español de DSD-HSC está integrado dentro del Registro de Enfermedades Raras del Instituto de Salud Carlos III (ISCIII) en Madrid (https://registroraras.isciii.es).
- •
El Registro Internacional (International DSD Registry [I-DSD Registry]) (https://www.i-dsd.org/)
En España existen dos asociaciones de pacientes adheridas a la FEDER (Federación Española de Enfermedades Raras) que reúnen personas afectadas por algún tipo de DSD:
- •
La Asociación GrApSIA (Grupo de Apoyo al Síndrome de Insensibilidad a los Andrógenos), constituida el año 2000 (https://grapsia.org/).
- •
La Asociación Española de Hiperplasia Suprarrenal Congénita, constituida el año 2013 (http://hiperplasiasuprarrenalcongenita.org/).
- •
Otras asociaciones a nivel internacional están recopiladas en Lee et al.3.
En la Sociedad Española de Endocrinología Pediátrica (SEEP) funcionan dos Grupos de Trabajo dedicados a DSD: uno sobre la HSC y otro sobre el resto de DSD (autor de esta Guía). En la Sociedad de Endocrinología y Nutrición (SEEN) funciona un Grupo de Trabajo dedicado a la Identidad de Género (GIDSEEN) que también trabaja sobre los DSD, aunque se dedica más a la transexualidad.
En España se ha planteado, a nivel del Ministerio de Sanidad, Servicios Sociales e Igualdad, la necesidad de acreditar CSUR (Centro, Servicio, Unidad de Referencia) dedicados a enfermedades endocrinológicas. Las Sociedades de Endocrinología (SEEP y SEEN) y la Asociación Española de Pediatría (AEP) han presentado una primera lista de fichas correspondientes a varias patologías y, entre ellas, se entregó una ficha correspondiente a las ADS/DSD (2017).
Se han creado (2017) Redes de Centros de Referencia Europeos para Enfermedades Raras (European Reference Networks for Rare Diseases [ERN]). Una está dedicada a enfermedades endocrinas raras (Rare Endocrine Diseases Reference Network [EndoERN]) con un área sobre las ADS/DSD, «Sex development and maturation» (http://endo-ern.eu/).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.