Comparar el comportamiento de la prueba de la tuberculina (PT) y el QuantiFERON TB® gold in-tube (QFT-GIT) en una población infantil integrada por contactos.
Material y métodosEstudio con recogida de datos prospectivo realizado en un distrito sanitario del País Vasco (España) de 300.000 habitantes, en niños y adolescentes (edad < 17 años) reclutados en un estudio de contactos durante un periodo de casi 3 años. El estudio incluyó la prueba de la tuberculina (PT), realizada con la técnica de Mantoux (con 2-TU de PPD RT23 con Tween 80), y el QFT-GIT simultáneamente y la recogida de datos demográficos y clínicos.
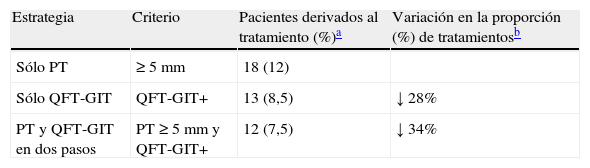
ResultadosEntre los 160 niños incluidos, el 14% tenía una PT positiva (≥ 5mm) y 11% un QFT-GIT positivo. La concordancia entre las pruebas fue del 95-96%, dependiendo del punto de corte de la PT elegido y fue mayor en los niños no vacunados (100%) y en los niños menores de 5 años (100%). Se observó una asociación significativa entre el resultado positivo de ambas pruebas con la exposición en el domicilio. El uso del QFT-GIT en el cribado de la infección tuberculosa latente supondría reducir entre el 28-34% de tratamientos preventivos con respecto al cribado convencional con la PT.
ConclusionesEl comportamiento del QFT-GIT fue comparable a la PT en la identificación de niños con infección tuberculosa por lo que podría potencialmente reemplazar a la PT.
To compare the results of the Mantoux Tuberculin Test (TT) and the QuantiFERON TB® Gold In-Tube (QFT-GIT) in a population of children and adolescents with TB contacts.
Material and methodsA prospective study using data collected on children and adolescents (< 17years) from a Health District of 300,000 inhabitants in the Basque Country (Spain) recruited into a TB contact study over a period of almost three years. The study included performing the Tuberculin Test using the Mantoux technique (with 2-TU of RT-23 PPD RT23 and Tween 80), and the QFT-GIT simultaneously, and collecting the demographic and clinical data.
ResultsOf the 160 children included in the study, 14% had a positive TT (≥ 5mm) and 11% a positive QFT-GIT. There was 95%-96% agreement between the tests, depending on the TT cut-off point chosen, and was higher in non-vaccinated children (100%) and in children less than 5 years-old (100%). A significant relationship was observed between a positive result for both tests with exposure in the home. The use of QFT-GIT in the screening of latent TB infection could reduce preventive treatments by 28%-34% compared with conventional screening with the TT.
ConclusionsThe behaviour of QFT-GIT was comparable to the TT in identifying children with a tuberculosis infection; therefore it could potentially replace the TT.
En países con baja incidencia de tuberculosis (TB) la identificación y el tratamiento de las personas con infección tuberculosa latente (ITL) constituye una medida esencial para el control de la TB1.
Hasta ahora, la prueba de referencia para el diagnóstico de la ITL ha sido la prueba de la tuberculina (PT). Sin embargo, la PT contiene limitaciones en la sensibilidad y particularmente en su especificidad, pudiendo dar lugar a resultados falsos positivos por reacciones cruzadas con la vacuna BCG y las micobacterias ambientales, que conllevaría la prescripción de tratamientos innecesarios2. Presenta además dificultades operativas importantes, como la de ser manejada por personal experimentado y necesitar dos visitas para obtener el resultado.
Recientemente, se están utilizando nuevas técnicas de diagnóstico de la ITL, entre las que destacan las pruebas basadas en la detección del interferón γ (IGRA) liberada por células T tras ser estimuladas con dos antígenos del M tuberculosis: early secreted antigenic target 6 (ESAT-6); culture filtrate protein 10 (CFP-10) y TB7.7 (RV 2654). Estos antígenos son transcritos en la región de diferencia 1, que es una región genómica específica del M tuberculosis y ausente en la BCG y la mayoría de las micobacterias ambientales3,4.
Un beneficio potencial de las IGRA deriva de su alta especificidad, cuyo uso implicaría la reducción de tratamientos innecesarios comparado con la PT. Las IGRA tienen además otras ventajas logísticas importantes respecto a la PT, como requerir una sola visita para su conclusión y proporcionar resultados no subjetivos.
Hasta la fecha se han comercializado dos tipos de IGRA, el QuantiFERON-TB® gold (y su nueva versión QuantiFERON-TB® gold in-tube [QFT-GIT] y el T-SPOT.TB® [T-Spot]).
Se han recomendado dos estrategias básicas para el cribado de la ITL con IGRA: a) el uso exclusivo de la IGRA reemplazando a la PT5, y b) el uso combinado de la PT y el QFT-GIT(la PT para el cribado inicial y una IGRA para confirmar los casos con PT positiva6), con variantes ajustadas a situaciones epidemiológicas y clínicas concretas7. La experiencia del uso de IGRA en niños es más limitada que en adultos y su inclusión en las guías clínicas está siendo más prudente. Recientemente, la Sociedad Española de Infectología Pediátrica (SEIP) y la Sociedad Española de Neumología Pediátrica (SENP) han publicado un documento de consenso en relación con el diagnóstico de la TB en edad pediátrica que incluye un apartado con el uso de las IGRA en el cribado de la ITL, aunque recomendando la PT como prueba de elección8.
En este estudio se comparó el comportamiento de la PT y del QFT-GIT en niños y adolescentes en contacto con enfermos de TB.
Material y métodosSe trata de un estudio con una recogida de datos prospectivo, llevado a cabo en un distrito sanitario del País Vasco (España) con una población de 300.000 habitantes y con una incidencia de TB de 14 casos por 100.000 habitantes en 2008. Se incluyó a personas menores de 17 años reclutadas consecutivamente en una investigación de contactos expuestas a enfermos de TB pulmonar con baciloscopia positiva en esputo. En este distrito el estudio de contactos corre a cargo del servicio de neumología del hospital de referencia (Hospital de Galdakao), que desarrolla su actividad en las consultas externas del propio hospital y en otros 5 centros periféricos dando cobertura a toda la población. Los niños menores de 7 años con sospecha de ILT fueron derivados al servicio de enfermedades infecciosas de pediatría del Hospital de Cruces-Baracaldo para completar el estudio. De cada niño se recogieron datos demográficos, datos clínicos, antecedente de la vacuna BCG (basada en la inspección de la cicatriz característica), y datos relacionados con su caso índice, como el estado bacteriológico en esputo y la proximidad y ámbito del contacto.
La selección de contactos para el estudio se hizo conforme a las recomendaciones del «Programa de control de la tuberculosis del País Vasco» y que sigue el modelo de los «círculos concéntricos» clasificando los contactos en tres categorías9: a) cerrados: individuos que comparten el mismo domicilio o están expuestos diariamente al caso índice por un espacio de tiempo ≥ 6h en lugares cerrados; b) asiduos: los expuestos diariamente < 6h en lugares cerrados, y c) ocasionales: individuos con una exposición menor que en el círculo anterior. En los contactos expuestos a casos índices bacilíferos fueron seleccionados para el estudio sistemáticamente todos los individuos pertenecientes a los círculo 1.° y 2.°. Cuando en el 2.° círculo se encontró una elevada prevalencia de infección o casos secundarios de TB se extendió el estudio al 3.er círculo. El estudio comprendió dos etapas. En la primera (coincidente con la fecha de diagnóstico del caso índice) se realizaron simultáneamente las pruebas del QFT-GIT y la PT a todos los contactos. En la segunda etapa (de 6-8 semanas después de la primera) se repitieron las pruebas si habían sido inicialmente negativas y si el periodo trascurrido desde la finalización de la exposición con el caso índice fue inferior a 8 semanas. En este trabajo se han analizado los resultados de la primera etapa.
Para la PT se utilizó la técnica del Mantoux (con 2-TU de PPD RT23 con TWeen 80) y su resultado fue evaluado 48 a 72h después por personal experimentado, siendo considerada positiva una induración ≥ 5mm independientemente de la BCG. Todos los niños con una PT positiva fueron sometidos a una radiografía de tórax y otras pruebas complementarias cuando hubo una sospecha de TB.
La prueba del QFT-GIT se realizó conforme a las instrucciones del fabricante. Se introdujo 1ml de sangre directamente en tres tubos heparinizados: un control negativo que contenía sólo heparina, 1 tubo con un mitógeno (phitohemaglutinina) y 1 tubo con los antígenos ESAT-6, CFP-10 y TB7.7 (Rv2654). Cada tubo fue agitado varias veces hasta conseguir una mezcla homogénea. En un plazo no superior a 2h desde la extracción sanguínea los tubos fueron introducidos en una incubadora a 37°C. Tras 24h de incubación, los tubos fueron centrifugados y se recogió el plasma. La cantidad de IFN-γ se midió mediante la prueba enzymelinked inmunosorbent (ELISA) con reactivos incluidos en el kit. El resultado se consideró positivo cuando el IFN-γ fue ≥ 0,35 U/ml después de restarle el control negativo. El resultado se consideró indeterminado con IFN-γ ≤ 0,35 U/ml (después de restarle el control negativo) y el IFN-γ del mitógeno menos el del control negativo fue ≥ 0,50 IU/ml y/o con IFN- γ > 0,8 U/ml en el control negativo.
Análisis estadísticoLa concordancia entre las pruebas del QFT-GIT y la PT se calculó usando el estadístico kappa (κ). Las diferencias de las frecuencias fueron evaluadas por la prueba exacta de Fisher. Se realizó un análisis univariado y multivariado para evaluar potenciales factores de riesgo asociados con los resultados del QFT-GIT y la PT. Se calculó el área bajo la curva ROC para valorar la capacidad discriminativa del modelo final. Los cálculos estadísticos se realizaron con el paquete estadístico SAS versión 9.2. La significación estadística fue definida por p ≤ 0,05.
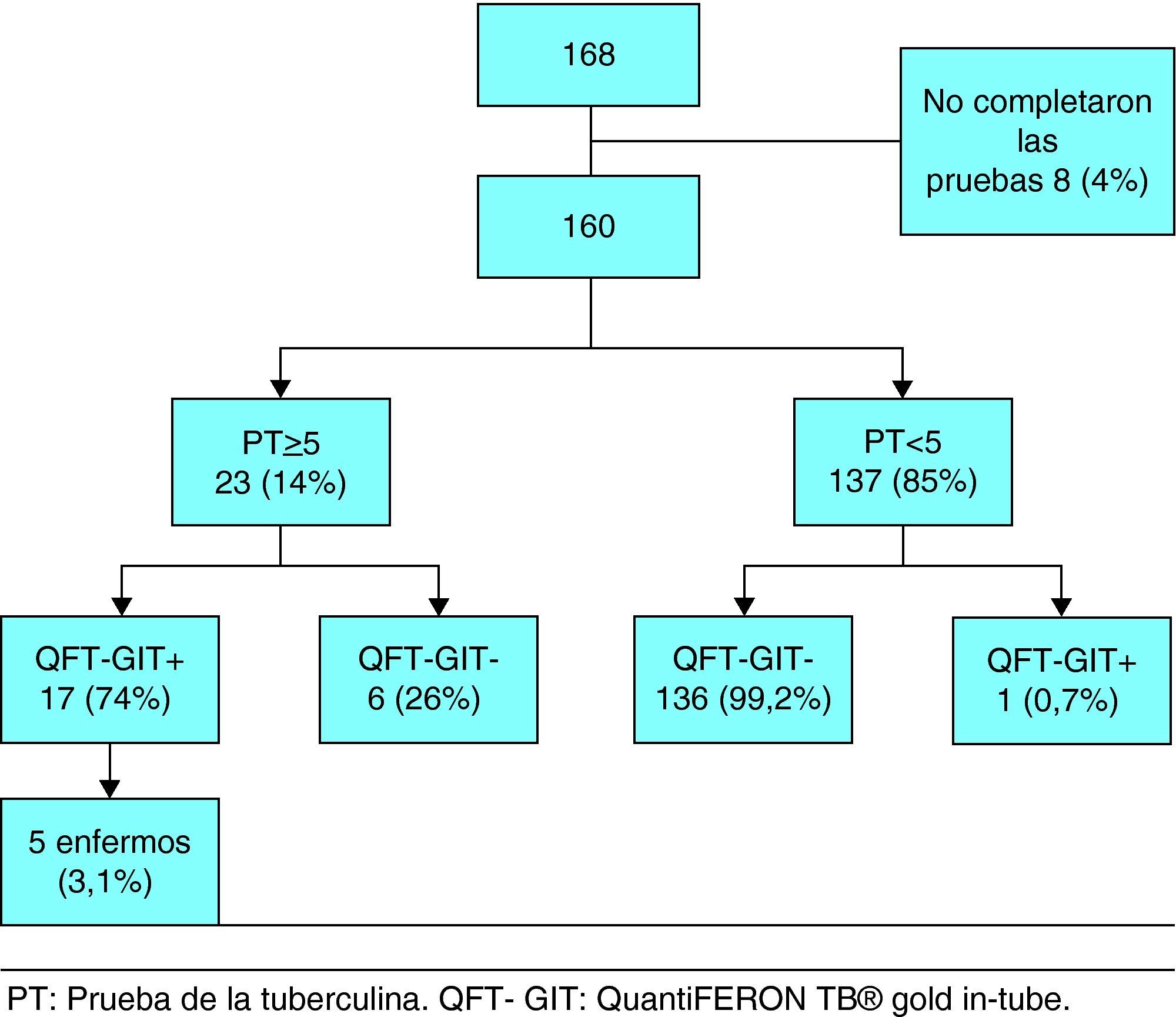
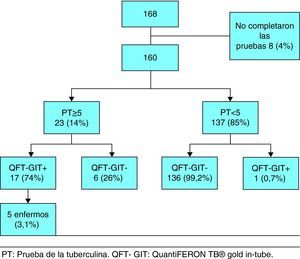
ResultadosEntre marzo de 2007 y diciembre de 2009 fueron enrolados un total de 168 niños y adolescentes pertenecientes a contactos de enfermos con TB pulmonar con baciloscopia positiva en esputo confirmada en cultivo. Ocho de ellos no completaron las pruebas y se excluyeron del estudio. La tabla 1 muestra las características demográficas y clínicas de los 160 individuos incluidos en el estudio. Noventa y seis sujetos fueron varones (60%), la edad media fue de 7,0 años (DS 4,5-9,6 años) y 22 (13,7%) nacieron en países con altas tasas de TB. Se constató la cicatriz de la BCG en 146 niños (91,2%). La exposición al Mycobacterium tuberculosis se produjo en el ámbito escolar en el 71,8% de los casos (115/160).
Características demográficas de la población (n=160)
| N.° | % | |
| Sexo | ||
| Varón | 96 | 60 |
| Mujer | 64 | 40 |
| Edad | ||
| Media (DS) | 4,5 | |
| ≤ 5 | 50 | 31,2 |
| > 5 y ≤ 8 | 72 | 45 |
| > 8 | 38 | 23,7 |
| País | ||
| Autóctono | 138 | 86,2 |
| Extranjero | 22 | 13,7 |
| BCG | ||
| Sí | 146 | 91,2 |
| No | 8 | 5 |
| Desconocido | 6 | 3,7 |
| Ámbito del contacto | ||
| Domicilio | 31 | 19,3 |
| Escolar | 115 | 71,8 |
| Otros | 14 | 8,7 |
| Proximidad contacto | ||
| Cerrado | 54 | 33,7 |
| Asiduo | 51 | 31,8 |
| Ocasional | 55 | 34,3 |
Entre los 160 participantes que completaron las pruebas, el 14% (23/160) tuvo la PT positiva (induración ≥ 5mm) y 11% (18/160) el QFT-GIT positivo. Entre los participantes con PT positiva 24% (6/23) fue QFT-GIT negativo, mientras que el 0,7% (1/137) de los participantes con PT negativa tuvo el QFT-GIT positivo (fig. 1). Hubo 5 casos de TB activa (3%) con PT y QFT-GIT, ambos positivos en todos ellos.
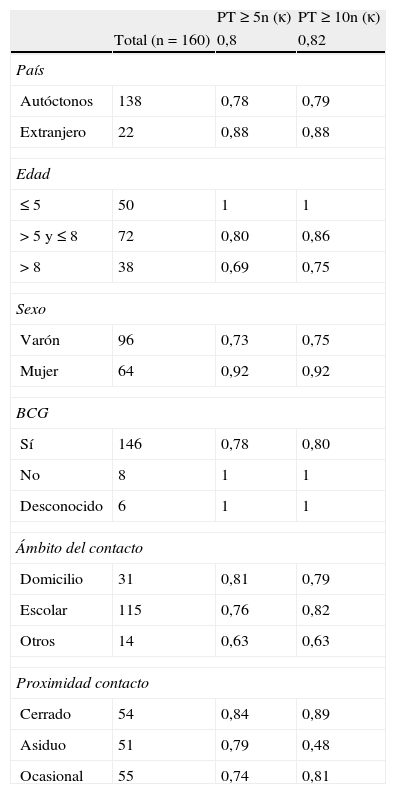
La concordancia global entre la PT y el QFT-GIT fue del 95,6% (κ=0,80) utilizando un punto de corte de la PT ≥ 5 m y del 96,2% (κ=0,82) con una PT ≥ 10mm (tabla 2). En la tabla 3 se recoge el índice κ con puntos de corte de la PT de ≥ 5mm y ≥ 10mm, y según diferentes condiciones. En no vacunados y en niños menores de 5 años la concordancia fue del 100% (κ=1).
Concordancia del QuantiFERON TB® gold in-tube (QFT-GIT) con dos puntos de corte de la prueba de la tuberculina
| Concordancia | QFT-GIT+ (n=18) | QFT-GIT− (n=142) | Total |
| PT | |||
| ≥ 5 | 17 (94,45%) | 6 (4,23%) | 23 |
| < 5 | 1 (5,55%) | 136 (95,77%) | 137 |
| PT | |||
| ≥ 10 | 16 (88,88%) | 4 (2,82%) | 20 |
| < 10 | 2 (11,12%) | 138 (97,18%) | 140 |
| Índice kappa entre PT con punto de corte de 5mm y QFT-GIT (IC del 95%)=0,805 (0,67, 0,94) | |||
| Índice kappa entre PT con punto de corte de 10mm y QFT-GIT (IC del 95%)=0,821 (0,68, 0,96) | |||
| Puntos de corte | ||
| Concordancia | PT > 5 | PT > 10 |
| Total | 153/160 (95,62%) | 154/160 (96,25%) |
| Positivo | 17/23 (73,91%) | 16/20 (80,00%) |
| Negativo | 136/137 (99,27%) | 138/140 (98,57%) |
PT: prueba de la tuberculina.
Concordancia entre el QuantiFERON TB® gold in-tube y la prueba de la tuberculina según diferentes condiciones de los contactos (n=160)
| PT ≥ 5n (κ) | PT ≥ 10n (κ) | ||
| Total (n=160) | 0,8 | 0,82 | |
| País | |||
| Autóctonos | 138 | 0,78 | 0,79 |
| Extranjero | 22 | 0,88 | 0,88 |
| Edad | |||
| ≤ 5 | 50 | 1 | 1 |
| > 5 y ≤ 8 | 72 | 0,80 | 0,86 |
| > 8 | 38 | 0,69 | 0,75 |
| Sexo | |||
| Varón | 96 | 0,73 | 0,75 |
| Mujer | 64 | 0,92 | 0,92 |
| BCG | |||
| Sí | 146 | 0,78 | 0,80 |
| No | 8 | 1 | 1 |
| Desconocido | 6 | 1 | 1 |
| Ámbito del contacto | |||
| Domicilio | 31 | 0,81 | 0,79 |
| Escolar | 115 | 0,76 | 0,82 |
| Otros | 14 | 0,63 | 0,63 |
| Proximidad contacto | |||
| Cerrado | 54 | 0,84 | 0,89 |
| Asiduo | 51 | 0,79 | 0,48 |
| Ocasional | 55 | 0,74 | 0,81 |
BCG: vacuna de la enfermedad de tuberculosis (Bacilo Calmette-Guerin); κ: índice kappa; N: frecuencia; PT: prueba de la tuberculina.
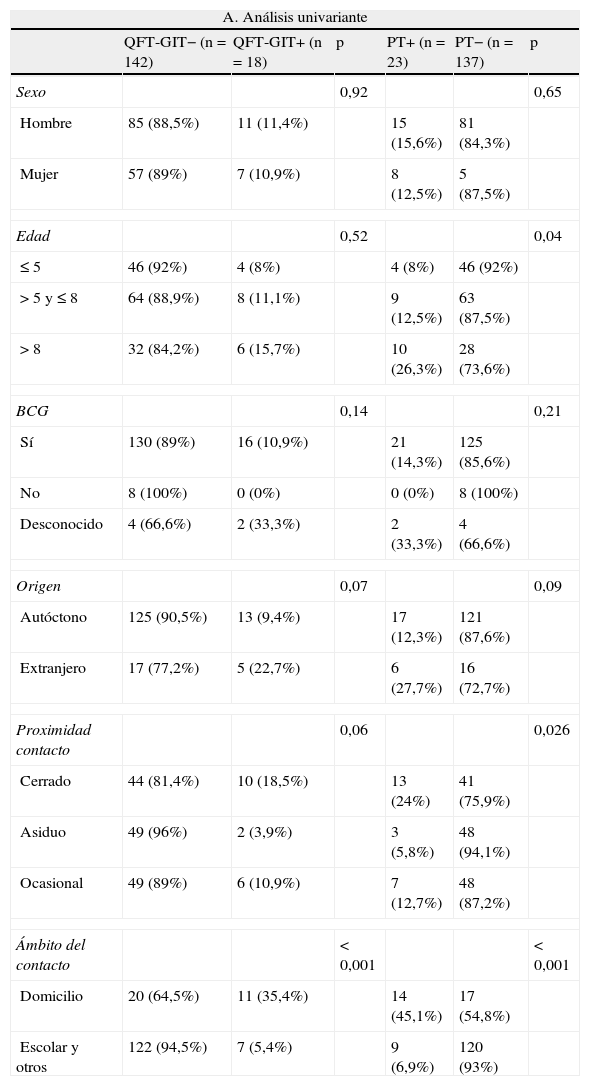
La proporción de niños con QFT-GIT positivo fue del 85% (11/13) para una PT ≥ 15mm, del 71% para PT entre 10-15mm y del 33% (1/3) para una PT entre 5-10mm. La concentración media de IFN-γ en sangre fue significativamente mayor en los enfermos con una TB activa (9,82 U/ml) que en los niños con ILT no enfermos (5,34 U/ml) (p=0,0015). En el análisis multivariante el ser contacto en el domicilio fue la única variable asociada con un QFT-GIT positivo (OR=9,5; IC del 95%, 3,32-27,64) y con una PT positiva (OR=10,98; IC del 95%, 4,12-29,23) (tabla 4).
Análisis univariante y multivariante de los factores relacionados con los resultados de la prueba de la tuberculina y del QuantiFERON TB® gold in-tube (QFT-GIT)
| A. Análisis univariante | ||||||
| QFT-GIT− (n=142) | QFT-GIT+ (n=18) | p | PT+ (n=23) | PT− (n=137) | p | |
| Sexo | 0,92 | 0,65 | ||||
| Hombre | 85 (88,5%) | 11 (11,4%) | 15 (15,6%) | 81 (84,3%) | ||
| Mujer | 57 (89%) | 7 (10,9%) | 8 (12,5%) | 5 (87,5%) | ||
| Edad | 0,52 | 0,04 | ||||
| ≤ 5 | 46 (92%) | 4 (8%) | 4 (8%) | 46 (92%) | ||
| > 5 y ≤ 8 | 64 (88,9%) | 8 (11,1%) | 9 (12,5%) | 63 (87,5%) | ||
| > 8 | 32 (84,2%) | 6 (15,7%) | 10 (26,3%) | 28 (73,6%) | ||
| BCG | 0,14 | 0,21 | ||||
| Sí | 130 (89%) | 16 (10,9%) | 21 (14,3%) | 125 (85,6%) | ||
| No | 8 (100%) | 0 (0%) | 0 (0%) | 8 (100%) | ||
| Desconocido | 4 (66,6%) | 2 (33,3%) | 2 (33,3%) | 4 (66,6%) | ||
| Origen | 0,07 | 0,09 | ||||
| Autóctono | 125 (90,5%) | 13 (9,4%) | 17 (12,3%) | 121 (87,6%) | ||
| Extranjero | 17 (77,2%) | 5 (22,7%) | 6 (27,7%) | 16 (72,7%) | ||
| Proximidad contacto | 0,06 | 0,026 | ||||
| Cerrado | 44 (81,4%) | 10 (18,5%) | 13 (24%) | 41 (75,9%) | ||
| Asiduo | 49 (96%) | 2 (3,9%) | 3 (5,8%) | 48 (94,1%) | ||
| Ocasional | 49 (89%) | 6 (10,9%) | 7 (12,7%) | 48 (87,2%) | ||
| Ámbito del contacto | < 0,001 | < 0,001 | ||||
| Domicilio | 20 (64,5%) | 11 (35,4%) | 14 (45,1%) | 17 (54,8%) | ||
| Escolar y otros | 122 (94,5%) | 7 (5,4%) | 9 (6,9%) | 120 (93%) | ||
| B. Análisis multivariante | ||||
| QFT-GIT | PT | |||
| OR (IC 95%) | p | OR (IC 95%) | p | |
| Edad | – | – | ||
| Proximidad contacto | – | – | ||
| Ámbito del contacto | 0,001 | 0,001 | ||
| Domicilio | 10,98 (4,12-29,9) | 9,58 (3,31-27,6) | ||
| Escolar y otros | Referencias | Referencias | ||
IC: intervalo de confianza del 95%; OR: odds ratio; PT: prueba de la tuberculina.
Las recomendaciones vigentes en el País Vasco en edad pediátrica establecen la indicación de un tratamiento preventivo en todos los contactos con una PT ≥ 5mm, con independencia del antecedente vacunal si el caso índice fue una TB pulmonar con baciloscopia positiva en esputo. Siguiendo este criterio, si utilizáramos el QFT-GIT para el cribado de la ITL como alternativa a la estrategia convencional con la PT se reduciría en un 28% el número de tratamientos preventivos, aplicando el QFT-GIT como única prueba, y en un 34%, aplicando el QFT-GIT en combinación con la PT (tabla 5).
Pacientes diagnosticados de infección tuberculosa latente que reciben quimioprofilaxis aplicando diferentes estrategias
Los resultados obtenidos con el QFT-GIT en este estudio fueron comparables a los de la PT, con un acuerdo entre ambas superior al 95% (coeficiente κ de 0,80) y la misma correlación con factores de exposición. Además de esto, no se observaron resultados indeterminados y la vacuna BCG impactó en la PT, lo cual explicaría algunos casos con discrepancia PT positivo, QFT-GIT negativo.
La sensibilidad de las IGRA para el diagnóstico de la ITL en niños no está bien establecida3,4 y su uso, especialmente en menores de 5 años, está sometido a mayores restricciones que en adultos.
En España existen muy pocos datos sobre el uso del QFT-GIT en población pediátrica ya que la mayoría de los estudios están realizados en adultos con T-SPOT10,11.
Debemos destacar el buen rendimiento del estudio de contactos en la identificación de casos nuevos de TB activa (3%) y la alta proporción de enfermos entre los infectados. De hecho, el 24 y el 18% de los niños con resultado positivo del QFT-GIT y de la PT, respectivamente, tenían una TB activa, ratificando el alto riesgo de progresión de infección a enfermedad en niños12 y la mayor especificidad del QFT-GIT para el diagnóstico de la TB.
Los 5 casos con TB activa contaron con PT y QFT-GIT positivos, soportados además en sólidas respuestas en ambas pruebas (induración media de la PT de 15mm, nivel medio de IFN-γ 9,5 U/ml). El nivel de IFN-γ fue significativamente mayor en enfermos con TB activa que en niños con infección tuberculosa no enfermos, lo que indica una relación entre la intensidad de la respuesta del IFN-γ y la probabilidad de enfermar, ya constatada en otros trabajos13,14.
El comportamiento de ambas pruebas fue similar en lo que respecta a su asociación con factores de exposición. El ser contacto en el propio domicilio se asoció independientemente con el riesgo de tener un resultado positivo del QFT-GIT y la PT.
Sin embargo, la proximidad del contacto estratificado en tres categorías no fue un predictor de riesgo con ninguna prueba posiblemente por la interferencia sobre los contactos no cerrados de otros factores de más peso no controlados en el estudio (como la duración total de la exposición o el grado de infecciosidad del caso índice).
En nuestro estudio la concordancia global entre la PT y el QFT-GIT fue del 95,6% (κ=0,80), con diferencias entre los vacunados (κ=0,78) y no vacunados (κ=1). Tan sólo hubo 7 casos discrepantes (4,5%): 6 con discrepancia PT positiva/ QFT-GIT negativo y 1 con discrepancia PT negativa/QFT-GIT positivo. Es infrecuente encontrar tan buenos resultados en la concordancia entre niños vacunados15-22. En un reciente estudio realizado en Cataluña la concordancia entre la PT y el QFT-GIT en el grupo de niños expuestos a enfermos con TB fue muy pobre tanto en no vacunados (κ=0,24) como en vacunados (κ=0,08).
Diversas guías clínicas recomiendan el uso preferente de la PT en el cribado de la ITL en niños menores de 5 años, teniendo en cuenta su mayor riesgo de progresión a una TB activa y una hipotética menor sensibilidad de las IGRA además de una mayor incidencia de resultados indeterminados en este grupo23. La excelente concordancia entre la PT y el QFT-GIT en menores de 5 años en nuestro estudio (κ=1) y la ausencia de resultados indeterminados contradicen, sin embargo, esta hipótesis.
La vacuna BCG justificaría algunos casos con discrepancia PT positiva/QFT-GIT negativo en nuestro estudio considerando el diferente comportamiento de la PT y de la concordancia entre las pruebas en vacunados y no vacunados. Esta idea estaría además respaldada por el hallazgo de la mayor proporción de QFT-GIT positivos con induraciones de la PT solidamente positivas (PT ≥ 15mm) que entre los reactores positivos con induraciones más débiles (5-14mm), lo que indica algunos falsos positivos de la PT en este último grupo.
Sin embargo, el impacto de la BCG sobre la PT pudo ser más limitado que el esperado. Según un reciente metanálisis2 en niños menores de 11 años vacunados una sola vez y antes del primer año de vida (que es el procedimiento habitualmente empleado en el País Vasco), cabría esperar hasta un 21% de falsos positivos de la PT, mientras que en nuestra cohorte el total de contactos con PT positiva sólo alcanzó el 11% (excluidos los casos de TB activa).
Además de la BCG, la discrepancia entre la PT e IGRA podría atribuirse a una sensibilización previa por Micobacterium avium (M. avium), de alta prevalencia en el País Vasco24 como ha sido constatada en un estudio reciente en Cataluña11, o a una antigua infección TB ya depurada, que por diferencias en la respuesta inmunológica medida por cada prueba sería detectada por la PT pero no por el QFT-GIT25. Esta hipótesis estaría apoyada en la excelente concordancia observada en los niños más jóvenes, en quienes la probabilidad de una infección previa es temporalmente menor, y por la asociación de la PT positiva con la edad constatada en el análisis univariante.
En ausencia de una prueba de oro para el diagnóstico de la ITL no es posible, sin embargo, asegurar que los casos con PT positivo y QFT-GIT negativo corresponden a falsos positivos de la PT y no a falsos negativos, especialmente aquellos con induraciones de la PT ≥ 15mm, que son predictoras de progresión a una TB activa12 y raramente estarían justificadas por la BCG (salvo en niños revacunados)2 ni por una sensibilización al M. avium.
Uno de los beneficios potenciales de las IGRA radica en la reducción de tratamientos preventivos como consecuencia de su mayor especificidad comparada con la PT. Según nuestros resultados, la opción de reemplazar la PT por el QFT-GIT o la aplicación de la estrategia combinada (cribado inicial con PT y confirmación con QFT-GIT de los casos PT positivo) conllevaría una reducción del 28 y el 34% de tratamientos preventivos, respectivamente, comparada con la estrategia convencional (con solo la PT). Por el contrario, el riesgo de utilizar las IGRA como prueba determinante del tratamiento sería la exclusión de posibles falsos negativos del QFT-GIT. Esta hipótesis implicaría una mayor incidencia de TB activa entre los individuos con PT positivo, QFT-GIT negativo, no tratados. Hasta ahora, en los pocos estudios longitudinales que han evaluado el valor pronóstico de las IGRA y la PT los resultados son contradictorios, dependiendo de la tasa de TB del lugar, las características de la población y el IGRA utilizado14,26–29. En lo que respecta a niños, un estudio de contactos realizado en Turquía29 encontró un valor predictivo similar de casos de TB con ELISPOT y con la PT, con una pequeña proporción de casos de progresión a TB activa no identificados con la IGRA pero sí con la PT. Por el contrario, en otros trabajos (en adultos) el QFT-GIT identificó mejor que la PT a los infectados que desarrollaron una TB activa, ninguno de ellos con una discrepancia basal PT+/QFT–GIT–14,26. Igualmente, en nuestra cohorte de contactos, integrada por niños y adultos, ninguno de los 144 contactos con resultados PT positivo, QFT-GIT negativo, no tratados ha enfermado de TB tras un período medio de seguimiento de 2 años (datos no publicados).
A diferencia de otros autores, no hemos encontrado resultados indeterminados del QFT-GIT a pesar de haber sido interpretados con los criterios más estrictos. Esta es una cuestión importante que se debe considerar, en cuanto que se ha utilizado el elevado número de resultados indeterminados como una limitación del uso de IGRA en niños3. En un reciente estudio se observó un 25% de resultados indeterminados con el QFT-GIT en niños inmunocompetentes y hasta el 66% en inmunodeficientes23. Las diferencias entre los distintos estudios podrían explicarse por una suma de factores, como son el criterio utilizado para definir un resultado indeterminado, el diseño del estudio y las características de la población incluida.
Nuestro estudio tiene limitaciones que debemos considerar. Primera, el tamaño de la muestra es reducido, sin embargo, el haber incluido de forma consecutiva a la inmensa mayoría de los casos elegibles contribuye a generalizar los resultados. Segunda, la elevada concordancia demostrada entre la PT y el QFT-GIT nos ha impedido analizar más profundamente el significado de las discrepancias entre ambas pruebas. Tercera, la vacunación con BCG se determinó mediante la constatación de la cicatriz característica, aunque de uso habitual, este método puede inducir a errores de interpretación.
En conclusión, el QFT-GIT puede potencialmente reemplazar a la PT en la detección de la ITL en contactos en edad pediátrica, especialmente en niños vacunados en BCG y en contextos con alta prevalencia en sensibilización al M. avium.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.