Las inundaciones son uno de los fenómenos naturales más descritos a nivel mundial, y su incidencia va en aumento debido a las consecuencias producidas por el cambio climático. La aparición de estos desastres conlleva riesgos en la población afectada, incluyendo el aumento de enfermedades transmisibles derivado principalmente del desplazamiento y del hacinamiento de la población, la deficiencia de medidas higiénico-dietéticas y la dificultad de acceso a servicios sociosanitarios. Las enfermedades infecciosas más frecuentemente descritas en estas catástrofes son las gastrointestinales, las respiratorias y las producidas por la sobreinfección de heridas. También se han descrito brotes epidémicos por infecciones menos prevalentes, como la leptospirosis, o infecciones transmitidas por vectores, cuyo aumento de incidencia ha sido fuertemente relacionado con este tipo de desastres.
Ante estos eventos es primordial el desarrollo de protocolos de vigilancia epidemiológica, así como la elaboración de consensos de diagnóstico y manejo terapéutico de las enfermedades transmisibles más prevalentes por parte de las sociedades científicas.
Este documento de consenso ha sido elaborado por la Sociedad Española de Infectología Pediátrica (SEIP) en colaboración con la Asociación Española de Pediatría (AEP) y la Sociedad Valenciana de Pediatría (SVP) con la finalidad de establecer recomendaciones para el manejo terapéutico de las principales enfermedades infecciosas que puedan producirse en los niños afectados por inundaciones, pudiendo ser extensible a otras catástrofes naturales.
Floods constitute one of the most widely described natural phenomena worldwide, and their frequency is increasing due to the consequences of climate change. Floods pose risks to the affected populations, including an increase in communicable diseases mainly due to population displacement and overcrowding, deficiencies in hygiene and dietary measures and difficulties accessing health care. The most frequently reported infectious diseases in the context of these disasters are gastrointestinal and respiratory diseases and diseases resulting from wound infection. Epidemic outbreaks of infections such as leptospirosis or vector-borne diseases, which are usually less prevalent but whose increased incidence is closely related to this type of disasters, have also been described.
These events evince the need to develop epidemiological surveillance protocols and for scientific societies to establish consensus-based guidelines for the diagnosis and therapeutic management of the most prevalent communicable diseases.
This consensus document was developed by the Sociedad Española de Infectología Pediátrica (SEIP) in collaboration with the Asociación Española de Pediatría (AEP) and the Sociedad Valenciana de Pediatría (SVP) to establish recommendations for the therapeutic management of the main infectious diseases that may affect children impacted by floods, which could also be applicable to other natural disasters.
Desde mediados de 2022 las inundaciones son el desastre natural más común a nivel mundial, y causan tanto muertes como elevados costes económicos. El deshielo de los polos y la subida del nivel del mar, atribuidos al cambio climático, figuran entre los responsables del incremento de fenómenos meteorológicos extremos, como fuertes precipitaciones, monzones, tsunamis y huracanes1. Este aumento se ha observado principalmente en países como Australia, Norteamérica, Centro y Sudeste de Europa, África y Sudeste asiático2.
Las principales enfermedades transmisibles que se han descrito tras desastres naturales, como las inundaciones, son secundarias a diversos factores que suceden de forma abrupta y que ponen en riesgo especialmente a los grupos más vulnerables, incluidos los pacientes pediátricos. La aparición de brotes epidémicos es secundaria al desplazamiento de la población afectada que ha de refugiarse en campamentos o edificios con mala ventilación, favoreciendo el hacinamiento y, por tanto, el aumento de infecciones respiratorias y digestivas. Se añaden la interrupción de servicios básicos como el abastecimiento de agua y comida y, por consiguiente, la deficiente higiene de los afectados, así como la predisposición de determinados grupos, como los niños no correctamente vacunados, inmunodeprimidos o pacientes crónicos con interrupción de su tratamiento de base, unido a una deficiencia de la asistencia sanitaria3,4.
Tras las recientes inundaciones producidas en nuestro país por la gota fría o DANA (depresión aislada en niveles altos) que ha afectado principalmente a la Comunidad Valenciana, la Sociedad Española de Infectología Pediátrica (SEIP), en colaboración con la Asociación Española de Pediatría (AEP) y la Sociedad Valenciana de Pediatría (SVP), han elaborado este documento con el objetivo de realizar recomendaciones sobre la atención de pacientes pediátricos con procesos infecciosos asociados a inundaciones. Debido a la escasa evidencia sobre el tratamiento antibiótico de algunas infecciones en población pediátrica, las pautas recomendadas se basan en la epidemiología descrita en la literatura y en la opinión de los autores, con la intención de que sea de utilidad como orientación inicial para el manejo de estas.
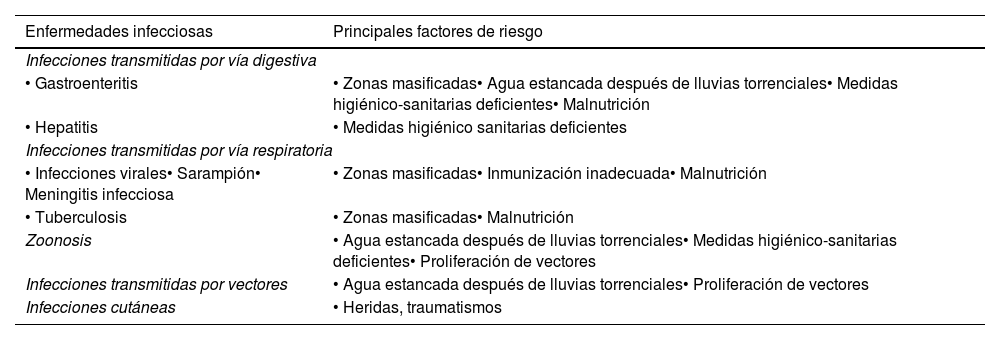
Enfermedades infecciosas asociadas a inundacionesEn las inundaciones y otros desastres naturales, la aparición de infecciones está relacionada con determinados factores de riesgo (tabla 1) y suele seguir un patrón cronológico determinado por las fases de la catástrofe3,5,6.
Principales enfermedades transmisibles descritas tras inundaciones y su relación con factores de riesgo
| Enfermedades infecciosas | Principales factores de riesgo |
|---|---|
| Infecciones transmitidas por vía digestiva | |
| • Gastroenteritis | • Zonas masificadas• Agua estancada después de lluvias torrenciales• Medidas higiénico-sanitarias deficientes• Malnutrición |
| • Hepatitis | • Medidas higiénico sanitarias deficientes |
| Infecciones transmitidas por vía respiratoria | |
| • Infecciones virales• Sarampión• Meningitis infecciosa | • Zonas masificadas• Inmunización inadecuada• Malnutrición |
| • Tuberculosis | • Zonas masificadas• Malnutrición |
| Zoonosis | • Agua estancada después de lluvias torrenciales• Medidas higiénico-sanitarias deficientes• Proliferación de vectores |
| Infecciones transmitidas por vectores | • Agua estancada después de lluvias torrenciales• Proliferación de vectores |
| Infecciones cutáneas | • Heridas, traumatismos |
En la fase inicial o fase de impacto, correspondiente a los primeros 4días, los brotes epidémicos son infrecuentes y las infecciones más descritas son las derivadas de la sobreinfección de heridas, quemaduras o fracturas. En caso de inundaciones también son frecuentes las neumonías por aspiración de agua.
En las cuatro semanas posteriores aparecen principalmente infecciones derivadas de la contaminación de agua y alimentos, que puede ocasionar brotes epidémicos secundarios a la aglomeración de la población afectada. En esta fase son frecuentes las infecciones virales estacionales.
Finalmente, en la última fase, o de recuperación, que tiene lugar aproximadamente al mes, suelen diagnosticarse infecciones con períodos de incubación prolongados, como la leptospirosis o infecciones transmitidas por vectores.
A continuación se describen la etiología, el diagnóstico microbiológico y el tratamiento de las enfermedades transmisibles más frecuentemente descritas en relación con inundaciones.
Infecciones gastrointestinalesLas infecciones gastrointestinales son un fenómeno común tras las catástrofes naturales. Las inundaciones provocan alteración del sistema de alcantarillado, interrupción del agua potable y riesgo de contaminación de las fuentes de agua, que, junto a la limitación de las medidas de higiene, favorecen las enfermedades transmitidas por agua o alimentos contaminados. Estas infecciones suelen manifestarse en las primeras semanas, agravando la morbilidad en poblaciones vulnerables, especialmente en áreas con sistemas de saneamiento comprometidos y limitación de acceso a agua potable.
Los principales agentes etiológicos incluyen bacterias enteropatógenas como Escherichia coli enterotoxigénica, Salmonella spp., Shigella spp., Campylobacter spp., Aeromonas spp. y Vibrio cholerae. Los virus entéricos, como rotavirus y norovirus, también son frecuentes en este contexto, junto con parásitos protozoarios como Giardia intestinalis y Cryptosporidium spp.6,7.
Los síntomas varían según el agente etiológico, y comúnmente incluyen diarrea, vómitos, dolor abdominal, fiebre y, en casos graves, deshidratación y alteraciones electrolíticas que pueden poner en riesgo la vida. El diagnóstico es clínico, con confirmación etiológica mediante estudios microbiológicos como coprocultivos, análisis de parásitos en heces, pruebas rápidas de detección de toxinas bacterianas, antígenos virales y parasitarios, y pruebas moleculares (PCR).
La terapia de rehidratación es fundamental, y puede realizarse mediante la administración de suero de rehidratación oral, o intravenosa en casos de deshidratación severa. Algunos casos precisarán, por su evolución o sospecha etiológica, la prescripción de antibiótico (tabla 2).
Infecciones transmitidas por vía digestiva. Recomendaciones sobre diagnóstico microbiológico y tratamiento
| Infecciones gastrointestinales | |
| Heces• Bacterias: coprocultivo• Virus: PCR molecular múltiple• Parásitos: microscopia/ tinción Ziehl-Neelsen/ PCR molecular múltiple | Se empleará tratamiento antibiótico empírico en caso de afectación del estado general o inmunosupresiónTratamiento ambulatorio:• Cefixima 8mg/kg/día cada 12-24h VO/5días (dosis máxima 400mg al día)Tratamiento intravenoso:• Cefotaxima 150 mg/kg/día cada 8h i.v./5días (dosis máxima 12g al día), o• Ceftriaxona 50-75 mg/kg cada 24h i.v./5días (dosis máxima 4g al día)En caso de sospecha de infección por Vibrio cholerae, valorar asociar:Azitromicina dosis única de 20mg/kg/día cada 24h v.o. (dosis máxima 500mg/dosis)Alergia a betalactámicos:• Ciprofloxacino 20mg/kg/día cada 12h v.o./i.v. (dosis máxima v.o.: 1,5g/día, i.v.: 1,2g/día) |
| Parasitosis: estrongiloidiasis | |
| Suero• Detección anticuerpos IgGHeces• Cultivo/PCR molecular | Primera elección:• Ivermectina 0,2 mg/kg/día cada 24 h v.o./1día |
| Otras parasitosis | |
| Heces• Bacterias: coprocultivo• Virus: PCR molecular múltiple• Parásitos: microscopia/tinción Ziehl-Neelsen/PCR molecular | Giardiasis:• Tinidazol oral dosis única 50mg/kg (máx. 2g)o• Metronidazol oral 30 mg/kg/día (dosis máxima 2g/día), 5-10díasCryptosporidium sppa• Nitazoxanidab v.o. 3días• 1-3 años 100mg (5ml)/12h• 4-11 años 200mg (10ml)/12h• >12 años 500mg/12h• Paromomicinac v.o.• 30mg/kg/día, 8h; 10-14días• ± Azitromicina 10mg/kg c/24h, 3días |
| Virus hepatitis A / Virus hepatitis E | |
| Suero:• SerologíaSangre total y heces:• PCR a VHA y VHE | Sintomático• Prevención: vacunación VHA• Vacunación de convivientes en caso de diagnóstico de un caso de infección por VHA32 |
En zonas endémicas también se describen brotes producidos por virus de la hepatitisA yE como consecuencia de la contaminación del agua potable6. Los síntomas digestivos suelen ser los más frecuentes, seguidos de ictericia y acolia8.
Parasitosis: estrongiloidiasisParasitosis causada principalmente por helmintos de la especie Strongyloides stercoralis.
Aunque se presenta generalmente en países subtropicales y tropicales, también es posible la transmisión en países de clima templado. En España se han descrito casos autóctonos, especialmente en la provincia de Valencia9.
El mecanismo de transmisión más frecuente es la entrada percutánea por contacto con larvas filariformes presentes en el suelo u otros materiales contaminados por heces humanas. Con menor frecuencia la transmisión se produce por ingesta de agua o alimentos contaminados, circunstancias todas ellas favorecidas con la pérdida de las medidas higiénico-sanitarias adecuadas tras una catástrofe natural10.
Las manifestaciones clínicas varían desde formas asintomáticas o subclínicas hasta formas graves de hiperinfestación o estrongiloidiasis diseminada que pueden ser letales en niños inmunocomprometidos.
La forma aguda suele presentarse como erupción eritematosa pruriginosa, de aspecto serpiginoso, correspondiente al desplazamiento de las larvas en tejido subcutáneo. Por las características de su ciclo biológico pueden producir afectación pulmonar con clínica de tos y disnea, o síntomas gastrointestinales a las 3-4semanas de la infestación, con dolor abdominal y diarrea.
La estrongiloidiasis crónica puede persistir durante años debido a la autoinfección. En general cursa desapercibida y, cuando es sintomática, suele afectar a la piel o al tracto gastrointestinal, con dolor abdominal y diarrea alternando con estreñimiento. Los síntomas respiratorios son inusuales, aunque las infecciones graves pueden ocasionar síndrome de Löffler, con tos, sibilancias y eosinofilia11.
El diagnóstico se basa en la detección de larvas en las heces mediante visualización directa al microscopio o su detección por técnicas moleculares y el cultivo larvario. La serología, con una alta sensibilidad (85%) y especificidad (97%), es de elección en pacientes poco sintomáticos y en la infección crónica11. A nivel analítico es frecuente encontrar eosinofilia y elevación de la IgE1,7. El tratamiento actual de elección es la ivermectina.
En la tabla 2 se explica el tratamiento de otras parasitosis cuya frecuencia puede aumentar tras inundaciones.
Infecciones cutáneas y de partes blandasLas infecciones de piel y partes blandas (IPPB) son comunes en la primera fase o primeros días después de los desastres hidrológicos, aunque pueden aparecer en las tres primeras semanas tras la catástrofe. Son secundarias a la sobreinfección de heridas traumáticas y afecciones dermatológicas relacionadas con la exposición al agua. Pueden producirse desde infecciones superficiales como celulitis, hasta más profundas tales como fascitis, miositis necrosante o incluso infecciones osteoarticulares.
Staphylococcus aureus y Streptococcus pyogenes son los microorganismos típicamente asociados con estas infecciones12. Sin embargo, varias publicaciones describen que las bacterias gramnegativas desempeñan un importante papel en las IPPB tras eventos hidrológicos. Entre ellas el género Aeromonas, que habita en agua dulce y salobre, puede producir celulitis simple o extenderse más profundamente, manifestándose como infección necrosante de tejidos blandos.
Las infecciones polimicrobianas, que incluyen otros organismos gramnegativos como Pseudomonas aeruginosa, Klebsiella pneumoniae y Escherichia coli, también fueron comunes entre los supervivientes de tsunamis e inundaciones. En general, ante una IPPB tras inmersión en aguas contaminadas debemos sospechar una etiología polimicrobiana o por bacilos gramnegativos.
Las infecciones cutáneas de aparición tardía y aquellas que no mejoran con regímenes antibióticos convencionales aumentan la sospecha de un microorganismo poco común. En algunas series publicadas se han notificado casos de infección debida a Burkholderia pseudomallei (melioidosis), micobacterias no tuberculosas (M.abscessus, M.fortuitum, M.chenolae) y hongos filamentosos (Aspergillus spp., Mucor spp.)4,12.
El diagnóstico es fundamentalmente clínico. En caso de heridas supuradas o en los que se realice drenaje quirúrgico, se recomienda remitir una muestra para cultivo.
El tratamiento inicial incluye una adecuada limpieza y la retirada, en su caso, de cuerpos extraños13.
Es primordial comprobar la correcta inmunización frente al tétanos, indicando una dosis de vacuna Td en caso de estado vacunal deficiente o desconocido, añadiendo inmunoglobulina antitetánica según el tipo de herida14.
En caso de complicación necrosante o heridas abscesificadas, es fundamental el desbridamiento quirúrgico rápido combinado con una terapia antibacteriana de amplio espectro.
Se recomienda una amplia cobertura antibiótica empírica de organismos grampositivos y gramnegativos en espera de los resultados del cultivo de la herida (tabla 3)13.
Infecciones cutáneas y de partes blandas. Recomendaciones sobre diagnóstico microbiológico y tratamiento empírico
| Frotis de herida• Cultivo en placaHemocultivoEn pacientes con síndrome febril | INFECCIONES DE HERIDAS, PIEL Y PARTES BLANDASHerida sin signos de sobreinfección:• Limpieza de herida con suero salino• Retirada de cuerpos extraños• No está indicado el empleo de antibiótico profilácticoHerida con signos de sobreinfección o infección de tejidos blandos:Tratamiento ambulatorio:1.aelección:• Trimetoprim-sulfametoxazol (TMP-SMX) 8-10 mg/kg/día de trimetoprim cada 8-12 h v.o. (dosis máxima 320 mg/dosis de trimetoprim cada 6 h)± ciprofloxacinoa 30 mg/kg/día cada 12 h v.o. (dosis máxima 1,5 g/día)En caso de exposición a suelo/aguas residuales/ inundaciones:• TMP-SMX 8-10 mg/kg/día de trimetoprim cada 8-12 h v.o. + metronidazol 30 mg/kg/día cada 8 h v.o. (dosis máxima 2,25 g/día)Alternativa:• Ciprofloxacinoaa 30 mg/kg/día cada 12 h v.o. (dosis máxima 1,5 g/día) + metronidazol 30 mg/kg/día cada 8 h v.o. (dosis máxima de metronidazol 2,25 g/día)• Amoxicilina-clavulánico 40-50 mg/kg/día cada 8 h v.o. (dosis máxima 3g al día de amoxicilina)1Se usará ciprofloxacino especialmente en heridas en plantas del pie o mala evoluciónTratamiento intravenoso:• Ceftazidima 150 mg/kg/día cada 8 h i.v. (dosis máxima 8g al día)+∘ Si < 10% SAMR: cloxacilina 100 mg/kg/día cada 4-6 h i.v. (dosis máxima 12 g/día)∘ Si> 10% SAMR: vancomicina 45 mg/kg/día cada 6-8 horas i.v. (dosis máxima 4g al día) o linezolid 30 mg/kg/día cada 8 h i.v. (en >12 años 600mg dosis cada 12 h)Alternativa o alergia a betalactámicos:• Ciprofloxacino 30 mg/kg/día cada 12 h i.v. (dosis máxima 1,2g al día) + vancomicina o linezolid i.v.En caso de exposición a suelo o aguas residuales/inundaciones:• Cefepima 150 mg/kg/día cada 8 h i.v. (dosis máxima 6g al día) + metronidazol 30 mg/kg/día cada 8 h i.v. (dosis máxima de metronidazol 4 g/día)ó• Piperacilina-tazobactam 300 mg/kg/día cada 6-8 h i.v. (dosis máxima 16g de piperacilina)∘ Si>10% de SAMR: piperacilina-tazobactam i.v. + vancomicina o linezolid i.v.Duración: 7-14 días según gravedadEn pacientes que precisen tratamiento intravenoso se podrá realizar terapia secuencial tras mejoría clínica y resolución de la fiebreVacunación antitetánicaRevisar calendario vacunalEn caso de vacunación incompleta (< 3 dosis), no vacunación o situación desconocida, se ha de administrar una dosis de vacuna Td, y en heridas tetanígenas completar con dosis de inmunoglobulina antitetánica i.m. administrada en lugar diferente14 |
Son una de las principales causas de morbimortalidad en niños menores de 5años tras un desastre natural. La destrucción de viviendas y el hacinamiento favorecen la transmisión de patógenos virales respiratorios. Asimismo, la inmersión o aspiración de agua contaminada tras una inundación puede producir infecciones bacterianas en el tracto respiratorio inferior6,12.
Los virus estacionales (virus influenza, virus respiratorio sincitial, adenovirus, SARS-CoV-2) son la etiología más frecuente en niños que residen en campamentos o refugios. También se han descrito infecciones bacterianas por Streptococcus pneumoniae y Bordetella pertussis, especialmente en niños no vacunados, y brotes por bacterias responsables de neumonía atípica, como Mycoplasma pneumoniae y Legionella spp3.
En caso de neumonía por inmersión, la etiología suele ser polimicrobiana, especialmente secundaria a microrganismos de la microbiota orofaríngea, S.pneumoniae y anaerobios, y puede complicarse con la formación de abscesos, empiema o necrosis pulmonar6,12.
El diagnóstico es clínico, pudiendo realizarse radiografía de tórax en caso de sospecha de neumonía bacteriana o aspirativa. Para el diagnóstico microbiológico se ha de solicitar un panel de PCR múltiple que incluya virus y bacterias atípicas en aspirado nasofaríngeo. En caso de neumonía grave con necesidad de ventilación mecánica, solicitar cultivo y pruebas moleculares de vías bajas (panel PCR múltiple de neumonía), de aspirado bronquial o de muestra obtenida mediante lavado broncoalveolar.
El tratamiento en caso de infección respiratoria viral ha de ser sintomático. En aquellos casos en los que se sospecha neumonía por inmersión o aspiración, el tratamiento de primera elección será amoxicilina-clavulánico (tabla 4).
Infecciones respiratorias. Recomendaciones sobre diagnóstico microbiológico y tratamiento antibiótico empírico
| Infección respiratoria | |
| Infecciones respiratorias de vías bajas o neumonías de probable etiología viral o por bacterias atípicas:• PCR múltiple en aspirado nasofaríngeoPacientes con necesidad de ventilación mecánica:• Cultivo de broncoaspirado o lavado broncoalveolar | Tratamiento ambulatorio:Sospecha de neumonía aspirativa:• Amoxicilina-clavulánico 80 mg/kg/día cada 8 h v.o. (dosis máxima 3g al día de amoxicilina). Duración: 5-7 díasAlergia a betalactámicos:• Levofloxacino v.o. (> 6 meses y <5 años: 16-20 mg/kg/día cada 12 h; > 5 años: 10 mg/kg/día cada 24 h, dosis máxima 500 mg/día). Duración: 5-7 díasSospecha de neumonía atípica:• Claritromicina 15 mg/kg/día cada 12 h v.o. (dosis máxima 500mg al día). Duración: 5-7 díasAlternativa: Azitromicina 10 mg/kg cada 24 h v.o. (dosis máxima 500 mg/día). Duración: 3-5 días (5 días en caso de Legionella spp.)Tratamiento intravenoso:• Amoxicilina-clavulánico 100-150 mg/kg/día cada 8 h i.v. (dosis máxima 6g al día de amoxicilina). Duración: 7-10 díasAlergia a betalactámicos:• Levofloxacino i.v. (> 6 meses y <5 años: 16-20 mg/kg/día cada 12 h; > 5 años: 10 mg/kg/día cada 12 h, dosis máxima 500 mg/día). Duración: 7-10 díasNeumonía grave:• Cefotaxima 150 mg/kg/día cada 8 h i.v. (dosis máxima 12g al día) + clindamicina 30 mg/kg/día cada 8 h i.v. (dosis máxima 2,7g al día). Duración: 7-10 días |
En inundaciones y otras catástrofes se ha observado un aumento en la incidencia de zoonosis como consecuencia del empeoramiento de las medidas higiénico-sanitarias y del mayor contacto con animales.
La leptospirosis es una de las zoonosis más relacionadas con eventos meteorológicos extremos. En estudios realizados en Filipinas y en las islas Fiji se demostró que, tras episodios de lluvias torrenciales, los diagnósticos de leptospirosis se incrementan significativamente15,16. Un metaanálisis reciente describe un riesgo elevado (OR: 2,19) de leptospirosis tras inundaciones17.
Esta infección es producida por espiroquetas del género Leptospira spp. (fundamentalmente L.interrogans), y los roedores son su principal reservorio en humanos. La Leptospira se reproduce en los túbulos renales del roedor excretándose por la orina, y el contagio se produce tras el contacto de piel no intacta o mucosas con roedores, agua, alimentos o superficies contaminadas4. Tiene una distribución mundial y, según los datos de la Red Nacional de Vigilancia Epidemiológica (RENAVE), en 2022 se diagnosticaron 50 casos en España18.
Dicha enfermedad tiene un período de incubación prolongado de hasta 20días, y su clínica varía desde cuadros subclínicos hasta formas graves con fallo multiorgánico.
La mayoría de las pacientes presentan un cuadro leve pseudogripal, con fiebre, mialgias, vómitos y cefalea típicamente frontal, siendo frecuente la inyección conjuntival e ictericia. Esta fase coincide con la fase septicémica de la infección. Sin embargo, algunos pacientes presentan cuadros graves secundarios a una hiperrespuesta inmune e ineficaz del huésped. La miocarditis, el fallo hepático, la insuficiencia renal y respiratoria, la meningitis y la coagulopatía son las formas clínicas más descritas en los cuadros graves19,20.
El diagnóstico microbiológico se realiza mediante serología (ELISA, inmunocromatografía y microaglutinación) o técnicas moleculares en sangre, líquido cefalorraquídeo u orina. La sensibilidad en sangre de la PCR es alta a la semana del inicio de los síntomas, siendo variable en orina al eliminarse de manera intermitente. Para su diagnóstico se pueden emplear técnicas de cultivo o microscopia, pero requieren de personal experto y medios especiales, por lo que actualmente están en desuso21. En general, se recomienda solicitar PCR en sangre en los primeros 10días o en orina, y serología a partir del séptimo día de clínica.
La penicilina es el tratamiento de elección en pacientes que precisen tratamiento parenteral. En formas leves la doxiciclina oral es la opción recomendada, independientemente de la edad22 (tabla 5).
Zoonosis. Recomendaciones sobre diagnóstico microbiológico y tratamiento antibiótico
| Leptospirosis | |
| Suero:• Detección anticuerposOrina y sangre total:• PCR Leptospira spp. | Formas leves/ambulatorio: doxiciclina 4 mg/kg/día cada 12 h v.o./7 días (dosis máxima 200mg al día)Alternativas: azitromicina 10 mg/kg/día cada 24 h v.o. el primer día, seguido de 5 mg/kg/día cada 24 h, 5 días (dosis máxima 500 mg/dosis)óAmoxicilina 50 mg/kg/día cada 8h v.o., 7 días (dosis máxima 6g al día)Formas graves/i.v.: penicilina G 250.000 UI/kg/día cada 6 h i.v. (dosis máxima 24 millones UI/día)óCefotaxima 150 mg/kg/día cada 8 h i.v., 7 días (dosis máxima 12g al día)óCeftriaxona 50-75 mg/kg cada 24 h i.v., 7 días (dosis máxima 4g al día) |
| Leishmaniasis | |
| Suero:• Detección anticuerposSangre total, biopsia, médula ósea:• PCR Leishmania spp. | Leishmaniasis visceral• Anfotericina B liposomal 3 mg/kg/día cada 24 horas i.v., días 1-5, 14 y 21 (dosis total 21 mg/kg)• En inmunodeprimidos: 4 mg/kg/día cada 24 horas i.v. los días 1-5, 10, 17, 24, 31 y 38 (dosis total 40 mg/kg)Leishmaniasis cutáneaTratamiento individualizado conjuntamente con dermatologíaLa mayoría de las lesiones precisan tratamiento local con crioterapia o termoterapia |
En relación con estos desastres naturales se han descrito un aumento de mordeduras por animales domésticos. La microbiota oral de perros y gatos incluye Pasteurella multocida, Capnocytophaga canimorsus, estafilococos, estreptococos y anaerobios, por lo que ante una mordedura con signos de sobreinfección el tratamiento antibiótico de elección debe ser amoxicilina-clavulánico4.
Nuestro país es área endémica de leishmaniasis, reportándose 387 casos según el último informe RENAVE publicado en 2023. Las comunidades autónomas con mayor incidencia fueron Cataluña, Comunidad Valenciana y Andalucía23. Tras episodios de inundaciones, se han descrito un aumento de Phlebotomus, vector de la enfermedad, por lo que se deberían extremar las medidas de vigilancia y control de vectores tras estos desastres1,24. El diagnóstico microbiológico y el tratamiento de la leishmaniasis se describen en la tabla 525.
Infecciones transmitidas por vectoresEn caso de inundaciones es frecuente el aumento de infecciones transmitidas por vectores. Inicialmente, las inundaciones pueden arrasar los hábitats de reproducción de artrópodos como los mosquitos y reducir su población. Sin embargo, en los días posteriores el agua estancada proporciona un lugar ideal de reproducción7.
En zonas endémicas se han registrado brotes de infecciones transmitidas por mosquitos como malaria, dengue, zika, chikungunya, fiebre amarilla, fiebre del Nilo Occidental (West Nile) y fiebre del Valle del Rift1,3,12.
El cambio climático, junto con otros factores ambientales y sociales, ha facilitado cambios regionales en la distribución de los mosquitos vectores de algunas infecciones, como el Culex o mosquito común para el virus del Nilo Occidental y el Aedes aegypti o Aedes albopictus para el dengue, ambos adaptados a nuevas regiones y condiciones en el sur de Europa, describiéndose en las últimas dos décadas cada vez de forma más frecuente brotes de estas dos enfermedades.
España ha experimentado brotes tanto de virus del Nilo Occidental como de dengue autóctono.
La amplia distribución y expansión de Aedes albopictus en el área mediterránea y otras regiones del país conlleva un riesgo moderado de transmisión autóctona del dengue durante su periodo de actividad (mayo-noviembre)26,27. Los primeros casos autóctonos se identificaron en 2018, habiéndose descrito casos en Murcia, Cataluña, Madrid e Ibiza.
Los síntomas del dengue suelen ser leves, e incluyen fiebre, cefalea, dolor retroorbitario, artralgias, mialgias, exantema y manifestaciones hemorrágicas, que se desarrollan en los primeros 4 a 7días. En algunos casos el curso puede ser grave o hemorrágico, y no es esperable en España encontrar estos casos, debido a que esta condición es característica de la reinfección por distintos serotipos en zonas endémicas.
El diagnóstico se realiza por pruebas serológicas o moleculares. El tratamiento es sintomático, con paracetamol para controlar la fiebre y el dolor. Se deben evitar los fármacos antiinflamatorios no esteroideos28.
Por otro lado, la circulación del virus del Nilo Occidental se ha documentado en España desde hace dos décadas. En la temporada 2023 se notificaron 19 casos en humanos autóctonos, afectando por primera vez las provincias de Cáceres, Huelva, Valencia, Barcelona y Toledo. En áreas con focos de infección y durante el periodo de actividad del vector existe un riesgo moderado de transmisión; en el resto del país el riesgo es bajo, aunque es previsible que el virus se pueda expandir a nuevos territorios.
La mayoría de las infecciones por el virus del Nilo Occidental son asintomáticas; entre un 20-40% desarrollan un cuadro pseudogripal de 2 a 5días de duración. Menos de un 1% manifiestan una enfermedad neuroinvasiva (meningitis, encefalitis y parálisis flácida aguda). El tratamiento de la enfermedad es de soporte29.
Ambos virus representan un desafío de salud pública, requiriendo un enfoque integrado que combine la vigilancia entomológica, el control vectorial y la educación de la población.
Infecciones inmunopreveniblesEn situaciones de catástrofe se han descrito brotes producidos por infecciones transmitidas por gotas, tales como sarampión o meningitis meningocócica. En nuestro país contamos con tasas elevadas de vacunación en pediatría, por lo que el riesgo poblacional no es elevado, pero sí el individual, en función de su estado inmunitario y en bolsas de no vacunados. Es primordial comprobar el estado de inmunización de los afectados, estableciendo campañas de vacunación y medidas de vigilancia y profilaxis frente a meningococo en caso de aparición de casos, así como las medidas de aislamiento y prevención si hay casos de sarampión, dada su elevada contagiosidad.
Medidas preventivas y vigilancia epidemiológicaEs fundamental establecer medidas de prevención para evitar la transmisión de enfermedades infecciosas basadas principalmente en garantizar una adecuada higiene, asegurar el acceso a agua potable y alimentos y, mejorar la asistencia médica en las zonas afectadas (tabla 6)2,4,30. Se debe mitigar la aparición de brotes epidémicos optimizando los programas de vacunación en zonas de riesgo, evitando la propagación de vectores y llevando a cabo protocolos de vigilancia epidemiológica31.
Medidas generales de prevención de las enfermedades infecciosas asociadas a desastres naturales
| Enfermedades | Medidas de prevención |
|---|---|
| Enfermedades transmitidas por el agua y alimentos contaminados | • Lavado de manos• Uso de agua potable o embotellada para beber y lavar la comida• Adecuada eliminación de excrementos y residuos |
| Enfermedades respiratorias | • Ventilación adecuada• Evitar espacios masificados• Lavado de manos• Inmunización correcta |
| Infecciones cutáneas | • Higiene adecuada• Uso de botas y calzado de protección• Inmunización frente al tétanos |
| Enfermedades asociadas a vectores | • Uso de repelentes• Ropa de manga y pantalón largo• Usar mosquiteras• Adecuado almacenamiento de agua (tapar los recipientes, eliminar objetos que acumulen agua) |
| Leptospirosis | • Evitar bañarse en aguas estancadas• Uso de botas y calzado de protección• Proteger los alimentos del contacto con roedores u otros animales• Colocar la basura en bolsas cerradas |
Aunque todas estas medidas son eficaces para disminuir el impacto de estas catástrofes, las más eficaces serían las preventivas, incluyendo la preparación de las zonas en riesgo y la implementación de medidas de evacuación rápidas y eficaces2.
ConclusiónLos fenómenos hidrológicos se relacionan con un aumento de enfermedades transmisibles, y la población pediátrica es uno de los grupos de mayor riesgo. La mayoría de las infecciones afectan a la población desplazada que ha de alojarse en espacios masificados sin condiciones higiénicas adecuadas, favoreciendo el incremento de infecciones relacionadas con la ingesta de agua y alimentos contaminados, infecciones respiratorias y zoonosis. La concienciación y el conocimiento sobre las posibles infecciones que se producen en estos desastres y su vigilancia epidemiológica optimizan la correcta atención de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.