La espondilodiscitis pediátrica (EDP) es una afección poco común, para la cual no existen guías clínicas internacionales específicas. No se han establecido factores relacionados con las complicaciones.
Nuestro objetivo fue describir las características clínicas y epidemiológicas de la EDP, analizar los factores asociados al desarrollo de complicaciones y evaluar el cumplimiento de las recomendaciones del Documento de consenso nacional (DCN) español para el abordaje diagnóstico y terapéutico de las infecciones osteoarticulares agudas.
Material y métodosEstudio ambispectivo, multicéntrico, nacional de dos cohortes de EDP: histórica (2008-2012) y prospectiva (2015-2020, después de la publicación del DCN).
Se incluyeron pacientes con diagnóstico de EDP. Se registraron datos demográficos, clínicos, microbiológicos y radiológicos. Los factores relacionados con el desarrollo de complicaciones se analizaron mediante regresión logística. Se realizaron comparaciones entre ambas cohortes.
ResultadosSe incluyeron 98 EDP. En el 84,7% el diagnóstico se confirmó mediante resonancia magnética. Se obtuvo aislamiento microbiológico en el 6,1%, siendo S. aureus sensible a meticilina el principal agente etiológico. Las complicaciones ocurrieron en el 18,9%, siendo la más frecuente el absceso de tejidos blandos. Del 8,6% de los pacientes con secuelas, el dolor persistente fue el más frecuente. Al comparar las cohortes, hubo una mejor adherencia a las recomendaciones de tratamiento del DCN en la cohorte prospectiva (57,6% frente a 12,9%, p<0,01), incluida una reducción en la duración de la terapia con antibióticos intravenosos (10 frente a 14 días, p<0,01).
ConclusionesLa evolución de la EDP en nuestra serie fue favorable, con baja frecuencia de complicaciones y secuelas. La adherencia a las recomendaciones del DCN fue alta. Se necesitan estudios con mayor tamaño muestral que establezcan nuevas recomendaciones para optimizar el abordaje de estas infecciones.
Pediatric spondylodiscitis (PSD) is an uncommon condition, for which there are no specific international clinical guidelines. Factors related to complications have not been stablished. Our aim was to describe clinical and epidemiological characteristics of PSD, to analyze factors associated with complications and to evaluate adherence to the recommendations of the Spanish National Consensus Document (NCD) for the diagnostic and therapeutic approach to acute osteoarticular infections.
Material and methodsAmbispective, multicenter, national study of two PSD cohorts: historical (2008-2012) and prospective (2015-2020, after publication of NCD).
Patients with diagnosis of PSD were included. Demographic, clinical, microbiological and radiological data were recorded. Factors related to the development of complications were analized by logistic regression. Comparisons between both cohorts were performed.
ResultsNinety-eight PSD were included. In 84.7%, diagnosis was confirmed by magnetic resonance imaging. Microbiological isolation was obtained in 6.1%, with methicillin-sensitive S. aureus as the main etiologic agent. Complications occurred in 18.9%, the most frequent being soft tissue abscess. Of the 8.6% of patients with sequelae, persistent pain was the most common. Comparing cohorts, there was better adherence to NCD treatment recommendations in the prospective one (57.6% vs. 12.9%, p<0.01), including a reduction in the lenght of intravenous antibiotic therapy (10 vs. 14 days, p<0.01).
ConclusionsThe evolution of PSD in our series was favorable, with low frequency of complications and sequelae. The adherence to the recommendations of the NCD was high. Studies with larger sample size are needed to establish new recommendations to optimize the approach to these infections.
El término espondilodiscitis (ED) comprende aquellas infecciones que afectan a los cuerpos vertebrales y discos intervertebrales, aunque a menudo se utiliza para referirse a todas las infecciones de la columna vertebral, ya se trate de osteomielitis (OM) vertebral, discitis aislada o ED propiamente dicha1–3. Además de ser procesos infrecuentes en la infancia, su sintomatología inespecífica, especialmente en niños pequeños, supone un reto diagnóstico importante para los pediatras4, siendo necesario un alto índice de sospecha para evitar posibles complicaciones y secuelas resultantes de retrasos en su diagnóstico y tratamiento2,5.
La ausencia de alteraciones en la radiología convencional hasta pasadas varias semanas tras el inicio de la enfermedad hace que la resonancia magnética (RM) sea la prueba de imagen de elección en el diagnóstico de ED3,6,7. En general, el aislamiento del microorganismo involucrado en el desarrollo de estas infecciones permitiría la administración del tratamiento antibiótico más apropiado en cada caso; no obstante, la ausencia de aislamiento microbiológico es el escenario más común en la ED pediátrica (EDP), situación que se da en hasta el 87-100% de los casos2,8. Esto, junto con la ausencia de recomendaciones estandarizadas para el tratamiento de estas infecciones en la población pediátrica9, explica la gran variabilidad en el abordaje de la EDP en nuestro medio.
En 2014 se publicó el Documento de consenso nacional (DCN) español para el abordaje diagnóstico y terapéutico de las infecciones osteoarticulares agudas (IOA) no complicadas en la edad pediátrica10,11, que incluía pocas recomendaciones específicas para la EDP. Iniciativas posteriores en países de nuestra región, incluyendo las guías de la Sociedad Europea de Enfermedades Infecciosas Pediátricas (ESPID), también han intentado establecer recomendaciones para el tratamiento de estas entidades en la infancia6,7,12.
La Red de Infecciones Osteoarticulares Pediátrica (RIOPed), actualmente compuesta de 66 hospitales por toda España, ha permitido recoger datos sobre las IOA pediátricas de manera retrospectiva entre 2008 y 2012 y prospectiva desde 2015, así como evaluar el impacto del DCN sobre el abordaje de la artritis séptica y la osteomielitis aguda (OMA) en nuestro medio un año después de su publicación13.
Material y métodosEl objetivo principal del estudio fue describir las características clínicas y epidemiológicas de la EDP y analizar los posibles factores asociados al desarrollo de complicaciones en estos pacientes. Como objetivos secundarios se evaluó la adherencia a las recomendaciones de diagnóstico y tratamiento incluidas en el DCN para la EDP y la necesidad de establecer nuevas recomendaciones para optimizar el abordaje de estas infecciones.
Estudio ambispectivo, multicéntrico y nacional realizado a través de la RIOPed en dos cohortes de pacientes menores de 16 años con EDP procedentes de 22 hospitales españoles en la cohorte histórica (entre 2008 y 2012) y de 37 en la cohorte prospectiva (entre septiembre de 2015 y mayo de 2020, tras la publicación del DCN).
El estudio fue aprobado por el Comité de Ética del Hospital Universitario Severo Ochoa y ratificado en los centros participantes.
Se incluyó a pacientes con diagnóstico de EDP, definida como la presencia de clínica sugestiva (fiebre, dolor de espalda, cojera, rechazo a la sedestación o a caminar) con hallazgos compatibles en la gammagrafía ósea o la RM realizadas y una respuesta adecuada al tratamiento antimicrobiano.
Se consideraron complicaciones la aparición de piomiositis, absceso de tejidos blandos, absceso intramedular, déficits neurológicos, trombosis venosa profunda, embolismo séptico y neumonía.
Se llevó a cabo un estudio descriptivo de ambas cohortes y se analizaron los factores asociados al desarrollo de complicaciones conjuntamente en las dos cohortes.
Se evaluaron las diferencias existentes entre antes y después de la publicación del DCN y el grado de adherencia a las recomendaciones de diagnóstico y tratamiento propuestas en él. Se calculó el porcentaje de adhesión a las recomendaciones que el grupo de expertos consideró de obligada realización: extracción de hemocultivo (HC) y realización de radiografía y RM. Se valoró el tratamiento antibiótico seleccionado (empírico y específico/dirigido) así como su duración (tabla 1).
Recomendaciones de tratamiento de las infecciones osteoarticulares establecidas en el Documento de Consenso Nacional
| Tratamiento intravenoso | <3 meses: cloxacilina+cefotaxima/gentamicina |
| 3 meses-5 años: cefuroxima o cloxacilina+cefotaxima | |
| >5 años: cefazolina o cloxacilina | |
| Tratamiento oral | Recién nacido-3 meses: cefuroxima-axetilo. Alternativa: amoxicilina-ácido clavulánico |
| 3 meses-5 años: cefuroxima-axetilo o cefadroxilo (especialmente en >2 años) | |
| > 5 años: cefadroxilo | |
| Tratamiento específico | SASM: cefadroxilo |
| SARM: clindamicina/ciprofloxacino/TMP-SMX+rifampicina | |
| S. pyogenes, S. agalactiae y S. pneumoniae: amoxicilinaa | |
| Kingella kingae: amoxicilina como primera opción; cefuroxima o amoxicilina-clavulánico |
SARM: S. aureus resistente a la meticilina adquirido en la comunidad; SASM: S. aureus sensible a la meticilina; TMP-SMX, trimetropim-sulfametoxazol.
Las variables cualitativas se expresaron como frecuencias absolutas y porcentajes y las cuantitativas como mediana y rango intercuartílico (RIC) tras verificar, mediante la prueba de Kolmogorov-Smirnov, que su distribución no era normal.
Las diferencias en los porcentajes de las variables cualitativas se analizaron con la prueba χ2 o la prueba exacta de Fisher, según correspondiera. Las comparaciones de las proporciones de columnas con más de dos categorías se ajustaron mediante la corrección de Bonferroni.
Las comparaciones entre grupos de variables continuas se llevaron a cabo mediante las pruebas U de Mann-Whitney o la de Kruskal-Wallis según el número de categorías comparadas.
Para evaluar los factores asociados al desarrollo de complicaciones, se llevó a cabo un análisis multivariante mediante regresión logística incluyendo las variables con significación estadística en el análisis bivariante y aquellas consideradas clínicamente relevantes por los investigadores.
El análisis fue realizado mediante el programa Statistical Package for the Social Sciences (SPSS), versión 25.0. Los valores de p<0,05 (bilateral) se consideraron estadísticamente significativos.
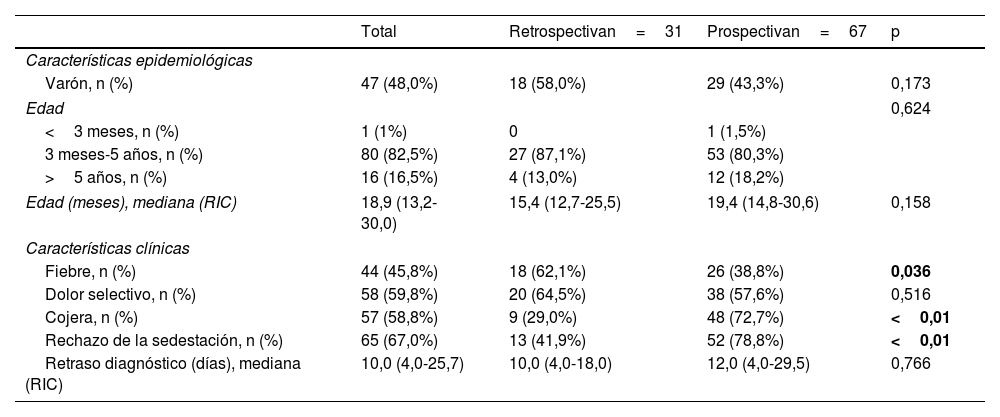
ResultadosDe los 1701 pacientes con IOA, 98 (5,8%) fueron diagnosticados de EDP, 31 (31,6%) en la cohorte retrospectiva y 67 (68,4%) en la cohorte prospectiva. La localización de la EDP fue lumbar en 52 casos (53,1%), dorsal en 8 (8,2%) y cervical en 7 (7,1%); en 31 pacientes (31,6%) no se registró la localización de la EDP. La fiebre fue más frecuente en la cohorte retrospectiva (62,1% vs. 38,8%, p=0,036) y la cojera y el rechazo a la sedestación en la cohorte prospectiva (29,0% vs. 72,7% y 41,9% vs. 78,8%, respectivamente; p<0,01), sin diferencias en el resto de las variables epidemiológicas y clínicas entre las dos cohortes (tabla 2). La tabla 3 presenta las pruebas complementarias realizadas, el tratamiento y la evolución de las dos cohortes.
Comparación de las características clínicas y epidemiológicas de la espondilodiscitis en las cohortes retrospectiva y prospectiva
| Total | Retrospectivan=31 | Prospectivan=67 | p | |
|---|---|---|---|---|
| Características epidemiológicas | ||||
| Varón, n (%) | 47 (48,0%) | 18 (58,0%) | 29 (43,3%) | 0,173 |
| Edad | 0,624 | |||
| <3 meses, n (%) | 1 (1%) | 0 | 1 (1,5%) | |
| 3 meses-5 años, n (%) | 80 (82,5%) | 27 (87,1%) | 53 (80,3%) | |
| >5 años, n (%) | 16 (16,5%) | 4 (13,0%) | 12 (18,2%) | |
| Edad (meses), mediana (RIC) | 18,9 (13,2-30,0) | 15,4 (12,7-25,5) | 19,4 (14,8-30,6) | 0,158 |
| Características clínicas | ||||
| Fiebre, n (%) | 44 (45,8%) | 18 (62,1%) | 26 (38,8%) | 0,036 |
| Dolor selectivo, n (%) | 58 (59,8%) | 20 (64,5%) | 38 (57,6%) | 0,516 |
| Cojera, n (%) | 57 (58,8%) | 9 (29,0%) | 48 (72,7%) | <0,01 |
| Rechazo de la sedestación, n (%) | 65 (67,0%) | 13 (41,9%) | 52 (78,8%) | <0,01 |
| Retraso diagnóstico (días), mediana (RIC) | 10,0 (4,0-25,7) | 10,0 (4,0-18,0) | 12,0 (4,0-29,5) | 0,766 |
RIC: rango intercuartílico.
En negrita, variables con diferencias estadísticamente significativas.
Comparación de las características diagnósticas, terapéuticas y de evolución de la espondilodiscitis entre las cohortes retrospectiva y prospectiva
| Total | Retrospectivan=31 | Prospectivan=67 | p | |
|---|---|---|---|---|
| Pruebas complementarias | ||||
| Leucocitos al ingreso (×109/L), mediana (RIC) | 12.100 (9.200-14.350) | 12.114 (9.100-13.700) | 11.680 (9.327-14.475) | 0,739 |
| VSG al ingreso, n (%) | 74 (75,5%) | 25 (80,6%) | 49 (73,1%) | 0,421 |
| VSG al ingreso (mm), mediana (RIC) | 50,0 (32,5-60,0) | 50,0 (30,5-58,0) | 50,0 (34,0-65,5) | 0,323 |
| PCR al ingreso, n (%) | 98 (100,0%) | 31 (100,0%) | 67 (100,0%) | 1 |
| PCR al ingreso (mg/L), mediana (RIC) | 13,0 (6,9-20,5) | 10,0 (8,0-19,5) | 14,0 (5,0-29,8) | 0,795 |
| HC al ingreso, n (%) | 79 (81,4%) | 24 (77,4%) | 55 (83,3%) | 0,485 |
| Radiografía al ingreso, n (%) | 88 (89,8%) | 28 (90,3%) | 60 (89,6%) | 0,907 |
| Radiografía | ||||
| Normal, n (%) | 43 (48,9%) | 14 (50%) | 29 (48,3%) | 0,884 |
| Compatible con OM, n (%) | 2 (2,0%) | 1 (3,2%) | 1 (1,5%) | 0,577 |
| Reducción del espacio discal, n (%) | 40 (45,5%) | 12 (42,9%) | 28 (46,7%) | 0,738 |
| Gammagrafía, n (%) | 44 (44,9%) | 14 (45,2%) | 30 (44,8%) | 0,972 |
| Gammagrafía compatible con espondilodiscitis, n (%) | 41 (93,2%) | 13 (92,9%) | 28 (93,3%) | 0,852 |
| RM, n (%) | 83 (84,7%) | 27 (87,1%) | 56 (83,6%) | 0,653 |
| RM compatible con discitis, n (%) | 83 (100%) | 27 (100%) | 56 (100%)a | 1 |
| Aislamiento microbiológico en HC | ||||
| HC estéril, n (%) | 73 (92,4%) | 23 (95,8%) | 50 (90,9%) | 0,340 |
| SASM, n (%) | 2 (2,5%) | 0 | 2 (3,6%) | |
| S. pneumoniae, n (%) | 1 (1,3%) | 1 (4,2%) | 0 (0%) | |
| Salmonella, n (%) | 1 (1,3%) | 0 | 1 (1,8%) | |
| Otros patógenos, n (%) | 2 (2,5%) | 0 | 2 (3,6%) | |
| Tratamiento | ||||
| Estancia hospitalaria (días), mediana (RIC) | 12,0 (9,0-16,0) | 15,0 (11,0-18,7) | 10,0 (8,0-15,0) | 0,003 |
| Tratamiento IV adecuado <3 meses, n (%) | 1 (100,0%) | 0 | 1 (100,0%) | - |
| Tratamiento IV adecuado 3 meses-5 años, n (%) | 32 (40,0%) | 3 (11,1%) | 29 (54,7%) | <0,01 |
| Tratamiento IV adecuado >5 años, n (%) | 9 (56,3%) | 1 (25,0%) | 8 (66,7%) | 0,306 |
| Duración tratamiento IV (días), mediana (RIC) | 11,5 (8,0-15,0) | 14,0 (10,7-18,5) | 10,0 (7,0-14,0) | 0,003 |
| Tratamiento oral adecuado 3 meses-5 años, n (%) | 40 (50,0%) | 4 (14,8%) | 36 (67,9%) | <0,01 |
| Tratamiento oral adecuado >5 años, n (%) | 4 (25,0%) | 1 (25,0%) | 3 (25,0%) | 1,00 |
| Duración tratamiento oral (días), mediana (RIC) | 28,0 (17,7-30,2) | 21,5 (14,7-28,5) | 28,0 (20,2-31,0) | 0,075 |
| Duración tratamiento total (días), mediana (RIC) | 37,0 (29,0-43,0) | 35,0 (28,5-42,5) | 40,0 (29,0-43,0) | 0,636 |
| Adecuación a las recomendaciones de tratamiento empírico | ||||
| Tratamiento IV con cloxacilina+cefotaxima (excluyendo <3 meses), n (%) | 33 (34,4%) | 18 (58,1%) | 15 (23,1%) | 0,001 |
| Tratamiento IV con amoxicilina-ácido clavulánico, n (%) | 4 (4,1%) | 3 (9,7%) | 1 (1,5%) | 0,057 |
| Tratamiento oral con amoxicilina-ácido clavulánico, n (%) | 16 (26,7%) | 10 (41,7%) | 6 (16,7%) | 0,032 |
| Evolución | ||||
| Complicaciones, n (%) | 17 (18,9%) | 6 (20,7%) | 11 (18,0%) | 0,763 |
| Secuelas, n (%) | 7 (8,6%) | 2 (6,7%) | 5 (9,8%) | 0,627 |
HC: hemocultivo; IV: intravenoso; OM: osteomielitis; PCR: proteína C reactiva; RIC: rango intercuartílico; RM: resonancia magnética; SASM: S. aureus sensible a la meticilina; VSG: velocidad de sedimentación globular.
En negrita, variables con diferencias estadísticamente significativas.
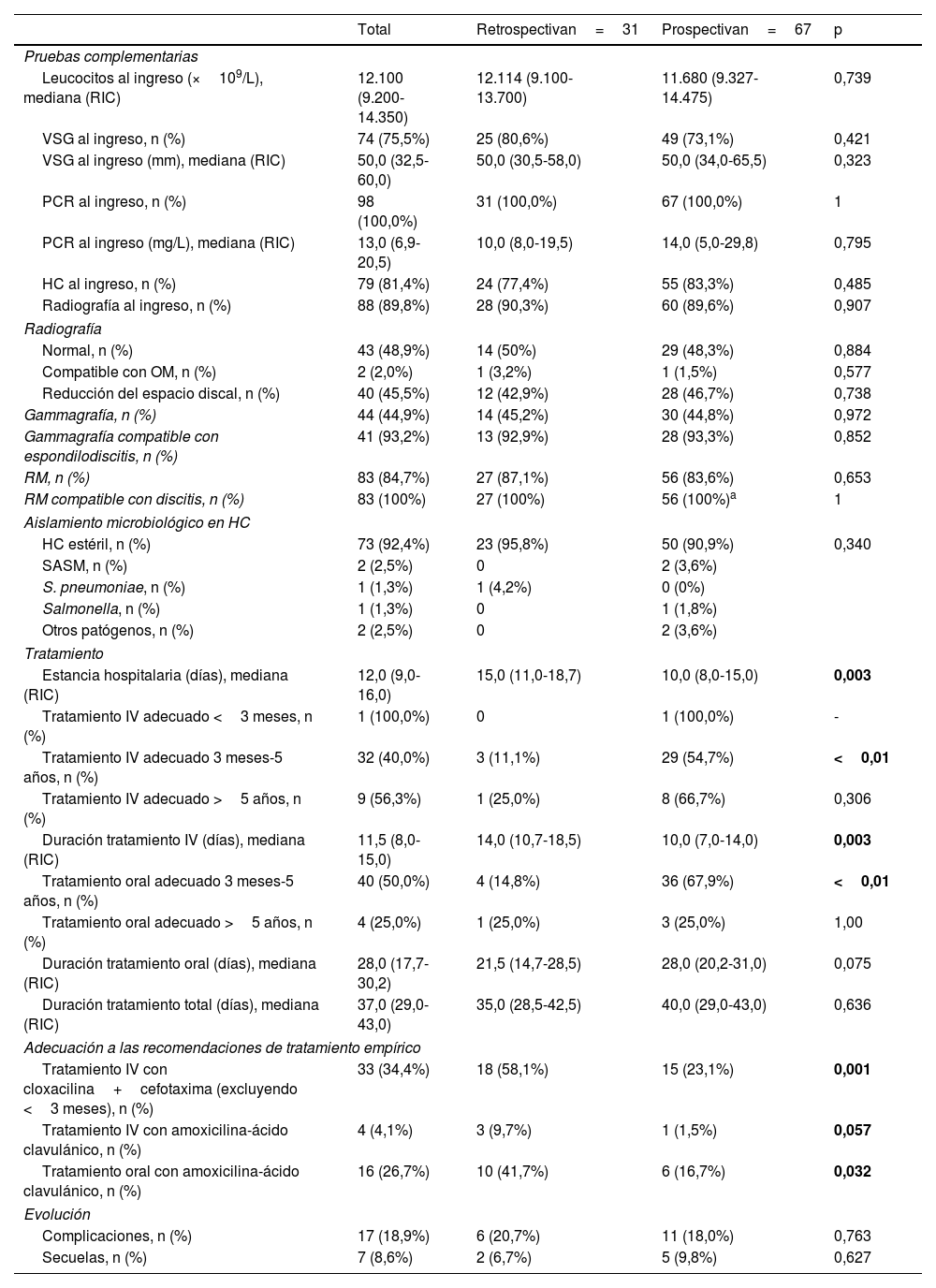
En total, se registraron complicaciones en el 18,9% de los pacientes (n=17), de las que las más frecuentes fueron los abscesos de partes blandas (58,8%) seguidos por la piomiositis (23,6%). Dos pacientes desarrollaron abscesos intramedulares (11,8%). No se detectaron otras complicaciones. Se observaron secuelas en el 8,6% de los pacientes (n=7), siendo la de mayor frecuencia el dolor residual persistente (57,1%) seguido por la cojera (14,3%). No se observaron diferencias en el porcentaje de complicaciones y de secuelas entre las dos cohortes (tabla 3).
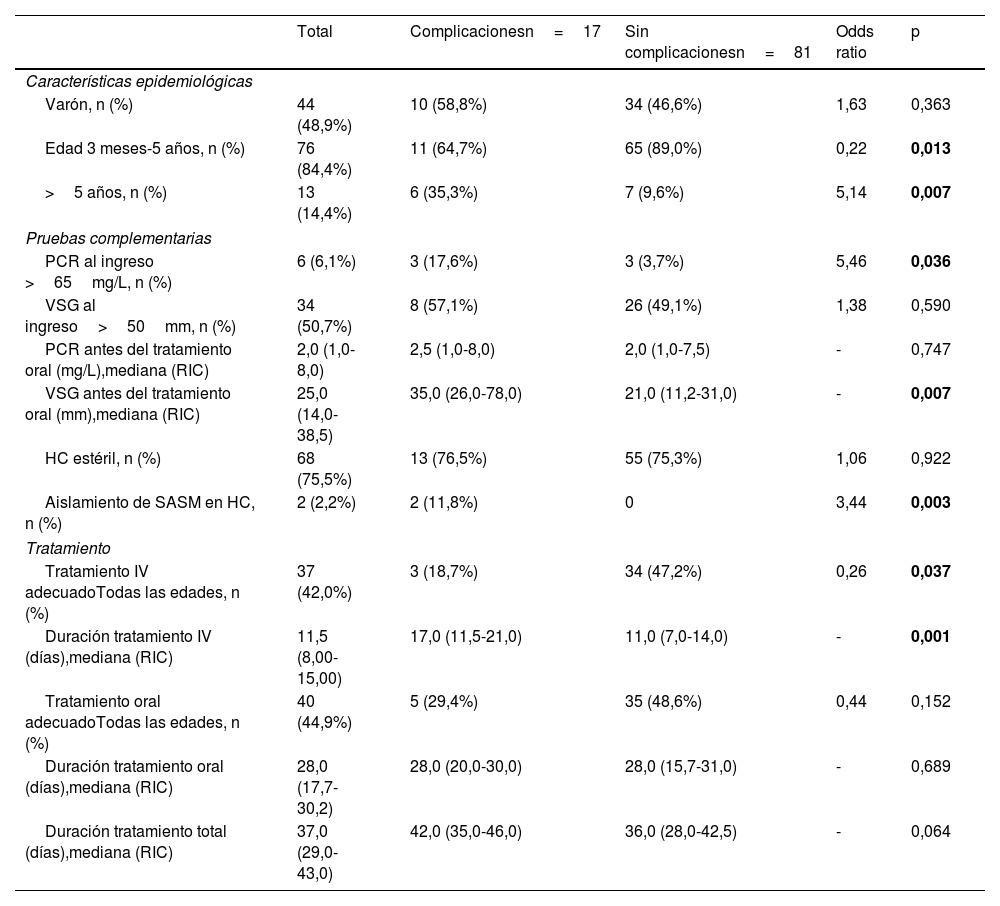
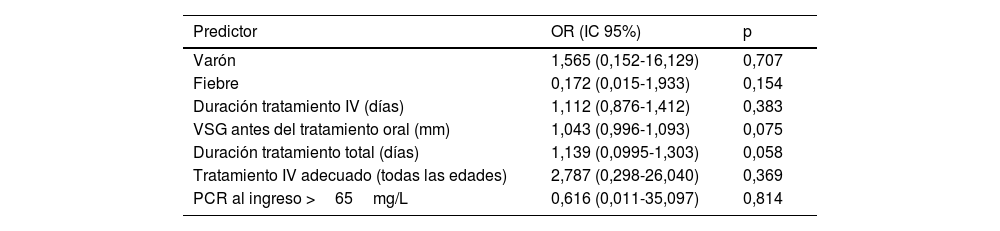
En el análisis bivariante, la edad superior a los 5 años, los niveles de proteína C reactiva (PCR) de más de 65mg/L al ingreso, la elevación de la velocidad de sedimentación globular (VSG) antes del tratamiento oral, el aislamiento de Staphylococcus aureus sensible a la meticilina (SASM) en el hemocultivo y el tratamiento inapropiado (con respecto a las recomendaciones del DCN) se asociaron a un riesgo mayor de complicaciones (tabla 4). En el análisis multivariante, ninguna de las variables analizadas se asoció a un aumento en el riesgo de complicaciones (tabla 5).
Factores asociados al desarrollo de complicaciones en la espondilodiscitis pediátricaa (análisis bivariante)
| Total | Complicacionesn=17 | Sin complicacionesn=81 | Odds ratio | p | |
|---|---|---|---|---|---|
| Características epidemiológicas | |||||
| Varón, n (%) | 44 (48,9%) | 10 (58,8%) | 34 (46,6%) | 1,63 | 0,363 |
| Edad 3 meses-5 años, n (%) | 76 (84,4%) | 11 (64,7%) | 65 (89,0%) | 0,22 | 0,013 |
| >5 años, n (%) | 13 (14,4%) | 6 (35,3%) | 7 (9,6%) | 5,14 | 0,007 |
| Pruebas complementarias | |||||
| PCR al ingreso >65mg/L, n (%) | 6 (6,1%) | 3 (17,6%) | 3 (3,7%) | 5,46 | 0,036 |
| VSG al ingreso>50mm, n (%) | 34 (50,7%) | 8 (57,1%) | 26 (49,1%) | 1,38 | 0,590 |
| PCR antes del tratamiento oral (mg/L),mediana (RIC) | 2,0 (1,0-8,0) | 2,5 (1,0-8,0) | 2,0 (1,0-7,5) | - | 0,747 |
| VSG antes del tratamiento oral (mm),mediana (RIC) | 25,0 (14,0-38,5) | 35,0 (26,0-78,0) | 21,0 (11,2-31,0) | - | 0,007 |
| HC estéril, n (%) | 68 (75,5%) | 13 (76,5%) | 55 (75,3%) | 1,06 | 0,922 |
| Aislamiento de SASM en HC, n (%) | 2 (2,2%) | 2 (11,8%) | 0 | 3,44 | 0,003 |
| Tratamiento | |||||
| Tratamiento IV adecuadoTodas las edades, n (%) | 37 (42,0%) | 3 (18,7%) | 34 (47,2%) | 0,26 | 0,037 |
| Duración tratamiento IV (días),mediana (RIC) | 11,5 (8,00-15,00) | 17,0 (11,5-21,0) | 11,0 (7,0-14,0) | - | 0,001 |
| Tratamiento oral adecuadoTodas las edades, n (%) | 40 (44,9%) | 5 (29,4%) | 35 (48,6%) | 0,44 | 0,152 |
| Duración tratamiento oral (días),mediana (RIC) | 28,0 (17,7-30,2) | 28,0 (20,0-30,0) | 28,0 (15,7-31,0) | - | 0,689 |
| Duración tratamiento total (días),mediana (RIC) | 37,0 (29,0-43,0) | 42,0 (35,0-46,0) | 36,0 (28,0-42,5) | - | 0,064 |
HC: hemocultivo; IV: intravenoso; PCR: proteína C reactiva; RIC: rango intercuartílico; SASM: S. aureus sensible a la meticilina; VSG: velocidad de sedimentación globular.
En negrita, variables con diferencias estadísticamente significativas.
Factores asociados al desarrollo de complicaciones en la espondilodiscitis pediátrica (análisis multivariante)
| Predictor | OR (IC 95%) | p |
|---|---|---|
| Varón | 1,565 (0,152-16,129) | 0,707 |
| Fiebre | 0,172 (0,015-1,933) | 0,154 |
| Duración tratamiento IV (días) | 1,112 (0,876-1,412) | 0,383 |
| VSG antes del tratamiento oral (mm) | 1,043 (0,996-1,093) | 0,075 |
| Duración tratamiento total (días) | 1,139 (0,0995-1,303) | 0,058 |
| Tratamiento IV adecuado (todas las edades) | 2,787 (0,298-26,040) | 0,369 |
| PCR al ingreso >65mg/L | 0,616 (0,011-35,097) | 0,814 |
IC: intervalo de confianza; OR: odds ratio; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
Con respecto a las recomendaciones diagnósticas recogidas en el DCN, no hubo diferencias en la frecuencia del uso de pruebas de imagen entre ambas cohortes (tabla 3). No hubo un descenso en el uso de la gammagrafía ósea como prueba complementaria, con un rendimiento diagnóstico en la detección de EDP del 92,9% y del 93,3% en las cohortes retrospectiva y prospectiva, respectivamente. El principal agente etiológico identificado fue el SASM, aislado en 2 pacientes de 18 meses y 13 años. En 2 pacientes de 1 y 11 años sin factores de riesgo conocidos se aislaron Streptococcus pneumoniae y Salmonella, respectivamente. Todos los aislamientos microbiológicos se obtuvieron de muestras para HC. El cultivo de la biopsia ósea se realizó en 2 pacientes de la cohorte prospectiva (3,1%), sin conseguirse identificación microbiológica. No fue posible comparar el coste-efectividad de esta técnica con respecto a la fase retrospectiva debido a la falta de estos datos en la cohorte histórica.
El impacto de las recomendaciones del DCN sobre el tratamiento intravenoso fue evidente en la cohorte prospectiva, ya que fue apropiado en el 57,6% de los pacientes en comparación con el 12,9% en la cohorte retrospectiva (p<0,01), principalmente en el subgrupo de pacientes entre 3 meses y 5 años de edad (54,7% vs. 11,1%; p<0,01), sin alcanzar la significación estadística en el subgrupo de pacientes mayores de 5 años, aunque se observó la misma tendencia (66,7% en la cohorte prospectiva vs. 25,0% en la cohorte retrospectiva; p=0,306). El uso de regímenes de terapia combinada intravenosa (cefotaxima+cloxacilina) en pacientes mayores de 3 meses disminuyó significativamente en la cohorte prospectiva (23,1% vs. 58,1%; p<0,01), y también hubo una reducción en el uso de amoxicilina-ácido clavulánico tras la publicación del DCN (1,5% vs. 9,7%, p=0,057). La duración de la estancia hospitalaria y del tratamiento intravenoso fueron menores en la cohorte prospectiva (10 vs. 15 días [p<0,01] y 10 vs. 14 días [p<0,01], respectivamente).
De manera similar, la adherencia a las recomendaciones de tratamiento oral del DCN fue superior en la cohorte prospectiva (60,0% vs. 16,1%; p<0,01), especialmente en el subgrupo de pacientes de 3 meses a 5 años de edad (67,9% vs. 14,8%, p<0,01). No se encontraron diferencias en la adherencia a las recomendaciones de tratamiento oral en los pacientes mayores de 5 años (tabla 3). El uso de amoxicilina-ácido clavulánico oral como terapia empírica descendió del 38,7% en la cohorte retrospectiva al 13,4% en la cohorte prospectiva (p<0,01). La duración de la antibioterapia oral fue mayor en la cohorte prospectiva (28,0 vs. 21,5 días, p=0,07), y no se observaron diferencias en la duración total del tratamiento entre las dos cohortes (tabla 3).
DiscusiónLa falta de protocolos que ofrezcan recomendaciones para el diagnóstico y tratamiento de la EDP hace necesario extrapolar las recomendaciones para otras IOA, lo que produce una variabilidad considerable en el abordaje de estas enfermedades. En su conjunto, esta situación dificulta el análisis de los resultados y la implementación de nuevas recomendaciones para optimizar el abordaje diagnóstico y terapéutico. El desarrollo del DCN10,11 permitió la estandarización del manejo general de la OMA, independientemente de su localización. La presente serie muestra el impacto de este documento en la práctica clínica, ya que hizo posible un abordaje más uniforme de la EDP en la cohorte prospectiva.
En el presente estudio, las características epidemiológicas y clínicas de ambas cohortes eran similares. Las diferencias encontradas en la presencia de fiebre, cojera y rechazo a la sedestación podrían haberse debido a una documentación más rigurosa en la cohorte prospectiva o a la edad media mayor de los niños en dicha cohorte.
En cuanto a la tasa de realización de pruebas de imagen, no se observaron cambios en la cohorte prospectiva tras la publicación del DCN, probablemente porque el abordaje diagnóstico que se empleaba en la cohorte retrospectiva ya era bueno. El alto porcentaje de RM realizado en ambas cohortes estuvo en línea con las recomendaciones diagnósticas de las guías de práctica clínica, como se ha descrito en otras series en España4.
La tendencia creciente en la realización de HC al ingreso se mantuvo en la cohorte prospectiva, con una tasa de HC similar a la reportada en otros estudios8, y también se mantuvo la proporción de aislamiento microbiológico alcanzada con esta técnica, que continúa siendo muy baja2,8,14. Como se ha descrito previamente2,6,8,15, el SASM continúa siendo el agente etiológico más frecuente en la EDP. La implementación de técnicas microbiológicas más sensibles, como la reacción en cadena de la polimerasa, podría conseguir un aumento en la tasa de diagnóstico microbiológico2,8 y una mayor fiabilidad en la identificación de los microorganismos causantes de estas infecciones, lo que permitiría comprobar si el papel protagonista atribuido a Kingella kingae en niños pequeños en estudios anteriores16–18 se mantiene en nuestro medio. El mayor rendimiento diagnóstico del cultivo de tejido óseo obtenido mediante biopsia, que oscila entre el 20 y el 40% dependiendo de la serie consultada2,8,14, no se observó en nuestro estudio, ya que esta técnica solo se realiza según el protocolo en uno de los centros participantes. Aunque algunas guías recientes recomiendan su realización para optimizar el coste-efectividad del diagnóstico microbiológico en la OMA7, especialmente en regiones con una prevalencia alta de cepas de S. aureus resistentes a la meticilina, como Estados Unidos, no es una técnica al alcance de todos los centros. Es probable que la necesidad de sedación para llevar a cabo la biopsia y de tener un equipo de anestesia/cirugía disponible para el diagnóstico, junto a la buena evolución de estas entidades con la antibioterapia empírica, sean responsables de la falta de implementación rutinaria de esta recomendación en la práctica clínica en nuestro medio.
La presencia de complicaciones en nuestro estudio fue inferior al 20-30% reportado previamente15, y las más frecuentes fueron los abscesos de tejidos blandos, en concordancia con la literatura previa4,15. El diagnóstico más temprano observado en nuestra serie podría explicar la menor tasa de complicaciones, aunque la escasez de aislamientos microbiológicos y la metodología del estudio no permitieron concluir si la virulencia de algunos microorganismos o un posible sesgo de gravedad afectaron los resultados en este sentido.
En el análisis de la cohorte prospectiva se reflejó que el DCN tuvo efecto en la elección de tratamiento antibiótico empírico, tanto intravenoso como oral, con un descenso en el uso de regímenes de antibioterapia combinada y de la amoxicilina-ácido clavulánico a favor de la monoterapia con antibióticos de espectro más reducido, como la cefuroxima, tal y como recomienda el documento de consenso11. El uso de amoxicilina-ácido clavulánico como tratamiento empírico oral también disminuyó a la vez que aumentó el uso de cefalosporinas con un espectro más reducido y una mayor tolerabilidad, como el cefadroxilo y la cefuroxima-axetilo. Esta reducción en el espectro antimicrobiano no conllevó un aumento en las complicaciones o secuelas en la cohorte prospectiva, lo que, junto con la ausencia de aislamiento de microorganismos resistentes, justifica, en nuestro medio, que se mantenga la recomendación de utilizar β-lactámicos de espectro más estrecho en monoterapia con cobertura frente a SASM y otros patógenos involucrados en el desarrollo de EDP en pacientes mayores de 3 meses (K. kingae y S. pyogenes)7, como se recomienda en el DCN para el abordaje de IOA11.
La reducción de 4 días en la duración del tratamiento intravenoso y de 5 días en la estancia hospitalaria en la cohorte prospectiva, con una duración promedio actual de 11 días para ambas, son hallazgos positivos en el nuevo abordaje de estas infecciones desde la publicación del DCN, teniendo en cuenta los potenciales efectos negativos, tanto físicos como psicológicos, que puede tener una estancia prolongada en los niños, además de un potencial aumento leve en la resistencia antimicrobiana. En todo caso, la duración de la antibioterapia intravenosa en ambas cohortes aún dista mucho de ajustarse a las pautas cortas recomendadas3,11,19, lo que constituye un punto de mejora en el abordaje de estas enfermedades en años venideros, asegurando a la vez que no haya un aumento en las complicaciones o las secuelas. Para este último objetivo, es esencial mantener en activo redes multicéntricas como, en nuestro caso, la RIOPed. Por añadidura, la reducción en la duración del tratamiento intravenoso no se asoció a una reducción en la duración total del tratamiento debido a la prolongación de la antibioterapia oral en la cohorte prospectiva en comparación con la retrospectiva, prolongación que no se podía atribuir a una mayor complejidad de la EDP en la cohorte prospectiva. La duración total del tratamiento de la EDP reportada en otras series es de al menos 4-6 semanas4,14,20,21, lo que es consistente con la duración media de 5 semanas que se encontró en la cohorte retrospectiva. La ausencia de complicaciones o secuelas adicionales en esta cohorte y la evolución favorable en la OM hematógena en localizaciones no vertebrales con una duración de tratamiento total de 3 a 4 semanas nos lleva a insistir en la reducción de la duración de la antibioterapia, en casos de EDP no complicada, a 4 semanas2–4,6,7,15, evaluando el efecto de esta modificación en estudios futuros.
Teniendo en cuenta que el estudio era multicéntrico y que se realizó en un número elevado de pacientes cuyo manejo fue más uniforme tras la publicación del DCN, cabría atribuir las tasas reducidas de complicaciones y secuelas que se encontraron a la optimización del abordaje diagnóstico y terapéutico observado en la cohorte prospectiva.
Nuestro estudio tiene varias limitaciones. La primera es el tamaño relativamente pequeño de la muestra debido a la baja frecuencia de la EDP, el diagnóstico fundamentalmente clínico de esta enfermedad, aunque con el apoyo de pruebas de imagen, y la escasez de aislamientos microbiológicos. No obstante, fue un estudio multicéntrico con criterios de selección uniformes y es una de las series más largas en la literatura.
En conclusión, en nuestra serie, la EDP tuvo una evolución favorable con una frecuencia baja de complicaciones (18,9%) y secuelas (8,6%). El aislamiento más frecuente, aunque en una proporción baja de pacientes, fue el SASM. Globalmente, el grado de adecuación a las recomendaciones recogidas en el DCN para el manejo de las IOA pediátricas fue bueno, habiendo mejorado con respecto a la cohorte retrospectiva, y la recomendación de utilizar la RM como la prueba de imagen de elección por su mayor sensibilidad en la detección de la afección de tejidos blandos y otras complicaciones asociadas debería mantenerse. Se podrán implementar regímenes más cortos de antibioterapia para analizar, en secciones futuras de este registro, los cambios que tengan lugar y determinar si sería conveniente establecer nuevas recomendaciones sobre la duración del tratamiento. Dada la continuidad de la RIOPed, será posible realizar estudios adicionales en muestras mayores, lo que podría contribuir a identificar los factores asociados a la aparición de complicaciones y secuelas en pacientes pediátricos con EDP.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento a Maria Repice por su ayuda con la versión en inglés del manuscrito y a la Sociedad Española de Reumatología Pediátrica (SERPE) por la beca de investigación que permitió la puesta en marcha de la red RIOPed.
Velasco Arnaiz Eneritz (Hospital Sant Joan de Déu, Barcelona, España), García-Fontecha César (Hospital Sant Joan de Dèu, Barcelona, España), Bustillo Alonso Matilde (Hospital Miguel Servet, Zaragoza, España), García Pardos Carmen (Hospital Universitario de Donosti, San Sebastián, España), Lirola Cruz María José (Hospital Sagrado Corazón, Sevilla, España), Díaz Delgado Rafael (Hospital Severo Ochoa, Madrid, España), Tagarro García Alfredo (Hospital Infanta Sofía, Madrid, España), Melendo Pérez Susana (Hospital Vall d’Hebron, Barcelona, España), Domènech Marçal Elia (Hospital Germans Trias i Pujol, Barcelona, España), Martínez Campos Leticia (Hospital La Inmaculada, Almería, España), Menasalvas Ana (Hospital Virgen de la Arrixaca, Murcia, España), Guarch-Ibáñez Borja (Hospital Josep Trueta, Girona, España), Sanz Santaeufemia Francisco José (Hospital Niño Jesús, Madrid, España), Figueroa Ospina Lucía (Hospital de Villalba, Madrid, España), Camacho Lovillo Marisol (Hospital Virgen del Rocío, Sevilla, España), Pareja León Marta (Hospital General de Albacete, España), Gavilán Martín César (Hospital San Juan, Alicante, España), García Mazarío María Jesús (Hospital Universitario de Guadalajara, España), Couceiro Giranzo Jose (Hospital provincial de Pontevedra, España), Rivero-Calle Irene (Hospital Clínico de Santiago de Compostela, A Coruña, España), Pujol Soler Berta (Hospital General de Granollers, Barcelona, España), Bustabad Sagrario (Hospital Universitario de Canarias, Santa Cruz de Tenerife, España), García Alfaro María Dolores (Hospital Marqués de Valdecilla, Santander, España).