La endocarditis infecciosa es una grave y poco frecuente afección del endocardio. La etiología micótica representa menos del 10% de dichos casos. Cada vez son más frecuentes, como grupos de riesgo, los niños con tratamiento antibiótico endovenoso, alimentación parenteral y catéteres venosos centrales por tiempo prolongado, aún sin cardiopatías previas. Se revisaron retrospectivamente las historias clínicas de 6 niños con endocarditis por Cándida y se describen los factores predisponentes, la evolución clínica y la terapéutica empleada. Los antimicóticos empleados fueron anfotericin B, 5-fluorocitocina y fluconazol. Se realizó exéresis quirúrgica de las vegetaciones, 5 plastias valvulares tricuspídeas y una sustitución valvular mitral. Sobrevivieron todos los pacientes y uno necesitó nueva plastia valvular tricuspídea después de un año de operado. Con un seguimiento medio de 5 años, todos mantienen buena función valvular sin recidivas infecciosas. Se recomienda una combinación de tratamiento antimicótico sinérgico y prolongado con la intervención quirúrgica precoz.
Infective endocarditis is a serious and uncommon condition affecting the endocardium. Less than 10% of these cases are of fungal origin. A growing number of individuals are at high risk, due to insertion of central venous catheters, total parenteral nutrition and prolonged exposure to broad-spectrum antibiotics, even without previous heart diseases. We retrospectively analysed the records of six children with Candida endocarditis, reviewing the comorbidities, clinical outcome, and treatment. The antifungal agents used were amphotericin B, 5-fluorocytosine and fluconazole. Patients underwent surgical excision of vegetation, five tricuspid valve repairs and one mitral valve replacement. There were no hospital deaths, and one child needed a new valvuloplasty one year later. The mean follow up was five years, and all have good valvular function without recurrent endocarditis. A combination of synergistic long-term antifungal treatment and early surgical intervention is recommended.
La endocarditis infecciosa es una enfermedad rara asociada con un alto grado de morbilidad y mortalidad1,2. Su incidencia en pediatría es de 0,8 a 3,3 por cada 1.000 ingresos hospitalarios, sobre todo en niños con enfermedades cardíacas congénitas2–5.
En los últimos años han ocurrido cambios significativos en sus características clínicas y epidemiológicas debido al desarrollo de intervenciones médicas que se emplean para mejorar la supervivencia y la calidad de vida, especialmente en recién nacidos y niños críticamente enfermos1,3,4,6.
La endocarditis micótica (EM) tiene una incidencia de 0,1 a 10% del total de las endocarditis infecciosas en pediatría3,7,8. Los grupos de riesgo principales incluyen recién nacidos pretérminos, pacientes inmunodeprimidos, trasplantados y otros con intervenciones quirúrgicas complejas que necesitan la inserción de catéteres venosos centrales, empleo de nutrición parenteral, exposición prolongada a los antibióticos de amplio espectro o implante de materiales protésicos1,3,5,7,9,10.
La mortalidad que alcanza 40 a 80%, indica la necesidad de combinar el tratamiento antimicótico, a dosis altas, con la cirugía precoz2,3,9. La operación normaliza la anatomía y la hemodinámica, elimina el foco séptico, disminuye la destrucción de estructuras cardíacas y reduce las complicaciones5,9,11,12.
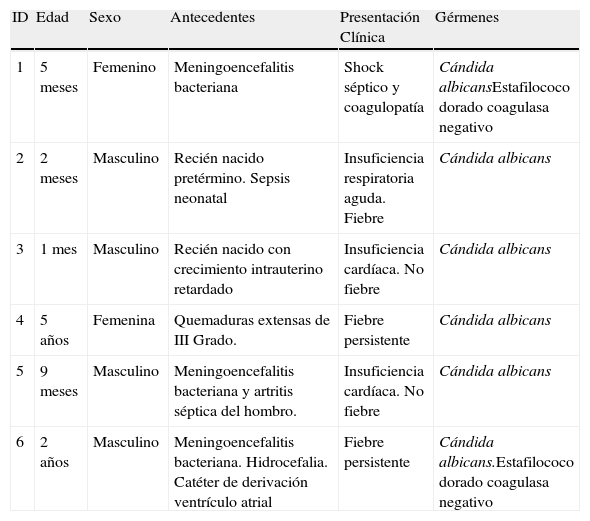
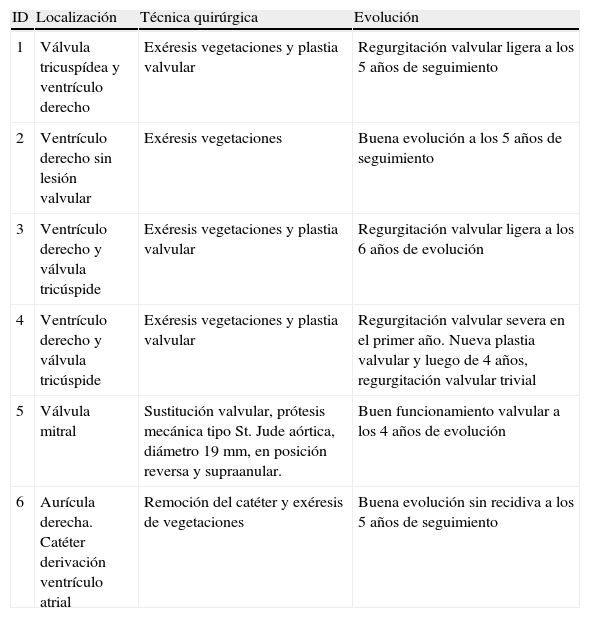
Pacientes y métodosLas características de los enfermos se muestran en las tablas 1 y 2. Todos fueron remitidos con antecedentes de enfermedades graves que necesitaron cateterismos venosos centrales y múltiples regímenes de antibióticos de amplio espectro.
Características preoperatorias de los pacientes
| ID | Edad | Sexo | Antecedentes | Presentación Clínica | Gérmenes |
| 1 | 5 meses | Femenino | Meningoencefalitis bacteriana | Shock séptico y coagulopatía | Cándida albicansEstafilococo dorado coagulasa negativo |
| 2 | 2 meses | Masculino | Recién nacido pretérmino. Sepsis neonatal | Insuficiencia respiratoria aguda. Fiebre | Cándida albicans |
| 3 | 1 mes | Masculino | Recién nacido con crecimiento intrauterino retardado | Insuficiencia cardíaca. No fiebre | Cándida albicans |
| 4 | 5 años | Femenina | Quemaduras extensas de III Grado. | Fiebre persistente | Cándida albicans |
| 5 | 9 meses | Masculino | Meningoencefalitis bacteriana y artritis séptica del hombro. | Insuficiencia cardíaca. No fiebre | Cándida albicans |
| 6 | 2 años | Masculino | Meningoencefalitis bacteriana. Hidrocefalia. Catéter de derivación ventrículo atrial | Fiebre persistente | Cándida albicans.Estafilococo dorado coagulasa negativo |
Datos intra y postoperatorios
| ID | Localización | Técnica quirúrgica | Evolución |
| 1 | Válvula tricuspídea y ventrículo derecho | Exéresis vegetaciones y plastia valvular | Regurgitación valvular ligera a los 5 años de seguimiento |
| 2 | Ventrículo derecho sin lesión valvular | Exéresis vegetaciones | Buena evolución a los 5 años de seguimiento |
| 3 | Ventrículo derecho y válvula tricúspide | Exéresis vegetaciones y plastia valvular | Regurgitación valvular ligera a los 6 años de evolución |
| 4 | Ventrículo derecho y válvula tricúspide | Exéresis vegetaciones y plastia valvular | Regurgitación valvular severa en el primer año. Nueva plastia valvular y luego de 4 años, regurgitación valvular trivial |
| 5 | Válvula mitral | Sustitución valvular, prótesis mecánica tipo St. Jude aórtica, diámetro 19 mm, en posición reversa y supraanular. | Buen funcionamiento valvular a los 4 años de evolución |
| 6 | Aurícula derecha. Catéter derivación ventrículo atrial | Remoción del catéter y exéresis de vegetaciones | Buena evolución sin recidiva a los 5 años de seguimiento |
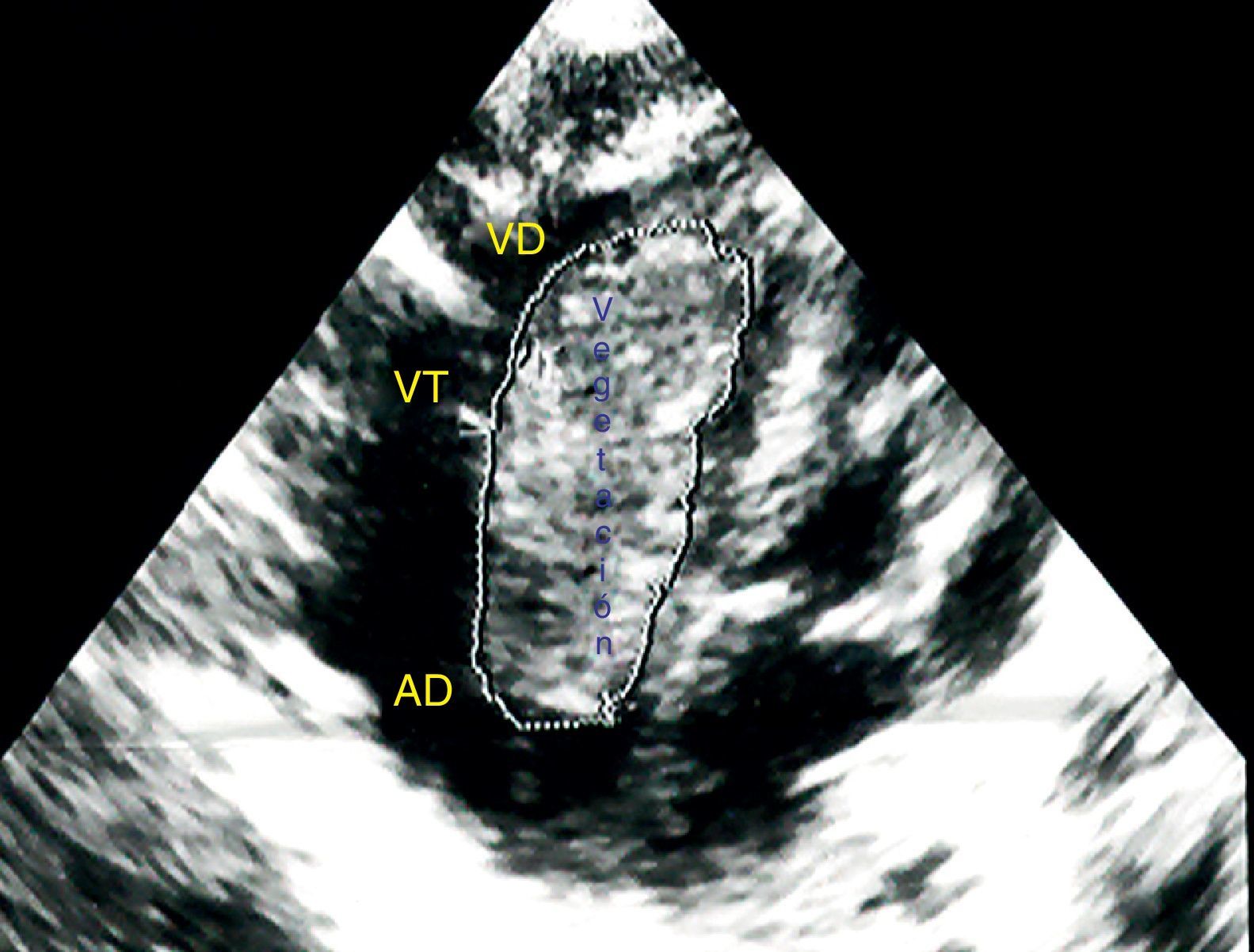
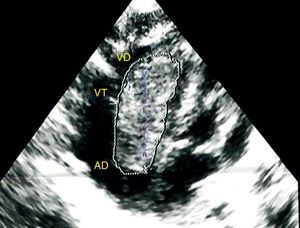
El ecocardiograma transtorácico confirmó el diagnóstico en 100% de ellos al mostrar vegetaciones muy grandes de aspecto tumoral, que causaban gradiente diastólico obstructivo de la válvula tricúspide en tres casos y uno en la válvula mitral (fig. 1).
Tres pacientes necesitaron apoyo inotrópico y 2 ventilación mecánica antes de la cirugía. Se tomaron muestras repetidas para hemocultivos en las primeras 24 horas y se inició tratamiento antibiótico empírico con vancomicina y amikacina que se mantuvo por 4 semanas en quienes se aisló estafilococo dorado coagulasa negativo. Asimismo, el tratamiento antimicótico se inició desde el primer día al considerar los antecedentes y el aspecto ecocardiográfico de las vegetaciones. Se emplearon anfotericina B y la 5-fluorocitocina por 5 semanas. Posteriormente se continuó con fluconazol oral hasta completar 6 meses.
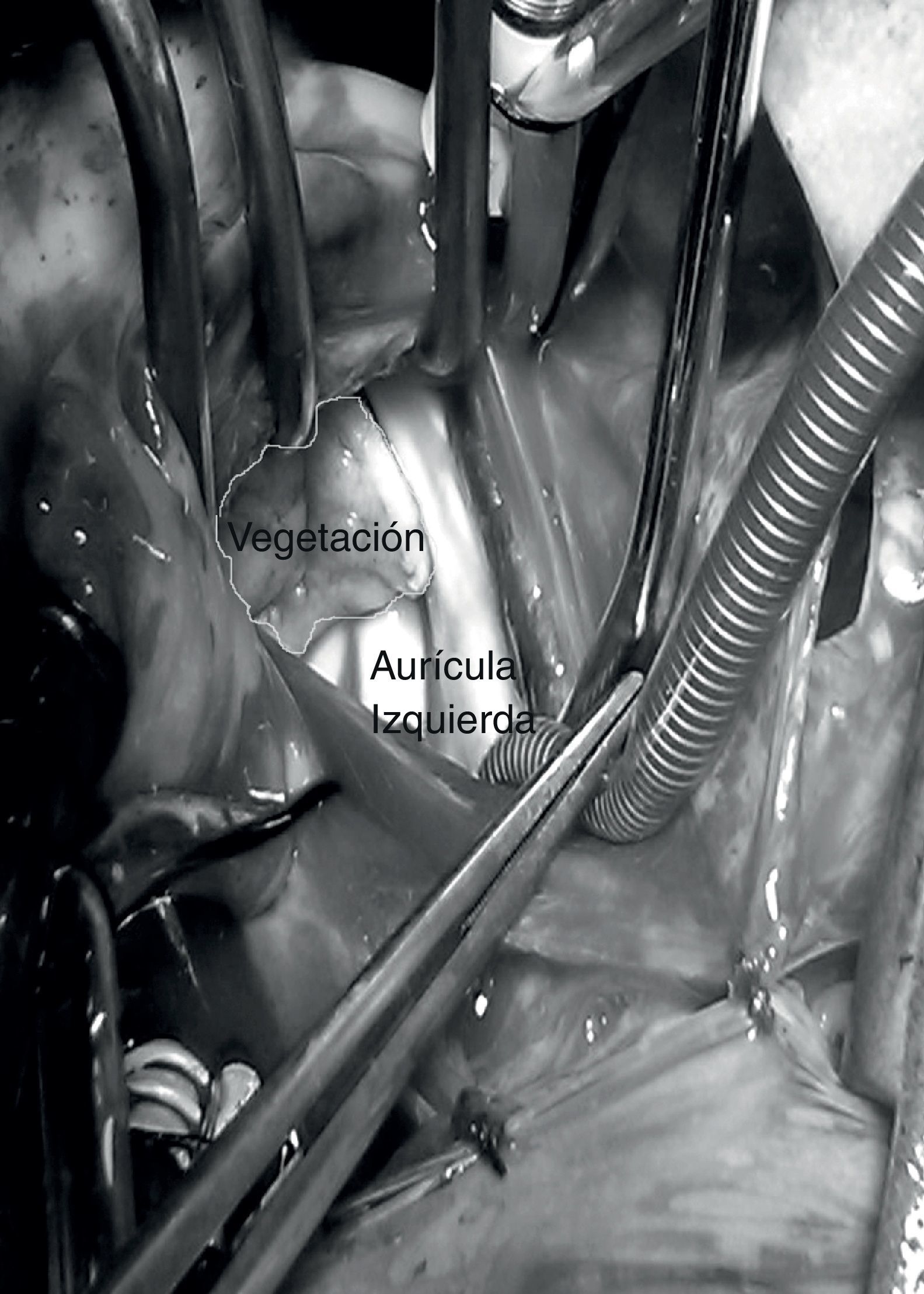
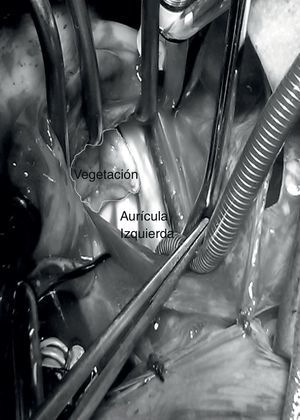
Las intervenciones quirúrgicas se realizaron de urgencia, una vez estabilizados hemodinámicamente los enfermos. Mediante esternotomía media se estableció la circulación extracorpórea en normotermia, se resecaron las vegetaciones y los detritos sépticos. Las plastias valvulares tricuspídeas consistieron en rotación de la valva anterior y anuloplastia parcial. El catéter de derivación del ventrículo cerebral al atrio derecho, se seccionó y extrajo la parte distal con las vegetaciones desde la aurícula derecha y la proximal a través de una incisión cervical. El caso con la lesión mitral tenía completamente destruida la válvula y necesitó reemplazo de la misma (fig. 2).
ResultadosNo hubo mortalidad en la serie y 83% se mantiene libre de reintervenciones. Con un seguimiento medio de 5 años, todos tienen buena función valvular sin recidivas infecciosas.
DiscusiónEl diagnóstico de la endocarditis micótica (EM) es reto debido a que estos niños están sumamente enfermos y las manifestaciones clínicas pueden ser poco evidentes, lo que obliga a mantener un alto índice de sospecha en aquellos que tienen factores de riesgo asociados2,3,7,9,10. Es particularmente interesante el caso con hidrocefalia y una gran vegetación en la punta del catéter de derivación ventrículo cerebral a la aurícula derecha, de lo cual no encontramos referencias en la literatura revisada.
Las especies de Cándida son las más aisladas en los cultivos3,8. El diagnóstico microbiológico puede ser difícil de obtener y aunque las técnicas de biología molecular como la reacción en cadena de polimerasas, permiten una mayor sensibilidad para detectar e identificar los organismos causales, todavía hay pocos reportes de su uso en esta enfermedad3,4,7.
La ecocardiografía ha adquirido un papel muy destacado para identificar la presencia, tamaño y situación de las vegetaciones; la magnitud de las lesiones valvulares o perivalvulares; el estado de la función cardíaca y si existen cardiopatías estructurales predisponentes2,4,8,9. Su valor aumenta si se tiene en cuenta que hasta un tercio de los enfermos tienen hemocultivos negativos, lo que podría retardar el inicio del tratamiento médico o quirúrgico2.
El tratamiento antimicótico aislado de la EM es generalmente insuficiente, por ello, la combinación de fármacos antifúngicos y de cirugía correctiva temprana mejora la supervivencia y representa el tratamiento de elección1,3,4,7,13,14.
El medicamento de primera línea es anfotericina B, sin embargo, dado que no tiene buena penetración en las vegetaciones, añadir la 5-fluorocitosina mejora sinérgicamente el resultado3,8,13. Se han ensayado clínicamente nuevos antimicóticos del grupo de las equinocandinas, como el caspofungin, no obstante, aún son pocas las comunicaciones al respecto y la necesidad de asociar o no la cirugía está por definir13–15. El fluconazol es menos tóxico y mejor tolerado, pero es solo fungistático para varias cepas de Cándida3,8,13.
Las metas de la cirugía son erradicar el foco de infección, reparar las lesiones endocárdicas y valvulares, corregir los defectos cardíacos predisponentes y evitar en lo posible los materiales protésicos. Las plastias valvulares muestran mejores resultados que las sustituciones2,3,5,6,9,11,12,14,16. Las bioprótesis tienen limitaciones importantes en su durabilidad durante la edad pediátrica por lo que se prefieren las prótesis mecánicas, a pesar de la necesidad de anticoagulación14.
Por otra parte, cuando la válvula se reemplaza durante la fase activa de la endocarditis infecciosa, los riesgos de infección del dispositivo implantado son sustanciales, tanto si son biológicas como mecánicas4,6,14. Aunque la supervivencia después de la escisión total de la válvula tricúspide es posible, sobre todo por la disponibilidad de medicamentos que disminuyen la resistencia vascular pulmonar como el sildenafilo, este procedimiento provoca regurgitación masiva y se requiere reoperación en la mayoría de los casos debido a fallo cardíaco derecho5,9. Por tanto, se aconseja la sustitución de la válvula tricúspide cuando existan muchas probabilidades de que la regurgitación postoperatoria sea severa17.
La mortalidad comunicada en la EM es importante, con altos índices de recidivas6,8,18. En nuestra comunicación ningún paciente falleció, probablemente por el pequeño número de casos de la serie o porque no se incluyeron enfermos con endocarditis protésicas o cardiopatías previas, en los cuales la mortalidad es mayor2,18.
Sin embargo, con las limitaciones del pequeño tamaño muestral, los resultados también parecen corroborar la estrategia de que un tratamiento médico sinérgico y prolongado hasta 6 meses para evitar recidivas, combinado con la intervención quirúrgica precoz una vez hecho el diagnóstico, basado en un alto índice de sospecha clínico y ecocardiográfico, brinda mayores probabilidades de eficacia clínica y de menor mortalidad.Es necesario reiterar la atención sobre la adecuada utilización de los catéteres venosos centrales, así como de una política de empleo de antibióticos correcta para evitar el uso indiscriminado y el cambio en la ecología microbiana que producen.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.