Bases del trasplante de progenitores1
El trasplante de progenitores hematopoyéticos (TPH) es la infusión de células progenitoras hematopoyéticas para restablecer la función medular en pacientes con algún daño de la medula ósea. Según la procedencia de los progenitores existen distintos tipos: el trasplante alogénico consiste en transferir células progenitoras desde un donante a otra persona. Cuando el donante y el receptor son genéticamente idénticos (gemelos univitelinos) recibe el nombre de trasplante singénico. El trasplante alogénico puede realizarse utilizando como donante a un hermano que ha heredado el mismo antígeno de histocompatibilidad (HLA), siendo entonces un trasplante HLA familiar idéntico. En los pacientes en los que no existe un donante familiar idéntico hay dos posibles soluciones, una es identificar un donante relacionado (familiar) parcialmente compatible (trasplante alogénico familiar parcialmente compatible) que comparta con el receptor un haplotipo y difiera en uno o más antígenos del otro haplotipo, también se puede utilizar un donante HLA compatible obtenido a través de los registros internacionales y se denomina trasplante alogénico no emparentado. En el trasplante autólogo las células progenitoras se obtienen del mismo paciente. Este procedimiento se realiza sobre todo en enfermedades neoplásicas tanto hematológicas como tumores sólidos, que precisan altas dosis de quimioterapia para erradicar completamente la neoplasia, el trasplante autólogo se utiliza como rescate infundiéndose en el momento que interese y así minimizar el tiempo de pancitopenia y por lo tanto los distintos riesgos producidos por el tratamiento agresivo.
Tradicionalmente el trasplante se ha realizado recogiendo las células madres de la medula ósea, con el descubrimiento de nuevos métodos de selección celular y la aparición de los factores de crecimiento se ha comenzado la utilización de otras nuevas fuentes como la sangre periférica y la sangre de cordón umbilical. En la obtención de progenitores hematopoyéticos, cuando se trata de trasplante autólogo se utilizan diferentes técnicas de tratamiento in vitro para erradicar las posibles células tumorales contaminantes (anticuerpos monoclonales, drogas citotóxicas). En la sangre periférica el porcentaje de progenitores es mucho menor que en médula ósea precisando una movilización para incrementar el número de células progenitoras. Ésta suele realizarse con la administración de factores de crecimiento, el más comúnmente utilizado ha sido el factor estimulante de colonias de granulocitos (G-CSF). Recientemente se ha comenzado a utilizar progenitores de sangre periférica movilizados por G-CSF como fuente en el trasplante alogénico. Aunque el uso de sangre periférica parece tener ventajas en la injertación con más rápida recuperación de la neutropenia y trombopenia, sin embargo existen incógnitas que hacen que su empleo no se haya hecho tan universal como en el trasplante autólogo.
El tratamiento de acondicionamiento se realiza en unidades de aislamiento con flujo laminar aéreo y tiene como objeto inmunosuprimir profundamente al receptor para facilitar el implante del injerto y eliminar poblaciones celulares no deseadas (citorreducción) ya sea por su naturaleza neoplásica o por presentar defectos intrínsecos de la hematopoyesis. La mayor parte de los acondicionamientos empleados se componen de dos o más quimioterápicos (con adicción o no de radioterapia) en dosis muy altas que en condiciones normales producirían una aplasia medular irreversible de no producirse la infusión a corto plazo de células progenitoras con capacidad reproductiva intacta.
Actualmente las indicaciones del trasplante están siendo mayores ampliándose a muchas enfermedades no malignas, excepto en algunas inmunodeficiencias en las que puede no ser preciso un tratamiento mieloablativo previo, por la naturaleza intrínseca del receptor y su incapacidad para rechazar el injerto, en el resto es preciso administrar un tratamiento fuertemente mieloablativo que erradique la hematopoyesis defectuosa.
Complicaciones pulmonares
El estado de inmunosupresión que se produce tras los tratamientos de acondicionamiento hace que estos pacientes presenten gran cantidad de procesos pulmonares infecciosos, pero actualmente el aumento del trasplante autólogo y el uso de G-CSF ha desembocado en la aparición de nuevas enfermedades pulmonares mediadas por fenómenos celulares. Las complicaciones pulmonares ocurren en el 40-60 % de los pacientes que reciben un TPH, constituyendo una importante causa de morbimortalidad tras este procedimiento.
La etiología de este tipo de enfermedades es a menudo multifactorial siendo las causas más importantes las siguientes:
1. Infecciones pulmonares. Producidas por diferentes agentes entre ellos virales, bacterianos y hongos, en muchas ocasiones no se consigue su identificación resolviéndose al instaurar tratamientos empíricos.
2. Agentes quimioterápicos e irradiación. Son responsables de neumonitis agudas y fibrosis pulmonar.
3. Enfermedad injerto contra huésped (EICH). Es la principal causa de afectación en los trasplantes alogénicos, tanto de la forma aguda aumentando la inmunosupresión y por lo tanto la probabilidad de infecciones, como la crónica siendo la causa principal de la bronquiolitis obliterante.
4. Mediadores celulares en el injerto leucocitario2. Son responsables de la hemorragia alveolar difusa y el síndrome de injerto autólogo, dos procesos cada vez más frecuentes tras los trasplantes autólogos.
Estas complicaciones (fig. 1) pueden clasificarse en tempranas o tardías según ocurran antes o después de los 100 primeros días postrasplante, además su frecuencia de aparición depende del tipo de trasplante realizado (autólogo o alogénico).
Figura 1. Cronología de las complicaciones pulmonares tras el trasplante. BOON, bronquiolitis obliterante organizando neumonía; HAD, hemorragia alveolar difusa; SIA, síndrome de injerto autólogo; BO, bronquiolitis obliterante. (Modificada de Krowka MJ, Rosenow EC, Hoagland HC. Chest 1985;87:237-46.)
Edema pulmonar
Es una complicación temprana poco frecuente, con una incidencia no establecida. Está producida frecuentemente por la gran cantidad de volúmenes infundidos para disminuir la toxicidad de los acondicionamientos, los antibióticos, productos sanguíneos y nutrición parenteral unido a la alteración cardíaca y renal producida por los distintos quimioterápicos e inmunosupresores. El diagnóstico de certeza se realiza con la ecocardiografía que muestra un corazón dilatado con disfunción ventricular izquierda. El tratamiento consiste en un control adecuado del peso y el uso de diuréticos e inotrópicos.
Síndrome de neumonía idiopática
Es un síndrome que aparece tras el TPH que consiste en hipoxemia y infiltrados pulmonar en la radiografía de tórax en ausencia de insuficiencia cardíaca congestiva y sin evidencia de etiología infecciosa.
En su etiología3 intervienen tratamientos tóxicos, procesos infecciosos no identificados y la EICH. Es una complicación de aparición temprana, en los primeros 50 días del trasplante y aunque está descrita tanto en el alogénico como autólogo, es más frecuente en el primer tipo. La incidencia4 después del trasplante alogénico es en torno al 12 % con una mortalidad del 71 %.
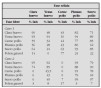
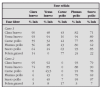
En 1992 este cuadro clínico fue reconocido como un síndrome, la terminología acuñada permitía la probabilidad de múltiples etiologías y distintas presentaciones clínicas con afectación pulmonar no infecciosa, el diagnóstico está basado en la comprobación por lavado broncoalveolar (LBA) de que no existe etiología infecciosa y la presencia de infiltrados pulmonares y cambios clínicos típicos de neumonía (tabla 1) (según NHLBI Workshop Summary)3. La entidad llamada hemorragia alveolar difusa estaba incluida en este síndrome, actualmente está mejor delimitada y presenta unos criterios diagnósticos definidos.
Infecciones pulmonares
Las infecciones pulmonares en el paciente trasplantado son muy frecuentes, la etiología depende de la fase en que se encuentre, cuando éste se encuentra en la fase neutropénica tras la quimioterapia usada durante el acondicionamiento, las infecciones son similares a las de cualquier paciente en estado de inmunosupresión severa. Después presenta una importancia especial la neumonía por citomegalovirus (CMV) que comentaremos a continuación.
La neumonía por CMV es muy frecuente en los 6 primeros meses postrasplante. La evolución es muy agresiva presentando una mortalidad del 85 %. Ésta aparece secundaria a la infección por este virus que en el 70 % de los casos se produce por la reactivación de un virus endógeno latente producida por la inmunosupresión en los pacientes con seropositividad a CMV. También puede ocurrir por la adquisición del virus desde los productos sanguíneos (bien médula ósea o derivados sanguíneos) utilizados de un donante seropositivo (ocurriendo en el 36 % de los receptores seronegativos). Los distintos factores de riesgo para desarrollar una neumonía por CMV son: ser receptor seropositivo, presentar edad elevada, presentar excreción o viremia positiva y presentar EICH moderada o intensa5.
Las manifestaciones clínicas habituales son fiebre, tos no productiva, disnea e hipoxemia. En la radiografía se encuentran infiltrados difusos intersticiales. El diagnóstico de certeza se realiza por la existencia de macrófagos con los característicos cuerpos de inclusión en el LBA. El uso de la inmunofluorescencia indirecta con anticuerpos monoclonales contra CMV en la muestra del LBA se ha demostrado una técnica sensible y específica para su diagnóstico y aunque aparece positiva en muchos pacientes seropositivos sin enfermedad activa, se ha demostrado que el 50 % de los pacientes asintomáticos en los que se encuentra desarrollarán una neumonía, por lo tanto aunque la detección de CMV no significa infección activa si establece un factor de riesgo importante6.
El tratamiento debe realizarse con ganciclovir y altas dosis de inmunoglobulinas pero normalmente una vez que se ha producido la afectación respiratoria el pronóstico es malo. Actualmente se ha demostrado que la búsqueda del virus en sangre tiene un alto valor predictivo para el desarrollo de neumonía. Por lo que se ha establecido la realización de búsqueda semanal de viremia usando cultivo, reacción en cadena de la polimerasa (PCR), inmunofluorescencia o antigenemia para realizar un tratamiento precoz y mejorar el pronóstico7. La profilaxis está muy debatida, es necesario el uso de productos seronegativos sobre receptores seronegativos. En pacientes seropositivos puede utilizarse altas dosis de aciclovir en torno a la realización del trasplante8.
Síndrome de injerto autólogo tras trasplante de células madre hematopoyética
Lee et al9 publicaron en 1995 un artículo titulado "Síndrome de injerto en trasplante autólogo de médula ósea y de sangre periférica", en el describen un nuevo cuadro clínico que aparece tras el trasplante autólogo de médula ósea o sangre periférica durante la fase de injerto leucocitario consistente en fiebre no infecciosa, rash en la piel, signos de permeabilidad capilar y hipoxemia con infiltrados pulmonares, identifican como factor precipitante el uso de G-CSF. Desde entonces otros muchos autores han identificado síndromes similares nombrados con distintos términos como: síndrome de fuga capilar10, síndrome de autoagresión11, síndrome de disfunción multiorgánica12 o síndrome de dificultad respiratoria periinjerto13.
La incidencia oscila entre un 7 y un 58 % dependiendo de los criterios diagnósticos empleados, por lo que Spitzer14 hace una revisión con el propósito de estandarizar estos criterios (tabla 2). La afectación respiratoria y el resto de síntomas producidos en el síndrome de injerto autólogo están causados por una respuesta inflamatoria sistémica mediada por una serie de citoquinas producidas por los leucocitos, de forma que en los pacientes con dificultad respiratoria aguda secundaria a síndrome de injerto autólogo (SIA) se encuentran unos niveles más altos de interleuquina 8 en LBA que en el resto de pacientes trasplantados15. La importancia clínica de este hecho recae en que el conocimiento de la modulación de las citoquinas permitiría el tratamiento y prevención del fallo respiratorio y el fracaso multiorgánico secundario a la reacción inflamatoria sistémica.
Los factores asociados con la aparición del cuadro son dispares dependiendo de los estudios pero el más intensamente relacionado es el uso de G-CSF, el cual produciría una rápida reconversión leucocitaria con aumento de la secreción de citoquinas mediadoras. El tratamiento con esteroides a altas dosis (en torno a 1 g/día) es utilizado por la mayoría de los autores reduciendo la mortalidad de forma significativa.
Hemorragia alveolar difusa
En 1989 Robbins et al16 publicaron en "The American Journal of Medicine" un artículo en el que describieron un síndrome que ocurría tras trasplante autólogo de célula madre progenitora caracterizado por disnea, tos no productiva, hipoxemia, infiltrados difusos en la radiografía de tórax y LBA donde se encontraban muestras hemorrágicas. Este síndrome fue reconocido gracias a la aplicación del LBA en este tipo de población y se denominó hemorragia alveolar difusa. La incidencia encontrada por Robbins es del 21 % y una mortalidad entre los pacientes del 73 %. La etiopatogenia al igual que en el SIA se relaciona con una respuesta inflamatoria mediada por neutrófilos a nivel pulmonar, cuya aparición coincide con la elevación brusca de leucocitos en sangre periférica, por lo que este cuadro podría ser una fase avanzada del SIA localizado a nivel pulmonar.
Aunque no existe ningún estudio prospectivo, parece que los tratamientos con corticoides a altas dosis (1 g al día intravenoso durante 3 días reduciendo la dosis de forma progresiva a la mitad cada 3 días hasta llegar a 60 mg/día, posteriormente se realiza un descenso lento durante 2 meses hasta suspender) presentan beneficio sobre el curso clínico17.
Bronquiolitis obliterante y enfermedad pulmonar obstructiva
La bronquiolitis obliterante ha sido descrita como una complicación tardía, a veces fatal que aparece tras el trasplante alogénico, se caracteriza por un patrón obstructivo progresivo de nueva aparición y cuando no se tiene confirmación histológica se denomina enfermedad pulmonar obstructiva (EPO). La incidencia publicada previamente oscila entre el 3,9 y 26 % en los supervivientes a largo plazo del trasplante alogénico18-20 debido a los distintos criterios diagnósticos empleados. Los síntomas y signos más comunes son tos productiva (60-100 %), disnea (50-70 %) y sibilancias diseminadas (40 %)18. El diagnóstico se basa en los parámetros espirométricos caracterizados por un patrón obstructivo progresivo de nueva aparición. La tomografía computarizada (TC) de alta resolución aporta datos importantes para el diagnóstico, apareciendo áreas de hipoatenuación con dilatación bronquiolar y bronquial y zonas parcheadas de atrapamiento aéreo a la espiración forzada21. El LBA presenta signos inflamatorios inespecíficos22 y la biopsia transbronquial es poco informativa porque el proceso afecta fundamentalmente a la vía aérea pequeña. Sólo en algunos casos se realiza biopsia pulmonar por toracoscopia abierta o vídeo-asistida presentando un patrón histológico característico de bronquiolitis obliterante23.
Los factores asociados descritos son la hipogammmaglobulinemia24, el uso de metotrexato como profilaxis para la EICH25, la existencia previa de EICH aguda19,20, los antecedentes de infección respiratoria en los primeros 100 días tras el trasplante19 y la mayor edad al recibir el trasplante19. También se ha descrito mayor incidencia en los pacientes con leucemia acondicionados con busulfán en comparación con los que reciben irradiación corporal total26, pero la EICH crónica es el factor más importante y directamente implicado con la enfermedad presentando la EPO una incidencia en este subgrupo de entre el 32-37 %19,27. La mortalidad varía desde un 14-100 %19, con una media del 65 % a los 3 años del trasplante18. Aunque no existe ningún estudio prospectivo, parece que la intensificación de los tratamientos con corticoides e inmunosupresores para la EICH crónica presentan beneficio sobre el curso clínico28 pero la respuesta al tratamiento es variable estimándose un 30 % de respuesta completa, un 30 % de parcial y un 40 % de no respuesta29. Puede administrarse prednisona a 1-1,5 mg/kg sin superar los 100 mg/día durante 4 a 6 semanas, si existe mejoría o permanece estable debe disminuirse progresivamente la dosis en 6 a 12 meses. Si no existe mejoría en un mes puede iniciarse tratamiento con ciclosporina o azatioprina (2-3 mg/kg/día, sin superar 200 mg/día), la dosis de ciclosporina debe ajustarse a los niveles séricos28. Se han descrito distintos factores predictores de buena respuesta al tratamiento29 pero lo que parece claro es que el descenso rápido del volumen espiratorio máximo en el primer segundo (FEV1) está asociado con una mayor mortalidad. Tras probar el tratamiento con corticoides e inmunosupresores sólo se aprecia mejoría en la función pulmonar en un 8-20 % de los casos28. Por lo que si no se produce respuesta en los primeros 6 meses prolongar el tratamiento a altas dosis sin existir otro signo de EICH crónico es perjudicial y aumenta la morbimortalidad29.
Bronquiolitis obliterante organizando neumonía (BOON)
El término BOON crea gran confusión por las dos primeras palabras que son similares al cuadro de bronquiolitis obliterante, el cual es diferente en términos de lesión anatomopatológica, hallazgos clínicos y pronóstico30. La BOON también llamada neumonitis organizada criptogenética es un cuadro excepcional en la población normal, forma parte de las distintas manifestaciones de distintas conectivopatías. Su incidencia está aumentando en los portadores de TPH. Aunque su origen en el trasplante es desconocido parece que está en directa relación con la presencia de EICH lo que hace pensar en la existencia de distintos factores inmunológicos como responsables.
Los hallazgos histológicos consisten en exudado organizado con focos de granulación y tejido conjuntivo en las vías respiratorias distales incluso en el alvéolo con áreas de neumonía organizada. También existe inflamación intersticial y fibrosis.
Las manifestaciones son tos, fiebre y disnea progresiva, con una variación en su estado respiratorio desde un estado leve al fallo respiratorio. En la radiografía de tórax o TC aparecen infiltrados alveolares de localización periférica, que pueden ir desde pequeños opacidades nodulares a verdaderos focos de consolidación realmente indistinguibles de los de una neumonía. En la función pulmonar destaca un patrón restrictivo con una importante disminución en la capacidad pulmonar total y afectación en la capacidad de difusión con disminución en la capacidad de transferencia pulmonar de monóxido de carbono (DLCO). El LBA normalmente muestra linfocitosis con disminución del ratio CD4+/CD8+. También pueden encontrarse neutrófilos y células plasmáticas. El tratamiento con corticoides produce normalmente una mejoría espectacular, siendo frecuente su recurrencia al suspender o disminuir el tratamiento.
Lesión pulmonar por quimioterápicos e inmunosupresores
Muchos agentes usados en el tratamiento de las enfermedades neoplásicas previamente a la realización del trasplante producen enfermedad pulmonar, normalmente aparece en el período temprano tras la realización del trasplante en forma de neumonías no infecciosas31 que se manifiestan como afectación alveolar difusa o afectación intersticial y su diagnóstico se realiza por sospecha clínica y por exclusión, el LBA permite excluir la infección. La interrupción de la droga es el primer paso terapéutico y muchos expertos aconsejan el inicio de tratamiento con corticoides de prueba durante unas semanas, si no existe mejoría pueden suspenderse. A largo plazo son responsables de la aparición de fibrosis pulmonar la cual también puede estar relacionada con el uso de irradiación.
Entre los agentes alquilantes el busulfán fue la primera droga descrita como causante de fibrosis pulmonar difusa, si bien su toxicidad reconocida aparece en el 4 %32 de los pacientes; ésta se produce tras tratamientos prolongados, su mecanismo de lesión se desconoce pero parece afectar a las células endoteliales33, encontrándose a nivel microscópico células gigantes y atipias sobre todo a nivel de los neumocitos tipo II. También se observan incremento de los fibroblastos. La instauración de la enfermedad es insidiosa, con tos, fiebre y disnea, y la manifestación más precoz en el estudio de función pulmonar es la disminución de la DLCO, su evolución es a la fibrosis pulmonar encontrando un patrón restrictivo con disminución de todos los volúmenes pulmonares. En la radiografía de tórax se encuentra un patrón reticulonodular difuso con predominio en las zonas basales, también se encuentran opacidades en los espacios aéreos. El pronóstico es malo si no hay una detección rápida del inicio de la enfermedad con interrupción del tratamiento e inicio de corticoterapia.
La ciclofosfamida es un agente citotóxico y su incidencia de toxicidad pulmonar es muy reducida, menor del 1 %.
Entre los agentes antimetabólicos, el metotrexato puede producir enfermedad pulmonar reversible como consecuencia de un mecanismo de hipersensibilidad32. Normalmente se produce una neumonitis intersticial reversible aunque en algunos casos pueden llegar a la fibrosis intersticial.
Los agentes citotóxicos como la bleomicina, mitomicina pueden desencadenar fibrosis pulmonar, la incidencia global depende de la dosis y está en torno a un 4 %.
Alteraciones aisladas de la función pulmonar tras el trasplante de progenitores hematopoyéticos
En varios estudios previos hay discrepancia sobre la existencia de alteraciones aisladas de la función pulmonar tras la realización de trasplante, la mayoría de ellos sugieren que las anormalidades de la función pulmonar son frecuentes durante los primeros meses tras su realización, sobre todo en las pruebas de difusión, pero existe una recuperación progresiva, no quedando alteraciones a largo plazo en los pacientes que no han presentado complicaciones graves34,35. La DLCO es la medida más precoz y sensible para el diagnóstico de las complicaciones pulmonares y su medición seriada puede ser un sistema útil para predecir qué pacientes desarrollarán neumonitis36.
Como hemos visto previamente el trasplante alogénico tiene como principal complicación la aparición de EICH, el cual tiene repercusión a nivel pulmonar produciendo enfermedad obstructiva de la vía respiratoria. El transplante autólogo presenta una prevalencia de complicaciones diferentes a las del alogénico, la no existencia de EICH hacen que la bronquiolitis obliterante y por lo tanto los patrones obstructivos no aparezcan, sin embargo el que se utilice sobre todo en tumores sólidos de gran malignidad que necesitan tratamientos previos muy agresivos (procedimientos quirúrgicos torácicos, infecciones previas, irradiación pulmonar) y regímenes quimioterápicos a altas dosis para eliminar el tumor, produce un tipo de patología pulmonar diferente con alteraciones de la función pulmonar sobre todo de tipo restrictivo secundarias a fibrosis pulmonar37.