Introducción
Desde la introducción de la zidovudina (AZT) como primer fármaco antirretroviral hasta hoy se han experimentado grandes cambios en el tratamiento antirretroviral y en la evolución de los pacientes. La introducción de los inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN), primero en monoterapia y posteriormente en biterapia, condujo a una mejoría clínica de los pacientes y a un descenso tanto de la mortalidad como de las manifestaciones clínicas específicas de la enfermedad. Sin embargo, hasta la introducción de los inhibidores de proteasa (IP) en 1996 no se produjo realmente un cambio llamativo y esperanzador en la evolución de la enfermedad1-3.
La introducción del tratamiento antirretroviral de gran actividad (TARGA), también conocido como HAART (highly active antiretroviral therapy) ha representado un antes y un después en la historia natural de la infección. Por TARGA se entiende el conjunto de terapias antirretrovirales constituidas por tres o más fármacos, que permiten suprimir la replicación viral hasta niveles indetectables. Esta terapia puede incluir dos o más ITIAN, junto con un no nucleósido (ITINN) y/o uno o dos IP.
No obstante, aunque la infección por el virus de la inmunodeficiencia humana (VIH) se ha convertido en una enfermedad crónica han aparecido nuevos retos y dificultades. Las complicaciones asociadas al tratamiento están originando un cambio en el planteamiento del mismo, de manera que hoy se tiende a ser más conservador. Las tendencias a la hora de tratar han variado no sólo en diferentes países, sino también dentro del mismo país. De ahí que hayamos realizado un estudio transversal de nuestros pacientes para valorar las terapias utilizadas en la actualidad, su eficacia y los efectos beneficiosos y perjudiciales derivados del tratamiento antirretroviral.
Material y métodos
Se realizó un corte transversal de los niños con infección por el VIH-1 seguidos hasta enero de 2002 en la Consulta de Inmunodeficiencias del Hospital 12 de Octubre. Dicho hospital es terciario y centro de referencia para el VIH.
La evaluación de todos los pacientes fue clínica, con revisiones cada 3 meses y analítica, mediante la realización trimestral de CD4 y carga viral en plasma. Se consideraron los diferentes estadios clínicos e inmunológicos según la clasificación de los CDC4,5. En cuanto a la carga viral se consideraron indetectables los pacientes que presentaron en el momento del corte una carga viral en plasma inferior a 300 copias/ml mediante la técnica Amplicor de Roche Diagnostics, con independencia de la previa. La adherencia al tratamiento se valoró a partir de la entrevista clínica realizada por psicólogas a los cuidadores y al niño, cuando éste era capaz de colaborar. Se elaboraron cuestionarios de cumplimiento y de calidad de vida propios, a partir de las recomendaciones establecidas por el Grupo Español para el Estudio del Sida, Sociedad Española de Pediatría y PNS (GESIDA/SEP/PNS) y el grupo GEEMA6,7. Los datos obtenidos se cotejaron con las curvas de adherencia, remitidas por el servicio de farmacia de nuestro hospital. Estas curvas se elaboran considerando la medicación que se lleva cada paciente y las fechas de recogida. Se valoró también la carga viral del paciente, de manera que si ésta era inferior a 300 copias/ml, se consideraba un dato indicativo más de cumplimiento correcto del tratamiento. Se consideró un buen cumplimiento cuando el paciente había recibido al menos el 90 % de las dosis prescritas.
Los datos se expresan en mediana y rango o media con desviación estándar. El análisis estadístico y el procesamiento de los datos se llevó a cabo mediante el programa Staview de McIntosh. Se siguió una estadística descriptiva simple.
Resultados
Hasta enero de 2002, 66 niños con infección por el VIH-1 eran seguidos en nuestro hospital. Todos salvo uno, del que se desconoce el modo de contagio, adquirieron la infección por transmisión vertical. Además, todos eran de raza blanca, salvo una niña africana. Fueron seguidos desde el nacimiento 21 niños. La mediana de edad en el momento de corte fue de 111 meses (límites, 18-216). La mediana de edad al diagnóstico fue de 24 meses ± 31 (límites, 1-140). En cuanto a la categoría clínica, 35 (53 %) se encuentran en categoría A, 11 en B y 20 en C. De los 20 que se incluyen en este último grupo, 15 presentaban encefalopatía, dos tuvieron neumonía por Pneumocystis jiroveci (antes P. carinii), dos infecciones bacterianas graves repetidas y un linfoma de Burkitt. De los 15 pacientes que presentaron encefalopatía, sólo dos no han recuperado la deambulación. Dentro de la categoría inmunológica, 28 se clasifican en el estadio 3 (43 %), 21 en estadio uno y 17 en dos. En la actualidad, se ha retirado la profilaxis primaria para P. jiroveci a 39 niños y la secundaria a tres. La mediana de CD4 fue de 953 ± 497 cél./μl (límites, 276-3.137), que en porcentajes arroja una mediana de 28 % ± 8 (límites, 12-42) La mediana de carga viral fue de 3,7 ± 5,5 log. Treinta y siete tenían una carga viral inferior a 300 copias/ml (2,4 log); todos ellos recibieron TARGA (tabla 1).
En cuanto al tipo de tratamiento, uno de los pacientes no recibía tratamiento, cuatro recibían terapia con dos ITIAN, 45 terapia con tres fármacos, 14, cuatro fármacos y dos, cinco. De los que reciben TARGA, la combinación más utilizada fue la compuesta por dos ITIAN y un IP (29/61), seguidos de la combinación de un ITIAN más un ITINN más un IP (tabla 2).
Al inicio de TARGA, la mediana de edad fue de 63 meses ± 43 (límites, 1-158), siendo el tiempo medio de tratamiento con TARGA de 45 meses ± 14 (límites, 13-71). Veintisiete niños (44 %) se encuentran en su primer ciclo de TARGA, 23, (38 %) en el segundo ciclo y 11 (18 %) han recibido tres o más ciclos.
La media de tiempo entre el primer y el segundo ciclo fue de 18 meses, entre el segundo y el tercero 47 meses y entre el tercero y el cuarto, 14 meses.
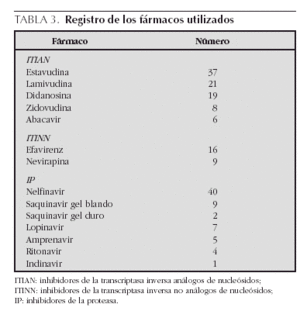
Dentro de los fármacos, los más usados fueron los ITIAN, seguidos de los IP y, en tercer lugar, los ITINN. En cuanto al fármaco más utilizado dentro de las diferentes familias destacan: estavudina (d4T) (37/91) entre los ITIAN; efavirenz (EFV) (16/25), entre los ITINN y nelfinavir (NFV) (40/68) entre los IP (tabla 3).
Del 88 % de los pacientes que recibían tratamiento antirretroviral, el 61 % presentaba buena adherencia (refieren cumplimiento total en los 7 días previos al control médico y recogen la medicación puntualmente). El 59 % de estos pacientes tenían además carga viral indetectable.
Discusión
No hay demasiados estudios transversales que muestren el estado actual de los pacientes con infección por el VIH; sin embargo, resultan muy útil para aproximarnos de manera más objetiva al estado clínico, inmunológico y virológico de estos pacientes y su relación con el tratamiento antirretroviral previo y actual8.
En nuestra serie, aunque la mayoría se encuentran asintomáticos en la actualidad, hasta el 30 % están en estadio clínico C. De los 15 pacientes que presentaron encefalopatía, sólo dos no recuperaron la deambulación, mientras que en todos los demás se ha observado una clara mejora de las habilidades motoras, persistiendo en la mayoría de los casos una discreta espasticidad. En cuanto a las capacidades intelectuales, también han mejorado enormemente y hoy cuentan con un grado notable de autonomía, si bien hemos observado, con cierta frecuencia, problemas de déficit de atención. Las infecciones bacterianas graves son ahora más inusuales y el paciente que presentó linfoma de Burkitt está en remisión completa.
Al analizar el estado inmunológico, el 42 % se clasifican en un estadio 3, si bien, si se reclasificasen teniendo en cuenta el porcentaje de CD4 actuales, el 75 % de los pacientes se clasificaría como 1 y sólo el 6 % como 3.
Además se ha observado un descenso de las infecciones oportunistas y no se ha producido ninguna de clase C en los últimos años. La retirada de profilaxis secundaria para P. jiroveci en pacientes con buen control inmunovirológico se planteó a partir de los datos obtenidos por otros grupos9,10. Así, se retiró la profilaxis primaria para P. jiroveci en 39 niños y la secundaria en tres, sin que se haya registrado ningún caso tras esto.
La mejoría clínica e inmunológica de todos estos pacientes, así como el descenso en la mortalidad, se encuentra claramente relacionada con el inicio de la terapia TARGA, lo que pone de manifiesto la importancia del tratamiento antirretroviral2,3,11-15. En nuestra cohorte, el último niño falleció en 1997.
En cuanto al control virológico, a pesar de que en la mayoría de los estudios se alcanza una proporción de enfermos con carga viral indetectable del 30 o 40 % tras el primer ciclo de TARGA, en nuestro estudio el porcentaje se eleva al 56 %16. Debe tenerse en cuenta, sin embargo, que este porcentaje no es comparable con otros estudios observacionales, o ensayos clínicos, dada la heterogeneidad de los pacientes. En nuestra cohorte, 12 pacientes han recibido tres o más ciclos de TARGA y en 16 niños fue necesario recurrir a combinaciones que incluían más de tres fármacos para su mejoría. Las causas de fracaso virológico fueron, fundamentalmente, mala adherencia y/o mala tolerancia, especialmente con los primeros IP. En contraposición, existen 4 niños en biterapia con dos ITIAN, que presentan cargas virales inferiores a 1.000. Todo ello pone de manifiesto una gran variabilidad y, en definitiva, la diferente gravedad de estos pacientes.
Al analizar las terapias utilizadas vemos cómo la mayoría (61/66) reciben terapia TARGA. La opción más habitual es la combinación triple (45/61), constituida en 29 casos por dos ITIAN y un IP. El ITIAN más usado es la d4T, que se ha mantenido como fármaco activo, en la mayoría de los casos desde el inicio de su administración dada su potencia y su bajo perfil de resistencias. No se ha observado ningún caso de toxicidad metabólica asociada a análogos o lactacidemia asintomática. Sin embargo, sí es muy frecuente la presencia de atrofia grasa en los niños que lo reciben, sobre todo de la grasa facial, persistiendo incluso en 2 pacientes que recibían dos ITIAN, incluyendo d4T y un IP, en los que se cambió el IP por nevirapina con el fin de mejorar la lipodistrofia. Sí se observó, sin embargo, una mejoría del perfil lipídico (resultados pendientes de publicación). Por ello, en la actualidad, a pesar de ser un fármaco bien tolerado y efectivo para el control del virus, se intenta evitar su uso en terapias iniciales en el niño.
La AZT es por hoy el menos utilizado, fundamentalmente por problemas de resistencias, ya que la mayoría lo recibieron en monoterapia.
De los ITINN, EFV es el más usado (16/23). La tolerancia fue buena y las alteraciones del sueño poco llamativas, de manera que no se ha tenido que suspender por efectos adversos en ningún paciente. La nevirapina también se ha usado con cierta frecuencia (9/23). La tolerancia ha sido correcta y tampoco hubo que suspenderla por efectos adversos, incluyendo el exantema. Por último, entre los IP, el más usado es el nelfinavir. La tolerancia ha sido buena. El efecto adverso más frecuente fue la diarrea, presente en la mayoría de los niños que lo reciben, si bien es bien tolerado y no ha provocado la suspensión en ningún caso. El lopinavir potenciado con ritonavir (Kaletra), a pesar de su reciente introducción, constituye el tercer IP más usado, y se utiliza sobre todo en niños con fracaso virológico y experiencia previa con IP. En nuestro estudio, 5 de los 6 pacientes que lo reciben tienen carga viral indetectable, salvo uno, que recibe 5 fármacos y que ha presentado múltiples fracasos terapéuticos por mala adherencia. Aunque inicialmente, dado su mal sabor, lo rechazan, posteriormente la tolerancia es buena.
Otro de los pilares fundamentales en la terapia antirretroviral es la adherencia14. La mayoría de los pacientes pediátricos que reciben triple terapia estándar, toman al día alrededor de 6 a 7 comprimidos cada 12 h o bien 6 comprimidos más una solución que, además, en muchas ocasiones sabe mal. La mejora de este aspecto resulta vital para que el tratamiento antirretroviral sea óptimo. Por ello, se están intentando elaborar complejos que incluyan dos o tres antirretrovirales, favoreciendo así su cumplimiento. El problema es que sólo pueden administrarse en niños mayores, que cuenten con más peso, pues sólo existe formulación en comprimidos. Otra alternativa es la prescripción de fármacos que pueden administrarse una vez al día, como la didanosina (ddI) o EFV. Si bien todavía existen dudas sobre la adecuidad en niños del uso de lamivudina (3TC) una vez al día, o la dosis correcta de tenofovir, otros fármacos como la emtricitabina (FTC), muy semejante al 3TC, se introducirá en breve, lo que facilitará la elaboración de estas pautas.
Otro aspecto que cabe destacar es que aunque la mayoría de los pacientes reciben su primer régimen de TARGA, el 38 % ya está en el segundo régimen y el 18 % en el tercero o más. Llama la atención que, al contrario de lo que muestran la mayoría de los estudios, según los cuales el tiempo de duración de la efectividad de la terapia se reduce en los siguientes regímenes, en nuestro estudio el tiempo que transcurre entre el segundo régimen y el tercero es mayor que entre el primero y el segundo. Esto podría explicarse, quizá, porque los pacientes recibieron fármacos nuevos, más eficaces para el control de la replicación viral y con más conocimiento de la farmacocinética, al contrario de los que se utilizaron más precozmente, o bien porque en ese momento no se disponía de otras opciones terapéuticas, lo cual obligaba a mantener la misma terapia.
En la actualidad, no todos los problemas están resueltos, ya que si bien se ha conseguido controlar la progresión de la enfermedad en la mayoría de los casos, este tratamiento lleva asociado una serie de efectos deletéreos cada vez más descritos, como el síndrome lipodistrófico y la alteración del metabolismo óseo. El síndrome lipodistrófico se caracteriza por una serie de alteraciones en la distribución de la grasa corporal, que pueden acompañarse de alteraciones en el metabolismo lipídico e hidrocarbonado. Esto conlleva una hiperlipemia y una resistencia periférica a la insulina, aumentando el riesgo de enfermedad cardiovascular y diabetes mellitus tipo 2, lo cual ya se está viendo en adultos con infección por el VIH. En cuanto al metabolismo óseo, tanto en niños como en adultos se ha observado una mayor incidencia de osteopenia y osteoporosis. En nuestra serie, el 40 % de los pacientes presentaba una disminución de la densidad mineral ósea17. Algunos de estos aspectos se han relacionado con el uso del tratamiento antirretroviral, en particular con algunos ITIAN, como la d4T y con los IP, aunque no hay datos definitivos. En lo que a la lipodistrofia se refiere el 24 % de nuestros pacientes presentan signos clínicos17. La lipodistrofia es más evidente en adolescentes y, en ocasiones, distorsiona su imagen corporal por lo que se convierte en un elemento negativo asociado al tratamiento, que puede favorecer su abandono. Dado que los niños reciben durante más tiempo tratamiento antirretroviral, se postula que las consecuencias futuras de estas alteraciones podrían ser mucho mayores que en los adultos, ya que también lo es el tiempo de exposición al tratamiento y de infección18-22. Existen pues muchos interrogantes en torno a este tema. Con el fin de minimizar estos problemas, en pacientes con buen control inmunovirológico se están realizando simplificaciones de tratamiento, sustituyendo el IP por nevirapina, EFV o abacavir (ensayo clínico en curso), que parecen ser efectivas, como muestran algunos estudios23-25. Otra estrategia que se está llevando a cabo en este momento es la interrupción programada de tratamiento26. Los resultados a largo plazo de estas opciones están pendientes de comprobar. Por todos estos problemas, hoy día se tiende a retrasar el inicio de la terapia antirretroviral.
Nuestro estudio desea destacar la situación actual de nuestros pacientes en un momento concreto. Estos datos han permitido ver los cambios que han experimentado con respecto al pasado y servirán como referencia para ver su evolución en los años próximos. Naturalmente presenta una serie de limitaciones, como son que se trata de una muestra relativamente pequeña; es un corte transversal y como tal tiene carácter descriptivo, pero no permite establecer relaciones estadísticas y, por último, que nuestro hospital es centro de referencia y nuestros datos pueden no ser aplicables a otras poblaciones.
En conclusión, la terapia antirretroviral ha supuesto un gran avance para el control de la infección por el VIH, lo que se ha traducido en el aumento de la supervivencia y una clara mejoría de la calidad de vida. Sin embargo, aunque los datos son esperanzadores, no cabe duda de que el camino por recorrer todavía es largo. La mejora en la presentación, posología y la reducción de los efectos secundarios asociados a la terapia antirretroviral son ahora uno de los objetivos prioritarios, que esperamos se vayan resolviendo en los próximos años. Por ello, a la hora de plantear el tratamiento debemos poner en la balanza los riesgos y los beneficios. Esto, asociado al mejor conocimiento de las complicaciones metabólicas y al desarrollo de nuevos antirretrovirales, irá probablemente modificando las recomendaciones vigentes. Todo ello justifica una evaluación periódica de nuestros pacientes, determinando las ventajas y los inconvenientes de las tendencias existentes, lo que ayudaría a perfilar el tratamiento más adecuado para cada caso y cada tiempo.