La obesidad en adolescentes tiene opciones terapéuticas limitadas y los resultados con las modificaciones de estilos de vida (MEV) son escasos. Liraglutida, un agonista del receptor GLP-1, fue el primer fármaco aprobado en España para el manejo de la obesidad en ≥12 años.
ObjetivoEvaluar la efectividad de liraglutida combinada con MEV en adolescentes con obesidad, comparándolo con MEV exclusivamente.
MétodosEstudio observacional retrospectivo de 62 adolescentes (12-18 años) con IMC ≥p95. El grupo intervención (n=31) recibió liraglutida junto con MEV, mientras que el grupo control (n=31) emparejado por edad, sexo y tiempo en tratamiento, solo siguió MEV. Se analizaron variables antropométricas, cardiovasculares y de composición corporal en tres momentos: inicio (T1), fin del tratamiento (T2: 6,9±4,7 meses) y seguimiento (T3: 12,5±4,9 meses). La comparación entre los dos grupos se realizó mediante un modelo ajustado de análisis de la covarianza para los cambios en las variables cuantitativas y regresión logística para la reducción del IMC ≥5% y ≥10%.
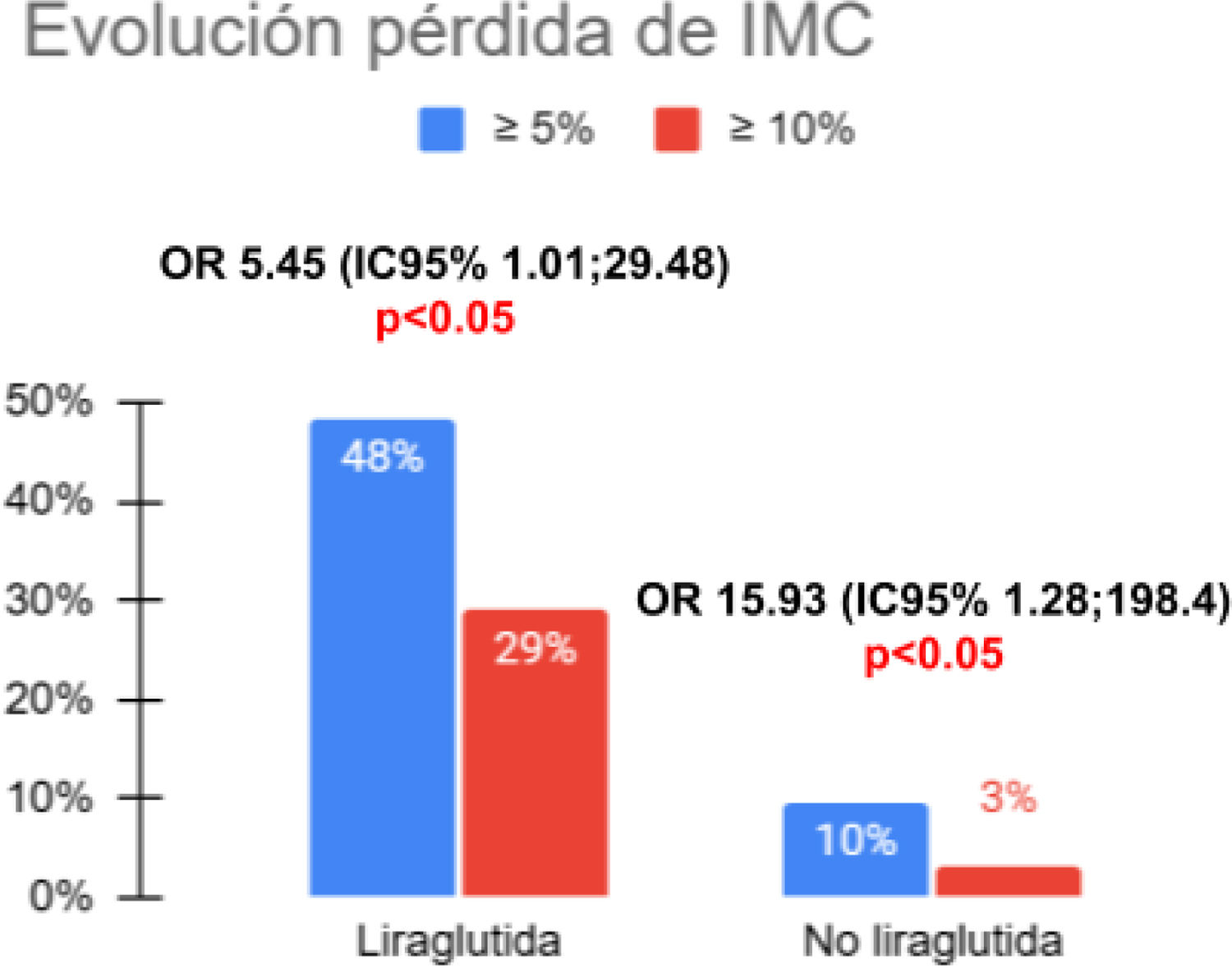
ResultadosEn el grupo intervención, el Z-IMC disminuyó significativamente (−1,09±0,24 vs. −0,10±0,25 en controles, p=0,001). Esto supuso una pérdida de ≥5% del IMC en un 48,4% de pacientes y ≥10% en un 29%, frente al 3% y 1% en el grupo control (p<0,05). La pérdida de peso se mantuvo tras 6 meses de seguimiento (T3). Se observó además una reducción significativa de insulina, HOMA-IR, triglicéridos, hipertensión arterial (HTA) sistólica y número de pacientes prediabéticos.
ConclusionesLiraglutida junto a MEV condujo a una mayor reducción del Z-IMC, del índice cintura/altura, y parámetros cardiometabólicos en comparación con el grupo con solo MEV. Es necesario investigar sus efectos a largo plazo y las dificultades para su implementación.
In the management of adolescent obesity, therapeutic options are limited and the outcomes of lifestyle modification (LM) alone are poor. Liraglutide, a GLP-1 receptor agonist, was the first drug approved in Spain for the management of obesity in adolescents aged 12 years or older.
ObjectiveTo evaluate the effectiveness of liraglutide combined with LM in adolescents with obesity compared to LM alone.
MethodsRetrospective observational study of 62 adolescents (12-18 years) with a body mass index (BMI) at or above the 95th percentile. The intervention group (n=31) received liraglutide plus LM, while controls (n=31) matched for age, sex and treatment duration were managed with LM alone. We analyzed anthropometric, cardiovascular and body composition variables at three time points: baseline (T1), end of treatment (T2: mean, 6.9 months; SD, 4.7), and followup (T3: mean, 12.5 months; SD, 4.9 months). Comparisons between groups were performed using adjusted analysis of covariance model for changes in quantitative variables and logistic regression for BMI reductions of 5% or greater and 10% or greater.
ResultsIn the intervention group, the BMI z score decreased significantly (mean,−1.09 [SD, 0.24] vs−0.10 [SD, 0.25] in controls; P=.001). This corresponded to a BMI reduction of 5% or greater in 48.4% of patients and 10% or greater in 29%, compared to 3% and 1%, respectively, in the control group (P<.05). The weight loss was maintained at six months of followup (T3). There was a significant reduction in insulin levels, the HOMA-IR, triglyceride levels, systolic hypertension (HTN), and the number of prediabetic patients.
ConclusionsLiraglutide combined with LM achieved a greater reduction in the BMI z score, waist/height ratio and cardiometabolic parameters compared to the LM alone. Further research is needed to assess its long-term effects and difficulties in its implementation.
Históricamente, el tratamiento de la obesidad en niños y adolescentes ha tenido unas opciones terapéuticas limitadas centradas en las modificaciones de los estilos de vida (MEV) a través de la dieta y la actividad física. Esta primera línea de tratamiento tiene unos resultados poco efectivos a corto y largo plazo, más aún en presencia de obesidades severas con comorbilidades asociadas1,2. En el 2007, en respuesta a la creciente prevalencia de la obesidad, un comité de expertos en pediatría y obesidad integrado por la Academia Americana de Pediatría junto a otras 14 sociedades médicas de EE. UU. publicaron unas recomendaciones con un enfoque escalonado para su manejo3. Si de los 3 a 6 meses no se obtenía una respuesta adecuada con las MEV se sugería el uso complementario de fármacos, pero solo en adolescentes ≥12 años con formas severas de obesidad, y solo en centros de atención terciaria. En el 2007, orlistat y sibutramina eran los únicos medicamentos aprobados en EE. UU. por la Food and Drug Administration (FDA), mientras que en la Agencia Europea de Medicamentos (EMA) no había ninguno. A pesar de estas recomendaciones, el empleo de fármacos para la obesidad pediátrica nunca fue ampliamente adoptado, debido quizás a que las opciones eran limitadas y el grado de eficacia de los agentes existentes era relativamente bajo. En la década del 2010, la sibutramina fue retirada en EE. UU. quedando solamente el orlistat, y algunos centros comenzaron a utilizar fármacos como la fentermina, topiramato y metformina de manera off-label ya que las MEV por sí solas eran insuficientes para lograr una reducción significativa y duradera del exceso de peso. Además, aunque la cirugía bariátrica estaba siendo más aceptada, sigue sin ser fácilmente accesible ni deseada por muchos pacientes y sus familias. Una década después, la FDA en el 2020 y la EMA en el 2021 aprobaron el uso de liraglutida para el tratamiento de la obesidad en ≥12 años4,5.
La liraglutida es un agonista del receptor del péptido 1 similar al glucagón (GLP-1 RA). Los receptores de GLP-1 están localizados en el páncreas, intestino e hipotálamo, y su activación potencia la secreción de insulina dependiente de glucosa, disminuyen la de glucagón, inducen saciedad al enlentecer el vaciado gástrico, y reducen el apetito y la ingesta por activación e inhibición de vías neuronales en el hipotálamo. Este último mecanismo es el más importante en la pérdida de peso. El uso de los GLP-1 RA tuvo como primera indicación el tratamiento de la DM2 en adultos, pero rápidamente se observó que además de mejorar el control metabólico ayudaba a la pérdida de peso. Este hecho dio lugar al desarrollo de ensayos clínicos en personas obesas no diabéticas en los que se observó que la pérdida de peso era mayor que en las personas diabéticas, logrando su indicación para la obesidad6. Actualmente liraglutida (Saxenda®, Victoza®) está indicada para el tratamiento de la obesidad en pacientes ≥12 años con un índice de masa corporal (IMC) ≥ percentil 95, y un peso superior a 60kg. Se administra diariamente vía subcutánea, y no está financiada por el Sistema Nacional de Salud.
El objetivo de este trabajo es valorar la efectividad de liraglutida junto a las MEV en un grupo de adolescentes afectos de obesidad comparado con un grupo control en el que solo se recomendaron MEV. Se analizan variables antropométricas, cardiovasculares y de composición corporal.
Pacientes y métodosEstudio observacional retrospectivo en dos grupos de pacientes adolescentes (12-18 años) obesos (IMC ≥p95) atendidos en la Unidad de Nutrición y Enfermedades Metabólicas en un hospital terciario entre febrero de 2022 y enero de 2024. A todos los pacientes que cumplían los criterios de inclusión se les ofreció el uso de liraglutida como herramienta farmacológica junto a MEV, siendo la familia la que realizaba la decisión de emplearlo ya que es un fármaco que no está financiado. En el grupo liraglutida se incluyeron 31 pacientes con un período mínimo de tratamiento de 6 semanas. La dosis inicial fue de 0,6mg/día, y se iba incrementando semanalmente según el grado de efectividad y la tolerancia hasta un máximo de 3mg. Se seleccionó un grupo control (no liraglutida) de 31 pacientes emparejado por edad, sexo y fecha de inicio del tratamiento, en los que solo se realizó MEV.
Se analizó el cambio en la evolución de los datos antropométricos (peso, talla, perímetro de cintura, índice cintura/cadera y Z-score del IMC según las tablas de Orbegozo7) en tres momentos: al inicio del tratamiento con liraglutida (T1), al finalizar dicho tratamiento (T2: 6,9±4,7 meses) y en la última visita después de haber finalizado el tratamiento (T3: 12,5±4,9 meses).
En los momentos T1 y T3 también se analizaron los cambios en los valores analíticos previo ayuno de 10horas (glucosa, insulina, HOMA-IR, HbA1c, triglicéridos, colesterol total, HDL, LDL y ácido úrico), de presión arterial (TA), y de composición corporal mediante bioimpedancia (BIA) con sistema BIA 101 Anniversary de AKERN®: Resistencia (Rz), Reactancia (Xc), ángulo de fase (PA), Masa libre de grasa (FFM) y Masa grasa (FM).
La hipertensión arterial sistólica y/o diastólica se definió según las guías clínicas de la Academia Americana de Pediatría8. La prediabetes se definió según dos de los criterios de la Asociación Americana de Diabetes: glucosa 100-125mg/dl y/o HbA1c 5,7-6,4%. La práctica de ejercicio extraescolar se cuantificó según su intensidad en ligera, moderada o vigorosa según el equivalente de gasto metabólico basado en el estudio de Ainsworth et al.9, contabilizando las horas totales de ejercicio semanal. El estudio fue aprobado por el Comité de Ética del Centro.
Análisis estadísticoLas variables cualitativas se presentan con su distribución de frecuencias absolutas y relativas. Las variables cuantitativas se expresan con la media y desviación estándar. El cambio en los valores antropométricos y analíticos entre los dos grupos se analizó mediante un análisis de la covarianza (ANCOVA) ajustado por sexo, edad, estadio de Tanner, tiempo en meses entre visitas y valor basal del parámetro evaluado. Para las variables pérdida de IMC ≥5% y >10% se ajustó un modelo de regresión logística. El cambio intragrupo en la presencia de prediabetes e hipertensión entre los momentos T1 y T3 se analizó mediante el test de McNemar para muestras pareadas, y para las variables de composición corporal mediante la t de Student para muestras pareadas. Para todos los contrastes se aceptó un valor de significación del 5%. El análisis de datos se realizó mediante el paquete estadístico IBM SPSS 26.0.
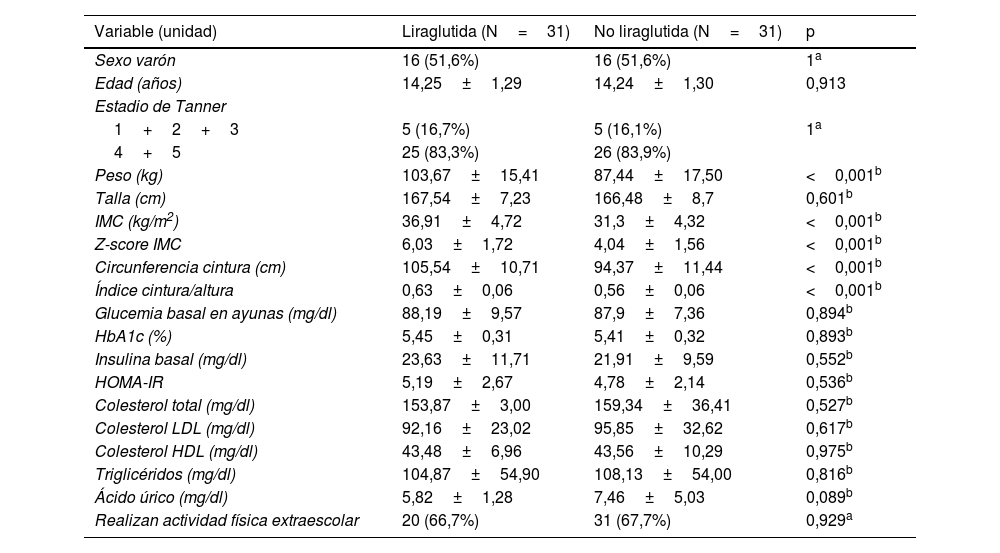
ResultadosEn la tabla 1 se muestran las características basales al inicio del estudio. El 51,6% son varones, y un 84% están en un estadio de Tanner 4-5. El grado de obesidad es mayor en el grupo con liraglutida, Z-score 6±1,7 versus 4±1,6 de los controles (p<0,001), así como el índice cintura/talla (0,63±0,01 vs. 0,56±0,11). No se observaron diferencias en el resto de las variables bioquímicas, de composición corporal y de práctica de ejercicio extraescolar.
Descripción inicial de la muestra
| Variable (unidad) | Liraglutida (N=31) | No liraglutida (N=31) | p |
|---|---|---|---|
| Sexo varón | 16 (51,6%) | 16 (51,6%) | 1a |
| Edad (años) | 14,25±1,29 | 14,24±1,30 | 0,913 |
| Estadio de Tanner | |||
| 1+2+3 | 5 (16,7%) | 5 (16,1%) | 1a |
| 4+5 | 25 (83,3%) | 26 (83,9%) | |
| Peso (kg) | 103,67±15,41 | 87,44±17,50 | <0,001b |
| Talla (cm) | 167,54±7,23 | 166,48±8,7 | 0,601b |
| IMC (kg/m2) | 36,91±4,72 | 31,3±4,32 | <0,001b |
| Z-score IMC | 6,03±1,72 | 4,04±1,56 | <0,001b |
| Circunferencia cintura (cm) | 105,54±10,71 | 94,37±11,44 | <0,001b |
| Índice cintura/altura | 0,63±0,06 | 0,56±0,06 | <0,001b |
| Glucemia basal en ayunas (mg/dl) | 88,19±9,57 | 87,9±7,36 | 0,894b |
| HbA1c (%) | 5,45±0,31 | 5,41±0,32 | 0,893b |
| Insulina basal (mg/dl) | 23,63±11,71 | 21,91±9,59 | 0,552b |
| HOMA-IR | 5,19±2,67 | 4,78±2,14 | 0,536b |
| Colesterol total (mg/dl) | 153,87±3,00 | 159,34±36,41 | 0,527b |
| Colesterol LDL (mg/dl) | 92,16±23,02 | 95,85±32,62 | 0,617b |
| Colesterol HDL (mg/dl) | 43,48±6,96 | 43,56±10,29 | 0,975b |
| Triglicéridos (mg/dl) | 104,87±54,90 | 108,13±54,00 | 0,816b |
| Ácido úrico (mg/dl) | 5,82±1,28 | 7,46±5,03 | 0,089b |
| Realizan actividad física extraescolar | 20 (66,7%) | 31 (67,7%) | 0,929a |
IMC: índice de masa corporal; HbA1c: hemoglobina glicosilada; HOMA-IR: índice de insulinorresistencia.
Datos presentados como media±desviación estándar excepto para las variables sexo, estadio de Tanner y actividad física extraescolar donde se describen con n (%).
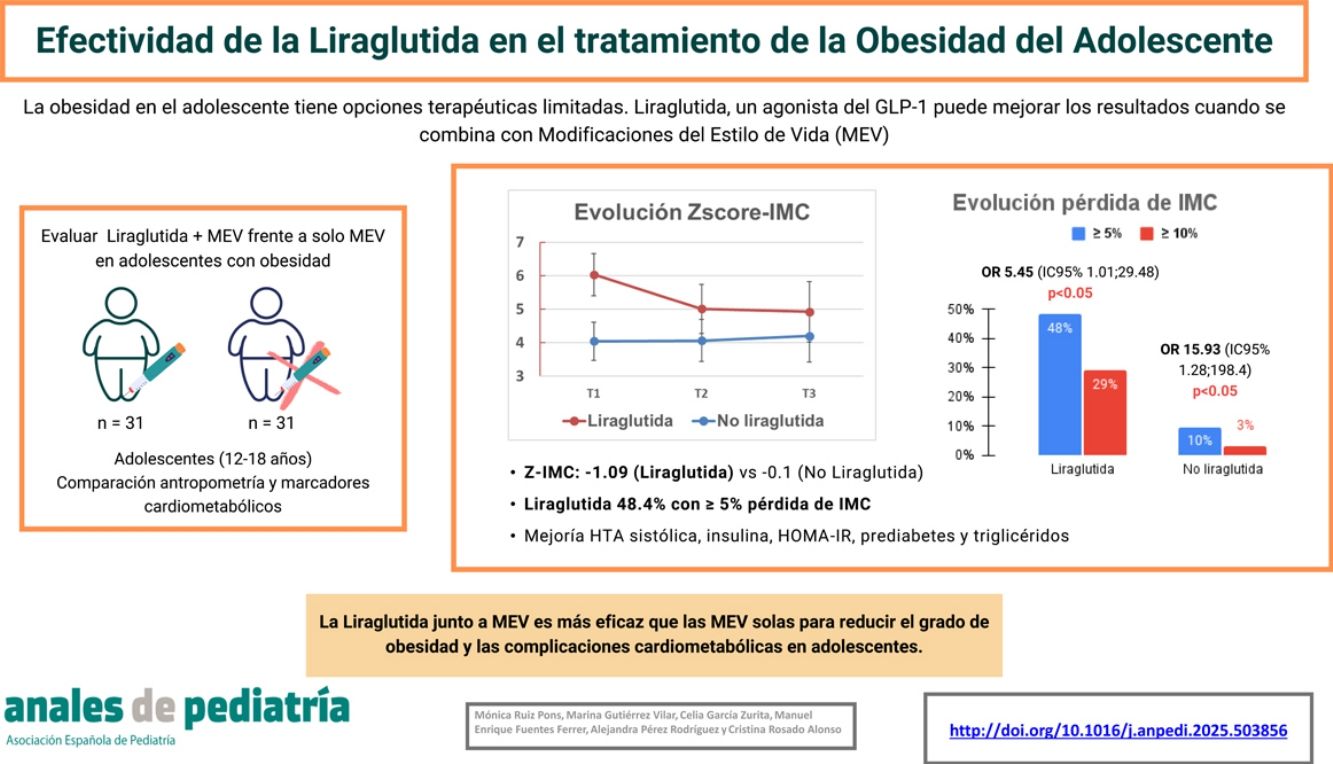
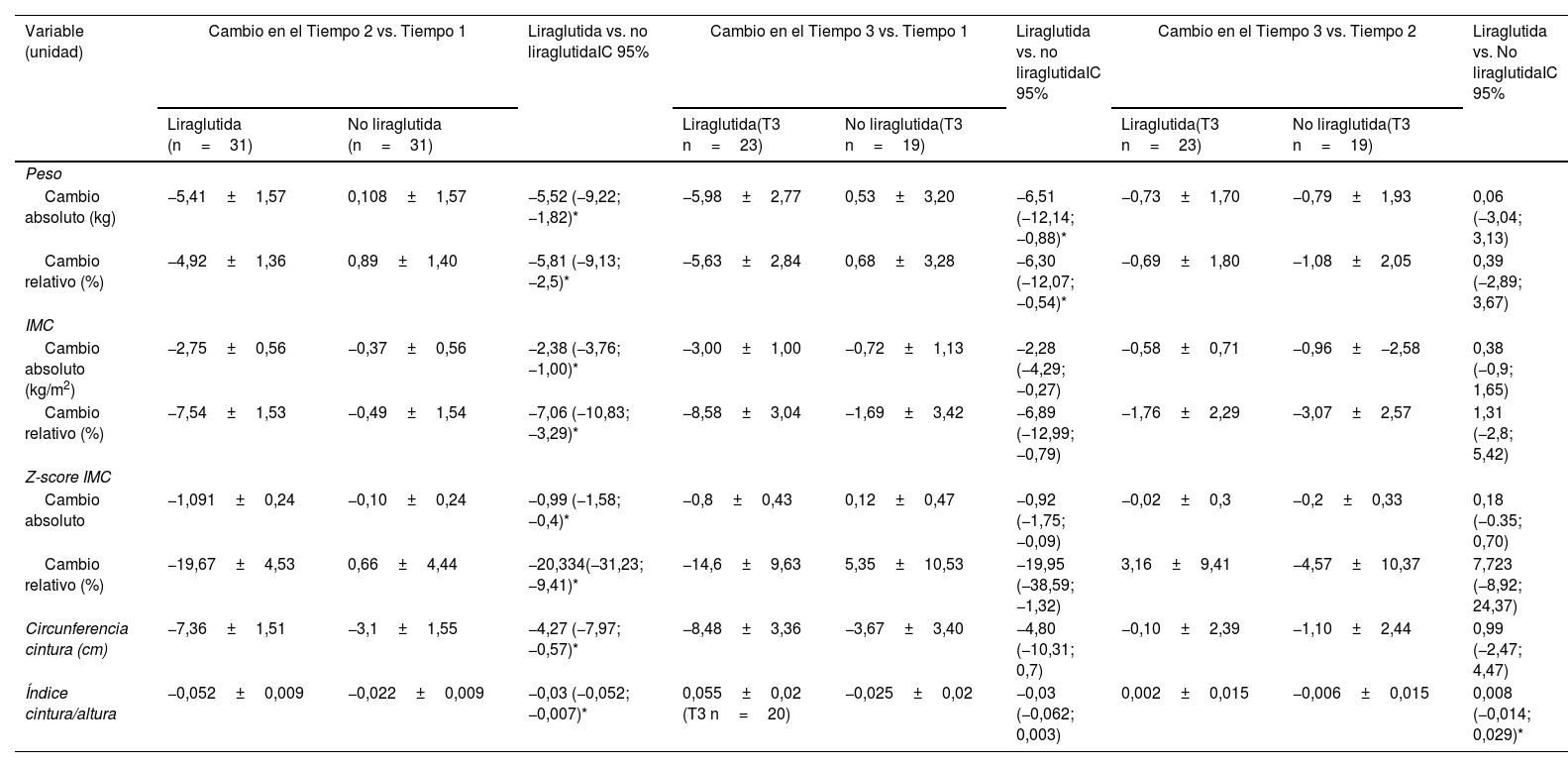
El tratamiento con liraglutida fue superior respecto al grupo no liraglituda en cuanto a la disminución del Z-IMC, con una diferencia de medias de −0,98 (IC 95% −1,57, −0,39; p=0,001). Esto supuso una disminución media del IMC de −2,38±0,68 (p=0,001), y de peso de −5,5±1,84kg (p=0,004) en este grupo. Al finalizar el tratamiento con liraglutida un 48,4% habían conseguido una pérdida de al menos un 5% del IMC y un 29% ≥10% del IMC, frente al 3% y 1% respectivamente de los pacientes sin liraglutida, diferencias ambas significativas (fig. 1). Asimismo, el perímetro de cintura disminuyó una media de −7,36±1,50cm en el grupo de liraglutida vs. −3,095cm, con una diferencia de medias de −4,26 (IC 95% −7,97, −0,56; p=0,025), y del índice cintura/talla de −0,03 (IC 95% −0,052, −0,007; p=0,012) (tabla 2).
Evolución de los cambios antropométricos
| Variable (unidad) | Cambio en el Tiempo 2 vs. Tiempo 1 | Liraglutida vs. no liraglutidaIC 95% | Cambio en el Tiempo 3 vs. Tiempo 1 | Liraglutida vs. no liraglutidaIC 95% | Cambio en el Tiempo 3 vs. Tiempo 2 | Liraglutida vs. No liraglutidaIC 95% | |||
|---|---|---|---|---|---|---|---|---|---|
| Liraglutida (n=31) | No liraglutida (n=31) | Liraglutida(T3 n=23) | No liraglutida(T3 n=19) | Liraglutida(T3 n=23) | No liraglutida(T3 n=19) | ||||
| Peso | |||||||||
| Cambio absoluto (kg) | −5,41±1,57 | 0,108±1,57 | −5,52 (−9,22; −1,82)* | −5,98±2,77 | 0,53±3,20 | −6,51 (−12,14; −0,88)* | −0,73±1,70 | −0,79±1,93 | 0,06 (−3,04; 3,13) |
| Cambio relativo (%) | −4,92±1,36 | 0,89±1,40 | −5,81 (−9,13; −2,5)* | −5,63±2,84 | 0,68±3,28 | −6,30 (−12,07; −0,54)* | −0,69±1,80 | −1,08±2,05 | 0,39 (−2,89; 3,67) |
| IMC | |||||||||
| Cambio absoluto (kg/m2) | −2,75±0,56 | −0,37±0,56 | −2,38 (−3,76; −1,00)* | −3,00±1,00 | −0,72±1,13 | −2,28 (−4,29; −0,27) | −0,58±0,71 | −0,96±−2,58 | 0,38 (−0,9; 1,65) |
| Cambio relativo (%) | −7,54±1,53 | −0,49±1,54 | −7,06 (−10,83; −3,29)* | −8,58±3,04 | −1,69±3,42 | −6,89 (−12,99; −0,79) | −1,76±2,29 | −3,07±2,57 | 1,31 (−2,8; 5,42) |
| Z-score IMC | |||||||||
| Cambio absoluto | −1,091±0,24 | −0,10±0,24 | −0,99 (−1,58; −0,4)* | −0,8±0,43 | 0,12±0,47 | −0,92 (−1,75; −0,09) | −0,02±0,3 | −0,2±0,33 | 0,18 (−0.35; 0,70) |
| Cambio relativo (%) | −19,67±4,53 | 0,66±4,44 | −20,334(−31,23; −9,41)* | −14,6±9,63 | 5,35±10,53 | −19,95 (−38,59; −1,32) | 3,16±9,41 | −4,57±10,37 | 7,723 (−8,92; 24,37) |
| Circunferencia cintura (cm) | −7,36±1,51 | −3,1±1,55 | −4,27 (−7,97; −0,57)* | −8,48±3,36 | −3,67±3,40 | −4,80 (−10,31; 0,7) | −0,10±2,39 | −1,10±2,44 | 0,99 (−2,47; 4,47) |
| Índice cintura/altura | −0,052±0,009 | −0,022±0,009 | −0,03 (−0,052; −0,007)* | 0,055±0,02 (T3 n=20) | −0,025±0,02 | −0,03 (−0,062; 0,003) | 0,002±0,015 | −0,006±0,015 | 0,008 (−0,014; 0,029)* |
T1=momento inicial del estudio; T2=finalización del tratamiento farmacológico; T3=momento final del estudio; IMC: índice de masa corporal.
Se presentan los valores de las medias del cambio y de la diferencia del cambio entre grupos junto al error estándar de la media (±EEM) estimados mediante el análisis de la covarianza (ANCOVA) ajustado por sexo, edad, estadio de Tanner, tiempo en meses entre visitas y valor basal del parámetro evaluado. En el caso de la cintura y cociente cintura/altura en T1 n=30, en T2 y T3 n=20.
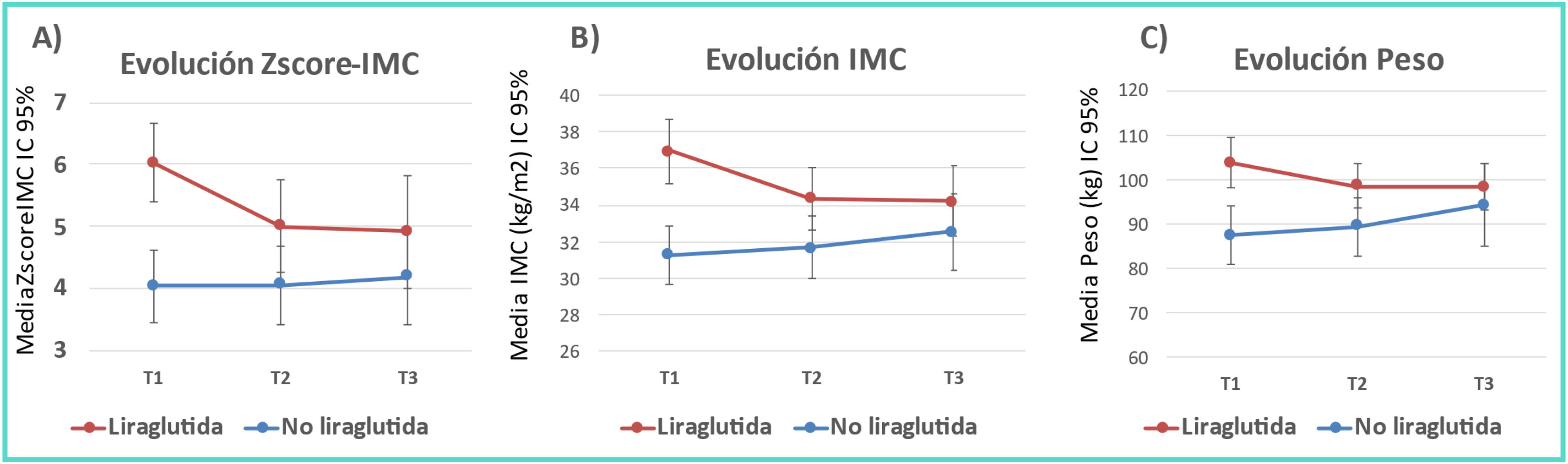
Tras un período medio de 6,1±3,5 meses de finalizado el tratamiento con liraglutida, no hubo diferencias significativas entre ambos grupos en los valores de Z-IMC, IMC, peso e índice cintura/talla (tabla 2).
Tiempo (T3 vs. T1)En la última visita, la pérdida de peso se mantenía en el grupo de liraglutida (Z-IMC de −0,8±0,42 vs. 0,11±0,46) y una diferencia de medias de 0,91 (IC 95% −1,7; −0,08; p=0,032) (tabla 2). No se objetivó afectación del crecimiento longitudinal.
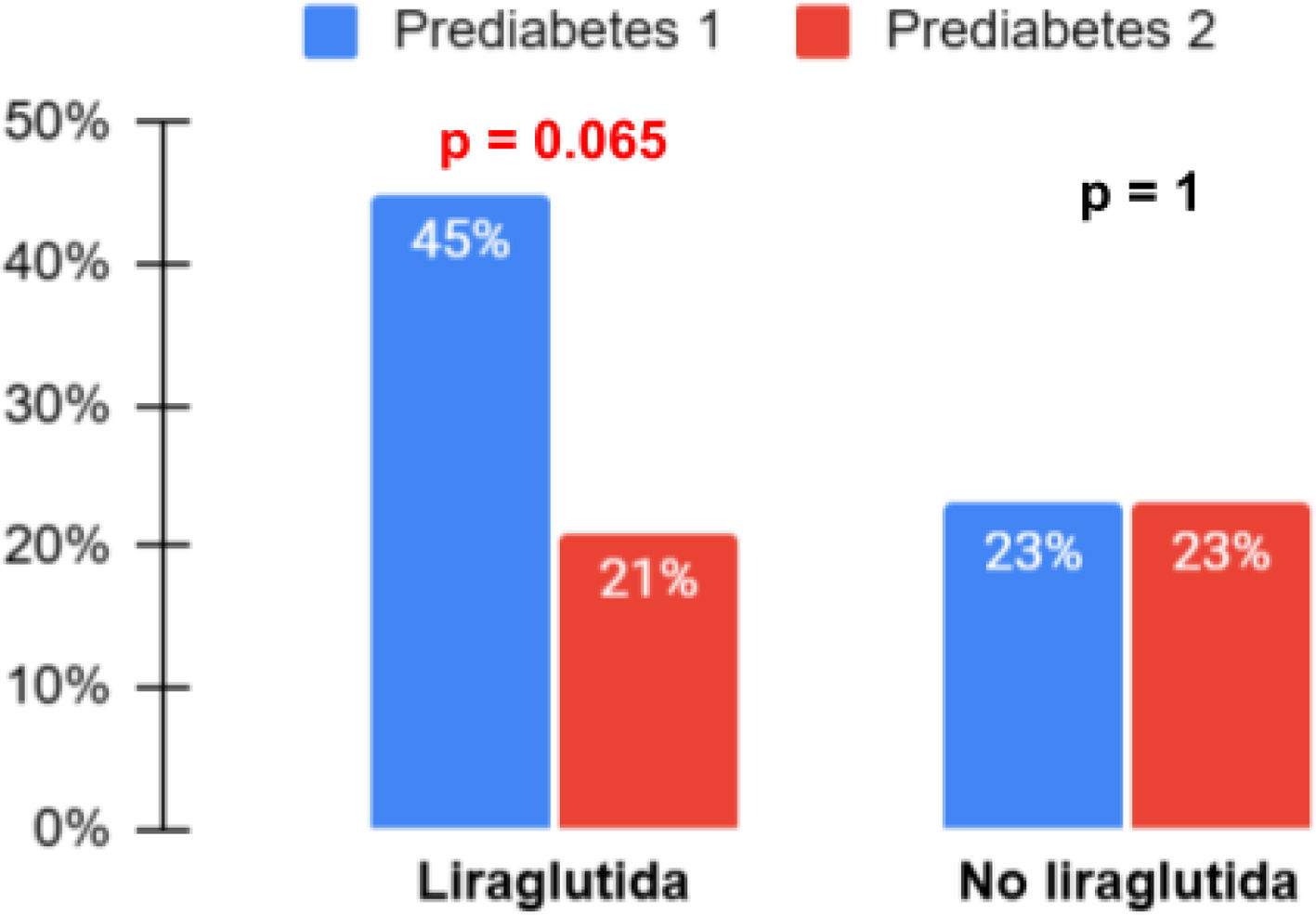
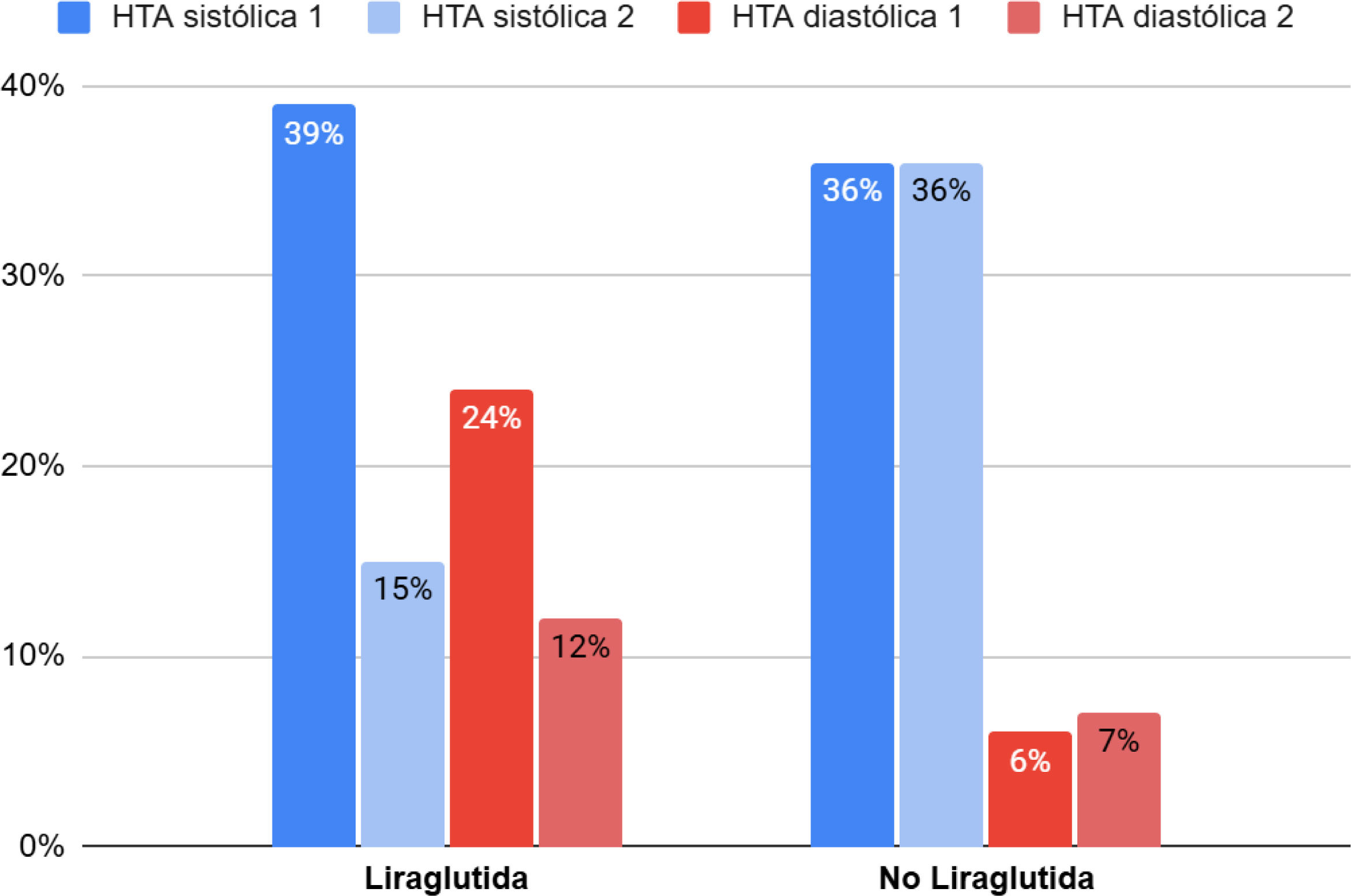
Marcadores cardiometabólicosEn el grupo con liraglutida se produjo una disminución significativa de los valores de insulina (diferencia de medias de −8,87 [IC 95% −16,6; −1,18]; p=0,025), HOMA-IR (diferencia de medias de −2,05 [IC 95% −3,8; −0,29]; p=0,023), y triglicéridos (diferencia de medias de −49,87 [IC 95% −81,54, −16,74]; p=0,004) respecto al grupo sin liraglutida, sin ser significativo en el resto de las variables analíticas estudiadas (tabla 3). Hubo una disminución del 46,2% de pacientes prediabéticos en el grupo con liraglutida mientras que en el grupo control la proporción se mantuvo igual (fig. 2). En ambos grupos disminuye el número de pacientes hipertensos, siendo solo significativa la disminución de la HTA sistólica (p=0,031) en el grupo con liraglutida (fig. 3).
Cambio medio estimado de los parámetros analíticos entre los momentos T1 y T3
| Variable (unidad) | Liraglutida (n=x) | No liraglutida (n=x) | Liraglutida vs. no liraglutidaIC 95% |
|---|---|---|---|
| Glucemia basal en ayunas | −2,70±1,65 (n=28) | −2,44±1,65 (n=27) | −2,66 (−3,86; 3,33) |
| HbA1c (%) | −0,28±0,08 (n=28) | −0,15±0,07 (n=26) | −0,13 (−0,29; 0,03) |
| Insulina basal (mg/dl) | −9,60±3,57 (n=27) | −0,73±3,55 (n=23) | −8,87 (−16,56; −1,18)* |
| HOMA-IR | −2,45±0,81 (n=26) | −0,39±0,80 (n=22) | −2,05 (−3,80; −0,30)* |
| Colesterol total (mg/dl) | −0,69±5,82 (n=29) | 8,03±5,78 (n=27) | −8,72 (−21,39; 3,96) |
| Colesterol LDL (mg/dl) | 0,98±3,46 (n=29) | 2,40±3,5 (n=24) | −1,42 (−8,91; 6,07) |
| Colesterol HDL (mg/dl) | 4,00±1,71 (n=29) | 3,17±1,74 (n=25) | 0,84 (−2,85; 4,53) |
| Triglicéridos (mg/dl) | −44,53±14,98 (n=29) | 4,62±14,89 (n=28) | −49,15 (−81,55; −16,74)* |
| Ácido úrico | −0,06±0,36 (n=26) | 0,218±0,32 (n=26) | −0,28 (−0,99; 0,43) |
T1=momento inicial del estudio; T3=momento final del estudio; HbA1c: hemoglobina glicosilada; HOMA-IR: índice de insulinorresistencia.
Se presentan los valores de las medias del cambio y de la diferencia del cambio entre grupos junto al error estándar de la media (±EEM) estimados mediante el análisis de la covarianza (ANCOVA) ajustado por sexo, edad, estadio de Tanner, tiempo en meses entre visitas y valor basal del parámetro evaluado.
Evolución de la HTA.
El valor p hace referencia al cambio intragrupo calculado mediante el test de McNemar para muestras apareadas. En el caso de la diferencia HTA sistólica inicial y final entre el grupo liraglutida vs. no liraglutida, p=0,031. Con respecto a la HTA diastólica, p=0,453. HTA: hipertensión arterial.
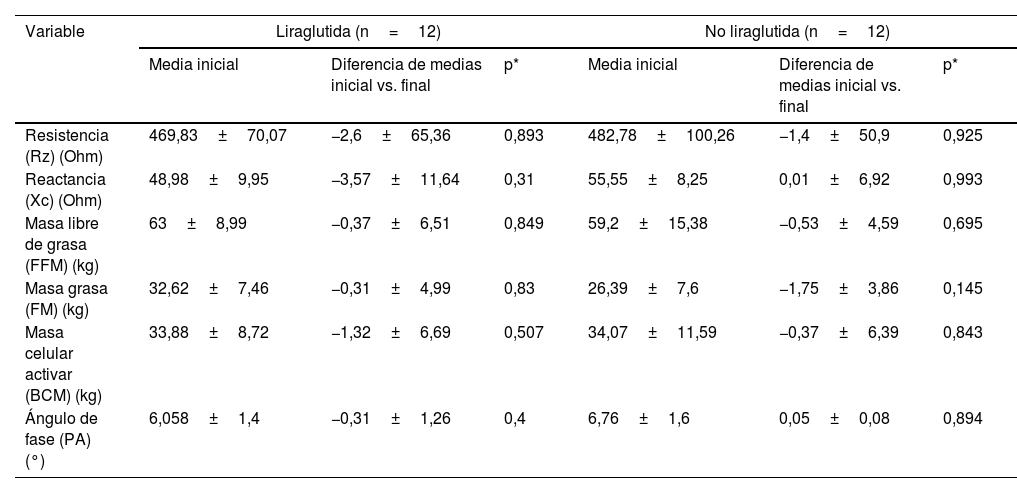
Debido a problemas técnicos con la BIA, solamente se muestran los datos de una submuestra de 12 pacientes en ambos grupos. Se observa una pérdida de FM y FFM durante la evolución T3 vs. T1 en ambos grupos, aunque no significativa (tabla 4).
Evolución bioimpedanciometría por subgrupos (liraglutida vs. no liraglutida)
| Variable | Liraglutida (n=12) | No liraglutida (n=12) | ||||
|---|---|---|---|---|---|---|
| Media inicial | Diferencia de medias inicial vs. final | p* | Media inicial | Diferencia de medias inicial vs. final | p* | |
| Resistencia (Rz) (Ohm) | 469,83±70,07 | −2,6±65,36 | 0,893 | 482,78±100,26 | −1,4±50,9 | 0,925 |
| Reactancia (Xc) (Ohm) | 48,98±9,95 | −3,57±11,64 | 0,31 | 55,55±8,25 | 0,01±6,92 | 0,993 |
| Masa libre de grasa (FFM) (kg) | 63±8,99 | −0,37±6,51 | 0,849 | 59,2±15,38 | −0,53±4,59 | 0,695 |
| Masa grasa (FM) (kg) | 32,62±7,46 | −0,31±4,99 | 0,83 | 26,39±7,6 | −1,75±3,86 | 0,145 |
| Masa celular activar (BCM) (kg) | 33,88±8,72 | −1,32±6,69 | 0,507 | 34,07±11,59 | −0,37±6,39 | 0,843 |
| Ángulo de fase (PA) (°) | 6,058±1,4 | −0,31±1,26 | 0,4 | 6,76±1,6 | 0,05±0,08 | 0,894 |
Los efectos secundarios más frecuentes fueron los gastrointestinales, sobre todo el dolor abdominal, motivo por el que 5 pacientes suspendieron el tratamiento. Once pacientes refirieron dificultades para mantener una pauta continua de tratamiento debido a los problemas de abastecimiento en farmacias y/o a la economía familiar. No se realizaron controles sistemáticos de glucemias. Ninguno presentó hipoglucemia clínica referida.
DiscusiónEl tratamiento con liraglutida junto a las MEV en nuestra muestra de pacientes adolescentes con obesidad consigue una reducción del Z-IMC significativamente superior al del grupo sin liraglutida. Esta disminución se mantiene hasta 6 meses después de haber finalizado el tratamiento, mientras que en el grupo control se produce un ligero ascenso (fig. 4). En el único ensayo aleatorizado controlado de Kelly et al. en el 202010, para estudiar los efectos de liraglutida en adolescentes obesos (125 con liraglutida y 125 del grupo placebo) durante un período de 56 semanas, observaron que la liraglutida mejoraba significativamente el Z-IMC respecto al grupo placebo (−0,23±0,05 vs. −0,00±0,05). Al igual que en adultos, se produce una reganancia de peso tras un período de seguimiento de 26 semanas después de finalizado el tratamiento. Tamborlane et al. estudiaron el efecto de la liraglutida junto a metformina en la modificación de los niveles de HbA1 en una muestra de 66 adolescentes con sobrepeso y DM2, frente a 66 placebo con DM2 y solo metformina a lo largo de 26 semanas11. La disminución del Z-IMC fue de −-0,25 en el grupo con liraglutida y de −0,21 en el grupo control, sin diferencias entre ambos. En el estudio de Zhou et al. en 21 pacientes prediabéticos con obesidad de 11 años de edad para valorar los efectos de la liraglutida en la disminución de los niveles de glucosa, observaron una disminución significativa del IMC a los 3 meses frente a un grupo placebo control12. Otros 2 estudios aleatorizados, doble ciego, pero cuyo objetivo principal era valorar la seguridad, farmacocinética y efectos secundarios de la liraglutida en 24 pacientes de 7-11 años13 y 12 pacientes de 12 a 17 años14, observaron reducciones del Z-IMC de −0,28±0,09 tras 8 semanas de tratamiento, y de −0,02±0,07 tras 5 semanas de tratamiento, respectivamente.
Evolución gráfica de los cambios antropométricos.
A) Evolución en el Z-score del IMC de ambos subgrupos. B) Evolución del IMC de ambos subgrupos. C) Evolución del peso de ambos subgrupos. T1=momento inicial del estudio; T2=finalización del tratamiento farmacológico; T3=momento final del estudio; IC: intervalo de confianza; IMC: índice de masa corporal.
En pediatría se desconoce exactamente cuánto peso es necesario perder o no seguir ganando para mejorar el IMC y sus complicaciones asociadas. En la revisión sistemática de la U.S Preventive Task Force15 sobre los efectos del tratamiento de la obesidad en niños y adolescentes, observaron que una modificación del Z-Score del IMC de −0,20 era clínicamente significativa, y modificaciones entre 0,20-0,25 ya constituyen umbrales para mejorar los factores de riesgo cardiometabólicos, y más aún cuando eran mayores de 0,5. Los cambios en los estilos de vida (educación nutricional y actividad física) según Cochrane16 tienen un impacto en el Z-Score del IMC de −0,06. En nuestro estudio, la reducción de −1,09 del Z-IMC se acompañó de una disminución significativa de los niveles de insulina, HOMA-IR, triglicéridos y de HTA sistólica en el grupo con liraglutida respecto al grupo control. Aunque hubo una disminución leve no significativa de la HbA1 en ambos grupos, el porcentaje de prediabéticos descendió un 46% en el grupo con liraglutida y se mantuvo igual en el grupo control. Ford et al.17 también observaron durante el seguimiento de 12 meses de 88 adolescentes con obesidad, que los descensos de las desviaciones estándar (DE) de IMC ≥0,5 se acompañaban de una disminución de triglicéridos (−30%), colesterol LDL (−15%) y PCR de alta sensibilidad (−45%), mientras que descensos menores, IMC-DE ≥0,25, mejoraban la sensibilidad a la insulina, la TA y el índice colesterol total/HDL. A mayor pérdida de IMC-DE, mayor disminución del perímetro de cintura, masa grasa y grasa de tronco medida con BIA.
En los 7 estudios aleatorizados con un total de 547 participantes18–22, cuando el objetivo principal de estudio era la reducción del IMC, no se observaron cambios significativos en los parámetros cardiometabólicos entre los grupos, mientras que en los que el objetivo principal era ver los cambios en la glucemia y/o HbA1 en poblaciones prediabéticas o con DM2, sí se producía una disminución significativa en estos parámetros, aunque no en el perfil lipídico o en las cifras de TA. Recientemente Apperley et al., en un estudio retrospectivo de 24 adolescentes con obesidad severa en tratamiento con liraglutida durante 3 meses, observaron una reducción significativa de −0,09 del Z-IMC, así como de los niveles de triglicéridos, colesterol y HbA1, junto a mejorías en la composición corporal y en la calidad de vida23,24.
En el análisis de la composición corporal de nuestros pacientes, se produce una disminución no significativa de FM y FFM en ambos grupos. Es difícil su interpretación al ser muestras pequeñas. El uso de análogos del GLP-1 RA como la liraglutida conducen a una pérdida de peso pero también a una rápida y significativa pérdida de masa magra, y aunque los estudios aún son escasos, se recomienda la práctica de ejercicio de resistencia muscular para minimizar dicha pérdida25. Nosotros solo valoramos la práctica de actividad física extraescolar referida por los pacientes en intensidad y horas/semana, y aunque era mayor en el grupo con liraglutida en el momento T3 (datos no mostrados), es una estimación indirecta ya que no utilizamos instrumentos de medición precisos ni tampoco el tipo de actividad practicada.
En 2023, la Academia Americana de Pediatría publicó su primera guía de práctica clínica basada en la evidencia sobre la evaluación y tratamiento del sobrepeso y la obesidad pediátrica, en la que recomienda la utilización de fármacos en adolescentes ≥12 años con un IMC ≥p9526. Casi simultáneamente también se publicaron varios ensayos clínicos fundamentales de fármacos para tratar la obesidad en adolescentes. Actualmente, la FDA ha aprobado la liraglutida, el semaglutide, la fentermina/topiramato y el setmelanotide (además del ya aprobado orlistat) para uso en la población pediátrica. La EMA ha aprobado la liraglutida y el semaglutide (2024) para población pediátrica ≥12 años y un IMC ≥p95, y el setmelanotide en ≥ 2años (2025) para obesidades monogénicas. Pero comenzar con un fármaco en la práctica clínica depende no solo de la edad y el IMC del paciente, sino también de la trayectoria del IMC, la presencia de comorbilidades, la respuesta a las MEV y las preferencias del paciente/familia. Debido a que la mayoría de los adolescentes con obesidad severa no logran una reducción clínicamente significativa del IMC solo con las MEV, parece prudente ofrecer de manera complementaria la utilización de fármacos. En la práctica, una estrategia adecuada sería probar la terapia de estilos de vida, por ejemplo, durante 4 a 6 semanas para evaluar la respuesta antes de comenzar con un tratamiento farmacológico. En nuestro estudio, la elección por parte de las familias de iniciar la liraglutida se produjo sobre todo en aquellos pacientes con un mayor exceso de peso y una ganancia continua, pese a las recomendaciones en las MEV. La severidad de la obesidad no constituye un factor predictivo de la efectividad de la liraglutida en adultos ni tampoco en poblaciones pediátricas27, solo el grado de respuesta inicial en las primeras semanas de tratamiento. La continuidad del tratamiento depende de la respuesta al fármaco, y de la capacidad económica de la familia. Si a los 3 meses no se obtiene respuesta se suspende su uso. Los efectos secundarios más frecuentes asociados a la liraglutida son los gastrointestinales (dolor abdominal, náuseas, vómitos, etc.), motivo por el que 5 de nuestros pacientes suspendieron el tratamiento. En el estudio de Kelly et al.9, 10 de los 13 pacientes que interrumpieron el tratamiento se debía a problemas gastrointestinales.
Aunque la evidencia que respalda la seguridad y eficacia del uso de fármacos antiobesidad en la población pediátrica está aumentando rápidamente, aún existe una discrepancia sustancial entre la alta prevalencia de obesidad y la escasa utilización de estos medicamentos en esta población. Los ensayos clínicos publicados hasta la fecha han analizado su uso durante menos de 2 años, y se desconoce el impacto que pudieran tener en el desarrollo fisiológico y psicológico del niño a largo plazo. Otra limitación para la utilización de estos fármacos es la idea de que los niños con obesidad pueden alcanzar un peso normal simplemente dejando de consumir alimentos poco saludables y realizando actividad física. Esta creencia hace suponer que los fármacos son innecesarios e incluso peligrosos, idea que no solo comparten los padres28, sino también algunos profesionales sanitarios. Finalmente, la ausencia de financiación pública también limita el acceso a estos fármacos29, aumentando aún más la brecha social de la mayor prevalencia de la obesidad en las familias con menores ingresos económicos.
Las limitaciones de nuestro estudio incluyen la pérdida de datos antropométricos en el momento T3, el 21% de los casos y el 39% de los controles. Aunque las MEV eran valoradas mensualmente por una dietista, el mayor porcentaje de pérdidas en los controles fue debido a la peor evolución de estos pacientes que abandonan el tratamiento. La descontinuación de la liraglutida supuso pérdidas en los casos. Uno de los mayores escollos del tratamiento de la obesidad es la tasa de abandonos que presenta, de un 40-70% según diferentes autores2. La distribución por grupos venía determinada por las posibilidades de las familias para usar la liraglutida, aparte de los problemas de abastecimiento en las oficinas de farmacia, por lo que en el análisis se ajustó por los valores antropométricos al inicio del estudio y otras variables que pudieran tener un efecto sobre las variables de resultado. Además, el software Bodygram necesario para la captura y tratamiento de las bioimpedancias sufrió un período de inactividad y problemas técnicos durante el período del estudio. Durante la actualización del software proporcionado por el proveedor se precisó la sustitución del equipamiento informático, para pasar de la versión BodygramPlus a BodygramHBO.
En conclusión, el uso de la liraglutida junto a las MEV en una muestra de adolescentes con obesidad severa condujo a una mayor reducción del Z-IMC (−1,09±0,24 vs. −0,10±0,25) y del índice cintura/altura, en comparación con un grupo control en el que solo se trataban con MEV. Esta pérdida de peso se acompañó de una disminución significativa de los niveles de triglicéridos, HOMA, insulina, HTA sistólica y número de pacientes prediabéticos respecto al grupo control. Previamente a la adición de la liraglutida, muchos de los pacientes continuaban ganando peso, pese a las recomendaciones en las MEV. El empleo de agonistas del receptor GLP-1 ha tenido un impacto terapéutico importante en el manejo de la obesidad ya que disminuyen el hambre al ralentizar el vaciamiento gástrico, y promueven la saciedad por sus efectos en el sistema nervioso central. Se necesitan más estudios para valorar los efectos a largo plazo de estos fármacos en el desarrollo fisiológico y psicológico del niño, si consideramos la obesidad pediátrica como una enfermedad crónica y con recaídas, y no como una falta de voluntad conductual.
Declaración de la IA generativa y las tecnologías asistidas por IA en el proceso de escrituraDurante la preparación de este trabajo, los autores utilizaron Chat GPT a fin de generar el resumen y abstract de la publicación. Tras utilizar dicha herramienta, los autores revisaron y editaron el contenido según necesidad, asumiendo la plena responsabilidad del contenido de la publicación.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.