En los últimos años se ha evidenciado un incremento en la incidencia de infecciones por bacterias multirresistentes. Las principales amenazas son los bacilos gramnegativos productores de β-lactamasas de espectro extendido, AmpC o carbapenemasas, Staphylococcus aureus resistente a meticilina y Enterococcus faecium resistente a vancomicina. Para hacer frente a este problema, es fundamental establecer programas de optimización en el uso de antimicrobianos específicos para pediatría, realizar una vigilancia epidemiológica activa y desarrollar una adecuada política de control de infecciones. Su abordaje terapéutico es, a menudo, complejo y multidisciplinar, y precisa frecuentemente del uso de antibióticos menos empleados. En este documento de posicionamiento, elaborado por la Asociación Española de Pediatría y la Sociedad Española de Infectología Pediátrica, se revisa la epidemiología y el tratamiento de estas infecciones siguiendo la mejor evidencia disponible.
A progressive increase in the incidence of infections caused by multidrug-resistant microorganisms is being reported. Among these resistant microorganisms, the main threats are extended-spectrum β-lactamase-, AmpC-, and carbapenemase-producing Gram-negative bacilli, methicillin-resistant Staphylococcus aureus and vancomycin-resistant Enterococcus faecium. To address this important problem, it is essential to establish pediatric Antimicrobial Stewardship programs, perform active epidemiological surveillance and develop an adequate infection control policy. The therapeutic approach of these infections is often complex, frequently requiring antibiotics with less experience in children. In this position document made by the Spanish Association of Pediatrics and the Spanish Society of Pediatric Infectious Diseases, the epidemiology and treatment of these infections are reviewed according to the best available evidence.
La resistencia a antimicrobianos supone, actualmente, uno de los principales problemas de salud pública1. La prevalencia de bacterias multirresistentes (BMR) se ha incrementado en las últimas décadas de forma significativa, estando incluidas por la Organización Mundial de la Salud dentro de las 10amenazas para la salud global.
Las infecciones por BMR son particularmente importantes en el entorno sanitario. Sin embargo, cada vez se observa con mayor frecuencia su distribución en la comunidad2. Estas infecciones presentan un peor pronóstico debido al retraso en el inicio de la antibioterapia adecuada y a la necesidad de antibióticos alternativos, menos efectivos y con peor perfil de seguridad3,4.
Los factores de riesgo para el desarrollo de infecciones por BMR son la colonización previa, la antibioterapia de amplio espectro, una estancia hospitalaria prolongada, el ingreso en unidades de enfermos críticos, la inmunosupresión y el uso de dispositivos invasivos4,5. Las medidas de control de infecciones en los pacientes hospitalizados (por ejemplo, higiene de manos, aislamiento de pacientes colonizados por BMR, etc.) y los programas de optimización de uso de antimicrobianos (PROA) son medidas fundamentales frente a este problema emergente de salud pública.
El tratamiento de las infecciones por BMR puede implicar también la utilización de antibióticos con los que se tiene menor experiencia; algunos utilizados desde hace décadas (por ejemplo, colistina o fosfomicina) y otros de más reciente aprobación6 (por ejemplo, tigeciclina, ceftolozano-tazobactam o ceftazidima-avibactam), con poca información disponible respecto a su uso en población pediátrica. La mayoría de la evidencia actual procede de estudios observacionales realizados en adultos7,8 y muy frecuentemente nos encontramos con la necesidad de recurrir al uso off-label de los escasos antimicrobianos disponibles.
El tratamiento debe individualizarse según la gravedad, las características del paciente, el foco de la infección y el patrón de sensibilidad de las bacterias aisladas. Además del tratamiento antimicrobiano, el tratamiento de soporte y el control del foco, siempre que sea posible, son prioritarios. En general, cuando se aísla una BMR en una muestra clínica se recomienda consultar a expertos. En las tablas 1 y 2 se muestran las dosis de los principales antibióticos utilizados en las infecciones por BMR. La duración del tratamiento antibiótico ha de ajustarse a la máxima evidencia disponible9.
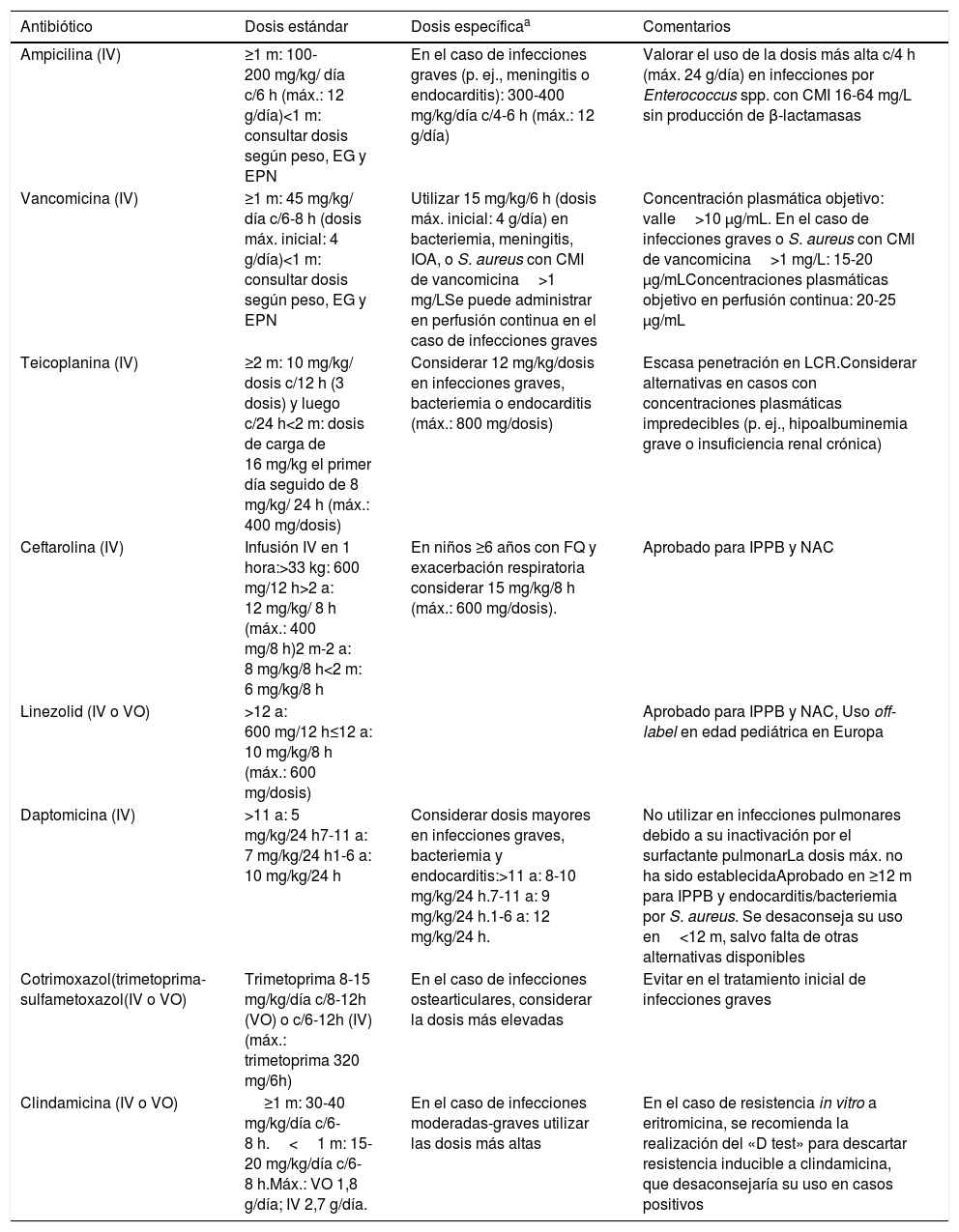
Dosis de los principales antibióticos utilizados en pediatría para el tratamiento de infecciones por cocos grampositivos resistentes
| Antibiótico | Dosis estándar | Dosis específicaa | Comentarios |
|---|---|---|---|
| Ampicilina (IV) | ≥1 m: 100-200 mg/kg/ día c/6 h (máx.: 12 g/día)<1 m: consultar dosis según peso, EG y EPN | En el caso de infecciones graves (p. ej., meningitis o endocarditis): 300-400 mg/kg/día c/4-6 h (máx.: 12 g/día) | Valorar el uso de la dosis más alta c/4 h (máx. 24 g/día) en infecciones por Enterococcus spp. con CMI 16-64 mg/L sin producción de β-lactamasas |
| Vancomicina (IV) | ≥1 m: 45 mg/kg/ día c/6-8 h (dosis máx. inicial: 4 g/día)<1 m: consultar dosis según peso, EG y EPN | Utilizar 15 mg/kg/6 h (dosis máx. inicial: 4 g/día) en bacteriemia, meningitis, IOA, o S. aureus con CMI de vancomicina>1 mg/LSe puede administrar en perfusión continua en el caso de infecciones graves | Concentración plasmática objetivo: valle>10 μg/mL. En el caso de infecciones graves o S. aureus con CMI de vancomicina>1 mg/L: 15-20 μg/mLConcentraciones plasmáticas objetivo en perfusión continua: 20-25 μg/mL |
| Teicoplanina (IV) | ≥2 m: 10 mg/kg/ dosis c/12 h (3 dosis) y luego c/24 h<2 m: dosis de carga de 16 mg/kg el primer día seguido de 8 mg/kg/ 24 h (máx.: 400 mg/dosis) | Considerar 12 mg/kg/dosis en infecciones graves, bacteriemia o endocarditis (máx.: 800 mg/dosis) | Escasa penetración en LCR.Considerar alternativas en casos con concentraciones plasmáticas impredecibles (p. ej., hipoalbuminemia grave o insuficiencia renal crónica) |
| Ceftarolina (IV) | Infusión IV en 1 hora:>33 kg: 600 mg/12 h>2 a: 12 mg/kg/ 8 h (máx.: 400 mg/8 h)2 m-2 a: 8 mg/kg/8 h<2 m: 6 mg/kg/8 h | En niños ≥6 años con FQ y exacerbación respiratoria considerar 15 mg/kg/8 h (máx.: 600 mg/dosis). | Aprobado para IPPB y NAC |
| Linezolid (IV o VO) | >12 a: 600 mg/12 h≤12 a: 10 mg/kg/8 h (máx.: 600 mg/dosis) | Aprobado para IPPB y NAC, Uso off-label en edad pediátrica en Europa | |
| Daptomicina (IV) | >11 a: 5 mg/kg/24 h7-11 a: 7 mg/kg/24 h1-6 a: 10 mg/kg/24 h | Considerar dosis mayores en infecciones graves, bacteriemia y endocarditis:>11 a: 8-10 mg/kg/24 h.7-11 a: 9 mg/kg/24 h.1-6 a: 12 mg/kg/24 h. | No utilizar en infecciones pulmonares debido a su inactivación por el surfactante pulmonarLa dosis máx. no ha sido establecidaAprobado en ≥12 m para IPPB y endocarditis/bacteriemia por S. aureus. Se desaconseja su uso en<12 m, salvo falta de otras alternativas disponibles |
| Cotrimoxazol(trimetoprima-sulfametoxazol(IV o VO) | Trimetoprima 8-15 mg/kg/día c/8-12h (VO) o c/6-12h (IV) (máx.: trimetoprima 320 mg/6h) | En el caso de infecciones ostearticulares, considerar la dosis más elevadas | Evitar en el tratamiento inicial de infecciones graves |
| Clindamicina (IV o VO) | ≥1 m: 30-40 mg/kg/día c/6-8 h.<1 m: 15-20 mg/kg/día c/6-8 h.Máx.: VO 1,8 g/día; IV 2,7 g/día. | En el caso de infecciones moderadas-graves utilizar las dosis más altas | En el caso de resistencia in vitro a eritromicina, se recomienda la realización del «D test» para descartar resistencia inducible a clindamicina, que desaconsejaría su uso en casos positivos |
CMI: concentración mínima inhibitoria; EG: edad gestacional; EMA: European Medicines Agency; EPN: edad posnatal; FQ: fibrosis quística; IPPB: infecciones de piel y partes blandas; IV: intravenoso; LCR: líquido cefalorraquídeo; NAC: neumonías adquiridas en la comunidad; RC: resistente a carbapenems; UI: unidades internacionales; VO: vía oral.
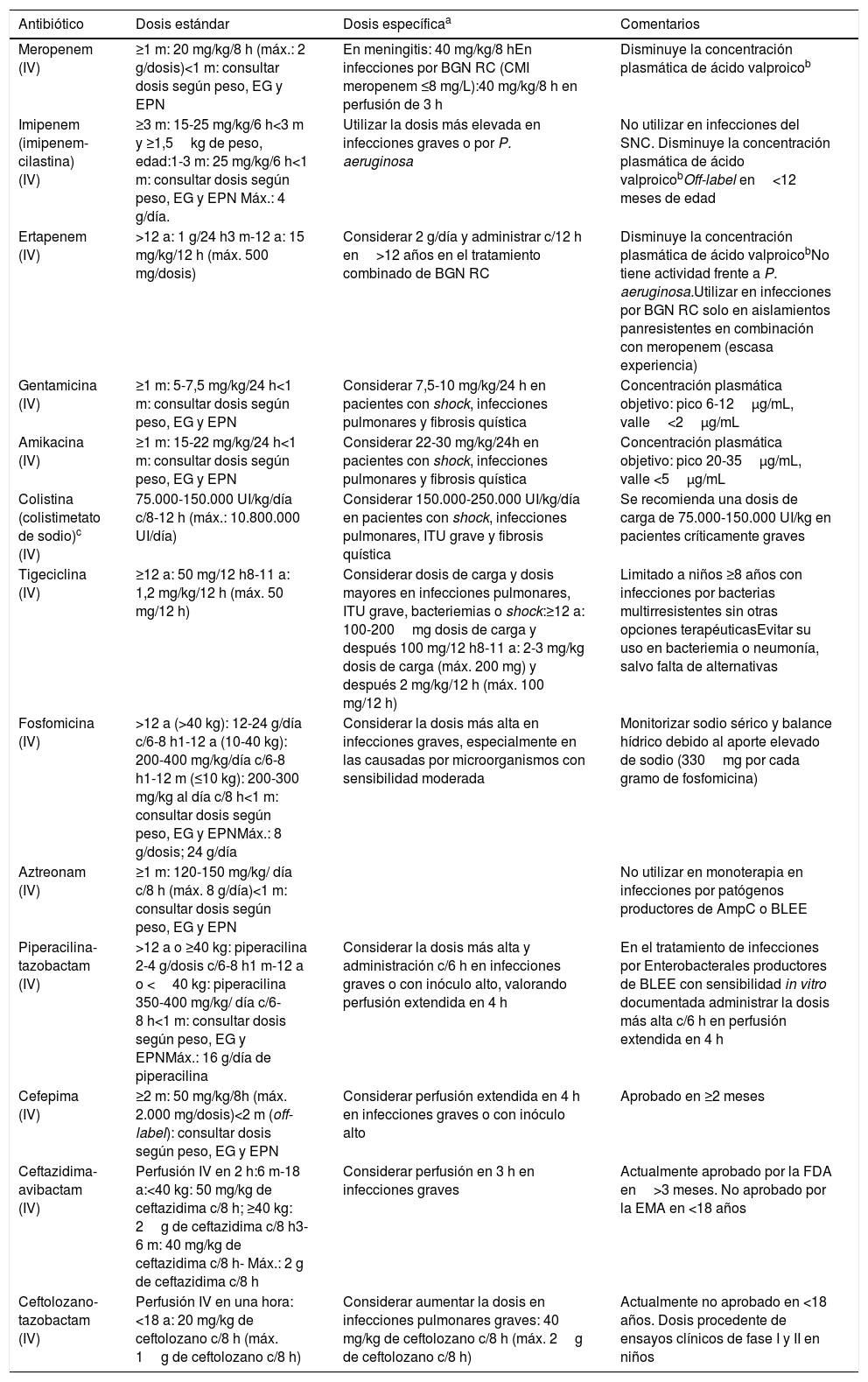
Dosis de los principales antibióticos utilizados en pediatría para el tratamiento de infecciones por bacilos gramnegativos resistentes
| Antibiótico | Dosis estándar | Dosis específicaa | Comentarios |
|---|---|---|---|
| Meropenem (IV) | ≥1 m: 20 mg/kg/8 h (máx.: 2 g/dosis)<1 m: consultar dosis según peso, EG y EPN | En meningitis: 40 mg/kg/8 hEn infecciones por BGN RC (CMI meropenem ≤8 mg/L):40 mg/kg/8 h en perfusión de 3 h | Disminuye la concentración plasmática de ácido valproicob |
| Imipenem (imipenem-cilastina) (IV) | ≥3 m: 15-25 mg/kg/6 h<3 m y ≥1,5kg de peso, edad:1-3 m: 25 mg/kg/6 h<1 m: consultar dosis según peso, EG y EPN Máx.: 4 g/día. | Utilizar la dosis más elevada en infecciones graves o por P. aeruginosa | No utilizar en infecciones del SNC. Disminuye la concentración plasmática de ácido valproicobOff-label en<12 meses de edad |
| Ertapenem (IV) | >12 a: 1 g/24 h3 m-12 a: 15 mg/kg/12 h (máx. 500 mg/dosis) | Considerar 2 g/día y administrar c/12 h en>12 años en el tratamiento combinado de BGN RC | Disminuye la concentración plasmática de ácido valproicobNo tiene actividad frente a P. aeruginosa.Utilizar en infecciones por BGN RC solo en aislamientos panresistentes en combinación con meropenem (escasa experiencia) |
| Gentamicina (IV) | ≥1 m: 5-7,5 mg/kg/24 h<1 m: consultar dosis según peso, EG y EPN | Considerar 7,5-10 mg/kg/24 h en pacientes con shock, infecciones pulmonares y fibrosis quística | Concentración plasmática objetivo: pico 6-12μg/mL, valle<2μg/mL |
| Amikacina (IV) | ≥1 m: 15-22 mg/kg/24 h<1 m: consultar dosis según peso, EG y EPN | Considerar 22-30 mg/kg/24h en pacientes con shock, infecciones pulmonares y fibrosis quística | Concentración plasmática objetivo: pico 20-35μg/mL, valle <5μg/mL |
| Colistina (colistimetato de sodio)c (IV) | 75.000-150.000 UI/kg/día c/8-12 h (máx.: 10.800.000 UI/día) | Considerar 150.000-250.000 UI/kg/día en pacientes con shock, infecciones pulmonares, ITU grave y fibrosis quística | Se recomienda una dosis de carga de 75.000-150.000 UI/kg en pacientes críticamente graves |
| Tigeciclina (IV) | ≥12 a: 50 mg/12 h8-11 a: 1,2 mg/kg/12 h (máx. 50 mg/12 h) | Considerar dosis de carga y dosis mayores en infecciones pulmonares, ITU grave, bacteriemias o shock:≥12 a: 100-200mg dosis de carga y después 100 mg/12 h8-11 a: 2-3 mg/kg dosis de carga (máx. 200 mg) y después 2 mg/kg/12 h (máx. 100 mg/12 h) | Limitado a niños ≥8 años con infecciones por bacterias multirresistentes sin otras opciones terapéuticasEvitar su uso en bacteriemia o neumonía, salvo falta de alternativas |
| Fosfomicina (IV) | >12 a (>40 kg): 12-24 g/día c/6-8 h1-12 a (10-40 kg): 200-400 mg/kg/día c/6-8 h1-12 m (≤10 kg): 200-300 mg/kg al día c/8 h<1 m: consultar dosis según peso, EG y EPNMáx.: 8 g/dosis; 24 g/día | Considerar la dosis más alta en infecciones graves, especialmente en las causadas por microorganismos con sensibilidad moderada | Monitorizar sodio sérico y balance hídrico debido al aporte elevado de sodio (330mg por cada gramo de fosfomicina) |
| Aztreonam (IV) | ≥1 m: 120-150 mg/kg/ día c/8 h (máx. 8 g/día)<1 m: consultar dosis según peso, EG y EPN | No utilizar en monoterapia en infecciones por patógenos productores de AmpC o BLEE | |
| Piperacilina-tazobactam (IV) | >12 a o ≥40 kg: piperacilina 2-4 g/dosis c/6-8 h1 m-12 a o <40 kg: piperacilina 350-400 mg/kg/ día c/6-8 h<1 m: consultar dosis según peso, EG y EPNMáx.: 16 g/día de piperacilina | Considerar la dosis más alta y administración c/6 h en infecciones graves o con inóculo alto, valorando perfusión extendida en 4 h | En el tratamiento de infecciones por Enterobacterales productores de BLEE con sensibilidad in vitro documentada administrar la dosis más alta c/6 h en perfusión extendida en 4 h |
| Cefepima (IV) | ≥2 m: 50 mg/kg/8h (máx. 2.000 mg/dosis)<2 m (off-label): consultar dosis según peso, EG y EPN | Considerar perfusión extendida en 4 h en infecciones graves o con inóculo alto | Aprobado en ≥2 meses |
| Ceftazidima-avibactam (IV) | Perfusión IV en 2 h:6 m-18 a:<40 kg: 50 mg/kg de ceftazidima c/8 h; ≥40 kg: 2g de ceftazidima c/8 h3-6 m: 40 mg/kg de ceftazidima c/8 h- Máx.: 2 g de ceftazidima c/8 h | Considerar perfusión en 3 h en infecciones graves | Actualmente aprobado por la FDA en>3 meses. No aprobado por la EMA en <18 años |
| Ceftolozano-tazobactam (IV) | Perfusión IV en una hora:<18 a: 20 mg/kg de ceftolozano c/8 h (máx. 1g de ceftolozano c/8 h) | Considerar aumentar la dosis en infecciones pulmonares graves: 40 mg/kg de ceftolozano c/8 h (máx. 2g de ceftolozano c/8 h) | Actualmente no aprobado en <18 años. Dosis procedente de ensayos clínicos de fase I y II en niños |
BGN: bacilos gramnegativos; BLEE: β-lactamasas de espectro extendido; CMI: concentración mínima inhibitoria; EG: edad gestacional; EMA: European Medicines Agency; EPN: edad posnatal; FDA: Food and Drug Administration; ITU: infección del tracto urinario; IV: intravenoso; RC: resistente a carbapenems; UI: unidades internacionales; SNC: sistema nervioso central.
ITU grave: asocia sepsis, shock séptico u otras complicaciones (p.ej., absceso renal).
La Organización Mundial de la Salud estableció en el año 2017 un listado de bacterias prioritarias para guiar la investigación y desarrollo de nuevos antibióticos10. Pseudomonas aeruginosa resistente a carbapenems (RC) y Enterobacterales (previamente conocidos como Enterobacteriaceae) RC o resistentes a cefalosporinas de tercera generación ocupan el primer puesto como prioridad crítica. Enterococcus faecium resistente a vancomicina y Staphylococcus aureus resistente a meticilina (SARM) figuran como prioridad alta. El presente documento se centra en el abordaje de las infecciones por estas bacterias, cuyo tratamiento supone un reto en la actividad pediátrica actual. En el caso de Enterococcus spp., debido a sus particularidades en cuanto a resistencias intrínsecas y adquiridas, se abordarán los distintos fenotipos más frecuentes.
Infecciones por cocos grampositivosStaphylococcus aureus resistente a meticilinaEl principal mecanismo de resistencia es la adquisición de una nueva proteína de unión a la penicilina, denominada PBP2a, que está codificada por el gen mecA11. En el laboratorio de microbiología se detecta mediante la evaluación de la sensibilidad a cefoxitina, mediante la detección molecular del gen mecA o mediante la detección de la PBP2a por inmunocromatografía. La presencia de este fenotipo implica resistencia a todos los β-lactámicos, con la excepción de las cefalosporinas ceftarolina y ceftobiprol. Tradicionalmente se han establecido diferencias entre los clones comunitarios y los relacionados con la asistencia sanitaria, con diferente perfil de sensibilidad y virulencia: los comunitarios presentan con mayor frecuencia sensibilidad a clindamicina y producción de la toxina leucocidina de Panton-Valentine. Sin embargo, en los últimos años, la introducción de clones comunitarios en los hospitales y la diseminación de clones hospitalarios en la comunidad han difuminado estas diferencias11.
EpidemiologíaLa resistencia a meticilina en S. aureus adquirido en la comunidad en niños empezó a describirse en España en el año 2006. Actualmente, estas cepas suponen entre un 5 y un 10% de las infecciones por S. aureus en niños, que llega a ser del 25% en el caso de neumonías adquiridas en la comunidad (NAC)12. La mayoría de los casos comunicados son infecciones de piel y partes blandas (IPPB), seguidas de neumonías y bacteriemias.
Aunque en otros países europeos su prevalencia ha disminuido progresivamente en los últimos años, en España se mantiene estable: se sitúa en torno al 12% de los aislamientos en hemocultivo en niños, según los datos del Centro Europeo de Control de Enfermedades (ECDC).
El estudio COSACO ha evidenciado una prevalencia de colonización por SARM en niños en España del 1,4%, con resistencia a meticilina en el 4,4% de los aislamientos de S. aureus13. De forma destacable, el 17% de los S. aureus aislados presentó resistencia a clindamicina, cifra que aumentó al 26% en el caso de SARM.
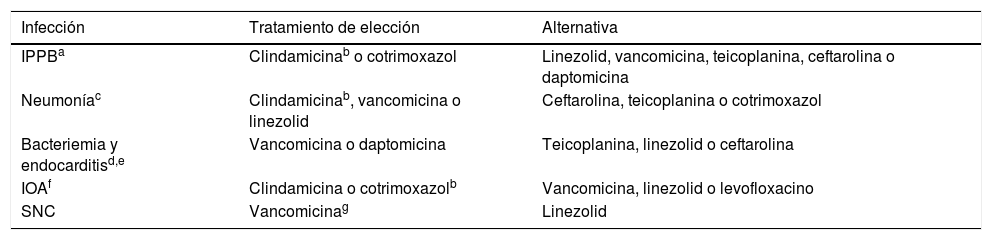
TratamientoEl adecuado control del foco debe considerarse el primer escalón y una prioridad absoluta para un tratamiento eficaz (tabla 3). En caso de bacteriemia persistente a pesar de un tratamiento correcto, debe realizarse una búsqueda activa de focos a distancia.
Tratamiento de las infecciones producidas por S. aureus resistente a meticilina
| Infección | Tratamiento de elección | Alternativa |
|---|---|---|
| IPPBa | Clindamicinab o cotrimoxazol | Linezolid, vancomicina, teicoplanina, ceftarolina o daptomicina |
| Neumoníac | Clindamicinab, vancomicina o linezolid | Ceftarolina, teicoplanina o cotrimoxazol |
| Bacteriemia y endocarditisd,e | Vancomicina o daptomicina | Teicoplanina, linezolid o ceftarolina |
| IOAf | Clindamicina o cotrimoxazolb | Vancomicina, linezolid o levofloxacino |
| SNC | Vancomicinag | Linezolid |
IOA: infección osteoarticular; IPPB: infecciones de piel y partes blandas; SNC: sistema nervioso central.
Considerar el orden de aparición en la tabla como el orden de elección.
Cuando se indique tratamiento oral, no existe solución de clindamicina comercializada en España, por lo que cotrimoxazol constituye una mejor alternativa.
En el caso de bacteriemia persistente: si tratamiento previo con vancomicina, cambiar a daptomicina. Si tratamiento con daptomicina, asociar ceftarolina o fosfomicina. En el caso de presencia de material protésico, valorar asociar rifampicina. Se define bacteriemia persistente como la persistencia de hemocultivos positivos tras 72 h o más del inicio de un tratamiento adecuado (incluyendo la retirada de catéter) o la aparición de tromboembolias sépticas o metástasis a distancia tras 72 h de antibioterapia.
En el caso de endocarditis sobre válvula protésica se recomienda: (vancomicina o daptomicina)+rifampicina+gentamicina.
En el caso de infecciones de prótesis osteoarticular con retención del material de ostesíntesis, asociar rifampicina. Algunos autores recomiendan iniciarla en una segunda fase dirigida al tratamiento del biofilm, tras 7 días de tratamiento15.
Asociar rifampicina a vancomicina en las infecciones con mantenimiento de material extraño (por ejemplo, válvula de derivación ventricular) y considerarlo en el resto de los casos. Rifampicina disminuye la concentración plasmática de linezolid un 30%, por lo que esta combinación no es recomendable.
Los glucopéptidos (vancomicina o teicoplanina) se han posicionado como los antibióticos de referencia para el tratamiento de infecciones por SARM. Sin embargo, su alta unión a proteínas plasmáticas limita su difusión a los tejidos. Por ello, es fundamental la monitorización de las concentraciones plasmáticas para garantizar valores adecuados para el tratamiento de infecciones graves. Desafortunadamente, en los últimos años se ha evidenciado un progresivo aumento de la concentración mínima inhibitoria (CMI) de estos antibióticos frente a los aislamientos de S. aureus. Además, existen dudas sobre el mayor riesgo de fracaso terapéutico en el caso de cepas con CMI de vancomicina ≥1,5mg/L14, por lo que recomendamos no utilizar vancomicina si la CMI≥2mg/L. Para CMI de 1,5mg/L (E-test), recomendamos valorar alternativas, consultando con un experto.
Entre las opciones disponibles, clindamicina y linezolid inhiben la síntesis de toxinas, por lo que su uso en monoterapia o combinadas con otros antibióticos puede ser útil en el caso de infecciones por cepas productoras de toxinas. Linezolid presenta muy buena difusión a tejidos y permite realizar terapia secuencial de vía intravenosa a oral, aunque puede presentar toxicidad hematológica y neurológica en tratamientos prolongados.
Rifampicina presenta una excelente actividad frente al biofilm; es recomendable asociarla al tratamiento antibiótico de elección en el caso de infecciones por S. aureus relacionadas con material protésico15. Cotrimoxazol mantiene en la actualidad actividad frente a la mayoría de los aislamientos de SARM. Además, está comercializado en España en solución oral, siendo una buena opción en infecciones leves o moderadas.
En bacteriemia o endocarditis por SARM con CMI de vancomicina ≥1,5mg/L, una buena opción es daptomicina. Este antibiótico es bactericida, está aprobado en niños mayores de un año y se administra en una sola dosis diaria. Como aspecto negativo destaca su inactivación por el surfactante pulmonar.
Ceftarolina es una cefalosporina de quinta generación aprobada desde el nacimiento para el tratamiento de IPPB y NAC, con excelente perfil de seguridad y buena actividad frente a SARM16, aunque la experiencia en niños es aún limitada.
Enterococcus spp.Los microorganismos del género Enterococcus se caracterizan por presentar resistencia intrínseca a múltiples antimicrobianos, incluyendo casi todas las cefalosporinas, lo que conlleva dificultades en su tratamiento. Además, también pueden adquirir resistencias (por ejemplo, a ampicilina y a vancomicina)17, lo que disminuye todavía más las opciones terapéuticas.
E. faecalis es el microorganismo más frecuente y es casi uniformemente sensible a aminopenicilinas siendo ampicilina el tratamiento de elección. E. faecium es el segundo en frecuencia y suele ser resistente a ampicilina y sensible a vancomicina. E. gallinarum y E. casseliflavus, mucho más infrecuentes, son intrínsecamente resistentes a vancomicina (aunque no a teicoplanina), si bien suelen ser sensibles a aminopenicilinas.
Otro aspecto relevante de Enterococcus spp. es su resistencia intrínseca de bajo nivel a los aminoglucósidos por un transporte deficiente al interior de la bacteria. Sin embargo, cuando se asocian con otro antibiótico que actúa en la pared celular (por ejemplo, un β-lactámico o un glucopéptido), se produce un incremento de la penetración del aminoglucósido en el microorganismo, lo que resulta en un efecto sinérgico bactericida, necesario para el tratamiento de infecciones graves (por ejemplo, endocarditis, meningitis y bacteriemia). Enterococcus spp. puede adquirir resistencia de alto nivel a aminoglucósidos y, en ese caso, no se produce sinergia con glucopéptidos o β-lactámicos. Asimismo, también se obtiene sinergia bactericida con la asociación de ampicilina y ceftriaxona, pero solamente frente a E. faecalis.
La resistencia a linezolid y daptomicina en Enterococcus spp. en la actualidad es muy infrecuente, principalmente relacionada con brotes en instituciones sanitarias o con la exposición previa a los mismos18.
EpidemiologíaEn aislamientos de E. faecium procedentes de hemocultivos en pacientes<18 años en el 2011-2012 en 12 países europeos, la prevalencia de resistencia a vancomicina fue del 8,3%19. No obstante, según los datos reportados por el ECDC, en los últimos años la resistencia a vancomicina en España en muestras invasivas procedentes de todos los grupos etarios ha sido del 0,1-0,3% para E. faecalis y del 1,8-2,5% para E. faecium, presentando una tendencia estable.
TratamientoSiempre que el aislamiento sea sensible a ampicilina, será el tratamiento de elección (tabla 4). La alternativa son los glucopéptidos (vancomicina o teicoplanina). En el caso de infecciones graves, como endocarditis, meningitis o bacteriemia, se recomienda la combinación de 2 antibióticos con el objetivo de alcanzar una sinergia bactericida20. Las combinaciones más empleadas son ampicilina junto a gentamicina o ceftriaxona en E. faecalis y vancomicina con gentamicina en E. faecium.
Tratamiento antimicrobiano de infecciones por Enterococcus spp
| Antibiótico principal | De eleccióna | Ampicilinab | ||
| Si R a ampicilina | Vancomicina o teicoplaninac | |||
| Si R a ampicilina y glucopéptidos | Daptomicinad o linezolide | |||
| Combinación | Infecciones leves | No precisa | ||
| Infecciones graves (endocarditis, meningitis y bacteriemia) | Ausencia de RAN a aminoglucósidos | Gentamicina (junto a ampicilina o vancomicina) | ||
| RAN a aminoglucósidos | Si S a ampicilina | Ampicilina+ceftriaxona (solo para a E. faecalis) | ||
| Si R a ampicilinaf | Daptomicinad+(ceftarolina, ampicilinac o fosfomicina), vancomicina+rifampicina o linezolid± (fosfomicina o fluoroquinolonas) | |||
R: resistente; RAN: resistencia de alto nivel (CMI ≥500mg/L de gentamicina); S: sensible.
Si infección urinaria: puede tratarse con amoxicilina, fosfomicina, nitrofurantoína o fluoroquinolonas.
E. faecium suele ser resistente a ampicilina, por lo que no se recomienda su uso de forma empírica contra esta especie.
En el caso de CMI de ampicilina ≤64mg/L podría valorarse el tratamiento con dosis altas de ampicilina. Considerar tratamiento combinado en estos casos.
Daptomicina, debido a su inactivación por el surfactante pulmonar, no se recomienda en el tratamiento de infecciones respiratorias. Además, presenta baja penetración en el sistema nervioso central. Utilizar dosis altas (ver tabla 1) en infecciones graves.
Cuando se administran combinaciones con aminoglucósidos, hay que evaluar previamente in vitro si existe resistencia de alto nivel mediante la determinación de la CMI. En el caso de resistencia de alto nivel (CMI de gentamicina ≥500mg/L o de estreptomicina ≥2.000mg/L), habría que utilizar alternativas como ampicilina con ceftriaxona en el caso de E. faecalis. Cuando la cepa es resistente a ampicilina y glucopéptidos, daptomicina o linezolid pueden ser una alternativa.
E. faecalis y E. faecium pueden adquirir resistencia a vancomicina y a teicoplanina mediada por el gen vanA, o bien mediada por el gen vanB, que solamente confiere resistencia in vitro a la vancomicina, pero no a la teicoplanina. Sin embargo, se ha descrito la emergencia de resistencia a teicoplanina durante el tratamiento con este antimicrobiano, por lo que no se aconseja utilizarlo en estos casos. La resistencia a vancomicina de E. gallinarum, E. casseliflavus y E. flavescens es intrínseca y está mediada por el gen vanC, que solo confiere resistencia a la vancomicina, pero no a la teicoplanina, por lo que podría utilizarse para el tratamiento17.
Infecciones por bacilos gramnegativosEnterobacterales productores de β-lactamasas de espectro extendidoLas β-lactamasas de espectro extendido (BLEE) son enzimas que tienen capacidad de hidrolizar y causar resistencia o sensibilidad disminuida a penicilinas, oximino-cefalosporinas (cefotaxima, ceftriaxona, ceftazidima y cefepima) y monobactámicos (aztreonam), pero no a cefamicinas (cefoxitina) ni a carbapenems. Generalmente son inhibidas in vitro por varios inhibidores de las β-lactamasas (por ejemplo, ácido clavulánico, tazobactam o avibactam), lo cual ayuda a diferenciarlas fenotípicamente de las β-lactamasas de tipo AmpC, que solo se inhiben por avibactam.
En la actualidad, las más frecuentes son las de tipo CTX-M. Las cepas productoras de BLEE habitualmente contienen otros genes que confieren resistencia a aminoglucósidos (sobre todo a gentamicina siendo más infrecuente a amikacina), cotrimoxazol o fluoroquinolonas, lo que limita aún más las posibilidades terapéuticas.
EpidemiologíaEn los últimos años se ha evidenciado un incremento notable en la prevalencia de Enterobacterales productores de BLEE, tanto en el ámbito hospitalario como en el comunitario. Una revisión reciente sobre aislamientos de Enterobacterales productores de BLEE en hemocultivos pediátricos a nivel mundial ha demostrado un incremento de su prevalencia del 3,5 al 8% desde 1996 hasta 201321.
La prevalencia en niños en España muestra una tendencia similar a la observada a nivel mundial. Un estudio que evaluó la epidemiología de las infecciones del tracto urinario (ITU) comunitarias en niños<14 años en España en el año 2016 objetivó una prevalencia de Enterobacterales productores de BLEE del 3,2%22. Los datos pediátricos en nuestro medio sobre infecciones no urinarias son escasos.
Entre los factores de riesgo asociados a infecciones por bacterias productoras de BLEE, destacan el ingreso hospitalario previo, cirugía o antibioterapia recientes, principalmente cefalosporinas de tercera generación, fluoroquinolonas y carbapenems, y la presencia de enfermedad crónica23. Además, la colonización por estas cepas podría incrementar el riesgo de infecciones24. Un aspecto relevante cada vez más conocido es la transmisión vertical en madres colonizadas por Enterobacterales productores de BLEE25.
TratamientoLa elección del tratamiento antibiótico está basada en el foco y gravedad de la infección, y el estado inmunológico del paciente8 (tabla 5). Tradicionalmente, los carbapenems han sido los antibióticos de elección en infecciones con este perfil de resistencia. Sin embargo, el incremento de la prevalencia de microorganismos resistentes a carbapenems ha resaltado la necesidad de definir antibióticos «ahorradores» de carbapenems que aseguren una efectividad similar sin favorecer la selección de cepas resistentes.
Tratamiento de las infecciones por Enterobacterales productores de β-lactamasas de espectro extendido
| Características de la infección | Antibióticos | |
|---|---|---|
| ITU no gravea | Aminoglucósidos, cotrimoxazol, amoxicilina-clavulánico, fosfomicina, cefoxitina o fluoroquinolonas | |
| Infecciones no gravesb | Foco de inóculo bajo-intermedioc | Piperacilina-tazobactam (dosis alta en perfusión extendida)e o ertapenem |
| Foco de inóculo altod | Meropenem, imipenem o ertapenemf | |
| Infecciones graves (sepsis grave o shock séptico) o inmunosupresión grave | Meropenem o imipenemg | |
ITU: infecciones del tracto urinario.
Fuente: Adaptada con permiso de Gutiérrez-Gutiérrez8.
Considerar paso secuencial a vía oral, según el foco de la infección, tras objetivar mejoría clínica y analítica, con cualquiera de las opciones incluidas en el tratamiento de ITU no grave.
Foco de inóculo bajo-intermedio: infección de catéter vascular y consecuente retirada; infecciones cutáneas (drenadas en el caso de presentar absceso), infecciones profundas (por ejemplo, intraabdominal) correctamente drenadas o ITU.
Foco de inóculo alto: neumonía, endocarditis, infecciones del sistema nervioso central e infecciones profundas inadecuadamente drenadas.
Aunque frecuentemente las bacterias productoras de BLEE presentan sensibilidad in vitro a piperacilina-tazobactam, se han descrito fracasos terapéuticos, sobre todo en presencia de infecciones con un alto inóculo (por ejemplo, neumonía, abscesos no drenados, etc.). Estudios observacionales han demostrado la eficacia de piperacilina-tazobactam, principalmente en infecciones con bajo inóculo, infecciones no graves y mediante la administración en perfusión extendida8.
El ensayo clínico MERINO, que evaluó en adultos la mortalidad a los 30 días del inicio de tratamiento de bacteriemias por Enterobacterales (E. coli y K. pneumoniae) resistentes a cefalosporinas de tercera generación, no demostró la no inferioridad de piperacilina-tazobactam frente a meropenem26. Sin embargo, varias limitaciones del estudio (por ejemplo, mortalidad principalmente debida a causas no infecciosas, administración de piperacilina-tazobactam mediante perfusión estándar, etc.) cuestionan la generalización de los resultados. Un subanálisis posterior demostró una mortalidad similar en el caso de bacteriemias de foco urinario e infecciones no graves, lo que coincide con lo demostrado en estudios observacionales previos8.
El uso de otros antibióticos (por ejemplo, aminoglucósidos, cotrimoxazol, amoxicilina-clavulánico, fosfomicina, cefoxitina o fluoroquinolonas) pueden ser una opción en el caso de ITU no grave, y como paso secuencial de vía intravenosa a vía oral tras el control inicial del foco infeccioso. En Enterobacterales productores de BLEE, ertapenem también es una buena alternativa a meropenem en algunos casos, al permitir disminuir la presión antibiótica sobre P.aeruginosa, además de las ventajas que conlleva su administración más espaciada.
Enterobacterales productores de AmpCLas β-lactamasas de tipo AmpC pueden ser cromosómicas (intrínsecas) o plasmídicas (adquiridas). Enterobacter spp., Citrobacter freundii complex, Serratia spp., Providencia spp., Morganella morganii y la especie recientemente denominada Klebsiella aerogenes (antes Enterobacter aerogenes) presentan constitutivamente el gen para la producción de AmpC, lo que les confiere resistencia intrínseca a ampicilina, amoxicilina-clavulánico y cefalosporinas de primera y segunda generación, si bien permanecen sensibles in vitro a cefalosporinas de tercera y cuarta generación, así como a piperacilina. Enterobacter spp. presenta el mayor riesgo de inducción de las AmpC27.
En el caso de la exposición a β-lactámicos, principalmente cefalosporinas y penicilinas, se puede producir desrepresión del gen e hiperproducción de la enzima, lo que confiriere el fenotipo característico AmpC, con resistencia a todos los β-lactámicos (salvo cefepima, carbapenémicos y las combinaciones con los nuevos inhibidores de las β-lactamasas, como ceftazidima-avibactam). Las β-lactamasas de tipo AmpC plasmídicas también pueden transferirse entre diferentes especies de Enterobacterales, incluyendo las que no producen constitutivamente AmpC.
TratamientoEn el caso de infecciones graves por microorganismos que producen AmpC, debido a la falta de evidencia suficiente, el uso de carbapenems resulta la opción más recomendable (tabla 6)27. Cuando pueda utilizarse, el tratamiento dirigido con ertapenem podría ayudar a reducir la presión antibiótica frente a P. aeruginosa. Algunos β-lactámicos no carbapenems, como cefepima o piperacilina-tazobactam, se consideran inductores débiles, por lo que pueden ser una alternativa en algunas circunstancias, mediante el uso de dosis alta y de perfusión extendida28. Se recomienda evitar el uso de piperacilina-tazobactam en infecciones con inóculo alto o con aislamientos con CMI de piperacilina-tazobactam >8mg/L, y de cefepima en aislamientos con CMI de cefepima >1mg/L29. Cefepima generalmente no es hidrolizada por las AmpC, por lo que es una excelente opción. En el tratamiento de ITU no graves podrían plantearse varias alternativas según la sensibilidad del aislamiento en el antibiograma (por ejemplo, aminoglucósidos, cotrimoxazol, fluoroquinolonas, etc.).
Tratamiento de infecciones por microorganismos con producción constitutiva o adquirida de AmpC
| Características de la infección | Antibióticos | |
|---|---|---|
| ITU no gravea,b | Aminoglucósidos, cotrimoxazol, fosfomicina o fluoroquinolonas | |
| Infecciones no gravesc | Foco de inóculo intermedio-bajoe,f | Cefepimad o piperacilina-tazobactam |
| Foco de inóculo altoe,g | Meropenem, imipenem, ertapenem o cefepimad,h | |
| Infecciones graves (sepsis grave o shock séptico) o inmunosupresión grave | Meropenem o imipenemg | |
ITU, infección del tracto urinario.
ITU no grave: no asocia sepsis, shock séptico ni otras complicaciones (por ejemplo, absceso renal).
En el caso de ITU no grave por Serratia spp, Providencia spp. o Morganella morganii, podría tratarse con cefotaxima o ceftriaxona si se confirma la sensibilidad a éstos, con una estrecha vigilancia.
Utilizar únicamente en aislamientos con CMI de cefepime ≤1mg/L. En infecciones con foco de inóculo intermedio o alto administrar cada 8 h en perfusión extendida (en 4 h).
Considerar paso secuencial a vía oral, según el foco de la infección, tras objetivar mejoría clínica y analítica, con cualquiera de las opciones incluidas en el tratamiento de ITU no grave.
El desarrollo de resistencias a los carbapenems constituye uno de los escenarios más preocupantes dentro de las resistencias a antimicrobianos, al perderse la actividad de uno de los grupos con mayor espectro. Además, frecuentemente asocian resistencia a otros grupos de antibióticos (por ejemplo, aminoglucósidos, fluoroquinolonas, etc.). En el caso de los Enterobacterales, esta resistencia suele deberse a la producción de carbapenemasas, mientras que en el caso de P. aeruginosa, en nuestro medio suele deberse a mecanismos no enzimáticos (por ejemplo, inactivación o represión de las porinas e hiperproducción de bombas de expulsión activa).
Estudios recientes realizados en Estados Unidos han demostrado un incremento en la prevalencia de infecciones por bacilos gramnegativos RC en niños: de 0% en 1999-2000 a 0,47% en 2010-2011 en el caso de Enterobacterales30, y de 9,4% en 1999 a 20% en 2012 en P. aeruginosa31.
Actualmente, España es un país de baja prevalencia de Enterobacterales RC: suponen el 4% del total de aislamientos invasivos de K. pneumoniae en el año 2017 (ECDC). La gran mayoría suceden en población adulta; en niños, ocurren principalmente en relación con brotes hospitalarios. La carbapenemasa más frecuente en España en la actualidad es la OXA-48, seguida de las metalo-β-lactamasas (MBL) y KPC32. Debido a la baja circulación de estas cepas en niños, su epidemiología no se conoce con exactitud, aunque se ha documentado un predominio de MBL tipo VIM33,34.
Las infecciones por estos microorganismos presentan mayor mortalidad3. Comparten factores de riesgo similares a los observados en los BGN productores de BLEE35.
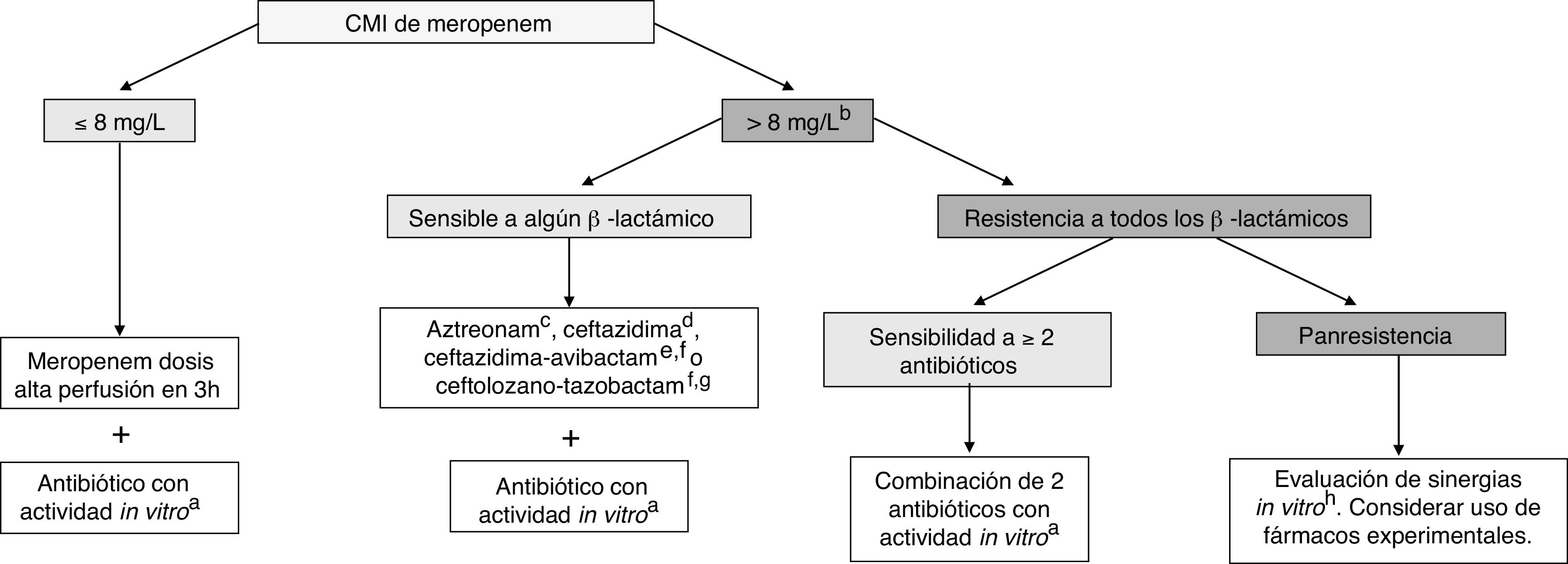
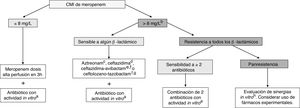
TratamientoActualmente, se recomienda tratamiento combinado con 2 o más antibióticos activos frente al microorganismo aislado en la mayoría de los casos (fig. 1). El estudio INCREMENT, realizado en adultos, propone el uso de monoterapia en infecciones con menor riesgo de gravedad36. Sin embargo, debido a múltiples aspectos, como las escalas utilizadas o el mayor desconocimiento sobre la farmacocinética/farmacodinamia de muchos antibióticos en niños, su extrapolación al paciente pediátrico resulta complicada. En la tabla 7 se presentan las posibles combinaciones según el foco de la infección. En infecciones no graves (por ejemplo, ITU sin criterios de gravedad) podría valorarse el uso de monoterapias.
Tratamiento de las infecciones por bacilos gramnegativos resistentes a carbapenems en niños.
Fuente: Adaptado de Hsu y Tamma.40.
a Posibles antibióticos: aminoglucósido, colistina, fosfomicina, fluoroquinolona o tigeciclina. Considerar el foco de la infección y la sensibilidad del aislamiento en la elección (tabla 7).
b Considerar si CMI de meropenem >4mg/L, especialmente en infecciones graves.
c Aztreonam puede utilizarse en infecciones por BGN productores de MBL (VIM, NDM o IMP) u OXA-48, si no se detecta coproducción de BLEE o AmpC; en el caso de detectarse, considerar su utilización en combinación con ceftazidima-avibactam si se demuestra sinergia in vitro.
d Ceftazidima puede utilizarse en infecciones por BGN productores de OXA-48 si no se detecta coproducción de BLEE o AmpC.
e Ceftazidima-avibactam puede utilizarse en infecciones por BGN RC no mediadas por MBL.
f Actualmente, ceftazidima-avibactam o ceftolozano-tazobactam, debido a su uso off-label en niños, debería ser limitado a infecciones graves en las que el microorganismo aislado no presente sensibilidad in vitro a otros β-lactámicos, o a infecciones por microorganismos panresistentes. Datos procedentes de adultos sugieren que el tratamiento combinado no es necesario cuando se usan los nuevos β-lactámicos-inhibidores de las β-lactamasas.
g Ceftolozano-tazobactam puede utilizarse en infecciones por P. aeruginosa RC no mediada por carbapenemasas.
h Posibles sinergias in vitro documentadas, pero con poca experiencia clínica: ceftazidima-avibactam+aztreonam, meropenem+ertapenem, meropenem+fosfomicina, ceftazidima-avibactam+fosfomicina.
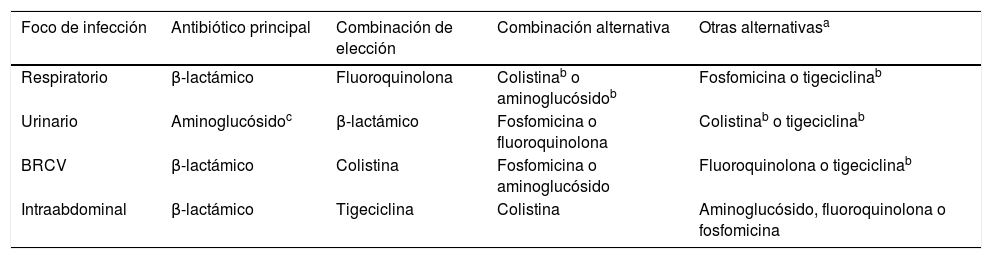
Antibióticos en infecciones por bacilos gramnegativos resistentes a carbapenems según el foco de la infección
| Foco de infección | Antibiótico principal | Combinación de elección | Combinación alternativa | Otras alternativasa |
|---|---|---|---|---|
| Respiratorio | β-lactámico | Fluoroquinolona | Colistinab o aminoglucósidob | Fosfomicina o tigeciclinab |
| Urinario | Aminoglucósidoc | β-lactámico | Fosfomicina o fluoroquinolona | Colistinab o tigeciclinab |
| BRCV | β-lactámico | Colistina | Fosfomicina o aminoglucósido | Fluoroquinolona o tigeciclinab |
| Intraabdominal | β-lactámico | Tigeciclina | Colistina | Aminoglucósido, fluoroquinolona o fosfomicina |
BRCV: bacteriemia relacionada con el catéter vascular.
Se utilizarán los antibióticos en la siguiente tabla siguiendo el algoritmo de la figura 1, teniendo en cuenta la sensibilidad del aislamiento in vitro. Se recomienda siempre consultar con un experto.
En el tratamiento de infecciones intraabdominales, con la excepción de tigeciclina o meropenem, el resto de los antibióticos deberán combinarse con un antibiótico con actividad anaerobicida (por ejemplo, metronidazol).
El uso de pautas optimizadas de meropenem (a doble dosis en perfusión extendida) posibilita alcanzar los objetivos farmacodinámicos en el caso de aislamientos con una CMI de meropenem ≤8mg/L37, y ha demostrado una eficacia adecuada en estudios observacionales38,39. Por ello, consideramos que es actualmente el tratamiento de elección en combinación con un segundo antibiótico activo in vitro7,40. En el caso de aislamientos con CMI de meropenem >8mg/L, la alternativa de elección sería un β-lactámico activo basado en los resultados del antibiograma interpretado. En el caso de no disponer de ninguno que preserve actividad frente al aislamiento, otras alternativas podrían ser colistina, aminoglucósidos, fosfomicina, fluoroquinolonas o tigeciclina.
Las nuevas combinaciones de β-lactámicos-inhibidores de las β-lactamasas comercializadas en España (cefazidima-avibactam y ceftolozano-tazobactam) carecen de aprobación en edad pediátrica en la actualidad. Sin embargo, estudios en fase II han demostrado su seguridad y eficacia en niños: ceftazidima-avibactam ha sido recientemente aprobada por la Food and Drug Administration en mayores de 3 meses de edad. Por tanto, su uso off-label podría contemplarse en el caso de aislamientos con CMI de meropenem>8mg/L y demostrada sensibilidad al antibiótico, priorizándose su uso en el caso de infecciones graves. Ceftazidima-avibactam presenta actividad frente a cepas productoras de carbapenemasas tipo OXA-48 y KPC, pero no frente a MBL, mientras que ceftolozano-tazobactam es inactivo frente a todos los tipos de carbapenemasas y activo frente a P. aeruginosa con resistencia a carbapenems no mediada por carbapenemasas.
En el caso de aislamientos extremadamente resistentes, con escasas opciones terapéuticas, se recomienda el estudio de posibles sinergias por el laboratorio de microbiología (por ejemplo, aztreonam-avibactam, meropenem-ertapenem, meropenem-fosfomicina)7. La combinación de aztreonam con avibactam (actualmente con ceftazidima-avibactam, al no estar comercializada todavía la combinación) ha demostrado su eficacia en cepas productoras de MBL resistentes a aztreonam. Por ello, podría ser una alternativa frente a este tipo de carbapenemasas en el caso de no disponer de otras opciones terapéuticas7.
Aunque la evidencia actual sobre el uso de antibióticos inhalados (por ejemplo, colistina o tobramicina) es limitada, podría considerarse su uso como tratamiento complementario al antibiótico sistémico en las infecciones pulmonares por BGN RC.
ConclusiónEn los últimos años se ha evidenciado un incremento progresivo en la incidencia de infecciones por BMR, cuyo tratamiento supone un reto importante. Para hacer frente a este problema, es fundamental establecer programas de optimización en el uso de antimicrobianos, realizar una vigilancia epidemiológica activa y desarrollar una adecuada política de control de infecciones. La escasez de opciones terapéuticas, incrementadas en el paciente pediátrico por la falta de ensayos clínicos, dificulta la elección de un tratamiento efectivo. El desarrollo de nuevos antibióticos va a permitir mejorar el pronóstico asociado a estas infecciones. Sin embargo, el uso prudente es un aspecto primordial para preservar su actividad.
FinanciaciónEste documento ha sido parcialmente financiado por el Fondo de Investigaciones Sanitarias, Instituto de Salud Carlos III (ISCIII), cofinanciado por el Fondo Europeo de Desarrollo Regional (FEDER), a través del Contrato Río Hortega de DAA (CM18/00100).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen la revisión del manuscrito a Natalia Mendoza Palomar (Unitat de Patologia Infecciosa i Immunodeficiències de Pediatria, Hospital Universitari Vall d’Hebron), M. Nieves Larrosa Escartín (Servei de Microbiologia, Hospital Universitari Vall d’Hebron), Silvia Manrique Rodríguez (Servicio de Farmacia, Hospital General Universitario Gregorio Marañón), Cecilia M. Fernández-Llamazares (Servicio de Farmacia, Hospital General Universitario Gregorio Marañón), Montserrat Giménez Pérez (Servicio de Microbiologia, Hospital Universitario Germans Trias i Pujol) y a Emilio Cendejas (Servicio de Microbiología y Parasitología, Hospital Universitario La Paz).