Investigar la relación entre densidad mineral ósea (DMO), edad, sexo, medidas antropométricas, ingesta dietética de calcio y actividad física diaria en niños prepúberes con fractura de antebrazo distal (FAD).
Material y métodosCiento sesenta niños (80 varones y 80 mujeres) de 3 a 10 años de edad con FAD y grupo control de 160 niños (pareados por edad y sexo). Se documentaron edad, sexo, peso, talla, pliegue tricipital (PT), índice de masa corporal (IMC), ingesta diaria de calcio y nivel de actividad física (ejercicio físico extraescolar: bajo si <1h/día, alto si >1h/día). La DMO se evaluó por densitómetro periférico DXA.
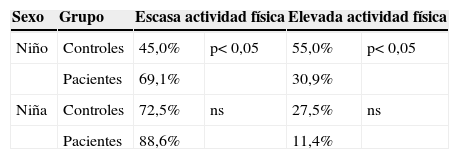
ResultadosEl trauma por precipitación leve-moderado (85,6%) fue el causante de la mayoría de las fracturas (fractura del radio en la mayoría de ellas [87,5%]). El IMC fue mayor en los pacientes (19,14kg/m2±3,50 versus 17,46kg/m2±2,67; p<0,0001). El grosor del PT fue similar en ambos grupos (20,28mm±8,24 versus 19,61mm±6,60; p>0,05). La actividad física estaba disminuida en el grupo de fracturados (actividad física extraescolar >1h: el 21,25 versus el 46,87%; p< 0,001). La ingesta diaria de calcio no estuvo asociada con mayor incidencia de FAD (918,75mg/día±338,04 versus 886,13mg/día±382,77; p>0,05). La DMO fue menor en los fracturados (0,2591g/cm2±0,0413 versus 0,2801g/cm2±0,0300; p<0,0001).
DiscusiónUna significativa reducción de la DMO, el sobrepeso y la escasa actividad física son factores de riesgo potencial para la FAD; la escasa ingesta dietética de calcio no se encuentra asociada. Las intervenciones en el estilo de vida pueden contribuir a reducir el riesgo de FAD en la infancia.
To investigate the relationship between bone mineral density (BMD), age, sex, anthropometric measurements, dietary calcium intake and daily physical activity, in prepubertal children with distal forearm fracture (DFF).
Methods160 children (80 males, 80 females) 3–10 years of age with DFF; control group of 160 children (age-sex matched) were studied. Age, sex, weight, height, tricipital skin fold thickness (TS), body mass index, daily calcium intake, and level of physical activity (extra-school physical exercise: low <1hour/day, high >1hour/day) registered. BMD assessed by peripheral DXA densitometer.
ResultsMost fractures were caused by mild-moderate precipitating trauma by accidental fall (85.6%), with radius fracture in most cases (87.5%). BMI was higher in patients (19.14kg/m2±3.50 vs. 17.46kg/m2±2.67; p<0.0001). TS thickness was similar in both groups (20.28mm±8.24 vs. 19.61mm±6.60; p>0.05). Physical activity was lower in study group (extra-school physical activity >1h: 21.25% vs. 46.87%; p<0.001). Daily calcium intake was not associated with DFF incidence (918.75mg/day±338.04 vs. 886.13mg/day±382.77; p>0.05). BMD was lower in fractured children (0.2591g/cm2±0.0413 vs. 0.2801g/cm2±0.0300; p<0.0001)
SummaryOur results suggest that significantly reduced bone mineral density, overweight and low physical activity are potential risk factors for fracture of the distal forearm, whilst low dietary intakes of calcium do not seem to be associated.
The current epidemic of infantile overweight might explain the increased incidence of fractures of the distal forearm.
El antebrazo distal es el sitio más frecuente de fractura durante la infancia y las fracturas en esta localización (fracturas de antebrazo distal [FAD]) están en aumento1,2. De manera similar, ha habido un incremento del número de niños diagnosticados de sobrepeso en los países desarrollados, incremento que ha sido mayor del 30% en las últimas 2 décadas3,4, por lo que puede pensarse que existe asociación entre ambos factores.
Las fracturas en edades avanzadas de la vida se asocian con reducción de la masa ósea; sin embargo, se suele pensar que las fracturas en los niños sólo reflejan el hecho de que las caídas son frecuentes en la infancia5. Existe evidencia indirecta de que la masa ósea puede influenciar el riesgo de fracturas en niños y adolescentes cuando se analiza la ingesta de calcio. Estos estudios han demostrado que los niños que evitan beber leche de vaca tienen mayor riesgo para las fracturas óseas prepuberales6,7. Es bien sabido que la ingesta dietética de calcio y el nivel de actividad física podrían influir en el desarrollo mineral óseo8. Hay evidencias que relacionan potentemente la inactividad física con el aumento de la prevalencia de osteoporosis. Cada vez es más aceptado que las raíces de la osteoporosis del adulto nacen en la infancia. Se argumenta que de todos los factores de vida modificables que influyen en el hueso, el ejercicio habitual durante el crecimiento tiene la mayor capacidad de reducir el problema público de salud que suponen las fracturas patológicas relacionadas con la osteoporosis9. Se ha documentado mejoría en la masa ósea femoral y lumbar entre el 1 y el 3% en los niños que completaron programas de ejercicio simples y diversos durante 10 a 20 min 3 veces por semana8–11.
La conferencia de consenso del National Institutes of Health (NIH) del año 2000 sobre prevención, diagnóstico y tratamiento de osteoporosis señaló la acreción mineral ósea durante la infancia como un determinante crítico de riesgo de osteoporosis en edades tardías de la vida12. Hay, por tanto, gran interés en aumentar la densidad mineral ósea (DMO) durante la infancia y la adolescencia con el objetivo de prevenir la osteoporosis tardía.
El propósito de este estudio es investigar la relación entre sobrepeso, ingesta dietética de calcio, nivel de actividad física y DMO en la población pediátrica con FAD comparada con el grupo control sin fracturas.
Material y métodosSe seleccionaron niños y niñas de 3 a 10 años con diagnóstico clínico y radiológico de FAD realizado en nuestro centro hospitalario. Todos los del grupo control asistían a una escuela pública aleatorizadamente elegida en un área de clase media económica de nuestra ciudad para que los resultados pudieran representar la población de referencia de nuestro hospital. Las medidas antropométricas del grupo control se realizaron en el colegio durante el horario de 8.00 a 14.00. Se calculó un tamaño muestral de 20 niños por año de edad; por tanto, se incluyó un total de 160 niños (80 niños y 80 niñas) con FAD con el mismo número y distribución etaria para el grupo control. Los criterios de inclusión fueron población mediterránea, raza caucásica, sin desarrollo puberal o en estadio prepuberal, sin enfermedades de relevancia, principalmente las relacionadas con el metabolismo óseo, y sin haber recibido ningún tratamiento que interfiera la mineralización ósea (p. ej. esteroides). El estado prepuberal se definió, según la estadificación de Tanner, como telarquia i para las niñas y volumen testicular menor de 4ml para los niños. Cuando se clasificaron de acuerdo con el índice de masa corporal (IMC), se consideró sobrepeso cuando fue superior al percentil 85 para la edad comparado con los percentiles de IMC de las tablas de referencia nacionales13.
El Comité de Ética del Hospital aprobó el estudio y en todos los casos se obtuvo consentimiento informado de los padres o tutores.
Las variables analizadas fueron sexo; peso (kg); talla (cm); IMC (kg/m2); grosor del pliegue tricipital (PT) (mm); ingesta dietética de calcio (mg/día); evaluación de la actividad física extraescolar valorada por los padres, y DMO (g/cm2) por medición periférica en el antebrazo distal mediante absorciometría radiográfica de energía dual (DXA) con el densitómetro periférico PIXI (Lunar Corporation).
La actividad física se valoró mediante un cuestionario que completaron los padres. El cuestionario permitió evaluar la actividad física extraescolar en las que el niño tomaba parte en una semana representativa de su actividad habitual en un puntaje de 0 (menos de 15min), 1 (15–29min), 2 (30–59min), 3 (1–2h) y 4 (más de 2h). Los niños que no realizaban ejercicio o lo hacían menos de 3 h a la semana se clasificaron como de escasa actividad física y los que practicaban más de 3 h a la semana se consideraron de elevada actividad física.
La ingesta dietética de calcio se cuantificó en mg/día por estimación de los derivados lácteos ingeridos diariamente, de acuerdo con las preguntas respondidas en el cuestionario de frecuencia alimentaria.
La valoración de la DMO medida en el antebrazo distal con densitómetro periférico PIXI permite obtener una evaluación precisa de la DMO con excelente resolución de imagen en sólo 5 s; además, por sus reducidas dimensiones y su peso menor de 27kg lo hacen adecuado para la medida de la DMO de forma ambulatoria. Las mediciones se efectuaron en el brazo no dominante en los controles y en el brazo no fracturado en el grupo de estudio dentro de los 3 meses siguientes a la fractura.
Análisis estádísticoEmpleamos el programa SPSS versión 13.0. Se realizó inicialmente un análisis estadístico descriptivo de la muestra, seguido de un test t de Student para la comparación de las variables cuantitativas entre los casos y los controles y un test de Chi cuadrado de Pearson o el estadístico exacto de Fisher para los parámetros cualitativos. Se aplicaron técnicas de regresión lineal múltiple para establecer un modelo que expresara los valores de DMO en función de la edad, el sexo, el peso, la talla, el grosor de PT, el IMC, la ingesta diaria de calcio y el ejercicio físico. Finalmente, se calculó para cada niño una puntuación puntuación estandarizada y normalizada (z-score) de IMC utilizando poblaciones de niñas y niños sin fracturas como grupo de referencia. Se consideró una p<0,05 como estadísticamente significativa.
ResultadosNo hubo diferencia estadísticamente significativa en la incidencia de fracturas entre el brazo derecho y el izquierdo (el 53,1 y el 46,9%). En el 85,6%, la causa fue por caída accidental mientras corría, caminaba o escalaba. El radio fue el hueso que se fracturó con más frecuencia (87,5%), seguido del cúbito y el radio juntos (10%) y del cúbito solo (2,5%).
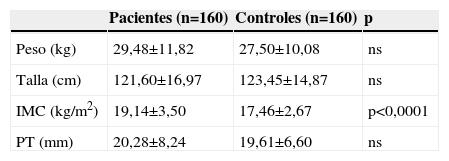
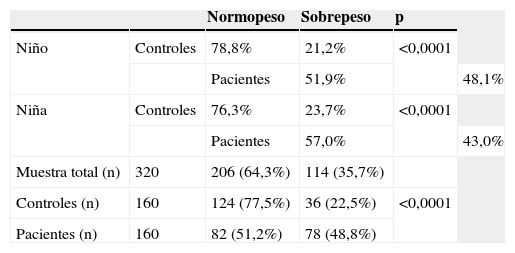
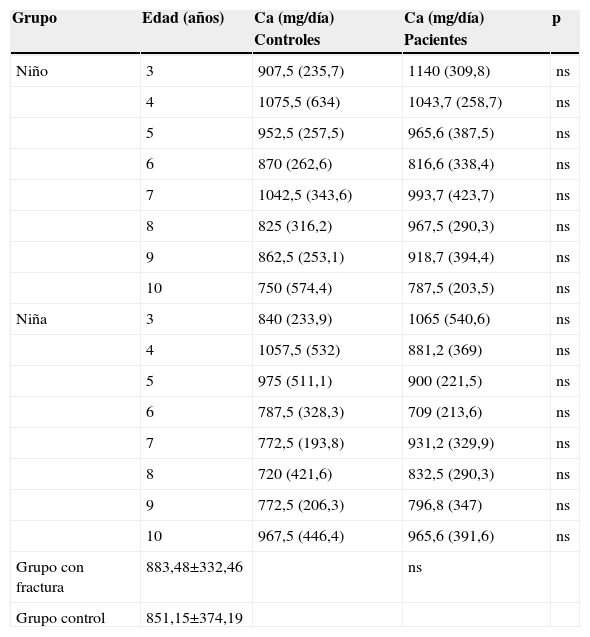
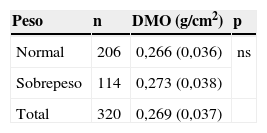
No hubo diferencias estadísticamente significativas en peso, talla y grosor de PT entre ambos grupos. El IMC fue mayor en el grupo de estudio que en el control (tablas 1 y 2). De los 320 participantes, 206 (64,3%) tenían peso en rango normal. En el grupo control, el 77,5% tenía peso normal frente al 51,2% del grupo de fracturados (tabla 3). Se apreció sobrepeso en el 22,6% de los componentes del grupo control (17 niños y 19 niñas) y en el 48,8% del grupo de estudio (40 niños y 38 niñas) (p<0,0001). La ingesta de calcio dietética total no evidenció diferencias significativas entre ambos grupos, ni cuando se separaron por edad ni por sexo (tabla 4).
Peso, talla, índice de masa corporal y grosor del pliegue tricipital en pacientes (fracturados) y controles (no fracturados). Media y desviación estándar
| Pacientes (n=160) | Controles (n=160) | p | |
| Peso (kg) | 29,48±11,82 | 27,50±10,08 | ns |
| Talla (cm) | 121,60±16,97 | 123,45±14,87 | ns |
| IMC (kg/m2) | 19,14±3,50 | 17,46±2,67 | p<0,0001 |
| PT (mm) | 20,28±8,24 | 19,61±6,60 | ns |
IMC: índice de masa corporal; PT: pliegue tricipital.
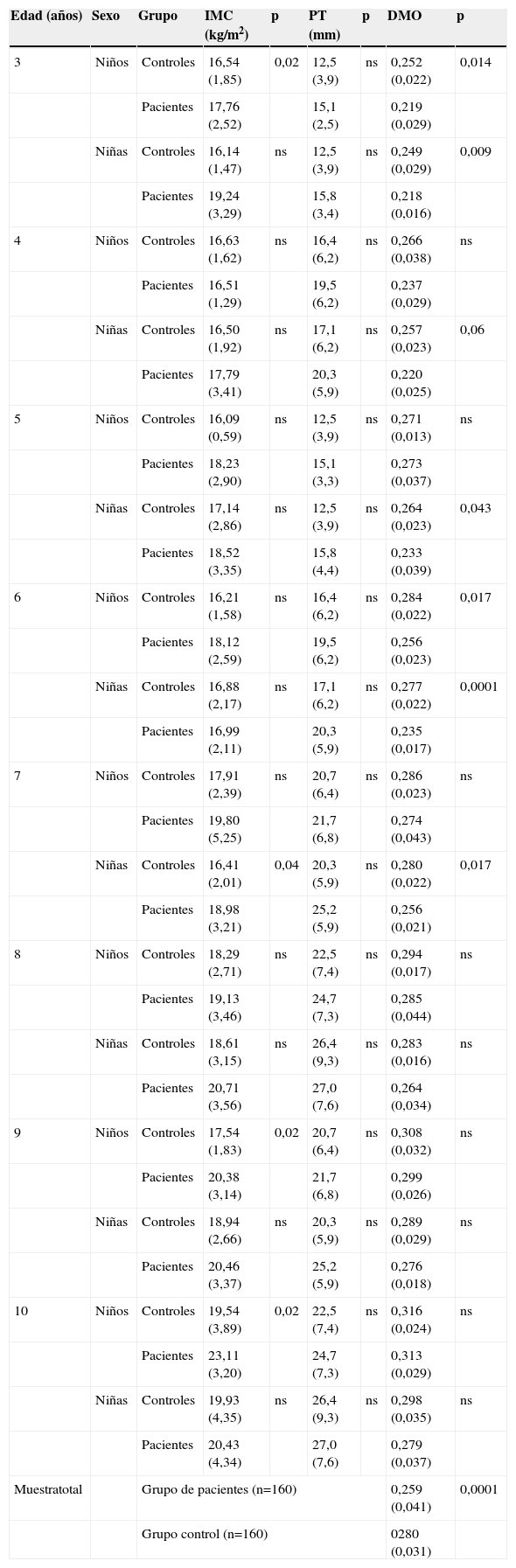
Índice de masa corporal, grosor del pliegue tricipital y densidad mineral ósea de acuerdo con la edad y sexo en controles y pacientes
| Edad (años) | Sexo | Grupo | IMC (kg/m2) | p | PT (mm) | p | DMO | p |
| 3 | Niños | Controles | 16,54 (1,85) | 0,02 | 12,5 (3,9) | ns | 0,252 (0,022) | 0,014 |
| Pacientes | 17,76 (2,52) | 15,1 (2,5) | 0,219 (0,029) | |||||
| Niñas | Controles | 16,14 (1,47) | ns | 12,5 (3,9) | ns | 0,249 (0,029) | 0,009 | |
| Pacientes | 19,24 (3,29) | 15,8 (3,4) | 0,218 (0,016) | |||||
| 4 | Niños | Controles | 16,63 (1,62) | ns | 16,4 (6,2) | ns | 0,266 (0,038) | ns |
| Pacientes | 16,51 (1,29) | 19,5 (6,2) | 0,237 (0,029) | |||||
| Niñas | Controles | 16,50 (1,92) | ns | 17,1 (6,2) | ns | 0,257 (0,023) | 0,06 | |
| Pacientes | 17,79 (3,41) | 20,3 (5,9) | 0,220 (0,025) | |||||
| 5 | Niños | Controles | 16,09 (0,59) | ns | 12,5 (3,9) | ns | 0,271 (0,013) | ns |
| Pacientes | 18,23 (2,90) | 15,1 (3,3) | 0,273 (0,037) | |||||
| Niñas | Controles | 17,14 (2,86) | ns | 12,5 (3,9) | ns | 0,264 (0,023) | 0,043 | |
| Pacientes | 18,52 (3,35) | 15,8 (4,4) | 0,233 (0,039) | |||||
| 6 | Niños | Controles | 16,21 (1,58) | ns | 16,4 (6,2) | ns | 0,284 (0,022) | 0,017 |
| Pacientes | 18,12 (2,59) | 19,5 (6,2) | 0,256 (0,023) | |||||
| Niñas | Controles | 16,88 (2,17) | ns | 17,1 (6,2) | ns | 0,277 (0,022) | 0,0001 | |
| Pacientes | 16,99 (2,11) | 20,3 (5,9) | 0,235 (0,017) | |||||
| 7 | Niños | Controles | 17,91 (2,39) | ns | 20,7 (6,4) | ns | 0,286 (0,023) | ns |
| Pacientes | 19,80 (5,25) | 21,7 (6,8) | 0,274 (0,043) | |||||
| Niñas | Controles | 16,41 (2,01) | 0,04 | 20,3 (5,9) | ns | 0,280 (0,022) | 0,017 | |
| Pacientes | 18,98 (3,21) | 25,2 (5,9) | 0,256 (0,021) | |||||
| 8 | Niños | Controles | 18,29 (2,71) | ns | 22,5 (7,4) | ns | 0,294 (0,017) | ns |
| Pacientes | 19,13 (3,46) | 24,7 (7,3) | 0,285 (0,044) | |||||
| Niñas | Controles | 18,61 (3,15) | ns | 26,4 (9,3) | ns | 0,283 (0,016) | ns | |
| Pacientes | 20,71 (3,56) | 27,0 (7,6) | 0,264 (0,034) | |||||
| 9 | Niños | Controles | 17,54 (1,83) | 0,02 | 20,7 (6,4) | ns | 0,308 (0,032) | ns |
| Pacientes | 20,38 (3,14) | 21,7 (6,8) | 0,299 (0,026) | |||||
| Niñas | Controles | 18,94 (2,66) | ns | 20,3 (5,9) | ns | 0,289 (0,029) | ns | |
| Pacientes | 20,46 (3,37) | 25,2 (5,9) | 0,276 (0,018) | |||||
| 10 | Niños | Controles | 19,54 (3,89) | 0,02 | 22,5 (7,4) | ns | 0,316 (0,024) | ns |
| Pacientes | 23,11 (3,20) | 24,7 (7,3) | 0,313 (0,029) | |||||
| Niñas | Controles | 19,93 (4,35) | ns | 26,4 (9,3) | ns | 0,298 (0,035) | ns | |
| Pacientes | 20,43 (4,34) | 27,0 (7,6) | 0,279 (0,037) | |||||
| Muestratotal | Grupo de pacientes (n=160) | 0,259 (0,041) | 0,0001 | |||||
| Grupo control (n=160) | 0280 (0,031) | |||||||
Media y desviación estándar.
DMO: densidad mineral ósea; IMC: índice de masa corporal; ns: diferencia no significativa; PT: pliegue tricipital.
Porcentajes de sobrepeso y normopeso de acuerdo con el sexo y el grupo
| Normopeso | Sobrepeso | p | ||
| Niño | Controles | 78,8% | 21,2% | <0,0001 |
| Pacientes | 51,9% | 48,1% | ||
| Niña | Controles | 76,3% | 23,7% | <0,0001 |
| Pacientes | 57,0% | 43,0% | ||
| Muestra total (n) | 320 | 206 (64,3%) | 114 (35,7%) | |
| Controles (n) | 160 | 124 (77,5%) | 36 (22,5%) | <0,0001 |
| Pacientes (n) | 160 | 82 (51,2%) | 78 (48,8%) |
Ingesta de calcio diaria (mg/día) de acuerdo con la edad, sexo y grupo
| Grupo | Edad (años) | Ca (mg/día) Controles | Ca (mg/día) Pacientes | p |
| Niño | 3 | 907,5 (235,7) | 1140 (309,8) | ns |
| 4 | 1075,5 (634) | 1043,7 (258,7) | ns | |
| 5 | 952,5 (257,5) | 965,6 (387,5) | ns | |
| 6 | 870 (262,6) | 816,6 (338,4) | ns | |
| 7 | 1042,5 (343,6) | 993,7 (423,7) | ns | |
| 8 | 825 (316,2) | 967,5 (290,3) | ns | |
| 9 | 862,5 (253,1) | 918,7 (394,4) | ns | |
| 10 | 750 (574,4) | 787,5 (203,5) | ns | |
| Niña | 3 | 840 (233,9) | 1065 (540,6) | ns |
| 4 | 1057,5 (532) | 881,2 (369) | ns | |
| 5 | 975 (511,1) | 900 (221,5) | ns | |
| 6 | 787,5 (328,3) | 709 (213,6) | ns | |
| 7 | 772,5 (193,8) | 931,2 (329,9) | ns | |
| 8 | 720 (421,6) | 832,5 (290,3) | ns | |
| 9 | 772,5 (206,3) | 796,8 (347) | ns | |
| 10 | 967,5 (446,4) | 965,6 (391,6) | ns | |
| Grupo con fractura | 883,48±332,46 | ns | ||
| Grupo control | 851,15±374,19 |
Ca: calcio; ns: diferencia no significativa.
Al analizar la actividad física extraescolar diaria en ambos grupos, se encontró predominio de escasa actividad física tanto en niños como en niñas (tabla 5).
Se comprobó un constante incremento en la DMO respecto a la edad en ambos sexos, mayor en niños que en niñas en todos los grupos. La DMO fue estadísticamente mayor en el grupo control, con diferencias significativas en las niñas a las edades de 3, 4, 5, 6 y 7 años, y en los niños a las edades de 3 y 6 años. Sin considerar sexo ni edad, la DMO fue menor en el grupo de fracturados que en los controles (tabla 2).
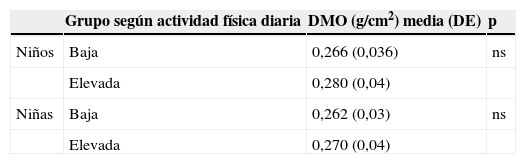
No hubo diferencia significativa en la DMO en relación con el nivel de actividad física extraescolar, ni en los niños ni en las niñas (tabla 6), ni al comparar los pacientes con sobrepeso y normopeso (tabla 7).
Densidad mineral ósea en relación con la actividad física diaria de acuerdo con el sexo
| Grupo según actividad física diaria | DMO (g/cm2) media (DE) | p | |
| Niños | Baja | 0,266 (0,036) | ns |
| Elevada | 0,280 (0,04) | ||
| Niñas | Baja | 0,262 (0,03) | ns |
| Elevada | 0,270 (0,04) |
DE: desviación estándar; DMO: densidad mineral ósea; ns: diferencia no significativa.
Al realizar el análisis de regresión múltiple lineal para expresar la DMO en función de todas las variables analizadas, encontramos que 3 son las variables que explican el 38,8% de la variabilidad de la DMO (coeficiente de correlación múltiple-R-de 0,623 y coeficiente de determinación-R2-de 0,388): edad (directamente proporcional, p<0,0001), sexo (mayor en niños, p<0,0001) y actividad física diaria (directamente proporcional, p<0,025).
DiscusiónNumerosas publicaciones indican que el antebrazo distal es el sitio más frecuente de fractura en la población en edad de crecimiento1,2. Nuestro estudio mostró que la mayoría de las FAD ocurrieron durante el juego o en deportes como resultado de un trauma precipitante leve o moderado más que por un trauma grave. Es probable que existan cambios esqueléticos en ciertas zonas específicas, como el antebrazo distal, que facilitarán la mayor incidencia de estas fracturas, aunque probablemente sean varios los factores de riesgo. En opinión de algunos autores, la mayoría de la fragilidad esquelética se podría explicar por un déficit en el crecimiento óseo transversal junto con un rápido crecimiento longitudinal3,4. No encontramos diferencias estadísticamente significativas en los resultados de las variables antropométricas de peso, talla y grosor de PT entre casos y controles. Sin embargo, debe señalarse el alto porcentaje de sobrepeso, tanto en el grupo de estudio como en el de control. Se observó mayor tasa de sobrepeso en las niñas al compararlas con los niños en ambos grupos, probablemente en relación con el menor nivel de actividad física. La asociación de sobrepeso con FAD es de gran interés, dado el actual aumento de la obesidad en la infancia y adolescencia en muchas partes del mundo5. Existe, por tanto, asociación entre sobrepeso y FAD, ya que el porcentaje con fracturas es el doble que en el grupo de control, con diferencias estadísticamente significativas. Estudios recientes han hecho hincapié en la mayor prevalencia de sobrepeso en niños con FAD, comparado con los niños sin fracturas6,14. En contraste con nuestro estudio y el de otros autores6,14, Ma y Jones15 describieron niñas de 9–19 años con fracturas de miembro superior que presentaban menor IMC y masa magra que los controles. Estos autores concluyeron que la masa ósea aumenta proporcionalmente con la masa magra, debido a que la mayoría de la carga ósea se debe a fuerzas musculares; probablemente, una escasa masa ósea se correlaciona con una escasa masa magra. La mayor tendencia de los niños con sobrepeso para fracturar sus huesos se puede atribuir, al menos parcialmente, a que son huesos adaptados para cargas musculares y no para cargas estáticas como es el peso corporal16, y también al hecho de que los niños con sobrepeso se caen con más fuerza que los delgados17. Goulding18 estudió niños con fracturas repetidas de antebrazo y no encontró menor puntuación estandarizada y normalizada (z-score) de masa magra, lo que indicaría que la inherente debilidad muscular podría explicar su contenido mineral óseo reducido. Se ha comprobado que los sujetos con sobrepeso tienen proporcionalmente menor cantidad de hueso para su peso corporal que los que tienen normopeso19. Por tanto, parece que un elevado peso corporal se relaciona con mayor vulnerabilidad para fractura ósea tras una caída.
La ingesta media de calcio fue similar en ambos grupos, tanto expresado por sexo como por edad. Estos resultados concuerdan con los de otros autores6,20 y podemos considerar que la ingesta de calcio en nuestra cohorte no se relaciona con el riesgo de fractura, probablemente porque la media de ingesta diaria de calcio registrada es suficiente para prevenir efectos deletéreos en el hueso. Se ha propuesto que una escasa ingesta de calcio podría ser causante del incremento significativo en la incidencia de fracturas en la población pediátrica6; sin embargo, estudios observacionales sobre la relación entre ingesta de calcio y ganancia de DMO han arrojado resultados equívocos21,22. De todas formas, está claro que el aumento de la ingesta de calcio mejora la ganancia de masa ósea antes y después de la pubertad23.
Los niveles más bajos de actividad física se dieron en el grupo con fracturas. Este escaso nivel de ejercicio podría afectar a factores como el balance y la coordinación motora con riesgo consecuente de caída24. El aumento del IMC podría resultar en una desventaja mecánica durante la caída. Además, es probable que el sobrepeso también impacte negativamente en la actividad física, reduciendo el estímulo anabólico sobre el hueso.
La tendencia a mayor actividad física en los niños sin fractura ósea se mantuvo en todos los grupos de edad, con la excepción de los de 6 años, en los que no hubo diferencia. Está bien documentado que la actividad física de los jóvenes con carga ósea intermitente es fuertemente osteogénica, especialmente antes de la pubertad25, y que el ejercicio físico regular ocupa un lugar crítico para maximizar la masa ósea. Cuando se evaluaron los 2 grupos de acuerdo con el sexo, observamos una clara prevalencia de niñas con menor nivel de actividad física en ambos grupos. Manias encontró niveles similares de actividad física en niños con fracturas únicas y en niños sin fracturas, mientras que los que presentaban fracturas recurrentes tenían menor actividad física24. Clark ha estudiado la relación entre parámetros de masa ósea medida por DXA en niños, y encontró mayor masa ósea y mayor riesgo de fractura en aquéllos con actividad física vigorosa; sin embargo, la mayor masa ósea asociada con el aumento de actividad probablemente no compense el riesgo causado por el aumento de la exposición a caídas26.
En nuestro estudio elegimos el brazo no dominante basándonos en que no existen diferencias significativas en la DMO entre ambos brazos en chicas jóvenes deportistas27, lo que indica que las fuerzas impuestas en los brazos con entrenamiento gimnástico aumentan la DMO sin apreciar diferencias en ambos brazos. Estos hallazgos indican que los valores elevados de DMO observados en gimnastas se deben principalmente a la actividad en sí misma más que a una tendencia a la selección. El estudio de Min en población coreana no mostró diferencia lateral para el radio distal, mientras que sí existía diferencia significativa para el calcáneo, y afirmaba que estos datos permiten recomendar una medición ósea en el radio distal durante los estudios comunitarios clínicos28. En sujetos jóvenes no deportistas probablemente exista mayor DMO en el brazo dominante27 pero no hay datos que justifiquen, al menos en el niño pequeño, la medida de DMO en el brazo dominante o no dominante.
En nuestro estudio hubo evidencia de un aumento constante en la DMO del antebrazo con la edad en ambos sexos. La DMO del antebrazo fue mayor en niños que en niñas en todos los grupos de edad estudiados, tanto en controles como en los sujetos con FAD. Los niños con FAD tenían menor DMO en el antebrazo (0,259g/cm2) que los controles (0,280g/cm2) (p<0,0001). Estos resultados indican que la DMO disminuida puede ser un riesgo de fractura en la infancia, de acuerdo con el estudio de Goulding18, que demostró que la FAD aumenta a medida que la DMO disminuye en el radio ultradistal.
Ninguna medida simple de densidad ósea se ha mostrado, de forma consistente, como la mejor predictora de riesgo de fractura en niños. En algunos estudios, el contenido mineral total corporal (CMTC) tras ajuste por talla, peso, edad y sexo tiene la mayor asociación con el riesgo de fractura. Clark7 documentó un aumento del 89% en el riesgo de fractura para cada descenso de una desviación estándar en el CMTC ajustado; sin embargo, Goulding6 encontró que la DMO y la densidad aparente mineral ósea, pero no el CMTC, se correlacionaban inversamente con el riesgo de fractura; otro estudio de casos y controles llevado a cabo por Jones et al29 descartó la asociación del CMTC y el riesgo de fractura. Esta discrepancia puede explicarse por el efecto de una mayor variación en el CMTC, que lleva a un debilitamiento de la predicción de fractura. Aun con limitaciones, la investigación de la DMO puede considerarse como una medida útil para evaluar el riesgo de fractura, al no requerir ajuste o manipulación30, aunque el valor predictivo sería más fuerte en caso de fracturas clínicamente significativas, como en el caso de la fractura de un hueso largo de extremidad inferior o 2 o más fracturas de un hueso largo de extremidad superior.
Los datos de nuesto estudio con evidencia de menor DMO en el grupo de fracturados que en el grupo control están de acuerdo con estudios en adultos31,32. Sin embargo, aunque los adultos con fracturas tienden a ser más ligeros que los individuos sin fracturas33, nuestos resultados muestran que una elevada proporción de niños y niñas con FAD tiene sobrepeso. Es probable que la inactividad pueda haber contribuido a la disminución de la DMO en estos pacientes. Otros autores han comprobado en niños con sobrepeso mayor incidencia de fracturas, aunque con DMO no disminuida34. No está claro si esto está causado por insuficiente DMO relacionada con IMC o por otros factores, como coordinación motora disminuida o patrones de actividad física alterados.
Podemos concluir que en una población pediátrica de 3 a 10 años el 45,6% de los niños con FAD tiene sobrepeso, practican menos actividad física diaria y tienen una menor DMO, mientras que el 22,5% de los niños sin fracturas presenta sobrepeso. La ingesta de calcio fue similar en ambos grupos. La DMO está directamente correlacionada con la edad, el sexo y la actividad física diaria; estas variables explican el 38,8% de la variabilidad de la DMO.
Hace algunas décadas se asumía que las fracturas de los niños eran una consecuencia inevitable del crecimiento, pero actualmente podemos decir que probablemente un buen número de fracturas pueden prevenirse al corregir factores de estilo de vida.