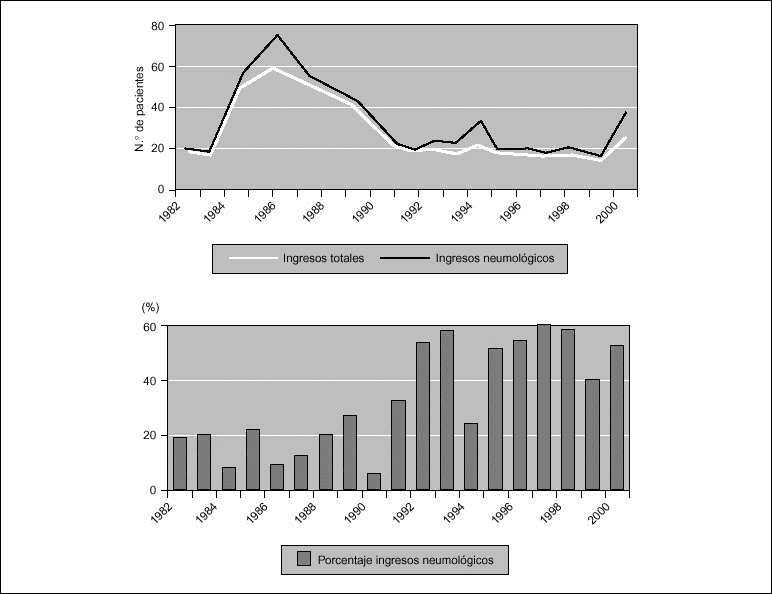
Introducción
El diagnóstico de las enfermedades pulmonares intersticiales (EPI) en la infancia constituye un verdadero reto para el neumólogo infantil. Las EPI son poco frecuentes en adultos y podemos considerarlas casi excepcionales en el niño, las series más amplias no superan el medio centenar. En un reciente estudio multicéntrico europeo se han logrado reunir 131 pacientes entre 38 centros (se había encuestado a 187 centros)1. Dada la rareza y las diversas clasificaciones empleadas de estas enfermedades no existen estadísticas válidas respecto a su prevalencia o incidencia. Bajo la denominación de EPI se agrupan un conjunto muy heterogéneo de enfermedades pulmonares subagudas y crónicas que tienen en común el producir un proceso inflamatorio crónico con lesión difusa del parénquima pulmonar afectando al intersticio, epitelio y espacios alveolares y al endotelio capilar. Como vemos no sólo está afectado el intersticio, por lo que el término enfermedad pulmonar intersticial puede producir confusión, motivo por el cual algunos autores prefieren denominar a este grupo de enfermedades: enfermedad pulmonar parenquimatosa difusa2. La morbilidad y mortalidad asociadas a EPI pediátrica es elevada, la mortalidad general está alrededor del 14-39 % y es mayor en los niños menores de 1 año3.
El paciente típico con EPI es un niño que se presenta con insuficiencia respiratoria progresiva e infiltrados pulmonares difusos en la radiografía. Pero existen otras patologías que pueden presentarse del mismo modo como las infecciones, la aspiración crónica, las enfermedades cardiológicas y la enfermedad pulmonar vascular4.
Las diversas enfermedades que pueden inducir una EPI comparten unas características clínicas, radiológicas e histológicas muy similares pero la etiología es muy amplia.
Clasificación
Esta enfermedad puede clasificarse según datos clínicos o histológicos. La evolución de la enfermedad puede definirse como aguda o crónica, se define como enfermedad pulmonar intersticial crónica a la que dura más de 6 meses. Otro criterio que suele utilizarse para su clasificación es el de causa conocida o desconocida (idiopática) o asociada a otros procesos (tablas 1, 2 y 3)5.
Desde el punto de vista histopatológico, la clasificación más utilizada ha sido la propuesta por Liebow et al6 basada en el tipo celular predominante que participa en el engrosamiento de la pared alveolar. Este autor clasifica esta enfermedad en: neumonitis intersticial usual, neumonitis intersticial descamativa, neumonitis intersticial de células gigantes, neumonitis intersticial de células plasmáticas, neumonitis intersticial linfoide y bronquiolitis obliterante con neumonitis intersticial6. Muchos autores dudan de incluir el último proceso bajo la denominación de enfermedad pulmonar intersticial. Con el tiempo se han excluido de las formas idiopáticas la neumonía de células gigantes y la intersticial linfoide; la primera es, en muchas ocasiones, una manifestación patológica de la neumoconiosis por metales pesados y la segunda se asocia fundamentalmente con el SIDA7. También existen dudas de si la neumonía usual y la descamativa son o no un continuo de la respuesta inflamatoria pues en algunos pacientes se han encontrado lesiones de ambos tipos al mismo tiempo o de forma evolutiva8. Más recientemente Katzenstein et al han propuesto una nueva clasificación en la que se incluye la neumonitis intersticial aguda y la neumonitis intersticial inespecífica9. Muchos patólogos encuentran dificultades para aplicar esta clasificación de adultos en niños. La clasificación de las EPI idiopáticas más aceptada hoy día en niños es la de la tabla 410.
El aspecto histológico de la neumonía intersticial usual es de una gran heterogeneidad de las lesiones desde inflamación alveolar hasta fibrosis intersticial difusa. En una biopsia pulmonar pueden observarse lesiones en los diversos estadios evolutivos junto a otras zonas del pulmón aparentemente sanas. Es muy rara en niños y probablemente muchos de los casos descritos hoy día se diagnosticarían de neumonitis intersticial inespecífica.
La neumonitis intersticial descamativa se caracteriza por un proceso inflamatorio inicialmente homogéneo con abundantes macrófagos intraalveolares. Esta enfermedad es rara pero bien caracterizada en niños, la mayoría de los casos se han descrito en niños menores de 1 año y en niños no se ha encontrado la asociación con el tabaquismo típica del adulto. La mortalidad de esta enfermedad es alta. Se han descrito casos familiares de neumonía intersticial descamativa de presentación durante la lactancia y con evolución generalmente fatal pero que puede responder al tratamiento con cloroquina11.
La neumonitis intersticial linfoide está en relación estrecha con el sida y con algunas conectivopatías. Esta enfermedad se caracteriza por la infiltración del intersticio por un grupo policlonal de linfocitos y células plasmáticas. En muchos aspectos es parecida a la neumonitis intersticial inespecífica pues en ésta también existe infiltrado del intersticio por linfocitos y células plasmáticas.
La neumonitis intersticial aguda no ha sido descrita en niños.
Más recientemente se ha introducido el término de neumonitis crónica de la infancia para referirse a un patrón histológico específico que aparece en algunos lactantes con patología intersticial pulmonar. En estos pacientes la biopsia pulmonar se caracteriza por un engrosamiento marcado de los septos alveolares, importante hiperplasia de neumocitos alveolares y un exudado alveolar que contiene numerosos macrófagos y focos de desechos de eosinófilos12. Estos hallazgos histológicos podrían reflejar la existencia de una neumonía de resolución lenta o recidivante sobre un pulmón inmaduro o con una alteración del desarrollo. No está claro que represente una enfermedad diferente sino más bien una forma de responder a una lesión de un pulmón en desarrollo10.
Clínica
Las manifestaciones clínicas iniciales suelen ser sutiles y poco específicas. La clínica puede variar desde un paciente completamente asintomático con radiografía compatible con el proceso hasta la más característica de tos de comienzo insidioso, disnea, taquipnea e intolerancia al ejercicio. Algunos niños con síntomas característicos de enfermedad pulmonar intersticial pueden tener inicialmente radiografías normales. La disnea suele ser el síntoma respiratorio más frecuente. En los lactantes podemos encontrar dificultad respiratoria con la alimentación y en los niños mayores intolerancia al ejercicio. La tos es improductiva y no suele impedir el sueño. En ocasiones se acompaña de dolor torácico. Durante la evolución la disnea aparece también durante el reposo y finalmente hay ortopnea. El inicio de la enfermedad suele ser insidioso, la taquipnea es uno de los signos más llamativos, en ocasiones con tiraje intercostal o subcostal leves. En la exploración física lo más llamativo es una auscultación pulmonar con estertores secos de timbre bajo y discontinuos que dan la impresión del despegamiento del Velcro.
Diagnóstico de la enfermedad pulmonar intersticial en niños
En un niño sin antecedentes neonatales respiratorios con taquipnea, tiraje intercostal y estertores secos, cuando se excluyen otras enfermedades respiratorias como fibrosis quística, debe sospecharse siempre la existencia de enfermedad pulmonar intersticial. En la tabla 5 se indican algunas de las pruebas complementarias necesarias para descartar otras enfermedades respiratorias en todo niño con sospecha de enfermedad pulmonar intersticial.
La principal herramienta para el diagnóstico diferencial de las EPI es la historia clínica. En primer lugar deberemos valorar si es un problema agudo (deberemos descartar en primer lugar un proceso infeccioso) o crónico. ¿Es un paciente inumodeprimido o inmunosuficiente? ¿Está diagnosticado de otra enfermedad que pueda asociarse a EPI (tabla 3)?; debemos realizar una anamnesis por aparatos detallada para buscar síntomas de otras enfermedades no pulmonares. Se debe hacer un interrogatorio exhaustivo sobre el contacto con polvos orgánicos (principalmente contacto con aves) o inorgánicos. Evaluación de los fármacos que ha utilizado el paciente, historia de radioterapia o trasplante de medula ósea (enfermedad injerto contra huésped crónica).
En la exploración física, además de los signos pulmonares descritos, deberemos descartar la existencia signos que alerten de la existencia de otras enfermedades como lesiones en piel en las vasculitis, hepatomegalia, signos de insuficiencia cardíaca, etc.
La analítica elemental permitirá valorar si existe anemia, con lo cual deberíamos descartar la existencia de sangrado a nivel pulmonar o hemosiderosis, neutropenia característica de los pacientes inmunodeprimidos, signos bioquímicos de afectación hepática o de insuficiencia renal, hematíes en orina que deberían hacer pensar en vasculitis con participación renal (enfermedad de Wegener). Cuando sospechemos la presencia de una neumonitis por hipersensibilidad, la presencia de precipitinas específicas en suero ayudará en el diagnóstico. Otras pruebas analíticas como la presencia de diversos anticuerpos ayudará a descartar la existencia de colagenosis o vasculitis.
Estudio radiológico
Generalmente existen alteraciones radiológicas desde el inicio de la enfermedad en la mayoría de los niños con EPI, pero se han descrito casos de pacientes sintomáticos con radiografía de tórax normal y otros con lesiones radiológicas llamativas con síntomas muy escasos o incluso estando asintomáticos. Existen diversos patrones radiológicos relacionados con EPI: vidrio esmerilado, reticular, nodular, reticulonodular y en panal de abeja. El patrón en vidrio esmerilado se encuentra al principio de la enfermedad y se relaciona con alveolitis activa, sin embargo, el patrón en panal de abeja se encuentra en los estadios terminales de la enfermedad. Los cambios en la radiografía de tórax suelen ser bilaterales y sin predominio de unas zonas en concreto.
La tomografía computarizada (TC) de alta resolución es más sensible para identificar los cambios tempranos del engrosamiento alveolar13,14. En un estudio que compara la utilidad de la radiografía simple con la TC de alta resolución en el diagnóstico de las EPI pediátricas en 20 pacientes que tenían diagnóstico histológico, se pudo comprobar que la radiografía permitía hacer un diagnóstico correcto en el 34% de los casos mientras que con la TC se hacía en un 61%13. Los diagnósticos que se podían hacer con más seguridad mediante la TC eran: proteinosis alveolar, linfangiectasia pulmonar y hemosiderosis pulmonar; sin embargo, fue menos útil para diferenciar entre la neumonitis intersticial inespecífica, la neumonitis descamativa o la linfocítica. Esta técnica tiene utilidad para valorar la gravedad y la extensión de la enfermedad, además de ayudar a evaluar cuál es la zona idónea para realizar la biopsia pulmonar buscando zonas de enfermedad más activa y eludiendo las zonas de fibrosis o panal de abeja15. La tomografía computarizada realizada en inspiración y espiración puede ayudar a demostrar la existencia de atrapamiento aéreo en pacientes con alveolitis alérgica extrínseca subaguda y en pacientes con bronquiolitis obliterante.
Se han descrito algunos patrones de TC en las distintas EPI pediátricas. Por ejemplo en la neumonitis intersticial inespecífica existe un patrón en panal de abeja en lóbulos superiores y un patrón en vidrio esmerilado uniforme en las zonas inferiores. En la proteinosis alveolar se encuentra un patrón en vidrio esmerilado con unos patrones lineales y reticulares sobreañadidos debidos al engrosamiento de los septos interlobulares. Durante los episodios agudos de sangrado pulmonar en las hemosiderosis idiopáticas se encuentra un patrón de vidrio esmerilado difuso, mientras que en las fases subagudas o crónicas se encuentran nódulos de un tamaño uniforme distribuidos por todo el pulmón. En la alveolitis alérgica extrínseca se encuentran zonas de opacificación en vidrio esmerilado con nódulos centrolobulares pequeños y mal definidos durante las fases agudas, también hay zonas parcheadas de atrapamiento aéreo. En las fases crónicas de alveolitis alérgica encontraremos zonas de fibrosis. En el 50% de los niños con histiocitosis de células de Langerhans multisistémica se encuentra afectación pulmonar que con frecuencia tiende a regresar espontáneamente. En la TC de estos pacientes encontraremos múltiples quistes de pared fina de menos de 1cm de tamaño y distribuidos fundamentalmente en las zonas superiores y medias del pulmón. También pueden encontrarse nódulos de 1-3 mm de tamaño de distribución peribronquial, estos nódulos se cavitan y forman luego los quistes.
La gammagrafía con galio se ha utilizado para identificar el grado de alveolitis, es más positiva durante la inflamación activa. El citrato de galio-67 es un radionúclido que se acumula en las zonas inflamatorias. Es una prueba sensible, aunque inespecífica, para detectar inflamación aguda15. La gammagrafía de ventilación con Xe-133 es útil para demostrar obstrucción bronquial en pacientes con bronquiolitis obliterante tras trasplante de medula en los que la función pulmonar es casi normal y aún no hay cambios en la TC. De todos modos, desde el advenimiento de la TC de alta resolución se utilizan mucho menos las técnicas isotópicas.
Estudios de función pulmonar
En los pacientes con enfermedad pulmonar intersticial existe una disminución de los volúmenes pulmonares, de la distensibilidad estática y de la capacidad de difusión. El patrón espirométrico típico es el de una enfermedad restrictiva. La capacidad de difusión es el índice funcional más sensible para evaluar la progresión de la enfermedad16.
Lavado broncoalveolar
La principal utilidad del lavado broncoalveolar en el diagnóstico diferencial de las EPI en niños es la de descartar la presencia de otras patologías. La existencia de macrófagos con hemosiderina dará una idea de la existencia de sangrado pulmonar típico de la hemosiderosis tanto idiopática como secundaria. La histiocitosisX puede ser diagnosticada con el hallazgo de células de Langerhans que se marcan específicamente con el anticuerpo monoclonal OKT617. La proteinosis alveolar puede diagnosticarse también gracias al LBA en el que encontraremos un material que se tiñe positivamente con la tinción ácida de Schiff y muy poco con azul alcián18. Ypor supuesto la principal utilidad del LBA es la de descartar infecciones como la infección por CMV o Pneumocystis carinii en pacientes inmunocomprometidos, sobre todo en SIDA.
La utilidad del LBA para la clasificación y seguimiento de la EPI idiopática en niños es mucho menor que la que se le ha dado en adultos19,20. Existen pocos estudios sobre cuáles son los valores normales de las diferentes células en LBA y la técnica está poco estandarizada en niños y no conocemos hasta qué punto la existencia de distintas proporciones celulares condiciona el pronóstico o la respuesta a fármacos en los niños.
Biopsia pulmonar
Es la técnica de elección para el diagnóstico de enfermedad pulmonar intersticial. No existe un acuerdo general sobre cuándo realizar una biopsia pulmonar en un niño con EPI; esta decisión debe ser individualizada y depende de la gravedad y velocidad de progresión de los signos clínicos y radiológicos. En general se tiende a ser más agresivo en los pacientes inmunodeprimidos para poder identificar infecciones oportunistas o EPI en relación con fármacos. Las decisiones terapéuticas que implica el diagnóstico de EPI justifican el obtener un diagnóstico certero mediante estudio histológico antes de iniciar un tratamiento en estos pacientes. Sin embargo, no todos los pacientes con EPI necesitan biopsia pulmonar cuando se puede llegar a un diagnóstico con métodos no invasivos20.
Como ya hemos dicho es especialmente útil marcar la zona de biopsia con la TC de alta resolución intentando buscar una zona que esté afectada pero que no presente aún signos de fibrosis o zonas quísticas. La muestra debe ser suficientemente grande para permitir diferentes tipos de tinciones y también examen con microscopia electrónica. Dada la poca frecuencia de esta patología sería conveniente que la muestra fuera examinada por un patólogo con experiencia en EPI.
La biopsia pulmonar a cielo abierto es, hasta el momento, el mejor procedimiento para obtener tejido pulmonar en niños, Coren et al utilizando una toracotomía tan pequeña como 2-4 cm obtienen resultados diagnósticos en 25 de 27 niños con EPI difusa21. La biopsia con toracoscopia puede ser igualmente eficaz y es menos agresiva22,23. La utilidad de la biopsia transbronquial en niños pequeños está muy debatida debido al pequeño tamaño de la muestra que puede obtenerse, que en la mayoría de las ocasiones es insuficiente para establecer un diagnóstico. Sin embargo, este método parece ser útil para la monitorización de niños tras trasplante pulmonar y en el diagnóstico de algunas patologías como la sarcoidosis22. En un estudio utilizando biopsia por punción percutánea con una aguja 18 G guiada por TC de alta resolución logran el diagnóstico histológico en el 58 % de los casos24.