Los pacientes con acondroplasia presentan, además de una talla baja desproporcionada, múltiples manifestaciones que requieren de un abordaje integral. El presente consenso de expertos en España responde a la necesidad de establecer unas directrices claras para el manejo de la acondroplasia con la introducción de un nuevo tratamiento, vosoritida.
Material y métodosPara la elaboración del consenso participó un panel de seis expertos en acondroplasia. Estos desarrollaron una revisión narrativa sobre las recomendaciones en acondroplasia y el tratamiento con vosoritida, que se consensuaron y adaptaron al contexto español en dos reuniones posteriores con formato de discusión estructurada.
ResultadosEste consenso de expertos incide en que la acondroplasia requiere de un manejo especializado y multidisciplinar donde se implique, de manera coordinada, a pediatras expertos, endocrinólogos pediatras o médicos genetistas, junto con especialistas en neurología, neurocirugía, neumología, otorrinolaringología, rehabilitación, ortopedia o psicología, entre otros. Este equipo multidisciplinar debe estar involucrado en la planificación del tratamiento con vosoritida —mediante la educación al paciente y sus cuidadores, el manejo de sus expectativas o la instrucción en los aspectos prácticos de la administración— en su inicio, así como en un seguimiento estrecho donde se valoren sistemáticamente variables antropométricas, bioquímicas, funcionales o aquellas comunicadas por el paciente.
ConclusionesEl presente protocolo para la administración de vosoritida permitirá la implementación homogénea y la optimización de los resultados de este tratamiento; así mismo, representa una oportunidad de mejorar el manejo de la acondroplasia en España desde un enfoque integral y multidisciplinar.
Patients with achondroplasia present, in addition to disproportionate short stature, multiple manifestations that require a comprehensive approach. The present consensus of experts in Spain responds to the need to establish clear guidelines for the management of achondroplasia with the introduction of a new treatment, vosoritide.
Material and methodsA panel of six experts in achondroplasia participated in the development of the consensus. They developed a narrative review of the recommendations on achondroplasia and vosoritide treatment, which were agreed upon and adapted to the Spanish context in two subsequent meetings with a structured discussion format.
ResultsThis protocol underscores that achondroplasia requires specialized and multidisciplinary management involving expert paediatricians and specialists in paediatric endocrinology or medical genetics, in collaboration with specialists in neurology, neurosurgery, pneumology, otorhinolaryngology, rehabilitation, and orthopedics or psychology, among others, with adequate coordination of care. This interdisciplinary team should be involved in the planning of vosoritide treatment (including the education of patients and caregivers, with management of their expectations, and their training in the practical aspects of vosoritide administration), treatment initiation and close monitoring with regular assessment of anthropometric, biochemical, functional or patient-reported variables.
ConclusionsThis protocol for the administration of vosoritide will allow standardised implementation and optimization of treatment outcomes. It also offers an opportunity to improve the management of achondroplasia in Spain through a comprehensive and interdisciplinary approach.
La acondroplasia representa la forma más común de displasia esquelética con talla baja desproporcionada, si bien se considera una enfermedad rara, ya que tiene una incidencia estimada entre 1/10.000 y 1/30.0001,2. Se trata de una enfermedad genética que se debe a variantes patogénicas en heterocigosis en el gen receptor del factor de crecimiento fibroblástico tipo3 (FGFR3) (MIM 134934), represor del crecimiento en el cartílago sujeto a osificación endocondral. El 99% de los pacientes presentan la variante patogénica c.1138G>A (NM_000142.5), y el 1%, la variante c.1138G>C (NM_000142.5). En el 80% de los casos la variante se presenta de novo, es decir, con progenitores no afectos, y tiene una penetrancia del 100%. Así mismo, las manifestaciones prenatales se detectan en el tercer trimestre del embarazo, lo que conlleva un diagnóstico tardío de la enfermedad3.
La acondroplasia es una enfermedad crónica compleja que se asocia con multitud de manifestaciones relacionadas o no con la represión del crecimiento. La diferente osificación endocondral propicia una talla baja desproporcionada de predominio rizomélico (media de 131±5,6cm en varones y de 124±5,9cm en mujeres), un fenotipo característico con macrocefalia, frente abombada, hipoplasia mediofacial y mano en tridente, además de estenosis del foramen magno con riesgo de hidrocefalia (que conlleva un mayor riesgo de muerte súbita en los primeros años de la vida), un mayor riesgo de otitis de repetición con posible pérdida auditiva y retraso del lenguaje en la infancia temprana, deformidades en forma de genu varo (con prevalencia de entre el 40%-70% de los pacientes) que pueden precisar de correcciones quirúrgicas3,4 o hiperlordosis lumbar y estenosis espinal que pueden implicar la claudicación de las extremidades inferiores y la limitación en las actividades de la vida diaria. Adicionalmente, estos pacientes tienen predisposición a la obesidad y al síndrome metabólico, que incrementan el riesgo cardiovascular y reducen su esperanza de vida5.
Estas múltiples manifestaciones impactan negativamente en la calidad de vida relacionada con la salud (CVRS) de los pacientes y de sus cuidadores6. Además, estos pacientes presentan problemas de autoestima o de ansiedad (un 50%-60% de los pacientes) debido a la desadaptación social7,8.
Hasta ahora, el principal recurso terapéutico para tratar a estos pacientes han sido las intervenciones quirúrgicas9,10. Estas incluyen intervenciones neuroquirúrgicas, como la cirugía para abordar la estenosis del foramen magno, o cirugías ortopédicas, como osteotomías correctivas de genu varo o elongaciones de los miembros. Sin embargo, los avances recientes en la comprensión de la patogenia han abierto nuevas vías para el desarrollo de tratamientos, como los moduladores del FGFR311-13. Entre ellos se encuentra vosoritida, que ha demostrado en distintos ensayos clínicos su capacidad para incrementar la velocidad de crecimiento en menores afectados14-17.
La complejidad de la enfermedad, así como de sus tratamientos, pone de manifiesto que la acondroplasia requiere de una atención multidisciplinar en centros especializados. Por este motivo, en los últimos años se han publicado diversas guías para optimizar el seguimiento integral de estos pacientes, así como mejorar su CVRS y favorecer su independencia y su inclusión social1,18-20. A pesar de estas guías, aún existen notables diferencias en las estrategias de manejo y seguimiento de los pacientes con acondroplasia21,22, lo que refleja la carencia de unas directrices claras y unificadas para el abordaje de estos pacientes, así como de unas recomendaciones que integren el uso de las nuevas terapias como vosoritida en España.
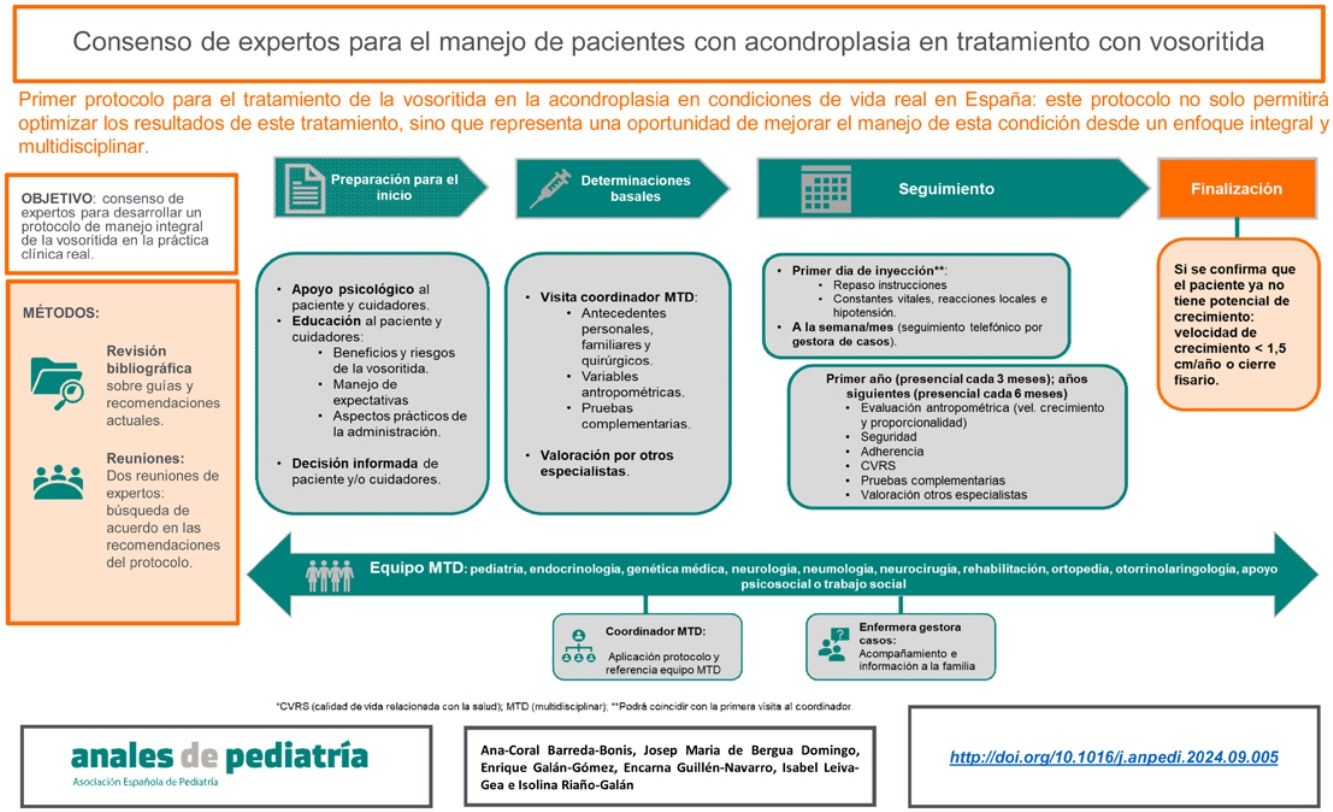
Con el objetivo general de abordar estas cuestiones, se elaboró el presente consenso de expertos en España en el que se pretende definir las principales pautas de manejo multidisciplinar especializado de la enfermedad y homogeneizar el protocolo de tratamiento y seguimiento de vosoritida en nuestro país.
Material y métodosEn la elaboración de este consenso participó un panel de seis expertos en acondroplasia y en el tratamiento con vosoritida que incluía a especialistas en traumatología, genética médica y endocrinología pediátrica. Estos participaron en la elaboración de una revisión narrativa y en la preparación de un informe preliminar sobre las recomendaciones en acondroplasia y en el tratamiento con vosoritida. Mediante dos reuniones se procedió a su revisión estructurada, buscando el consenso mediante discusión dirigida.
Trabajo preliminarEn primer lugar los expertos realizaron una revisión bibliográfica narrativa que tenía como objetivo recopilar las guías y consensos actuales en acondroplasia, así como estudios sobre la eficacia, la seguridad o las pautas de administración de vosoritida. Estas publicaciones sirvieron de base para la preparación de un informe preliminar donde se incluían las principales recomendaciones recopiladas.
Reuniones de expertosA continuación, los expertos participaron en dos reuniones que tenían como finalidad consensuar las recomendaciones identificadas en la literatura y llevarlas al contexto español. Estas reuniones tenían un formato de mesa redonda, donde cada experto presentaba sus perspectivas, sus experiencias y sus conocimientos sobre el tema. El consenso se alcanzaba de manera cualitativa mediante la formulación de preguntas dirigidas y estructuradas sobre las recomendaciones planteadas en el informe de base.
ResultadosA continuación se exponen las recomendaciones principales consensuadas por el panel de expertos relacionadas con el modelo asistencial para la implementación de vosoritida o con las distintas fases del tratamiento: preparación, evaluación inicial e inicio y seguimiento.
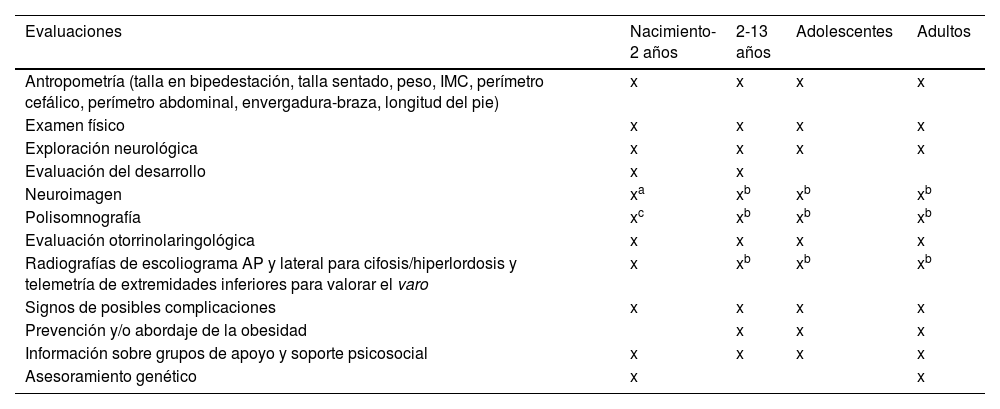
Modelo asistencial para la implementación del protocoloLa complejidad de la enfermedad y de su tratamiento pone de manifiesto que su manejo precisa de una atención multidisciplinar coordinada y especializada (ver el cronograma del seguimiento habitual de los pacientes con acondroplasia en la tabla 1 [adaptación Leiva-Gea et al.20]) que no siempre se produce. Por tanto, la administración de vosoritida representa una oportunidad para iniciar un seguimiento adecuado y global de estos pacientes. Este enfoque permitirá una administración más segura del tratamiento y una evaluación rigurosa de sus resultados. Adicionalmente, mejorará la asistencia clínica de los pacientes, además de su autonomía y de la adherencia al tratamiento8.
Cronograma adaptado de la Asociación Americana de Pediatría para el seguimiento de pacientes con acondroplasia
| Evaluaciones | Nacimiento-2 años | 2-13 años | Adolescentes | Adultos |
|---|---|---|---|---|
| Antropometría (talla en bipedestación, talla sentado, peso, IMC, perímetro cefálico, perímetro abdominal, envergadura-braza, longitud del pie) | x | x | x | x |
| Examen físico | x | x | x | x |
| Exploración neurológica | x | x | x | x |
| Evaluación del desarrollo | x | x | ||
| Neuroimagen | xa | xb | xb | xb |
| Polisomnografía | xc | xb | xb | xb |
| Evaluación otorrinolaringológica | x | x | x | x |
| Radiografías de escoliograma AP y lateral para cifosis/hiperlordosis y telemetría de extremidades inferiores para valorar el varo | x | xb | xb | xb |
| Signos de posibles complicaciones | x | x | x | x |
| Prevención y/o abordaje de la obesidad | x | x | x | |
| Información sobre grupos de apoyo y soporte psicosocial | x | x | x | x |
| Asesoramiento genético | x | x |
Antes del año, a ser posible antes del mes de vida.
IMC: índice de masa corporal.
Fuente: adaptado de Leiva-Gea et al.20.
El presente protocolo está dirigido, por tanto, a un equipo multidisciplinar experimentado en acondroplasia, localizado idealmente en un centro de referencia en displasias esqueléticas1. En este equipo será imprescindible contar con un coordinador principal que homogeneizará el cuidado de los pacientes y mediará la comunicación con otros miembros del equipo. El coordinador debe poseer experiencia comprobada en el manejo de la entidad, independientemente de su especialidad1,8,23. Las especialidades involucradas en el equipo multidisciplinar incluirán, idealmente, a genética médica y/o endocrinología pediátrica y/o un pediatra con experiencia en displasias esqueléticas, junto con especialistas en neuropediatría, neurocirugía, neumología pediátrica, otorrinolaringología, ortopedia y traumatología pediátrica y rehabilitación. Otras especialidades implicadas serán anestesia, psicología y trabajo social24. Es importante que tanto los pacientes como sus cuidadores cuenten con apoyo psicológico desde el inicio y durante todo el proceso. Así mismo, se recomienda involucrar a una enfermera gestora de casos, que acompañe a la familia y coordine las visitas y las exploraciones complementarias requeridas. La enfermera de casos, además, facilitará la continuidad de los cuidados de estos pacientes y su transición desde pediatría hasta la unidad de adultos. Estos especialistas deben contar con experiencia clínica en el manejo de esta entidad y con estructuras de apoyo para los pacientes y sus familias24,25.
Características técnicas de vosoritida: modo de empleoVosoritida es un análogo del péptido natriurético de tipoC indicado en pacientes con acondroplasia confirmada genéticamente con edades superiores a los cuatro meses25 (indicación aprobada por la European Medicines Agency [EMA] y financiada en España26,27) y que se puede administrar hasta el cierre fisario y hasta que la velocidad de crecimiento sea inferior a 1,5cm/año.
La vía de administración es subcutánea y se administra una vez al día. Existen tres viales de presentación (vosoritida 0,4mg, 0,56mg y 1,2mg en polvo) acompañados de una jeringa de vidrio precargada con agua para su reconstitución25. La dosis habitual es de 15-30μg/kg de peso15, aunque esta puede variar en relación con la distribución corporal del fármaco en función del peso.
Las recomendaciones detalladas con respecto a la presentación, inyección y almacenamiento del fármaco se detallan en el Apéndice.
Preparación para el inicio del tratamientoAntes del inicio con vosoritida el equipo multidisciplinar involucrado debe proporcionar la información necesaria tanto a los pacientes como a sus cuidadores para que tomen una decisión informada acerca de su tratamiento. Puede ser útil mantener, además, una conversación a solas con el paciente, en la que se emplee un lenguaje adaptado, con el objetivo de conocer su comprensión individual y su opinión24. Durante este proceso comunicativo se debe abordar la motivación del paciente y de los cuidadores con el tratamiento con vosoritida28, los criterios de elección, el concepto de respuesta y el tiempo potencial para observarla o la seguridad del tratamiento. Adicionalmente, se debe enfatizar que vosoritida es un tratamiento electivo y que su interrupción no causará daños al paciente24. Los profesionales sanitarios deben dejar el tiempo suficiente tanto a los pacientes como a sus cuidadores para que estos procesen esta información y hagan las preguntas pertinentes. También, han de considerar que estos han podido recibir información sobre vosoritida proveniente de diversas fuentes que puede llevar a confusión o a preocupación. Estas cuestiones deben ser igualmente abordadas24.
En cuanto a la respuesta, los profesionales deben indicar que este tratamiento proporciona una ganancia de talla (1,57cm/año de media, siendo superior en los varones con respecto a las mujeres: 1,98 vs. 1,55cm/año), y que esta ganancia podría hacer que la talla final sea funcionalmente más adaptativa16,29. Igualmente, deben comunicar que la respuesta a vosoritida puede variar entre pacientes, y que diversos factores pueden impactar en la ganancia de altura29. También que la evaluación de la respuesta al tratamiento no es inmediata y que requiere de la valoración de medidas antropométricas seriadas durante al menos uno o dos años tras el inicio del tratamiento16,24,29. Es recomendable mostrar las curvas de crecimiento adaptadas para que los pacientes aprecien el beneficio del tratamiento. Adicionalmente, se debe explicar que en la actualidad no existe evidencia de que vosoritida mejore otros aspectos, aparte del crecimiento lineal24, si bien este tratamiento se asocia con una tendencia a la mejoría en la desproporción entre los segmentos superior e inferior24,30. En cuanto a la seguridad, los profesionales deben explicar el tipo de eventos registrados en los ensayos clínicos, así como reseñar la posible aparición de efectos adversos graves que, aunque infrecuentes, se han observado en los estudios15,17,30.
Evaluación inicialEn la visita inicial, el coordinador repasará el manejo de las expectativas con respecto al tratamiento y proporcionará al paciente y a sus cuidadores información sobre el procedimiento a realizar o el entrenamiento en el modo de empleo del fármaco. El entrenamiento para la administración subcutánea de la medicación consiste en un taller práctico adaptado a las características psicosociales del paciente y de sus cuidadores.
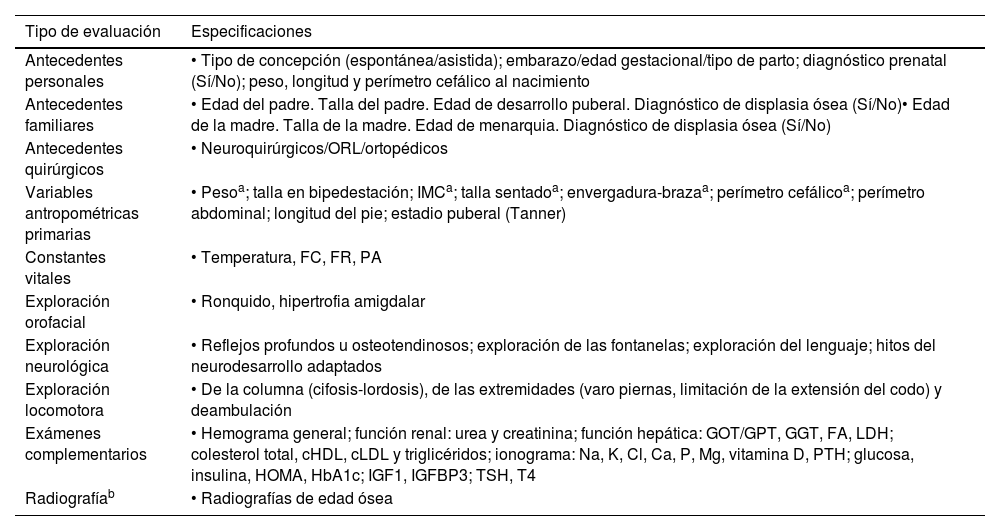
En esta visita, el coordinador, además, realizará una valoración integral del paciente: recogerá su historia médica y comprobará el cumplimiento de los criterios de elección para vosoritida. Adicionalmente, llevará a cabo las exploraciones y los exámenes complementarios recomendados, que se detallan en la tabla 2. Comprobará también si el paciente ha tenido un seguimiento en consonancia con las recomendaciones de las guías publicadas (tabla 1).
Lista de evaluaciones realizadas por el coordinador principal
| Tipo de evaluación | Especificaciones |
|---|---|
| Antecedentes personales | • Tipo de concepción (espontánea/asistida); embarazo/edad gestacional/tipo de parto; diagnóstico prenatal (Sí/No); peso, longitud y perímetro cefálico al nacimiento |
| Antecedentes familiares | • Edad del padre. Talla del padre. Edad de desarrollo puberal. Diagnóstico de displasia ósea (Sí/No)• Edad de la madre. Talla de la madre. Edad de menarquia. Diagnóstico de displasia ósea (Sí/No) |
| Antecedentes quirúrgicos | • Neuroquirúrgicos/ORL/ortopédicos |
| Variables antropométricas primarias | • Pesoa; talla en bipedestación; IMCa; talla sentadoa; envergadura-brazaa; perímetro cefálicoa; perímetro abdominal; longitud del pie; estadio puberal (Tanner) |
| Constantes vitales | • Temperatura, FC, FR, PA |
| Exploración orofacial | • Ronquido, hipertrofia amigdalar |
| Exploración neurológica | • Reflejos profundos u osteotendinosos; exploración de las fontanelas; exploración del lenguaje; hitos del neurodesarrollo adaptados |
| Exploración locomotora | • De la columna (cifosis-lordosis), de las extremidades (varo piernas, limitación de la extensión del codo) y deambulación |
| Exámenes complementarios | • Hemograma general; función renal: urea y creatinina; función hepática: GOT/GPT, GGT, FA, LDH; colesterol total, cHDL, cLDL y triglicéridos; ionograma: Na, K, Cl, Ca, P, Mg, vitamina D, PTH; glucosa, insulina, HOMA, HbA1c; IGF1, IGFBP3; TSH, T4 |
| Radiografíab | • Radiografías de edad ósea |
No existen atlas de referencia ósea en pacientes con acondroplasia, por lo que se adopta el Atlas de Greulich y Pyle por convención internacional, pese a la limitación metodológica.
Ca: calcio; cHDL: colesterol de lipoproteínas de alta densidad (high-density lipoprotein colesterol); Cl: cloro; cLDL: colesterol de lipoproteínas de baja densidad (low-density lipoprotein colesterol); FA: fosfatasa alcalina; FC: frecuencia cardiaca; FR: frecuencia respiratoria; GGT: gammaglutamil transpeptidasa; GOT: glutámico-oxalacético transaminasa; GPT: glutámico-pirúvico transaminasa; HbA1c: hemoglobina A1c; HOMA: modelo de evaluación homeostática (homeostasis model assessment); IGF1: factor de crecimiento similar a la insulina-1 (insulin-like growth factor 1); IGFBP-3: proteínas transportadoras de los factores de crecimiento similares a la insulina-3 (insulin-like growth factor binding protein-3); IMC: índice de masa corporal; K: potasio; LDH: lactato deshidrogenasa; Mg: magnesio; ORL: otorrinolaringología; P: fósforo; PA: presión arterial; PTH: hormona paratiroidea (parathyroid hormone); TSH: hormona estimulante de la tiroides (thyroid-stimulating hormone).
El inicio del tratamiento (o día 0) se podrá realizar el mismo día de la visita inicial al coordinador o en diferentes días, según los protocolos de cada centro.
Antes de la administración de vosoritida la enfermera gestora de casos instruirá a los cuidadores sobre cómo preparar e inyectar este medicamento (ver instrucciones en el Apéndice). Además, ofrecerá la aplicación (app) myVOXZOGO, que permitirá monitorizar la adherencia tanto a los profesionales sanitarios como a los cuidadores. Esta app incluye información relacionada con la acondroplasia y el empleo de vosoritida.
Antes de la administración del fármaco y una hora después, la enfermera registrará las constantes vitales básicas del paciente, vigilará las reacciones locales y los síntomas de hipotensión e informará a los cuidadores acerca de la posibilidad de aparición de eventos adversos y de las pautas de actuación ante estos. También facilitará los datos de contacto del hospital para su notificación. Para asegurar la destreza de los cuidadores con la técnica de inyección, estos podrán acudir al hospital durante dos o tres días adicionales para realizar la administración del medicamento.
Durante esta visita y en todas las sucesivas, el personal de farmacia hospitalaria entregará la medicación. Para ello, es esencial que los cuidadores dispongan de una nevera portátil para transportar la medicación sin alterar la cadena de frío.
Seguimiento tras el inicio del tratamiento: visitas telefónicasSe recomienda valorar una primera cita telemática a la semana o al mes del inicio del tratamiento, según las necesidades del paciente y los protocolos del centro. En esta cita, la enfermera gestora de casos realizará una consulta telefónica para asegurar la correcta evolución y seguimiento del tratamiento. Adicionalmente, resolverá las dudas que hayan podido surgir al paciente y a sus cuidadores, monitorizará su adherencia y los posibles efectos adversos.
Seguimiento tras el inicio del tratamiento: visitas presencialesDurante el primer año de tratamiento, los pacientes harán visitas cada tres meses. En estas visitas, el especialista a cargo del seguimiento realizará una revisión médica y recopilará las medidas antropométricas que se estandarizan en función de las gráficas adaptadas de Neumeyer para la monitorización de pacientes con acondroplasia31,32. Además, prestará especial atención a los cambios en la velocidad de crecimiento y a los parámetros de seguridad, y tendrá en cuenta la adherencia y las dificultades en la técnica de inyección, principalmente en los más jóvenes.
A partir del primer año de tratamiento se realizarán visitas cada seis meses. En estas visitas, el especialista valorará si el paciente cumple con los criterios de velocidad de crecimiento y si debe continuar o no con el tratamiento. En concreto, el tratamiento se debe interrumpir si se confirma que el paciente presenta una velocidad de crecimiento menor de 1,5cm/año y/o el cierre fisario. Estos indicadores denotan que el paciente ya no presenta potencial de crecimiento25.
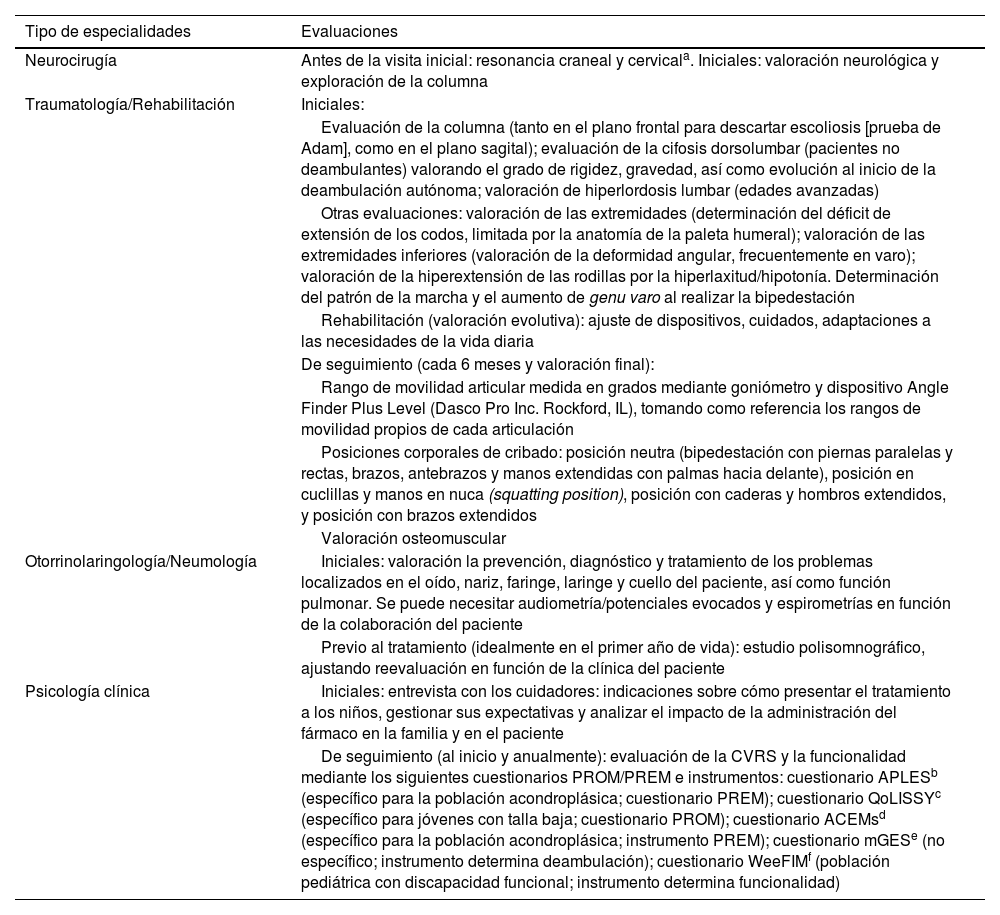
En la tabla 3 se resumen las medidas y las pruebas complementarias que se realizan durante el inicio y el seguimiento del tratamiento y su frecuencia. Así mismo, en la tabla 4 se detallan las valoraciones principales realizadas por parte de los distintos especialistas implicados.
Listado de medidas y pruebas complementarias y su frecuencia realizadas durante el inicio y el seguimiento del tratamiento
| Procedimientoa | Evaluación | Día 1 - Inicio tratamiento | Mes 1 | 3 meses | Cada 6 meses | Anual | Final del seguimiento |
|---|---|---|---|---|---|---|---|
| Historia médica | XX | XX | XX | XX | XX | XX | |
| Apoyo familiar y otros grupos de apoyo | XX | XX | XX | XX | XX | ||
| Talla de los progenitores | XX | ||||||
| Pruebas genéticas diagnósticas (tras exploración física completa) | XX | ||||||
| Medicación concomitante | XX | XX | XX | XX | XX | ||
| Examen físico completo (incluyendo antropometría y estadio de Tanner) | XX | XX | XX | XX | XX | XX | |
| Variables relacionadas con el rango de movilidad articular, caderas | XX | XX | XX | XX | XX | ||
| Historial menstrual (si aplica) | XX | XX | XX | XX | XX | ||
| CVRS y funcionalidadb | XX | XX | XX | ||||
| ECG | XX | XX | |||||
| Ecocardiograma | XX | XX | |||||
| Análisis clínicos (hematología, bioquímica y análisis de orina) | XX | XX | XX | ||||
| Metabolismo hidrocarbonadoc | XX | XX | XX | ||||
| Metabolismo lipídicod | XX | XX | XX | ||||
| Metabolismo proteicoe | XX | XX | XX | ||||
| Metabolismo óseof | XX | XX | XX | ||||
| Pruebas de función tiroidea | XX | XX | XX | ||||
| DXA | XXg | ||||||
| Rayos X de mano izquierda (edad ósea) | XX | XX | |||||
| Telemetrías de miembros inferiores en bipedestación (si el paciente es deambulante) | XX | XXg | |||||
| Rayos X escoliograma lateral | XX | XXg | |||||
| Administración del fármaco | XX | ||||||
| Adherencia del fármaco | XX | XX | XX | XX | XX | XX | |
| Eventos adversos | XX | XX | XX | XX | XX | XX |
Incluye: glucosa, HbA1c (hemoglobina A1c), insulina, péptido C, índice HOMA (modelo de evaluación homeostática [homeostasis model assessment]).
Incluye: colesterol total, cHDL (colesterol de lipoproteínas de alta densidad [high-density lipoprotein colesterol]); cLDL (colesterol de lipoproteínas de baja densidad [low-density lipoprotein colesterol]), triglicéridos.
Lista detallada de las evaluaciones realizadas por las distintas especialidades
| Tipo de especialidades | Evaluaciones |
|---|---|
| Neurocirugía | Antes de la visita inicial: resonancia craneal y cervicala. Iniciales: valoración neurológica y exploración de la columna |
| Traumatología/Rehabilitación | Iniciales: |
| Evaluación de la columna (tanto en el plano frontal para descartar escoliosis [prueba de Adam], como en el plano sagital); evaluación de la cifosis dorsolumbar (pacientes no deambulantes) valorando el grado de rigidez, gravedad, así como evolución al inicio de la deambulación autónoma; valoración de hiperlordosis lumbar (edades avanzadas) | |
| Otras evaluaciones: valoración de las extremidades (determinación del déficit de extensión de los codos, limitada por la anatomía de la paleta humeral); valoración de las extremidades inferiores (valoración de la deformidad angular, frecuentemente en varo); valoración de la hiperextensión de las rodillas por la hiperlaxitud/hipotonía. Determinación del patrón de la marcha y el aumento de genu varo al realizar la bipedestación | |
| Rehabilitación (valoración evolutiva): ajuste de dispositivos, cuidados, adaptaciones a las necesidades de la vida diaria | |
| De seguimiento (cada 6 meses y valoración final): | |
| Rango de movilidad articular medida en grados mediante goniómetro y dispositivo Angle Finder Plus Level (Dasco Pro Inc. Rockford, IL), tomando como referencia los rangos de movilidad propios de cada articulación | |
| Posiciones corporales de cribado: posición neutra (bipedestación con piernas paralelas y rectas, brazos, antebrazos y manos extendidas con palmas hacia delante), posición en cuclillas y manos en nuca (squatting position), posición con caderas y hombros extendidos, y posición con brazos extendidos | |
| Valoración osteomuscular | |
| Otorrinolaringología/Neumología | Iniciales: valoración la prevención, diagnóstico y tratamiento de los problemas localizados en el oído, nariz, faringe, laringe y cuello del paciente, así como función pulmonar. Se puede necesitar audiometría/potenciales evocados y espirometrías en función de la colaboración del paciente |
| Previo al tratamiento (idealmente en el primer año de vida): estudio polisomnográfico, ajustando reevaluación en función de la clínica del paciente | |
| Psicología clínica | Iniciales: entrevista con los cuidadores: indicaciones sobre cómo presentar el tratamiento a los niños, gestionar sus expectativas y analizar el impacto de la administración del fármaco en la familia y en el paciente |
| De seguimiento (al inicio y anualmente): evaluación de la CVRS y la funcionalidad mediante los siguientes cuestionarios PROM/PREM e instrumentos: cuestionario APLESb (específico para la población acondroplásica; cuestionario PREM); cuestionario QoLISSYc (específico para jóvenes con talla baja; cuestionario PROM); cuestionario ACEMsd (específico para la población acondroplásica; instrumento PREM); cuestionario mGESe (no específico; instrumento determina deambulación); cuestionario WeeFIMf (población pediátrica con discapacidad funcional; instrumento determina funcionalidad) |
ACEMs: Achondroplasia Child Experience Measures; APLES: the Achondroplasia Personal Life Experience Scale; mGES: modified Gait Eficacy Scale; PREM: patient-reported experience measures; PROM: patient-reported outcome measures; QoLISSY: Quality of Life of Short Stature Youth; WeFIM: Functional Independence Measure for Children.
Actualmente no existe consenso sobre la realización de radiografías de edad ósea anuales durante todo el seguimiento. Además, su interpretación presenta limitaciones, ya que la referencia empleada (atlas de Greulich y Pyle) no incluye a sujetos con acondroplasia y se desconoce su evolución natural. No obstante, se abre la posibilidad de realizar estos reconocimientos de manera periódica por interés científico, aunque no tengan un impacto directo en las decisiones del tratamiento.
En resumen, el presente consenso español de expertos responde a la urgencia de desarrollar un protocolo para el manejo de la acondroplasia tras el lanzamiento de un nuevo tratamiento, vosoritida, aprobado en 202133 y financiado en España para pacientes a partir de los cuatro meses de edad27. Por tanto, se trata de uno de los primeros protocolos, del que tenemos conocimiento, que se desarrolla en este nuevo contexto24,34.
Adicionalmente, este protocolo cubre la necesidad de optimizar y unificar los criterios de seguimiento y evaluación de los resultados de vosoritida en la práctica clínica. Esto es crucial, ya que los estudios clínicos presentan ciertas limitaciones en el momento actual: un seguimiento inferior a diez años o falta de evaluación de variables dependientes de la respuesta13,15-17,24,30. Adicionalmente, se desconoce si el tratamiento con vosoritida impacta en variables no antropométricas o si existe taquifilaxia a largo plazo.
En líneas generales, con este protocolo se incide en la importancia del manejo de la acondroplasia desde una atención especializada y multidisciplinar, de acuerdo con los consensos internacionales1,8,18. Esta atención debe implicar, de manera coordinada, a un grupo de distintos especialistas —genética médica y/o endocrinología pediátrica y/o pediatría, junto con neuropediatría, neumología pediátrica, neurocirugía, otorrinolaringología, rehabilitación y ortopedia, entre otros—, en línea con las consideraciones prácticas para el manejo de vosoritida publicadas recientemente1,8,18,24. Al igual que en los consensos internacionales, se incide en que el equipo multidisciplinar debe estar involucrado en la educación del paciente y de sus cuidadores, si bien en este protocolo se especifica la importancia de revisar las expectativas sobre la respuesta a vosoritida, así como los aspectos prácticos sobre su administración y seguimiento. Esto también se remarca en la publicación reciente de Semler et al.24.
La evaluación inicial y el seguimiento del paciente deben ser integrales e implican la coordinación del equipo multidisciplinar. Esta evaluación requiere la valoración de variables antropométricas, así como bioquímicas, funcionales o aquellas comunicadas por el paciente. Además, conlleva un seguimiento muy estrecho, con visitas y evaluaciones más frecuentes durante el primer año, al igual que se especifica en el consenso internacional1. Este seguimiento se extiende hasta la finalización del tratamiento.
De manera adicional a la aplicación de estas directrices, existen distintas iniciativas que impulsarán la obtención de una comprensión más profunda de esta entidad, además del impacto de vosoritida en la misma. Entre estas se incluye el desarrollo de registros en los que se recojan variables resultado de manera estandarizada, así como la promoción de la investigación biomédica con la creación y el establecimiento de biobancos específicos para la acondroplasia con marcadores de metabolismo óseo en sangre u orina durante el seguimiento.
ConclusionesEl presente protocolo para la aplicación de vosoritida en la acondroplasia permitirá optimizar los resultados de este tratamiento en la práctica clínica real. Además, representa una oportunidad de mejorar el manejo de esta condición desde un enfoque integral y multidisciplinar y de alcanzar una comprensión más profunda de las implicaciones del tratamiento de la acondroplasia, tanto a nivel del crecimiento como en el resto de las manifestaciones clínicas.
FinanciaciónLa redacción de este documento ha sido elaborada por un medical writer independiente suministrado por la agencia Nueva Investigación y financiado por BioMarin Pharmaceutical Inc.
Conflicto de interesesLos autores declaran que han recibido honorarios como consultores por parte de BioMarin para la realización del presente trabajo.
ACB ha recibido financiación como ponente por parte de BioMarin y forma parte de ensayos clínicos con BioMarin y QED Therapeutics.
IRG ha recibido financiación como ponente por parte de BioMarin.