La mortalidad de los recién nacidos pretérmino ha experimentado en los últimos años una notable reducción. Sin embargo, no se ha visto acompañada de una disminución en la morbilidad asociada en los supervivientes1. La inmadurez del aparato digestivo y las frecuentes complicaciones que acontecen en las primeras semanas de vida, muchas de las que requieren tratamientos intensivos, dificultan enormemente el establecimiento de una nutrición enteral suficiente para satisfacer las necesidades metabólicas del prematuro. Como consecuencia, muchos de estos pacientes precisan adecuar su balance energético y metabólico mediante el uso de nutrición parenteral de forma prolongada (NPP)2. La NPP en el período neonatal, sin embargo, tiene como contrapartida el hecho de presentar con frecuencia una amplia cohorte de complicaciones secundarias, y la colestasis es una de las más importantes y frecuentes3,4. La colestasis asociada a NPP (CANPP) se define como un aumento del valor de bilirrubina directa (BD) superior a 2 mg/dl, del 15% del total de bilirrubina, de enzimas biliares o de aminotransferasas en pacientes con nutrición parenteral de más de 2 semanas de duración tras descartar otras causas de colestasis5. Su incidencia es variable y está en relación con diversos factores, entre los que destacan la inmadurez y el peso al nacimiento. Por tanto, la CANPP es tanto más frecuente cuanto menor es la edad de gestación y menor es el peso al nacimiento. Asimismo, la duración es un factor decisivo, de modo que la incidencia de colestasis aumenta exponencialmente a partir de las 2 semanas de nutrición parenteral exclusiva5,6. Otros factores etiológicos de menor relevancia son las infecciones, la oxidación de los complejos multivitamínicos o la cirugía intestinal6. Los prematuros en los que se desarrolla colestasis tienen un riesgo elevado de desarrollo de complicaciones hepáticas graves como cirrosis, enfermedad terminal hepática y las complicaciones derivadas; los pacientes más susceptibles son los grandes prematuros y aquéllos con síndrome de intestino corto debido a la dificultad para administrar una nutrición enteral total efectiva4. En los últimos años se han intentado diversas aproximaciones terapéuticas a la CANPP, como el octapéptido de colecistoquinina, ácido tauroursodesoxicólico o antibióticos. Sin embargo, la utilización del ácido ursodesoxicólico (AUDC) es el único tratamiento aprobado por la FDA (Food and Drug Administration; EE. UU.) para su uso en pacientes pediátricos7–13.
Dada la incertidumbre respecto de la eficacia del AUDC y la escasa experiencia en prematuros con CANPP, los autores de este artículo se plantearon la realización de un estudio retrospectivo de 2 años en el que se incluyeron aquellos pacientes ingresados en este servicio y diagnosticados de CANPP mediante la utilización de la sistemática que hay en cuanto al protocolo de diagnóstico, tratamiento y seguimiento bioquímico y clínico de estos pacientes.
Material y métodosDiseñoSe trata de un estudio retrospectivo de 2 años de duración (enero de 2005 a diciembre de 2006) en el que se han incluido todas las historias clínicas de los pacientes ingresados en el Servicio de Neonatología del Hospital Universitario La Fe, que se han etiquetado como colestasis secundaria a NPP (CNPP). Entre los pacientes seleccionados se han diferenciado 2 grupos: a) grupo que ha recibido tratamiento con AUDC y b) grupo que no ha recibido tratamiento. Se ha utilizado un método de búsqueda mediante términos clave (prematuridad, colestasis, nutrición parenteral, ácido ursodesoxicólico, vía central, bilirrubina directa, aminotransferasas, gammaglutamil transpeptidasa) que ha permitido identificar a todos aquellos pacientes afectados de una CNPP e ingresados durante el período neonatal. Se han recogido datos relativos a las características generales de los pacientes, datos relacionados con las características y la duración de la nutrición parenteral, y datos evolutivos de los marcadores bioquímicos de colestasis y de daño hepatocelular obtenidos mediante determinaciones seriadas. Los datos se han tabulado en una base de datos correlacional diseñada ad hoc que ha permitido la comparación estadística entre ambos grupos.
PoblaciónSe trata de un estudio retrospectivo que comprendió desde enero de 2005 hasta diciembre de 2006. Entre todos los pacientes seleccionados por los epígrafes de la búsqueda en la base de datos del Servicio de Neonatología, se identificaron un total de 24 pacientes que se pudieron adscribir a la definición de NPP, se entendió como tal la nutrición parenteral que incluyera todos los componentes esenciales de la nutrición (carbohidratos, lípidos, aminoácidos, vitaminas y minerales) durante un período superior a 14 días, en los pacientes en los que se hubiera desarrollado una colestasis secundaria a ésta tras descartar otras causas primarias de colestasis con elevación por encima de los valores medios (+ 2 desviaciones estándar) de los valores normales de aminotransferasas y de gammaglutamil transpeptidasa (GGT) referidos por el laboratorio central para el período neonatal, y con una bilirrubina conjugada superior a 2 mg/dl.
Del total de pacientes, 17 recibieron tratamiento con AUDC en dosis de 15 a 30 mg/kg/día hasta su alta definitiva, mientras que 7 no recibieron tratamiento alguno y sirvieron como grupo control.
Métodos analíticosSe realizaron determinaciones de aminotransferasa glutamicoxalacética (GOT) (aspartato aminotransferasa) y aminotransferasa glutamicopirúvica (GPT) (alanina-aminotransferasa) mediante análisis colorimétrico basado en ensayo en la reacciones catalizadas por la oxalacético y pirúvico oxidasas, respectivamente. Los productos derivados se leyeron en un colorímetro a una longitud de onda de 550 nm tamponado entre pH 7,0 y 7,5 con una solución que contiene L-alanina, ácido cetoglutárico, una fuente de fosfato inorgánico, y las enzimas piruvato y oxalacético oxidasas.
La determinación de GGT se realizó mediante la utilización de un sustrato, que es una solución tamponada que contiene L-gammaglutamil-p-nitroanilida como sustrato, glicil-glicina, nitrito sódico y opcionalmente cloruro de magnesio. Esta solución se incubó conjuntamente con la solución sustrato (plasma sanguíneo del paciente) y con una solución de sulfato de 8-hidroxiquinolina a un pH entre 0,8 y 1,3 durante un período predeterminado de tiempo. Cuando la incubación se hubo completado, se añadió una solución alcalina para elevar el pH a 10,5 para promover el desarrollo del color. Se procedió después a medir la densidad óptica de la solución final mediante un espectrofotómetro. Las determinaciones restantes (bilirrubina total [BT], conjugada, no conjugada, fosfatasas alcalinas) se realizaron por medios automatizados estándar.
Protocolo de intervenciónEn todos los pacientes diagnosticados de CANPP, se procedió a recoger los datos de las determinaciones seriadas de GOT, GPT, GGT, BT, bilirrubina indirecta y BD, y se diferenciaron 2 grupos: aquellos pacientes tratados con AUDC y los que no recibieron este tratamiento, que sirvieron de grupo control. El tratamiento consistía en AUDC en dosis de 15 a 30 mg/kg/día repartido en 2 dosis de forma continua hasta la normalización de la analítica y siempre bajo control del Servicio de Gastroenterología. La indicación o no del tratamiento se individualizó en cada caso por parte de los gastroenterólogos y se siguieron criterios clínicos (edad gestacional, curva ponderal, características de las heces, marcadores bioquímicos). Al tratarse de un estudio retrospectivo, no hubo unos criterios totalmente uniformes con las limitaciones que se suponen a la hora de evaluar los resultados.
Análisis estadísticoSe efectuaron las valoraciones estadísticas descriptivas para todos los parámetros estudiados. Dado el número limitado de pacientes, se realizaron las comparaciones mediante la utilización de pruebas no paramétricas, se utilizó el test de la U de Mann-Whitney para variables emparejadas y la prueba de Kruskal-Wallis para variables no emparejadas o independientes. Las diferencias se consideraron estadísticamente significativas para una alfa inferior a 0,05. La comparación de la evolución temporal de los datos se realizó mediante la utilización del logrank test, que permitió obtener el valor de p en cada punto temporal y determinar las diferencias entre grupos14.
Se realizó un estudio de regresión simple para correlacionar las concentraciones plasmáticas de valores bioquímicos de daño hepatocelular y obstrucción de vías biliares con el tiempo de nutrición parenteral total. Para los cálculos se utilizó el Statistical Package for the Social Sciences versión 11.0 (SPSS® Chicago; Illinois; EE. UU.).
ResultadosParámetros demográficos y etiológicosEn total se seleccionaron 24 pacientes, sus datos clínicos y epidemiológicos más importantes vienen resumidos en la tabla 1. De los 24 casos estudiados, 15 (62,5%) fueron prematuros y, de ellos, la CANPP se dio preferentemente entre los prematuros de menos de 32 semanas de gestación. También cabe destacar que 23 pacientes (95,6%) tuvieron un cuadro clínico etiquetado como sepsis clínica (confirmada o no bacteriológicamente), se confirmó la asociación de prematuridad e infección como factores predisponentes esenciales en este proceso. La incidencia por sexo supone un predominio neto de los varones con un 62,5% de los pacientes de sexo masculino frente a un 37,5% de las pacientes de sexo femenino (tabla 1). Sin embargo, no hubo diferencias entre ambos grupos (AUDC y no AUDC) en cuanto a sexo, edad de gestación, o etiologías asociadas (malformaciones, cirugía o infecciones) como se indica en la tabla 1.
Tabla 1. Características de los pacientes con colestasis secundaria a nutrición parenteral prolongada que han recibido y no han recibido ácido ursodesoxicólico para el tratamiento de la colestasis
| UDCA (n=14) | No UDCA (n=7) | p | |
| Sexo (M/F) | 9/5 | 4/3 | NS |
| Peso al nacimiento (g)a | 1.560 (1.225, 2.050) | 1.480 (1.145, 2.210) | NS |
| Edad gestacional (semanasa) | 32 (28, 36) | 31 (28, 36) | NS |
| Duración de la nutrición parenteral (días)a | 21 (17, 39) | 24 (16, 44) | NS |
| Aaminotransferasa glutamicoxalacéticab (valor máximo en U/l) | 192,7±152 | 215,5±134 | NS |
| Aminotransferasa glutamicopirúvicab (valor máximo en U/l) | 108,6±91,01 | 114,9±77,04 | NS |
| Gammaglutamil transpeptidasab (valor máximo en U/l) | 258,04±118,22 | 334,16±99,44 | <0,05 |
| Bilirrubina conjugadab (valor máximo en mg/dl) | 4,3±2,57 | 7,6±1,88 | <0,05 |
| Cirugía intestinal con/sin resección | 3/14 | 2/7 | NS |
F: femenino; M: masculino; NS: no significativo; UDCA: ácido ursodesoxicólico. Significación: p<0,05 frente a UDCA.
a Valores expresados en mediana (P 50) e intercuartiles (P 25 y P 75, respectivamente) entre paréntesis.
b Valores expresados en media ± desviación estándar.
Parámetros bioquímicos de daño hepatocelular
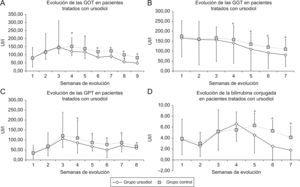
Los paneles A y B de la figura 1 muestran la evolución de los valores plasmáticos de aminotransferasas. En las primeras semanas de inicio del tratamiento se observa un incremento similar en ambos grupos (control y tratado). Sin embargo, a partir de las 3.a semana de iniciado el tratamiento, los valores de aminotransferasas del grupo tratado comienzan a disminuir mientras que en el grupo control permanecen elevadas. Esta diferencia persiste pasadas 5 semanas de tratamiento y es estadísticamente significativa (p<0,05).
Figura 1. Evolución de los biomarcadores de daño hepático y de enzimas indicadoras de colestasis en pacientes afectados de colestasis por nutrición parenteral prolongada tratados o no con ácido ursodesoxicólico (Ursodiol®). Panel A: aminotransferasas glutamicoxalacéticas o aspartato aminotransferasas; Panel B: aminotransferasas glutamicopirúvicas o alanina-aminotransferasas; Panel C: gammaglutamil transpeptidasas; Panel D: bilirrubina conjugada.
Parámetros bioquímicos indicadores de colestasis
La figura 1 en el panel C muestra cifras de GGT que están inicialmente incrementadas en ambos grupos. Sin embargo, a partir de las 4 semanas de iniciado el tratamiento se observa un descenso significativo en el grupo tratado con AUDC, que fue significativo en las siguientes semanas en las que se realizaron controles (p<0,05). Las cifras de bilirrubina conjugada (fig. 1 panel D) aparecen inicialmente incrementadas en ambos grupos, pero luego experimentan un descenso significativo a partir de las 5 semanas de iniciado el tratamiento con AUDC (p<0,05).
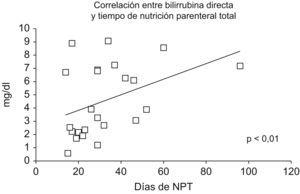
La correlación entre las cifras de BD o conjugada máxima plasmática y el tiempo de nutrición parenteral total ha sido altamente significativo (p<0,01), como se demuestra en el cálculo del coeficiente de regresión para estos parámetros (fig. 2).
Figura 2. Correlación lineal entre los días de nutrición parenteral total y la bilirrubina directa plasmática (mg/dl). El valor de coeficiente de correlación (R2) es significativo (p<0,01).
Discusión
La supervivencia de los recién nacidos de extremada baja edad gestacional ha tenido como consecuencia el incremento en la incidencia y la gravedad de la enfermedad asociada a la inmadurez. Estos pacientes son especialmente susceptibles a sufrir infecciones, que con frecuencia tienen como complicación la afectación del aparato digestivo, lo que obliga muchas veces a la suspensión de la nutrición enteral y el paso a la nutrición parenteral total durante períodos prolongados de tiempo.
En este estudio, al igual que se refleja en la literatura médica, los pacientes aquejados de CANPP son la mayoría prematuros (62,5%) y prácticamente la totalidad (95,5%) había padecido con antelación a la colestasis un proceso infeccioso generalizado de carácter nosocomial. Los mecanismos que explicarían la acción favorecedora de la secreción biliar por el AUDC incluyen la corrección de la deficiencia de ácidos biliares, la mejoría del flujo biliar, el desplazamiento de los ácidos biliares citotóxicos (cólico y litocólico), y la administración de mecanismos citoprotectores, estabilizadores de membrana e inmunomoduladores. De todos modos, estos últimos están todavía en discusión, y hay en la actualidad un estudio prospectivo aleatorizado en marcha con pacientes neonatales para dilucidar finalmente la utilidad de este fármaco15–19.
Dentro de los estudios publicados, Chen et al15 realizaron un estudio retrospectivo en prematuros por debajo de 1.500 g en el que se seleccionaron 30 pacientes, 12 tratados con AUDC y 18 no tratados, durante un período de tiempo similar al de este estudio. Los pacientes recibieron la medicación de forma profiláctica, a diferencia de los pacientes de este estudio. Los resultados obtenidos por este grupo parecen indicar que la acción del AUDC logró frenar la instauración de la colestasis y, sobre todo, disminuir el tiempo hasta su resolución. En este estudio el tratamiento se inició cuando la colestasis ya estaba establecida, lo que podría haber dificultado el efecto favorecedor. Así, Chen et al15 encontraron una disminución de los valores pico de la bilirrubina conjugada, mientras que en este estudio los valores máximos fueron similares y no se comenzaron a encontrar diferencias hasta pasadas varias semanas de tratamiento. Estos datos, en este caso, han de ser interpretados con cautela, ya que no se trata de un estudio aleatorizado y el retraso en la mejoría de los parámetros podría estar en relación con el paso del tiempo y la mayor edad gestacional corregida. Sin embargo, hay que tener en cuenta que las diferencias encontradas entre ambos grupos se mantuvieron en el tiempo. Así, la administración del AUDC después de iniciada la colestasis podría tener menor efectividad y un intervalo libre mayor hasta que se observe el descenso en los valores plasmáticos de los marcadores de colestasis.
Por otra parte, se ha observado una correlación directa entre las cifras de bilirrubina conjugada y la duración de la nutrición parenteral. Parece que la mejoría de los parámetros bioquímicos tras la administración del AUDC no estaría en relación con el resultado final de la colestasis excepto para la bilirrubina conjugada, que sí parece ser el predictor más fiable de la evolución de la hepatopatía a largo plazo16. Los efectos citoprotectores del AUDC no están claramente establecidos. En estos pacientes, aunque se ha podido detectar un moderado descenso, no ha sido estadísticamente significativo, tal vez por el tamaño de la muestra y las limitaciones en el diseño del estudio. Algunos autores en series muy pequeñas encontraron un descenso de GOT, GPT y lactatodeshidrogenasa en pacientes pediátricos con CNPP, con un efecto de rebote al suprimir la medicación que ocasionó una subida de los valores de las enzimas en plasma17. Sin embargo, el estudio de Chen C.Y. et al no indica variación alguna en el valor de aminotransferasas en pacientes tratados profilácticamente con AUDC15. Es más, en una amplia y reciente revisión de la literatura médica no se ha podido constatar un efecto beneficioso sobre la toxicidad hepática del AUDC traducido por un descenso de las aminotransferasas, pero sí es cierto que los autores con mayor experiencia señalan el beneficio del AUDC como profiláctico de la colestasis en pacientes de alto riesgo18,19. Sin embargo, en el momento de publicación de este estudio, todavía no se dispone de datos a largo plazo sobre complicaciones hepáticas secundarias que permitan diferenciar el grupo tratado con AUDC del que no lo fue.
En conclusión, este trabajo, con las limitaciones de diseño que presenta, apunta, al igual que la literatura médica, a que la utilización del AUDC en el tratamiento de la CNPP parece ser eficaz en disminuir los valores bioquímicos relacionados con la colestasis, pero no con la citotoxicidad. Por tanto, los beneficios a largo plazo sobre el hepatocito no se han establecido. La dosis de 30 mg/kg/día es segura y bien tolerada y parece ser la ideal de acuerdo con la presente experiencia y la reflejada en la literatura médica15–19. Sin embargo, hacen falta más estudios para establecer la dosificación óptima y el tiempo de duración del tratamiento para el período neonatal. Así, en pacientes con síndrome de intestino corto esta dosificación puede no ser del todo eficaz, ya que el AUDC se absorbe en el intestino delgado. La utilización del AUDC debe ser precoz para lograr cuanto antes un descenso de los parámetros de riesgo. La utilización profiláctica del AUDC en pacientes de alto riesgo de desarrollo de CANPP debería ser objeto de un estudio prospectivo aleatorizado con una serie amplia de pacientes con potencia estadística suficiente para poder demostrar la reducción del daño hepático, el grado y la duración de la colestasis y, en un seguimiento a largo plazo, la aparición de complicaciones hepatobiliares crónicas en estos pacientes.
Autor para correspondencia.
M. Vento
Dirección: maximo.vento@uv.es