Ante la posible coexistencia de la infección por el virus SARS-CoV-2 con otras infecciones estacionales, se pretende identificar síntomas diferenciales. Se ha estudiado el papel de los niños en el contagio intrafamiliar y la sensibilidad de la reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) en un área con baja transmisión comunitaria.
Material y métodosEstudio observacional transversal. Pacientes entre 0-15 años estudiados por técnica RT-PCR por sospecha clínica de infección por virus SARS-CoV-2 en los meses de marzo-mayo del 2020. Encuesta sobre síntomas y contactos. Determinación de anticuerpos anti-SARS-CoV-2 al menos 21 días después del test RT- PCR.
ResultadosSe incluyó a 126 pacientes, 33 con infección confirmada y edad media 8,4 años (IC del 95%, 6,8-10,0), edad superior a los no infectados. La fiebre fue el síntoma más común y con mayor sensibilidad. Las diferencias encontradas fueron una mayor frecuencia de anosmia (p=0,029) y cefalea (p=0,009) entre los niños infectados con una especificidad del 96,7 y el 81,5% respectivamente. No hubo diferencias en la duración de los síntomas.
Un 81,8% de los infectados fue probablemente contagiado en el núcleo familiar, en un 85,2% por un progenitor que trabajaba fuera del hogar. La sensibilidad de RT-PCR fue 70,9% y su valor predictivo negativo 91,1%.
ConclusionesEl cuadro clínico es inespecífico y los síntomas más específicos difíciles de detectar en niños más pequeños. Los niños tuvieron un papel reducido en la transmisión intrafamiliar. La sensibilidad de la RT-PCR podría estar relacionada con una menor contagiosidad infantil tras una semana de infección.
Given the possible coexistence of infection by the SARS-CoV-2 with other seasonal infections, the aim is to identify differential symptoms. There has been studied the role of children in intrafamily contagion and the sensitivity of reverse transcriptase polymerase chain reaction (RT-PCR) in an area with low community transmission.
Material and methodsCross-sectional observational study. Patients between 0-15 years studied by RT-PCR technique due to clinical suspicion of infection by SARS-CoV-2 virus in the months of March-May 2020. Survey on symptoms and contacts. Determination of Anti-SARS-CoV-2 antibodies at least 21 days after the RT-PCR test.
Results126 patients were included, 33 with confirmed infection and mean age 8.4 years (95% CI 6.8-10,5), age higher than not infected. Fever was the most common symptom and with greater sensitivity. The differences found were a greater frequency of anosmia (P=0.029) and headache (P=.009) among children infected with a specificity of 96.7% and 81.5% respectively. There were no differences in the duration of the symptoms. 81.8% of those infected were probably infected in the family nucleus, 85.2% by a parent who worked outside the home. The sensitivity of RT-PCR was 70.9% and its negative predictive value 91.1%.
ConclusionsThe clinical picture is nonspecific and the more specific symptoms difficult to detect in younger children. Children had a reduced role in the intrafamily transmission. The sensitivity of RT-PCR could be related to a less contagiousness in children after one week of infection.
Desde el inicio de la actual pandemia por el virus SARS-CoV-2, el papel de los niños como vectores del contagio se ha ido redefiniendo. En un primer momento, fueron considerados importantes vehículos de transmisión, probablemente por extrapolación con lo que sucede con otros virus, como la gripe1. Estudios posteriores han ido cuestionando su capacidad de contagio, especialmente la de los menores de 10 años2-4. En nuestra comunidad autónoma se implantaron las medidas de confinamiento poblacional en un momento en que la tasa de transmisión comunitaria era relativamente baja. La incidencia acumulada alcanzada por esta infección en nuestra población pediátrica, entre los meses de marzo y junio, en los que estuvo vigente el estado de alarma, fue inferior a la de otros territorios5-7. Los estudios de seroprevalencia en nuestra área estimaron una tasa de contagio del 2,0% en la población general y del 0,5% en menores de 15 años, siendo en España del 3,0% en menores de 10 años8,9.
Nuestro sistema sanitario estableció medidas, como circuitos asistenciales diferenciales para el aislamiento de pacientes o dispositivos de diagnóstico móvil, que contribuyeron a reducir la transmisión. En el Servicio de Urgencias Pediátricas, se estableció un protocolo de cribado de infección, mediante la técnica de reacción de cadena de la polimerasa con transcriptasa inversa (RT-PCR) para virus SARS-CoV-2 en muestra nasofaríngea ante cualquier caso de sospecha. Los criterios clínicos se fueron modificando según avanzaba el conocimiento de la enfermedad (tabla 1).
Síntomas y signos que indicaron la realización de RT-PCR en el Servicio de Urgencias de Pediatría durante el período de estudio
| Fiebre |
| Tos |
| Dificultad respiratoria |
| Odinofagia |
| Anosmia/hiposmia |
| Ageusia/disgeusia |
| Mialgias |
| Cefalea |
| Dolor torácico |
| Rinorrea |
| Diarrea |
| Lesiones cutáneas compatibles con vasculitis |
En previsión de la coexistencia en época otoñal-invernal de la infección por virus SARS-CoV-2 con otras infecciones producidas por virus estacionales, planteamos el presente estudio con el objetivo principal de identificar características clínicas diferenciales de la infección por el virus SARS-CoV-2. Como objetivos secundarios se busca estudiar las posibles rutas de contagio en niños, en un área donde apenas hubo transmisión comunitaria y evaluar su papel en la transmisión dentro del núcleo familiar. Por último, se estudiará la rentabilidad de las técnicas de diagnóstico mediante RT-PCR, no bien establecidas en la población pediátrica, con respecto a otros métodos diagnósticos10.
MétodosSe trata de un estudio observacional transversal. Los padres o tutores legales de los menores otorgaron consentimiento informado para su participación, en mayores de 12 años se solicitó también su consentimiento. El estudio fue autorizado por el Comité Autonómico de Ética de la Investigación de Galicia (Código 2020/275).
Población de referencia: nuestra población de referencia comprende a 73.000 niños. Se invitó a participar a todos los pacientes pediátricos (0-15 años) estudiados mediante técnica de RT-PCR nasofaríngea realizada por sospecha clínica de infección por virus SARS-CoV-2 durante el período de estudio.
Criterios de inclusión: todos los pacientes entre 0 y 15 años tratados mediante test RT-PCR por sospecha clínica durante el período de estudio cuyos padres/tutores legales otorgaron consentimiento y no cumplían ninguno de los criterios de exclusión.
Criterios de exclusión: pacientes con inmunodeficiencia por déficit de inmunoglobulinas (Ig) séricas. Se excluyó del estudio a los pacientes a los que se solicitó RT-PCR en estudio de contactos asintomáticos.
Período de estudio: marzo-mayo del 2020, meses posteriores a decretarse el estado de alarma y el confinamiento poblacional.
Técnicas diagnósticas: la extracción de ácidos nucleicos de las muestras nasofaríngeas se realizó mediante el instrumento STARlet (Microlab) con el cartucho de extracción STARMag 96×4 Universal Cartridge Kit. La amplificación y la detección fueron realizadas en un termociclador CFX-96 system (Bio-Rad Laboratories, Hercules, CA, EE. UU.) mediante el kit Allplex™ 2019-nCoV assay (Seegene In, Seúl, Corea del Sur). Esta técnica amplifica 3dianas virales: la ARN polimerasa dependiente de ARN (RdRP) y el gen de nucleocápside (N) específicos para SARS-CoV-2, y una región conservada en el gen E, que codifica una proteína estructural de la envuelta de los Sarbecovirus. Todos los pacientes incluidos en el estudio fueron tratados mediante un análisis para la determinación de la presencia de anticuerpos anti-SARS-CoV-2 tipo IgA e IgG3,4, semanas después de la realización de RT-PCR. La determinación se realizó mediante la técnica Euroimmun Anti-SARS-CoV-2 ELISA IgG e IgA (Euroimmun) que detecta anticuerpos IgG o IgA dirigidos a la subunidad S1 incluyendo el receptor RBD de la proteína Spike.
Entrevista estructurada: todos los pacientes fueron tratados mediante una encuesta sobre manifestaciones clínicas y posibles rutas de transmisión realizado al tiempo que el análisis serológico. Los datos fueron obtenidos por 2de los investigadores mediante entrevista estructurada al progenitor que acompañaba a paciente, junto con este si era mayor de 10 años. Se preguntó específica e individualmente por la presencia y la duración de una lista de síntomas y signos previamente establecidos por los investigadores (tablas 2-4).
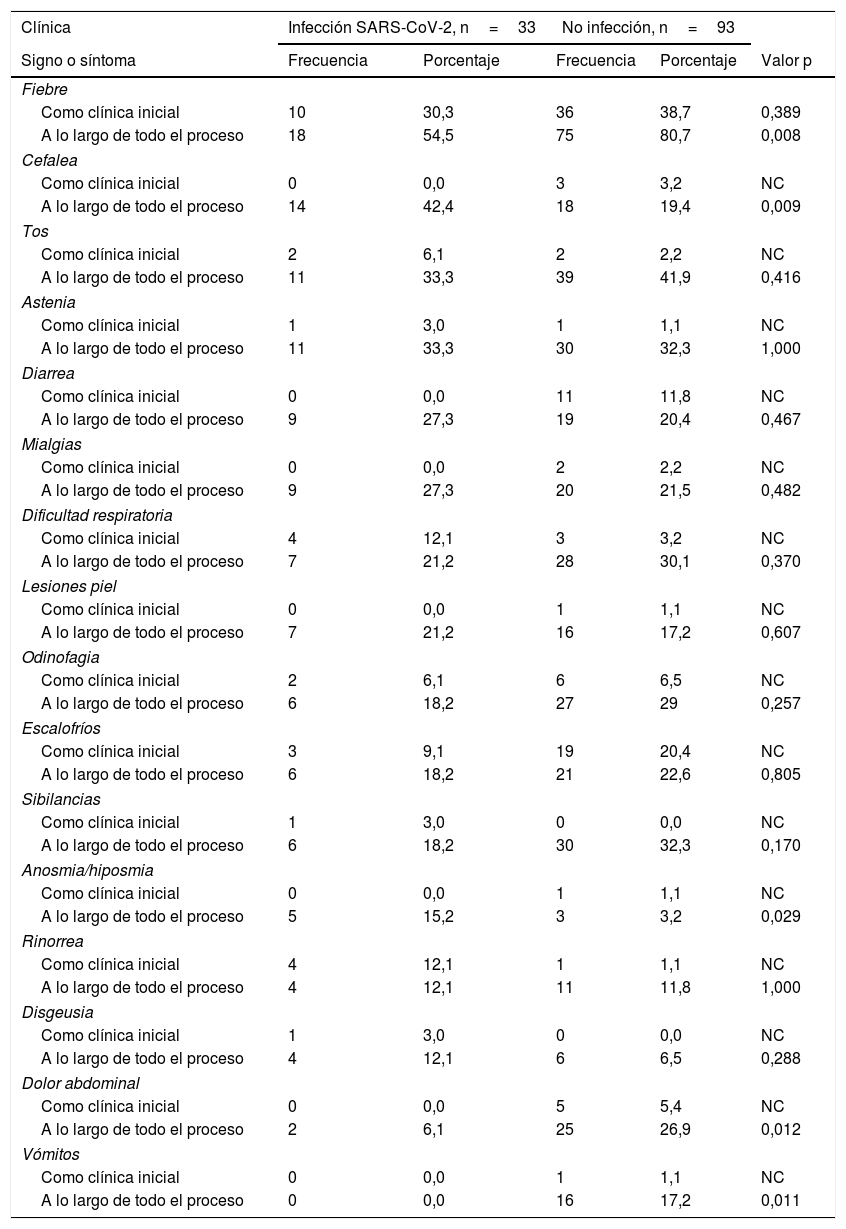
Frecuencia de las diferentes manifestaciones clínicas entre niños con infección confirmada por virus SARS-CoV-2 y niños con sospecha clínica no confirmada
| Clínica | Infección SARS-CoV-2, n=33 | No infección, n=93 | |||
|---|---|---|---|---|---|
| Signo o síntoma | Frecuencia | Porcentaje | Frecuencia | Porcentaje | Valor p |
| Fiebre | |||||
| Como clínica inicial | 10 | 30,3 | 36 | 38,7 | 0,389 |
| A lo largo de todo el proceso | 18 | 54,5 | 75 | 80,7 | 0,008 |
| Cefalea | |||||
| Como clínica inicial | 0 | 0,0 | 3 | 3,2 | NC |
| A lo largo de todo el proceso | 14 | 42,4 | 18 | 19,4 | 0,009 |
| Tos | |||||
| Como clínica inicial | 2 | 6,1 | 2 | 2,2 | NC |
| A lo largo de todo el proceso | 11 | 33,3 | 39 | 41,9 | 0,416 |
| Astenia | |||||
| Como clínica inicial | 1 | 3,0 | 1 | 1,1 | NC |
| A lo largo de todo el proceso | 11 | 33,3 | 30 | 32,3 | 1,000 |
| Diarrea | |||||
| Como clínica inicial | 0 | 0,0 | 11 | 11,8 | NC |
| A lo largo de todo el proceso | 9 | 27,3 | 19 | 20,4 | 0,467 |
| Mialgias | |||||
| Como clínica inicial | 0 | 0,0 | 2 | 2,2 | NC |
| A lo largo de todo el proceso | 9 | 27,3 | 20 | 21,5 | 0,482 |
| Dificultad respiratoria | |||||
| Como clínica inicial | 4 | 12,1 | 3 | 3,2 | NC |
| A lo largo de todo el proceso | 7 | 21,2 | 28 | 30,1 | 0,370 |
| Lesiones piel | |||||
| Como clínica inicial | 0 | 0,0 | 1 | 1,1 | NC |
| A lo largo de todo el proceso | 7 | 21,2 | 16 | 17,2 | 0,607 |
| Odinofagia | |||||
| Como clínica inicial | 2 | 6,1 | 6 | 6,5 | NC |
| A lo largo de todo el proceso | 6 | 18,2 | 27 | 29 | 0,257 |
| Escalofríos | |||||
| Como clínica inicial | 3 | 9,1 | 19 | 20,4 | NC |
| A lo largo de todo el proceso | 6 | 18,2 | 21 | 22,6 | 0,805 |
| Sibilancias | |||||
| Como clínica inicial | 1 | 3,0 | 0 | 0,0 | NC |
| A lo largo de todo el proceso | 6 | 18,2 | 30 | 32,3 | 0,170 |
| Anosmia/hiposmia | |||||
| Como clínica inicial | 0 | 0,0 | 1 | 1,1 | NC |
| A lo largo de todo el proceso | 5 | 15,2 | 3 | 3,2 | 0,029 |
| Rinorrea | |||||
| Como clínica inicial | 4 | 12,1 | 1 | 1,1 | NC |
| A lo largo de todo el proceso | 4 | 12,1 | 11 | 11,8 | 1,000 |
| Disgeusia | |||||
| Como clínica inicial | 1 | 3,0 | 0 | 0,0 | NC |
| A lo largo de todo el proceso | 4 | 12,1 | 6 | 6,5 | 0,288 |
| Dolor abdominal | |||||
| Como clínica inicial | 0 | 0,0 | 5 | 5,4 | NC |
| A lo largo de todo el proceso | 2 | 6,1 | 25 | 26,9 | 0,012 |
| Vómitos | |||||
| Como clínica inicial | 0 | 0,0 | 1 | 1,1 | NC |
| A lo largo de todo el proceso | 0 | 0,0 | 16 | 17,2 | 0,011 |
Ordenadas según su frecuencia entre los niños infectados.
NC: no calculada por tamaño muestral
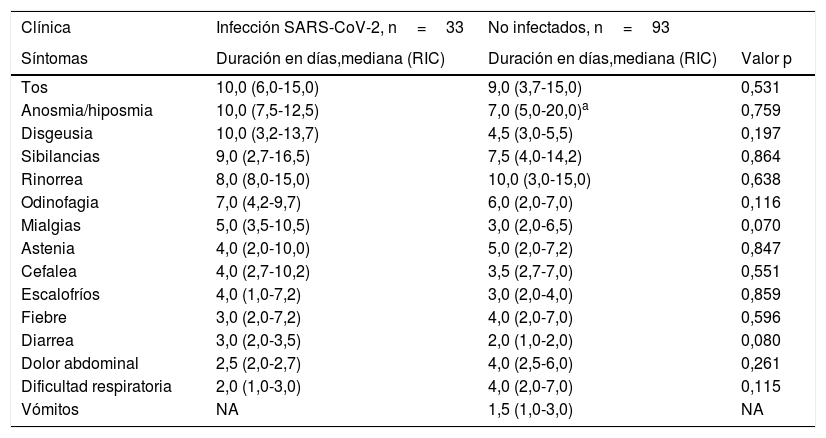
Duración (días) de las diferentes manifestaciones clínicas entre niños con infección confirmada por virus SARS-CoV-2 y niños con sospecha no confirmada
| Clínica | Infección SARS-CoV-2, n=33 | No infectados, n=93 | |
|---|---|---|---|
| Síntomas | Duración en días,mediana (RIC) | Duración en días,mediana (RIC) | Valor p |
| Tos | 10,0 (6,0-15,0) | 9,0 (3,7-15,0) | 0,531 |
| Anosmia/hiposmia | 10,0 (7,5-12,5) | 7,0 (5,0-20,0)a | 0,759 |
| Disgeusia | 10,0 (3,2-13,7) | 4,5 (3,0-5,5) | 0,197 |
| Sibilancias | 9,0 (2,7-16,5) | 7,5 (4,0-14,2) | 0,864 |
| Rinorrea | 8,0 (8,0-15,0) | 10,0 (3,0-15,0) | 0,638 |
| Odinofagia | 7,0 (4,2-9,7) | 6,0 (2,0-7,0) | 0,116 |
| Mialgias | 5,0 (3,5-10,5) | 3,0 (2,0-6,5) | 0,070 |
| Astenia | 4,0 (2,0-10,0) | 5,0 (2,0-7,2) | 0,847 |
| Cefalea | 4,0 (2,7-10,2) | 3,5 (2,7-7,0) | 0,551 |
| Escalofríos | 4,0 (1,0-7,2) | 3,0 (2,0-4,0) | 0,859 |
| Fiebre | 3,0 (2,0-7,2) | 4,0 (2,0-7,0) | 0,596 |
| Diarrea | 3,0 (2,0-3,5) | 2,0 (1,0-2,0) | 0,080 |
| Dolor abdominal | 2,5 (2,0-2,7) | 4,0 (2,5-6,0) | 0,261 |
| Dificultad respiratoria | 2,0 (1,0-3,0) | 4,0 (2,0-7,0) | 0,115 |
| Vómitos | NA | 1,5 (1,0-3,0) | NA |
Ordenadas según su mayor duración en los casos.
NA: no aplica; RIC: rango intercuartílico.
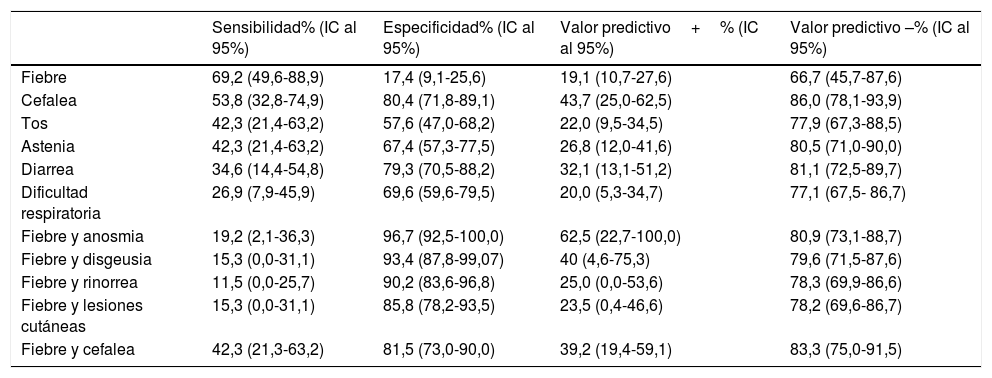
Capacidad diagnóstica expresada mediante los valores de sensibilidad, especificidad, valor predictivo para los principales síntomas y asociaciones de los mismos
| Sensibilidad% (IC al 95%) | Especificidad% (IC al 95%) | Valor predictivo+% (IC al 95%) | Valor predictivo –% (IC al 95%) | |
|---|---|---|---|---|
| Fiebre | 69,2 (49,6-88,9) | 17,4 (9,1-25,6) | 19,1 (10,7-27,6) | 66,7 (45,7-87,6) |
| Cefalea | 53,8 (32,8-74,9) | 80,4 (71,8-89,1) | 43,7 (25,0-62,5) | 86,0 (78,1-93,9) |
| Tos | 42,3 (21,4-63,2) | 57,6 (47,0-68,2) | 22,0 (9,5-34,5) | 77,9 (67,3-88,5) |
| Astenia | 42,3 (21,4-63,2) | 67,4 (57,3-77,5) | 26,8 (12,0-41,6) | 80,5 (71,0-90,0) |
| Diarrea | 34,6 (14,4-54,8) | 79,3 (70,5-88,2) | 32,1 (13,1-51,2) | 81,1 (72,5-89,7) |
| Dificultad respiratoria | 26,9 (7,9-45,9) | 69,6 (59,6-79,5) | 20,0 (5,3-34,7) | 77,1 (67,5- 86,7) |
| Fiebre y anosmia | 19,2 (2,1-36,3) | 96,7 (92,5-100,0) | 62,5 (22,7-100,0) | 80,9 (73,1-88,7) |
| Fiebre y disgeusia | 15,3 (0,0-31,1) | 93,4 (87,8-99,07) | 40 (4,6-75,3) | 79,6 (71,5-87,6) |
| Fiebre y rinorrea | 11,5 (0,0-25,7) | 90,2 (83,6-96,8) | 25,0 (0,0-53,6) | 78,3 (69,9-86,6) |
| Fiebre y lesiones cutáneas | 15,3 (0,0-31,1) | 85,8 (78,2-93,5) | 23,5 (0,4-46,6) | 78,2 (69,6-86,7) |
| Fiebre y cefalea | 42,3 (21,3-63,2) | 81,5 (73,0-90,0) | 39,2 (19,4-59,1) | 83,3 (75,0-91,5) |
Variables de estudio: las variables clínicas estudiadas fueron la edad, el sexo, la fecha de inicio de los síntomas, el cuadro clínico inicial, otros síntomas y signos surgidos en cualquier momento de la evolución y la duración de cada uno de ellos, la identificación mediante fotografía de lesiones cutáneas (urticaria, perniosis, exantema). Fecha del contacto con persona/s infectada/s por virus SARS-CoV-2 y descripción del contacto, número y parentesco de los familiares afectados, gravedad de los casos infectados intrafamiliares, secuencia de contagio intrafamiliar y número de convivientes.
Análisis estadístico: para el análisis descriptivo, las variables cualitativas se describieron con frecuencia y porcentaje y las cuantitativas con mediana y rango intercuartílico (RIC) o media e intervalo de confianza (IC del 95%). Se estudiaron la sensibilidad, la especificidad, el valor predictivo positivo y el valor predictivo negativo de RT-PCR, considerando como prueba de referencia el análisis de anticuerpos anti-SARS-CoV-2 tipo IgG. Se definieron 2grupos de pacientes, aquellos con un resultado positivo en alguna de las pruebas frente a otros con los 2resultados negativos. Una vez definidos los 2grupos se compararon para las distintas variables del estudio. Para la comparación de 2variables cualitativas se utilizó la prueba de la chi al cuadrado. Si una de las variables era cuantitativa, se analizó la normalidad de la distribución de los datos con el test de Shapiro Wilk y se aplicó la prueba de Mann-Whitney ya que ninguna variable se ajustó a una distribución normal en los grupos considerados. Para la comparación de 2variables cuantitativas se utilizó la correlación de Spearman. Por último, se calculó la capacidad diagnóstica de los síntomas de acuerdo con sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo. Se estableció un nivel de significación estadística bilateral de p<0,05 para todos los contrastes de hipótesis. Los datos fueron analizados con SPSS (IBM) versión 19 y EPIDAT 3.1 (Xunta de Galicia).
ResultadosSe incluyó a 126 pacientes, 33 de ellos corresponden a los infectados y 93 a los no infectados. Esto supone que los menores de 15 años supusieron el 2,2% del total de infectados en nuestra área durante el período de estudio, puesto que se diagnosticaron un total de 1.650 pacientes.
La incidencia acumulada de infección confirmada en esta franja de edad en nuestra población fue del 0,04%. Entre ambos grupos no se obtuvieron diferencias significativas (p=0,535) en cuanto al sexo (66,7 vs. 59,1% varones, respectivamente), aunque sí con respecto a la edad (p=0,035).
Los niños/as en los que se confirmó la infección tenían una edad media superior, 8,4 años (IC del 95%, 6,8-10,0) frente a los no infectados 6,5 años (IC del 95%, 5,7-7,4). La frecuencia de los síntomas, tanto al inicio como durante todo el proceso, y su duración en ambos grupos pueden verse en las tablas 2 y 3.
En cuanto a las manifestaciones clínicas iniciales, la más frecuente en ambos grupos fue la fiebre, sin hallarse diferencias significativas entre grupos. En el grupo de infectados, tras la fiebre, los síntomas iniciales más comunes fueron dificultad respiratoria y rinorrea. Y entre los no infectados, escalofríos y diarrea. Ningún niño infectado refirió diarrea como primera manifestación y ningún niño no infectado refirió disgeusia ni anosmia como síntoma inicial.
En el curso de la evolución, la fiebre continuó siendo el dato más común, siendo significativamente más frecuente entre los no infectados (p=0,008) y entre los varones (p=0,039), seguido por la tos. No hubo diferencias entre los grupos en la frecuencia de disnea ni de síntomas constitucionales, como astenia o mialgias, asociados a la infección por virus SARS-CoV-2, ni tampoco de lesiones cutáneas, presentes en un 21,2% de los casos.
Las únicas diferencias encontradas entre ambos grupos fueron una mayor frecuencia de cefalea (p=0,009) y anosmia (p=0,029) entre los niños infectados. Por el contrario, la fiebre (p=0,008), los vómitos (p=0,011) y el dolor abdominal (p=0,012) fueron más frecuentes entre los no infectados. No se observaron diferencias en la duración de ninguno de los síntomas (tabla 3). La fiebre duró de mediana 3 días (RIC 2,0-7,2) en el grupo de infectados y 4 días (RIC 2,0-7,0) entre los no infectados.
Solo una paciente infectada de 14 años precisó ingreso hospitalario por neumonía bilateral de moderada gravedad que no precisó terapia intensiva. La capacidad diagnóstica de los principales síntomas, como la fiebre, la cefalea, la tos, la astenia, la diarrea y la dificultad respiratoria, en los niños sintomáticos se puede observar en la tabla 4. Analizando todos los síntomas presentados, aquel que ha mostrado mayor sensibilidad ha resultado ser la fiebre (69,23%) y los síntomas con mayor especificidad, anosmia (96,7%), disgeusia (93,4%), rinorrea (88,0%), lesiones piel (82,6%) y cefalea (80,4%). La asociación con fiebre aumenta la especificidad en todos los síntomas, excepto de la anosmia y disgeusia que mantienen los mismos valores ya de por sí elevados (tabla 4).
En cuanto a la vía del contagio, un 19,4% de los no infectados refirieron haber tenido un contacto estrecho con una persona infectada y sin embargo, no demostraron infección, encontrándose una diferencia significativa con los infectados (p<0,001) en los que un 66,7% tuvo un contacto estrecho con RT-PCR confirmada. En este grupo un 81,8%, frente a un 9,7% en el grupo no infectado, tuvieron familiares con síntomas (p<0,001).
El número medio de familiares afectados entre los infectados fue de 3,8 (IC del 95%, 3,4- 4,2) frente a 2,6 (IC del 95%, 0,9-4,4) entre los no infectados (p=0,026). Sin embargo, no hubo diferencias en cuanto al número de familiares que precisaron ingreso hospitalario, siendo un bajo porcentaje en ambos grupos.
Solo 6 de los 33 niños infectados no tuvieron ningún infectado en la familia y presumiblemente se contagiaron fuera de casa. En 3de ellos no se consiguió identificar el mecanismo de contagio. Entre los presumiblemente identificados se encuentra la paciente más grave de nuestra serie, quien no contagió a ningún miembro de su familia.
La vía más probable de contagio de esta paciente fue un profesor positivo del colegio con el que tuvo un contacto estrecho en los días previos al inicio de la clínica, como también sucedió en otros 2infectados con otro profesor y un compañero escolar adolescente, respectivamente.
La presencia de infección en la madre o en el padre fue significativamente mayor en el grupo de infectados (p<0,001). Entre los no infectados, 3 niños cuya madre estaba infectada no se infectaron y tampoco un niño con padre infectado. No hubo diferencias en cuanto a la presencia de infección de otros adultos en el núcleo familiar. En 19 (57,6%) infectados se detectó infección en otros niños de la familia (hermanos), antes o después del paciente, pero todos los niños siempre después del inicio de la clínica en los adultos, siendo significativo con respecto a los no infectados (p<0,001). La media de convivientes intrafamiliares fue de 4,6 entre los infectados.
Analizando el origen del brote intrafamiliar solo se consideró al propio sujeto en una paciente de sexo femenino y 13 años, contagiada presumiblemente en su colegio y que solo transmitió la infección a su madre. En el 85,2% de los pacientes infectados contagiados en su entorno familiar el origen fue uno de los progenitores, seguido por otros familiares (7,4%) y abuelos (3,7%). Se analizó la influencia del trabajo de los padres fuera de casa en el contagio. Se encontraron diferencias con un mayor porcentaje de madres (100%) (p=0,022) y padres (81,3%) (p=0,002) que estuvieron infectados entre aquellos que trabajaban fuera de casa, aunque no fuese directamente cara al público.
En los infectados con contacto bien establecido con una persona infectada se intentó determinar el período de incubación que presentó una mediana de 11,5 días (RIC 3,7-18,2).
En el contagio intrafamiliar la diferencia de días entre la aparición de clínica en el primer infectado familiar y los síntomas en el niño tuvo una mediana de 14 días (RIC 6,0-26,0).
En la mayoría de los pacientes infectados (87,9%) los síntomas de los adultos infectados precedieron a la clínica en el niño, en 3 casos fueron simultáneos. En un único caso la clínica del niño precedió a la del adulto.
Por último, se ha analizado la rentabilidad diagnóstica de las técnicas de RT-PCR. Teniendo en cuenta que 22 pacientes tuvieron un resultado positivo para RT-PCR y anticuerpos IgG, 11 tuvieron una IgG positiva siendo negativa la PCR y ningún paciente presentó un test de PCR positivo con IgG negativa. En la tabla 5 se pueden ver los datos de sensibilidad, especificidad y valor predictivo. La mediana desde la aparición de síntomas hasta la realización de RT-PCR fue 8 días (RIC 3,8-23,0) y hasta el primer análisis serológico 51 días (RIC 32,0-6,0). Todos los niños con una determinación de IgG negativa con IgA positiva fueron invitados a realizar una segunda determinación 3-4 semanas más tarde. Tres pacientes rechazaron participar y en el resto el título de IgG persistió negativo descartando la infección.
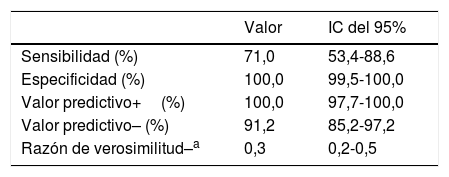
Sensibilidad, especificidad, valor predictivo positivo y negativo para RT-PCR
| Valor | IC del 95% | |
|---|---|---|
| Sensibilidad (%) | 71,0 | 53,4-88,6 |
| Especificidad (%) | 100,0 | 99,5-100,0 |
| Valor predictivo+(%) | 100,0 | 97,7-100,0 |
| Valor predictivo– (%) | 91,2 | 85,2-97,2 |
| Razón de verosimilitud–a | 0,3 | 0,2-0,5 |
Presentamos como principales hallazgos en este estudio las fuertes similitudes encontradas entre los datos clínicos presentes en los niños infectados por virus SARS-CoV- 2 frente a aquellos que no lo estaban. Así como las limitaciones diagnósticas de las técnicas empleadas.
El cuadro clínico registrado es altamente inespecífico y no ha permitido distinguir claramente qué síntomas o qué duración de los mismos podría relacionarse con esta infección.
Recientemente, ha sido publicada una revisión sistemática10 sobre la utilidad de distintos signos y síntomas clínicos para predecir la posibilidad de infección SARS-CoV-2 que solo incluye a pacientes adultos, al no existir en la literatura hasta la fecha datos referidos a niños en cuanto a sensibilidad y especificidad de las manifestaciones clínicas, tal y como se ha realizado en el presente estudio. Un tercio de los pacientes infectados presentó fiebre como primer síntoma, sin hallarse diferencias con los no infectados.
Los síntomas que han demostrado mayor especificidad frente a la infección, como la cefalea o las alteraciones del olfato, tal y como sucede en adultos10,11, son difíciles de detectar en niños de corta edad. Estas se presentaron más frecuentemente entre los infectados, especialmente entre los mayores de 10 años y su presencia podría incrementar la sospecha.
Las manifestaciones gastro-intestinales12-14, en general, han sido más frecuentes entre los no infectados, aunque la presencia de diarrea ha mostrado una especificidad del 79,3% para la infección. Y aunque no ha habido diferencias entre grupos en la frecuencia de las manifestaciones cutáneas, su presencia presenta una especificidad elevada y mayor si se asocia a fiebre15,16.
Se debe tener en cuenta que la incidencia acumulada de infección por virus SARS-CoV- 2 durante el período de confinamiento en menores de 15 años en nuestra área ha sido inferior a la registrada en otras series pediátricas de otros países o de otros territorios en nuestro país5-7,10. Nuestros datos de incidencia acumulada son inferiores a los obtenidos en los estudios serológicos poblacionales en nuestra área8,9, lo que sugiere una alta frecuencia de asintomáticos entre la población infantil. La mayor edad de los infectados, frente a los no infectados, reafirma lo mostrado en otros estudios poblacionales, donde los menores de 10 años demostraron una menor incidencia acumulada2-4. Estaría en discusión saber si este grupo etario se infecta menos o si las técnicas basadas en la detección de carga viral en la nasofaringe son menos rentables en este grupo17,18.
En cuanto a la vía de contagio, en nuestro estudio la intrafamiliar resultó ser la más frecuente, teniendo en cuenta la limitación de contactos establecido por el confinamiento19. Los adultos fueron el origen de los brotes intrafamiliares en la práctica totalidad de los casos del grupo de infectados, precediendo su clínica en 2semanas a la de los menores. Los progenitores han sido los principales vectores de transmisión frente a otros familiares, aun siendo convivientes, como los abuelos. Y de manera significativa aquellos padres que tenían que desplazarse a su puesto de trabajo fuera del domicilio. Es de destacar que aquellos niños contagiados fuera del núcleo familiar apenas contagiaron a sus familiares, un solo caso (3,0%), lo que apoya la potencial menor contagiosidad de los menores. Un estudio reciente realizado en Suiza, donde la población no estuvo confinada20,ha mostrado que solo en un 8,0% de las familias el paciente índice era un niño, otros estudios refieren porcentajes similares21. En otras revisiones no se ha logrado identificar la transmisión niño-adulto en el seno familiar22.
Las familias de nuestra serie son pequeñas, con lo que el contacto con sujetos infectados, al margen de las medidas prevención adoptadas, ha sido reducido y la tasa de inoculación del virus posiblemente menor. Ha sido estudiada la exposición a un mayor inóculo con una posible mayor gravedad. Guallar et al. han estudiado 3pequeños brotes en Madrid23. En 2no se realizaron medidas de distanciamiento social y en otro sí, siendo el curso de la enfermedad más leve. Otros autores postulan que un menor inóculo, por las medidas de distanciamiento social, podría explicar que actualmente el virus «teóricamente sea menos virulento» que al inicio de la pandemia.
La relación entre inóculo y gravedad clínica ya ha sido demostrada en otras infecciones como gripe, virus respiratorio sincitial o SARS24,25. Nuestros datos podrían apoyar esta relación, dada la escasa gravedad de nuestros pacientes infectados y de sus familiares con respecto a otras series, si bien hemos de ser cautos con esta afirmación, dado que no hemos analizado la edad ni la presencia de comorbilidades entre los familiares que podrían haber influido en la menor gravedad detectada26-28. Algunos estudios relacionan la presencia de una mayor carga viral con la gravedad y con el desarrollo de anticuerpos12,29,30.
La transmisión comunitaria ha sido limitada en nuestra serie, teniendo en cuenta el confinamiento poblacional existente durante el período de estudio. Existen dudas sobre el papel transmisor de la infección en la comunidad de la población pediátrica. Danis et al. describieron, previo a la suspensión generalizada de la actividad educativa, un brote en los Alpes franceses, donde un niño infectado no transmitió la infección a ninguno de sus 112 contactos considerados como de alto riesgo31. Otros estudios y la experiencia en varios países europeos tras la reapertura de escuelas en el mes de mayo parecen indicar una transmisión intraescolar reducida32,33.
En cuanto al test de RT-PCR, este resultó positivo en 1 de cada 5 niños analizados (17,0%). Esta baja positividad podría estar justificada por el número de pruebas realizado, dada la coexistencia temporal con otras infecciones, especialmente en el primer mes de estudio. Sin embargo, se ha tener en cuenta que algunos de los pacientes negativos demostraron infección tras el estudio serológico, lo que arroja unos resultados de sensibilidad (70,9%) y valor predictivo negativo (91,1%) limitados para la RT-PCR en esta población. Estos valores podrían estar relacionados con errores en la técnica de recogida de las muestras o con el número de días transcurrido desde el inicio de los síntomas, la mediana fue 8 días, cuando podría empezar a descender la carga viral34.
El intervalo de mayor contagiosidad transcurre entre 2días antes de la clínica hasta el día 7 coincidiendo con la mayor carga viral. Cabría también tener en cuenta una posible menor excreción viral a nivel de la vía respiratoria en los menores de 10 años, que podría relacionarse con su menor contagiosidad, especialmente transcurrida una semana del inicio de la infección. Aunque no hay evidencia clara de que aquellos con menor carga viral contagien menos ni que los pacientes infectados pediátricos asintomáticos presenten menor carga que los adultos12,35.
Como principales limitaciones de nuestro estudio destacamos el tamaño muestral y la posibilidad de extrapolar ciertos resultados, como las rutas de contagio, fuera de una situación de confinamiento poblacional. Así como, la imposibilidad de conocer la viremia y su posible influencia sobre la clínica. Al tratarse de datos clínicos recogidos mediante encuesta a los padres/pacientes y no exploración, el sesgo de memoria de los entrevistados o el derivado de su capacidad para identificar la clínica puede haber influido en los resultados.
Como conclusiones, queremos destacar la gran inespecificidad del cuadro clínico ligado a la infección por virus SARS-CoV-2, la dificultad de detectar los síntomas específicos entre aquellos de menor edad y el papel reducido de los niños en la transmisión intrafamiliar en situación de confinamiento. La sensibilidad detectada en la técnica RT-PCR podría estar relacionada con el descenso de la carga viral tras una semana de infección y, con relación a ello, tal vez podría suponerse una menor contagiosidad infantil tras este período.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.