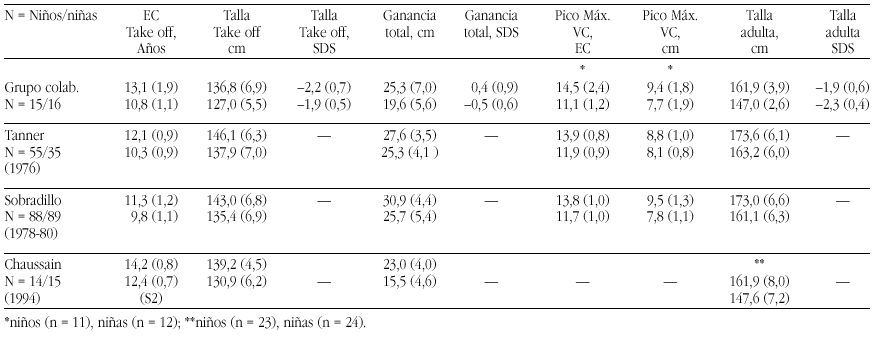
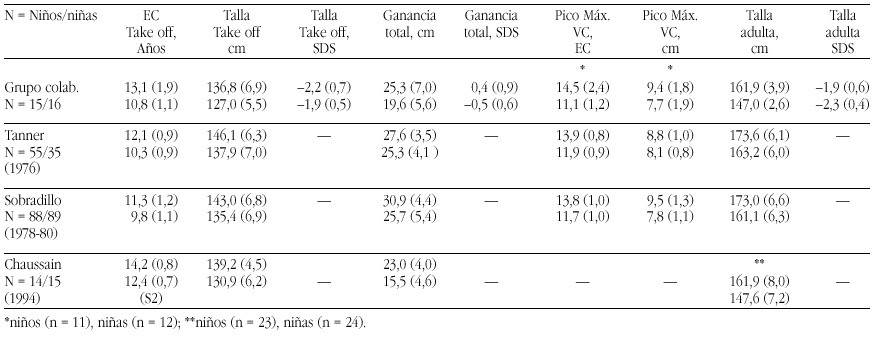
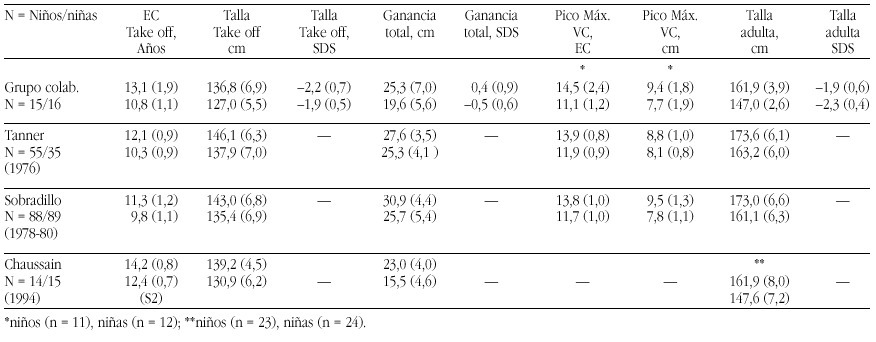
Pseudohipoaldosteronismo tipo I
Se trata de una condición hereditaria, descrita en 1958 por Cheek y Perry1, y caracterizada por pérdida salina, hipovolemia, hiponatremia, hiperkaliemia y acidosis metabólica, en presencia de niveles marcadamente elevados en plasma de actividad de renina y de aldosterona. Deben diferenciarse dos entidades clínica y genéticamente diferentes: en una la resistencia periférica a los mineralocorticoides está aparentemente presente en diversos órganos (forma múltiple), mientras que en la otra se limita exclusivamente al riñón (forma renal) (tabla 1).
Pseudohipoaldosteronismo tipo I (forma múltiple)
Se trata de una entidad poco frecuente, con herencia autosómica recesiva, en la que existe una aparente resistencia periférica a la acción de los mineralocorticoides en riñón, colon, glándulas sudoríparas y glándulas salivales2. Los padres de los enfermos son normales y no presentan elevación de la aldosterona plasmática. Esta forma clínica causa una pérdida salina de extrema gravedad y tiene peor pronóstico que la forma renal. Los episodios de pérdida salina pueden ya ocurrir inmediatamente tras el nacimiento y ser seguidos de muerte por colapso periférico. De manera característica la concentración de Cl y Na en el sudor está elevada lo que, unido a la frecuente aparición de infecciones respiratorias, puede inducir a confundir esta síndrome con la fibrosis quística del páncreas3,4).
Estudios recientes de biología molecular han demostrado que este proceso está causado por mutaciones "con pérdida de función" de uno de los genes codificantes de las subunidades proteicas que forman el canal epitelial de sodio (ENaC). El ENaC está formado por tres proteínas (a, b y g) que presentan dos terminales citoplásmicas, dos dominios transmembranosos y una larga asa extracelular5. La subunidad a parece ser fundamental para el correcto funcionamiento del complejo. Las tres subunidades son estructuralmente homogéneas y poseen un 35% de aminoácidos idénticos. Una posible topología de membrana es la de un complejo formado por 2 subunidades a, una subunidad b y una subunidad g6 (figura 1). El ENaC está presente en membranas epiteliales de riñón, pulmón, colon, glándulas exocrinas, piel y folículo piloso. Los genes que codifican las subunidades b (SNCC1B) y g (SNCC1G) están localizados en 16p12. El gen codificante de la subunidad a (SNCC1A) está localizado en 12p137. En la forma múltiple, autosómica recesiva, se han encontrado mutaciones homocigotas de las tres subunidades del ENaC, incluyendo mutaciones"missense", "nonsense" y con cambio del marco de lectura8-11. Los puntos críticos parecen estar situados en las zonas codificantes de segmentos extracelulares de la proteína ricos en cisteína12. Es interesante señalar que el síndrome de Liddle está causado por mutaciones con "ganancia de función" de los canales b y g del ENaC13.
La clínica depende de un transporte alterado de Na+ en numerosos órganos (riñón, pulmón, colon y glándulas exocrinas) con subsecuente pérdida salina por orina y heces y elevación de electrólitos en sudor y saliva. En conse cuencia, la elevación plasmática de los niveles de renina y aldosterona no son el resultado de un resistencia periférica propiamente dicha a la acción de los mineralocorticoides sino que derivan de la contracción sostenida del volumen del EEC. Los hallazgos reportados de una actividad reducida del enzima Na,K-ATPasa en membranas de hematíes son, sin duda, de carácter secundario.
La comprensión de la patogenia ha avanzado considerablemente mediante el desarrollo de ratones transgénicos en los que se ha abatido ("knock-out") la expresión de una de las subunidades a, b or g del ENaC. Es notable el hecho de que los ratones sin función de la subunidad aENaC mueren al nacimiento por incapacidad de eliminar el líquido alveolar fetal14. Si estos ratones se "rescatan" de la muerte por la inducción de la actividad aENaC pulmonar, desarrollan un cuadro completo de pseudohipoaldosteronismo con pérdida salina e hiperkaliemia15. Los ratones deficientes en actividades bENaC y gENaC no mueren de insuficiencia respiratoria neonatal y dearrollan también un cuadro de pérdida salina precoz y grave con hiperkaliemia, similar al observado en humanos16-18. Los hallazgos neonatales observados en ratones con deficiente expresión de aENaC solo se observan excepcionalmente en el ser humano con pseudohipoaldosteronismo19, probablemente porque el ENaC, si bien está formado por dos subunidades a alteradas, mantiene suficiente capacidad para transportar Na+ y absorber el líquido alveolar fetal10. Sin embargo, debe de existir un cierto grado de incapacidad de transportar Na+ a través de la vía aérea si consideramos la gran incidencia de infecciones pulmonares observada en estos enfermos20. Este transporte alterado deNa+ puede también demostrarse mediante la medición del voltaje transepitelial nasal21.
Pseudohipoaldosteronismo tipo I (forma renal)
Ocurre con mucha mayor frecuencia que la forma múltiple y se hereda con carácter autosómico dominante. Los enfermos presentan un cuadro clínico de pérdida salina renal, acidosis metabólica e hiperkaliemia pero no presentan alteraciones en pulmón, colon o glándulas exocrinas. Las manifestaciones clínicas son extremadamente variables, desde formas graves de pérdida salina neonatal con hiperkaliemia amenazante hasta formas que permanecen asintomáticas a lo largo de la vida22. Aunque el defecto primario es permanente la mayoría de los pacientes presentan una mejoría espontánea a partir de los 2 años de edad, probablemente como consecuencia de una mayor madurez funcional del transporte proximad de Na+, de un desarrollo del apetito por la sal y de una mejor respuesta renal a los mineralocorticoides23.
Estudios recientes de biología molecular han demostrado que esta forma dominante está causada por mutaciones con "pérdida de función" en el gen codificante de la síntesis del receptor de los mineralocorticoides. Este receptor es una proteína formada por 984 aminoácidos que pertenece a la gran familia de receptores esteroideos. Estos receptores están constituidos por un dominio inmunogénico, un dominio con "dedo" de cinc que se une al ADN y un dominio que se liga a la hormona, en este caso la aldosterona. En contraste con el receptor de los glucocorticodes que está presente en numerosos tejidos, la expresión génica del receptor de los mineralocorticoides se limita a células específicas de los túbulos renales distal y colector, del epitelio colónico y de los conductos de las glándulas exocrinas. En todos estos epitelios la aldosterona estimula la reabsorción selectiva de Na+ (figura 2). El gen codificante posee 9 exones y ha sido localizado en 4q31.124. Existen al menos dos isoformas que se expresan en cantidades equivalentes en riñón, colon y glándulas sudoríparas25.
Se han identificado mutaciones heterocigotas del gen codificante de los mineralocorticoides en una pocas familias con la forma renal de pseudohipoaldosteronismo tipo I26,27. Nosotros hemos estudiados dos familias provenientes de la misma zona de Galicia que presentaban ambas un probando heterocigoto para la misma mutación, es decir, un codon de terminación prematura a nivel del codon 537 del exon 2 (R537 * Stop)28. El estudio de los familiares de estos dos probandos revelóque muchos individuos adultos portadores de la mutación permanecían totalmente asintomáticos pero presentaban una elevación de la aldosterona en plasma. Estos datos apoyan la conclusión de que solamente una pequeña proporción de heterocigotos desarrolla un cuadro clínico de pérdida salina. La causa de estas diferencias fenotípicas es desconocida pero puede estar relacionada con hábitos de ingesta de sal o con intercurrencias que conducen a depleción de volumen extracelular. Es también posible que polimorfismos o mutaciones en los genes que codifican las subunidades del ENaC pueden jugar un papel coadyuvante. Polimorfismos y mutaciones que conducen a una "perdida" o "ganancia" de función del ENaC pueden agravar o atenuar, respectivamente, las consecuencias de una función alterada del receptor de los mineralocorticoides29-31. Es interesante señalar que se han descrito también mutaciones con "ganancia de función" del gen del receptor de los mineralocorticoides que dan origen a un cuadro familiar de hipertensión arterial que remeda el hiperaldosteronismo primario32.
Se han generado ratones transgénicos en los que se ha abatido el gen de los mineralocorticoides. Estos ratones "knock-out" desarrollan pérdida salina en el periodo neonatal con estimulación secundaria del eje renina-aldosterona33-35.
Pseudohipoaldosteronismo tipo II
Un síndrome familiar de hipertensión arterial, hiperkaliemia, acidosis metabólica, actividad de renina plasmática disminuida y función renal normal fue caracterizado como una nueva entidad clínica por Gordon y cols en 197036. La hipertensión es un síntoma característico de adolescentes y adultos pero puede estar ausente en niños. La entidad reportada por Spitzer y cols37, que asocia retraso de crecimiento, hiperkaliemia, acidosis metabólica y normotensión arterial, corresponde en realidad, a este mismo síndrome. El término "síndrome del shunt de cloro" ha sido también propuesto en base a la hipótesis de que en esta enfermedad existe una anomalía tubular primaria que causa una hiperreabsorción de ClNa en el asa ascendente de Henle lo que induce una secreción disminuida de K+ e H+ en el túbulo colector cortical que no responde al administración de mineralocorticoides (pseudohipoaldosteronismo)38.
El tipo de herencia más probable es autosómico dominante ya que se han descrito familias con hijos y un progenitor afectos39. Aunque el defecto genético sigue siendo desconocido, estudios de linkage en ocho familias con aparente transmisión autosómica dominante han permitido demostrar que existía una heterogeneidad en la localización del gen afecto ya que dicho linkage era evidente para las zonas cromosómicas 1q31-42 y 17p11-q2140. Aunque la hipótesis del "cortocircuito" de Cl está ampliamente aceptada, se sigue desconociendo la naturaleza íntima de este fenómeno. La diversas hipótesis emitidas (deficiencia de APN, insensibilidad tubular al APN, deficiencia de PGE2) no han recibido confirmación. Estudios de biología molecular han descartado también la existencia de mutaciones con "ganancia de función" en los genes SLC12A1 y SLC12A3, que codifican los cotransportadores Na-2Cl-K y Na-K, respectivamente. Los estudios de linkage parecen también excluir una ganancia de función en el gen CLCNKB, codificador del canal de cloro ClC-Kb.