Introducción
La insuficiencia respiratoria es uno de los principales motivos por el que los niños pueden precisar ingreso en una unidad de cuidados intensivos pediátricos (UCIP). El fallo respiratorio implica un inadecuado intercambio de oxígeno y/o dióxido de carbono que puede ser debido a lesión pulmonar, fallo cardíaco, enfermedades neurológicas, musculares o fallo multiorgánico, entre otras causas. Estos pacientes con frecuencia requieren ventilación mecánica para mejorar el intercambio gaseoso y disminuir el trabajo respiratorio1.
Para disminuir las complicaciones asociadas a la ventilación mecánica se está empleando cada vez más la ventilación no invasiva (VNI). Su principal ventaja es evitar la intubación intratraqueal y la traqueostomía, y disminuir secundariamente el riesgo de neumonía asociada a ventilación mecánica y las necesidades de sedación y permitiendo en ocasiones la alimentación oral1,2. La VNI puede estar indicada en la insuficiencia respiratoria aguda (IRA) o crónica agudizada, pero también en el postoperatorio de determinados trastornos, para facilitar y acelerar la retirada de la ventilación mecánica invasiva, para evitar la reintubación intratraqueal y en pacientes que, por medidas de limitación terapéutica, no deban ser intubados3.
La extensión de la aplicación de la VNI en adultos se inició a finales de la década de 1980 en pacientes con hipoventilación nocturna, pero su introducción en el paciente pediátrico se inicia a mediados de los años 1990 en Estados Unidos en pacientes con insuficiencia respiratoria crónica sin hipoxia4. Desde entonces esta nueva modalidad de ventilación asistida se está empleando cada vez más en pacientes pediátricos con insuficiencia respiratoria de distinta etiología5-13. A continuación se presenta nuestra experiencia con la aplicación de VNI en niños críticamente enfermos durante un año y medio.
Pacientes y métodos
Se incluyeron en el estudio los pacientes ingresados en la UCIP del Hospital Universitario Central de Asturias en los que se aplicó VNI desde el 1 de mayo de 2002 hasta el 31 de octubre de 2003. Las indicaciones para el uso de la VNI fueron la IRA con fallo predominantemente hipoxémico o hipercápnico y la IRA postextubación. Las contraindicaciones de la VNI fueron: parada cardiorrespiratoria, inestabilidad hemodinámica o arritmia cardíaca inestable, disminución del nivel de conciencia con puntuación de Glasgow menor de 10 puntos, deformidad, trauma o cirugía facial, parálisis de cuerdas vocales, neumopatía bullosa, neumotórax, ausencia de reflejo de tos o nauseoso, secreciones respiratorias abundantes, hemorragia digestiva alta y agitación o falta de colaboración del paciente para mantener la mascarilla14.
Para la VNI se utilizaron tanto respiradores convencionales (Dräger® Babylog 8000plus, Bear Cub® BP 2001) como específicos (Respironics® BiPAP® S/T-D, Respironics® BiPAP® Vision, EME® Infant Flow® Driver, Dräger® CF 800, Taema® Neftis). La VNI se aplicó mediante la administración de una presión positiva continua en la vía aérea (CPAP) o en dos niveles (BiPAP), con un sistema humidificador del aire y a través de sistemas externos a la tráquea o interfases. La interfase se elegía entre una de las cuatro siguientes en función de su disponibilidad y de la edad del niño: mascarilla buconasal, mascarilla nasal, prótesis nasal corta, prótesis faríngea (tubo intratraqueal cortado con su extremo inferior colocado en la parte alta de la faringe). Una vez conectada al respirador, se adaptaba al paciente de la forma más cómoda y con menos fugas posible, mediante gorros, cinchas con velcro o esparadrapos (en caso de las prótesis faríngeas).
En todos los casos se iniciaba la VNI con la administración de una presión positiva espiratoria continua (EPAP) de 4 cmH2O, que aumentaba de forma progresiva de 1 en 1 cmH2O según la necesidad y tolerancia del paciente. En los casos en que se empleó el modo BiPAP se asociaba una presión positiva inspiratoria (IPAP) igual a la EPAP (4 cmH2O), y se incrementaba posteriormente de 2 en 2 cmH2O según la necesidad y la tolerancia del paciente. En los casos en que se empleó un respirador convencional se utilizó la modalidad de presión de soporte (PS) o ventilación mandatoria intermitente sincronizada (SIMV). Las presiones se incrementaban hasta conseguir unos volúmenes corrientes apropiados para la edad del paciente y observar una disminución del trabajo respiratorio y una mejoría de la oxigenación y la ventilación. Si la insuficiencia respiratoria era de predominio hipoxémico se incrementaba la EPAP hasta alcanzar un reclutamiento pulmonar valorado por la disminución de la necesidad de oxígeno por debajo del 60 % de fracción inspiratoria de oxígeno (FiO2) con una saturación transcutánea mayor del 90 %. Si la insuficiencia respiratoria era fundamentalmente hipercápnico, aumentaba la presión diferencial entre EPAP e IPAP. En todos los casos se aseguraba una frecuencia respiratoria mínima, entre 10 y 30 resp./min según la edad del paciente.
La eficacia de la VNI se definía por: a) disminución del trabajo respiratorio del paciente, indicado por la frecuencia respiratoria, la frecuencia cardíaca y los signos externos de trabajo respiratorio (tiraje, bamboleo abdominal, aleteo nasal); b) disminución de las necesidades de oxígeno; c) una mejoría gasométrica, y d) mejoría en los parámetros de oxigenación (presión parcial arterial de oxígeno [PaO2]/FiO2, índice de oxigenación) y de ventilación (índice de ventilación).
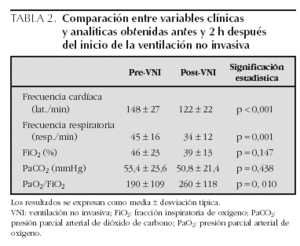
Para este estudio se recogieron los datos de frecuencia cardíaca, frecuencia respiratoria, FiO2, PaCO2 y PaO2 antes del inicio de la VNI y en las 2 h siguientes a su aplicación. En los pacientes que recibían oxigenoterapia por flujo, la FiO2 se estimó mediante tablas publicadas al efecto15. Los datos de oxigenación y ventilación sólo se recogieron en los pacientes en los que se realizaron gasometrías arteriales antes y después del inicio de la VNI (13 casos).
Para el análisis se han utilizado estadísticos descriptivos simples, como media, mediana, desviación estándar, rangos y cuartiles. Para las comparaciones se utilizaron pruebas no paramétricas como la U de Mann-Whitney y la prueba de Kruskal-Wallis para variables independientes y la prueba de Wilcoxon para variables relacionadas, estimándose como significativos valores de p < 0,05.
Resultados
Desde el 1 de mayo de 2002 hasta el 31 de octubre de 2003 ingresaron en nuestra UCIP 97 pacientes que precisaron soporte respiratorio, en 23 de los cuales (23,7 %) se aplicó VNI un total de 24 veces. Para este estudio se ha analizado cada episodio de VNI como un caso independiente.
Los pacientes presentaban una edad media de 36,7 ± 46,4 meses (rango, 0,4-158,4), con una mediana de 21,1 meses. La distribución del sexo fue 10 varones y 14 mujeres. La VNI se aplicó por insuficiencia respiratoria hipoxémica en 14 casos (58,3 %), hipercápnica en 4 casos (16,7 %) y por insuficiencia respiratoria postextubación en 6 casos (25 %).
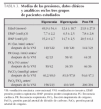
Las enfermedades que presentaban, las modalidades de VNI, respiradores e interfases que se utilizaron se recogen en la tabla 1. La patología más frecuente fue la neumonía (45,8 %), seguida de la bronquiolitis (16,7 %). El respirador más empleado fue el Babylog 8000plus (9 casos; 37,5 %), con modalidad de PS en 8 casos y de CPAP en un caso, usando como interfase la prótesis faríngea. El segundo respirador más utilizado fue el BiPAP® Vision en modalidad Spontaneous/timed (S/T) (5 casos; 20,8 %), utilizando la mascarilla buconasal en 3 casos y la mascarilla nasal en dos. En 4 casos (16,7 %) se utilizó el respirador Neftis®, diseñado para uso domiciliario, en modalidad BiPAP con mascarilla nasal en un paciente y mascarilla buconasal en tres. El respirador CF 800, específico de CPAP, se empleó con prótesis faríngea en 3 casos (12,5 %). En los 3 casos restantes se empleó el respirador Infant Flow® Driver con prótesis nasal corta en modalidad CPAP, el respirador BiPAP® S/T-D con mascarilla buconasal en modalidad BiPAP y el respirador BP 2001 con prótesis nasal corta en modalidad SIMV. Se encontró una diferencia significativa en la edad media de los pacientes en los que se utilizó un respirador convencional frente a aquellos en los que se empleó un respirador específico de VNI (6,1 meses frente a 58,6 meses; p < 0,001). No hubo diferencias en las edades medias de los pacientes según la interfase empleada (p = 0,07). Así, la prótesis faríngea se utilizó en 12 pacientes con una edad media de 22,8 meses; la prótesis nasal corta se utilizó en 2 pacientes con una edad media de 9,7 meses; la mascarilla nasal se empleó en 3 pacientes con una edad media de 44,4 meses; y la mascarilla buconasal se empleó en 7 pacientes con una edad media de 64,9 meses.
La duración media de la VNI fue de 3,7 ± 3,7 días (límites, 0-15), con una mediana de 3 días. Las presiones medias administradas fueron: EPAP, 7,5 ± 2,1 cmH2O (límites, 4-12); IPAP 16,3 ± 4,1 cmH2O (límites, 11-25). La IPAP media fue mayor, aunque no significativa, cuando se utilizaron respiradores convencionales que cuando éstos eran específicos de VNI (18,2 cmH2O frente a 14,7 cmH2O, p = 0,101), no existiendo diferencias de las presiones administradas con las distintas interfases.
En relación con la eficacia de la VNI, tras 2 h de su aplicación se observó una disminución significativa de la frecuencia cardíaca y de la frecuencia respiratoria y una mejoría de la oxigenación (tabla 2). La PaCO2 y la FiO2 administrada también se redujeron, aunque este cambio no fue estadísticamente significativo. En la tabla 3 se muestran las presiones administradas y los valores clínicos y analíticos recogidos antes y 2 h después del inicio de la VNI en cada grupo estudiado. Se observó una EPAP mayor en los grupos de IRA hipoxémica e IRA postextubación, mientras que en el grupo de IRA hipercápnica se administró una mayor presión diferencial entre IPAP y EPAP (diferencias no significativas). En todos los grupos disminuyó la frecuencia cardíaca y la frecuencia respiratoria tras el inicio de la VNI. La PaCO2 se redujo notablemente en el grupo de IRA hipercápnica, descendió más discretamente en el grupo de IRA postextubación y aumentó en el grupo de IRA hipoxémica. Por último, la oxigenación mejoró claramente en los grupos de IRA hipoxémica e IRA postextubación, mientras que no se modificó en el grupo de IRA hipercápnica (tabla 3).
Cinco pacientes (20,8 %) no respondieron de forma adecuada a la VNI, requiriendo intubación y ventilación mecánica convencional. Tres de ellos presentaban IRA hipoxémica (2 casos de bronquiolitis y un caso de hipoventilación central con neumonía); otro paciente presentaba una distrofia muscular congénita y precisó reintubación tras el intento de retirar la ventilación mecánica; y otro presentaba IRA hipercápnica secundaria a fallo cardíaco. La duración media de la VNI antes de que los pacientes fueran intubados fue de 17 ± 15 h (límites, 3-36). Tres de los 5 pacientes tenían menos de 6 meses; así, la edad media de los pacientes que precisaron reintubación fue de 11,7 ± 17,6 meses, menor que la de los pacientes en los que la VNI fue efectiva, aunque esta diferencia no fue estadísticamente significativa (11,7 meses frente a 43,3 meses; p = 0,120). Ninguna otra variable presentó diferencias en los dos grupos (tabla 4). No falleció ningún paciente; sin embargo, el paciente con distrofia muscular se hizo dependiente de la ventilación mecánica y precisó traqueostomía.
Las complicaciones fueron mínimas y se relacionaban con las interfases. No se observó ningún caso de barotrauma, distensión gástrica ni broncoaspiración, aunque 14 pacientes recibieron alimentación enteral por sonda nasogástrica a débito continuo durante la VNI. En 6 pacientes con mascarilla buconasal apareció una dermatitis irritativa en el puente nasal que se trató con curas tópicas.
Discusión
La VNI ha demostrado su eficacia para el tratamiento de la IRA en el adulto, siendo capaz de disminuir la necesidad de intubación intratraqueal, la incidencia de neumonía nosocomial y la mortalidad2,16-19. Sin embargo, los estudios realizados en niños son todavía escasos e insuficientes para apoyar la aplicación sistemática de esta técnica en la IRA. En nuestra experiencia, la VNI puede inducir una mejoría clínica y gasométrica en el niño con dificultad respiratoria, siendo eficaz hasta en el 79,2 % de los casos, aunque nuestros resultados están limitados por el pequeño número de muestra y el carácter retrospectivo del estudio.
La aplicación de la VNI en los niños presenta más dificultades que en el adulto, tanto por la falta de colaboración de los pacientes más pequeños como por la necesidad de disponer de material adecuado para cada edad9,13. Para mejorar la adaptación del niño a la VNI se puede utilizar una sedación consciente con midazolam o propofol en dosis bajas14. En este estudio no hemos recogido el uso de sedantes previo al inicio de la VNI, aunque en algunos pacientes empleamos una perfusión continua de midazolam administrada en dosis bajas durante la adaptación a la VNI, sin empeorar su esfuerzo respiratorio.
El problema de la disponibilidad del material adecuado es más difícil de resolver. Para la aplicación de la VNI pueden utilizarse respiradores convencionales, en modalidad de presión-control o de presión de soporte con tiempo inspiratorio limitado. Con la limitación del tiempo inspiratorio se evita que las fugas alrededor de la interfase alarguen el tiempo inspiratorio hasta alcanzar la presión programada, con lo que el paciente iniciaría la espiración en contra del respirador y se produciría la descoordinación y el fracaso de la técnica14. El principal inconveniente de los respiradores convencionales es que no compensan las fugas de la interfase como los respiradores específicos de VNI, por lo que la IPAP programada debe ser relativamente mayor para conseguir el volumen corriente adecuado. En este estudio se ha utilizado el respirador Babylog® 8000 plus, que dispone de modalidad de presión de soporte con limitación del tiempo inspiratorio y de un trigger muy sensible capaz, en nuestra experiencia, de detectar el esfuerzo inspiratorio del paciente a través de la interfase. Sin embargo, por sus características sólo puede cubrir las necesidades ventilatorias de los pacientes de menor edad. En este estudio se utilizó en pacientes menores de un año con buena tolerancia, aunque precisaron una mayor IPAP que los pacientes en los que se emplearon respiradores específicos de VNI.
En la VNI pediátrica, la elección de la interfase y su adecuado ajuste al paciente es el elemento más importante para lograr la adaptación del niño a la VNI9,13,14. Una interfase de tamaño no adecuado o mal ajustada producirá un aumento del flujo del respirador con el fin de compensar las fugas, lo cual origina una intolerancia al soporte respiratorio. En la actualidad existen en el mercado muchos modelos de mascarillas nasales o buconasales de varios tamaños, aunque en muchas UCIP no están disponibles. La mascarilla buconasal es más adecuada para situaciones agudas, pero es más claustrofóbica y existe mayor dificultad para aspirar secreciones. La mascarilla nasal es más cómoda, pero precisa que el paciente mantenga la boca cerrada, pues en caso contrario la compensación de fugas hará intolerable la mascarilla14. Estas son las principales interfases empleadas en nuestra unidad en niños mayores de un año. En los lactantes, ante la dificultad de disponer de la mascarilla adecuada, se utilizaron principalmente prótesis faríngeas, aunque resultan más incómodas y no permiten controlar las fugas.
Para estimar la eficacia de la VNI se deben evaluar parámetros objetivos, como los datos obtenidos de las gasometrías realizadas antes y después del inicio de la VNI. Para valorar la dificultad respiratoria sería preferible un sistema objetivo de puntuación de la disnea, pero dadas las limitaciones de un estudio retrospectivo se han elegido variables como la frecuencia cardíaca y respiratoria, utilizados en otros estudios similares4,5,8,11. Al igual que en estos estudios, todos los parámetros estudiados mejoraron tras el inicio de la VNI. Al distribuir a los pacientes en tres grupos de IRA (hipoxémica, hipercápnica y postextubación) se observa igualmente una mejoría en los parámetros indicativos de dificultad respiratoria y de oxigenación. Sin embargo, la ventilación empeora en el grupo de IRA hipoxémica, ya que en este grupo se observa el mayor número de pacientes en los que la VNI no fue eficaz (excluyendo a estos pacientes, la media de la PaCO2 en el grupo de IRA hipoxémica pasaría de 36,7 mmHg previo a la VNI a 39 mmHg tras la VNI). Pueden existir diversas explicaciones para dicha tendencia a la elevación transitoria de la PaCO2 en el grupo hipoxémico (datos referidos en la tabla 3 a las primeras 2 h de tratamiento); una de ellas puede ser consecuencia de la estrategia básica de tratamiento de la insuficiencia respiratoria tipo I o hipoxémica dirigida a la elevación de la EPAP ajustando la IPAP de forma progresiva, ya que en estos pacientes no existe un importante componente de hipoventilación alveolar (como ocurre en los fracasos respiratorios de tipo II o hipercápnicos); otra explicación podría ser que como consecuencia de la mejoría en la oxigenación la frecuencia respiratoria disminuye (tabla 3), lo que podría hacer que la ventilación sea menor si no se ajusta adecuadamente el nivel de IPAP. Para evaluar la eficacia real de la VNI en niños y para determinar qué pacientes se podrían beneficiar de su aplicación, es necesaria la realización de estudios prospectivos aleatorizados en los que se recojan datos objetivos9. Actualmente se está poniendo en marcha un estudio multicéntrico internacional avalado por el Grupo de Trabajo de Respiratorio de la Sociedad Española de Cuidados Intensivos Pediátricos, cuyo objetivo es describir las características epidemiológicas del uso de la VNI en niños en la UCIP (indicaciones, contraindicaciones, técnica, metodología, modos ventilatorios, equipamiento, duración, sedación, evolución y complicaciones).
En nuestro estudio la VNI no fue eficaz en el 20,8 % de los casos, un porcentaje superior al referido en otros artículos (Padman et al4: 6,7 %; Fortenberry et al5: 10,7 %; Padman et al8: 8 %). En estos trabajos no se incluyeron pacientes por debajo de los 4 meses de edad, que representan la quinta parte de nuestra muestra. De hecho, en nuestro estudio el 60 % de los pacientes en los que la VNI no fue eficaz tenía menos de 6 meses. Esto confirma la dificultad de la aplicación de esta modalidad ventilatoria en los niños más pequeños, aunque posiblemente el número de pacientes que precisan intubación disminuiría si el tamaño muestral fuera mayor, debido a que también hay que tener en cuenta la experiencia del personal que aplica la VNI. Además de la edad destaca que los pacientes en los que fracasó la VNI partían de una situación basal peor (mayor frecuencia cardíaca, frecuencia respiratoria y PaCO2 y peor PaO2/FiO2) (tabla 4). Por otra parte, el principal dato indicativo de fracaso de la VNI es la elevación de la PaCO2 en las primeras horas.
En conclusión, la VNI puede ser una alternativa a la ventilación mecánica convencional para el tratamiento de la insuficiencia respiratoria aguda de distinta etiología. Su éxito depende no sólo de las características del paciente y de su patología, sino también de la disponibilidad del material adecuado, la experiencia del personal, la elaboración de protocolos específicos y la labor de enfermería, sobre todo durante el inicio de la técnica.