El trasplante de progenitores hematopoyéticos (TPH) de donante familiar compatible es el tratamiento de elección en la aplasia medular adquirida (AMA) grave en la infancia. Se presenta la experiencia de Grupo Español para el Trasplante de Médula Ósea en Niños en esta enfermedad a lo largo del período cronológico 1982-2004.
Pacientes y métodosRecibieron un trasplante 62 pacientes con una mediana de edad de 10 años. En el período 1982-1990 lo recibieron 18 pacientes y en el período 1991-2004, 44. El régimen de acondicionamiento varió según el período cronológico; en el primero se utilizó preferentemente la asociación de radioterapia y ciclofosfamida (72 % de los casos) y en el segundo ciclofosfamida con o sin globulina antitimocitaria (62 %). La profilaxis de enfermedad injerto contra huésped más utilizada fue la ciclosporina (57/62 pacientes).
ResultadosUn total de 51 pacientes están vivos y en remisión completa de su aplasia con períodos de observación de entre 24 y 289 meses (mediana de 127 meses). La probabilidad de supervivencia actuarial libre de eventos a 5 años es del 82%. Dicha supervivencia se incrementó del 61 al 90 % entre los dos períodos analizados. Un total de 11 pacientes fallecieron por fracaso o pérdida del injerto (3), enfermedad injerto contra huésped aguda o crónica asociada a infecciones (4) o fallo multiorgánico (4). El análisis univariante evidenció dos factores con valor predictivo para la supervivencia: el intervalo diagnóstico/trasplante y el período cronológico en que se efectuó (en ambos, p=0,03).
ConclusionesEsta experiencia confirma que el trasplante de progenitores hematopoyéticos de donante familiar compatible es el tratamiento de elección para la aplasia medular grave adquirida, con un porcentaje de supervivencia libre de episodios del 90 % en la actualidad.
Allogeneic haematopoietic stem-cell transplantation is the treatment of choice for acquired aplastic anaemia in children. Experience with this approach from Spanish Working Party for Bone Marrow Transplantation in Children in two sequential time periods (1982-1990 and 1991-2004) is reported.
Patients and methodsSixty two consecutive patients with a median age of 10 years were transplanted; 18 in the 1982-1990 period and 44 in the 1991-2004 period. Conditioning regimen consisted mainly of irradiation and cyclophosphamide in the first period (72 % of patients) and cyclophosphamide±anti-thymocyte globulin (62 %) in the second. Graft versus host disease prophylaxis consisted of cyclosporine in most patients (57/62).
ResultsFifty one patients are alive and disease-free at a median follow-up of 127 months. Five years probability of event-free survival is 82 %. The survival increased from 61 % to 91 % during the two time periods. Eleven patients died from graft failure or rejection (3), acute or chronic graft versus host disease and infection (4) or multi-organ failure (4). Univariate analysis identified two significant prognostic factors: interval diagnostic/transplant and time period of transplant (for both p=0.03).
ConclusionsThis experience corroborates that allogeneic haematopoietic stem-cell transplantation is the best treatment for severe acquired aplastic anaemia, with a current disease – free survival of 90 % of patients.
La aplasia medular adquirida es una alteración hematológica caracterizada por la existencia de pancitopenia y médula ósea aplásica o hipoplásica. Los criterios diagnósticos y su clasificación de acuerdo con su gravedad (moderada, grave o muy grave) según el International Agranulocytosis and Aplastic Anemia Study Group1 se exponen en la tabla 1. Los síndromes de fracaso medular congénito deben ser excluidos en los niños que presentan citopenias e hipoplasia medular antes de diagnosticarlos de aplasia medular adquirida (AMA), dado que el pronóstico y la actitud terapéutica varían radicalmente entre ambos procesos. La AMA es una enfermedad infrecuente en la infancia, con una incidencia anual que oscila entre los 2 y los 6 casos por millón de habitantes en Europa y Estados Unidos. Su incidencia es más alta en la India y en Japón debido a diferencias en los factores inmunogenéticos y ambientales2.
Clasificación de la aplasia medular adquirida de acuerdo a su gravedad
|
El trasplante de progenitores hematopoyéticos (TPH) de un donante familiar de locus del antígeno de histocompatibilidad (HLA) idéntico es el tratamiento de elección en la AMA grave y muy grave en la infancia3,4. En los pacientes que carecen de un donante familiar adecuado debe utilizarse tratamiento inmunosupresor5 y en caso de fracaso del mismo puede realizarse un TPH utilizando donantes alternativos, como no emparentados o emparentados parcialmente compatibles6.
Los resultados obtenidos con TPH de donante familiar idéntico han ido mejorando a lo largo de los últimos 20 años gracias a nuevos regímenes de acondicionamiento y de profilaxis de la enfermedad injerto contra el huésped (EICH) y a mejoras en los tratamientos de soporte7,8.
El Grupo Español para el Trasplante de Médula Ósea en Niños (GETMON) publicó los resultados obtenidos en España en la década de 1980 con la utilización de TPH de donante familiar compatible en AMA9. Este trabajo tiene como objetivo completar dicho estudio con los pacientes que recibieron trasplantes hasta el año 2004.
PACIENTES Y MÉTODOSEntre enero de 1982 y diciembre de 2004, 62 pacientes con aplasia medular adquirida grave o muy grave recibieron un TPH procedente de un donante familiar compatible en 10 centros pertenecientes a GETMON, previo consentimiento informado de sus padres o tutores. En el período cronológico 1982-1990 18 pacientes recibieron un trasplante y en el período 1991-2004, 44. La mediana de edad al diagnóstico fue de 10 años, con un intervalo de entre 2 y 18 años; 30 eran varones y 32, niñas. Un total de 25 pacientes presentaban una aplasia grave y 37, muy grave. Todos habían sido sometidos a estudio cromosómico para descartar una aplasia congénita. En 50 pacientes la etiología se consideró idiopática y en 12, secundaria: a infecciones virales en 8 casos y a toxicidad por drogas (cloramfenicol) en 4. Las características de los pacientes se detallan en la tabla 2.
Características de los pacientes
| Número de pacientes | 62 |
| Edad al trasplante en años | 10 (2-18) |
| Sexo varon/niña | 30/32 |
| Gravedad al diagnóstico: | |
| Grave | 25 |
| Muy grave | 37 |
| Etiología | |
| Idiopática | 50 |
| Secundaria | 12 |
| Tratamiento previo | |
| Ninguno | 48 |
| Esteroides y andrógenos | 10 |
| Inmunosupresores | 4 |
| Trasfusiones previas | |
| < 20 | 10 |
| > 20 | 52 |
No hubo diferencias significativas entre los pacientes en cada período cronológico en cuanto a edad, sexo, gravedad de la aplasia, etiología, tratamiento médico previo al trasplante y número de transfusiones recibidas antes del TPH.
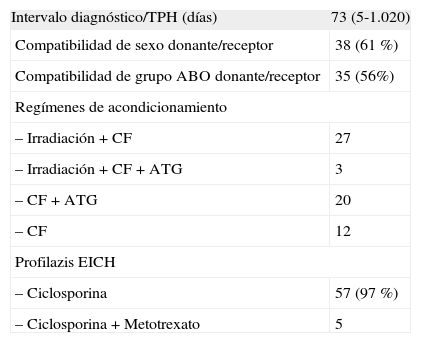
Características del TPHEl intervalo entre el diagnóstico de la aplasia y la realización del TPH fue de 5 a 1.020 días, con una mediana de 73 días. No hubo diferencia significativa para esta variable entre ambos grupos cronológicos. Las características de los TPH se muestran en la tabla 3. En lo que se refiere a las técnicas de acondicionamiento al TPH, hubo una disminución en el período 1991-2004 en la utilización de radioterapia (corporal total, nodal total o toracoabdominal) que se aplicó en el 38 % de los pacientes respecto al grupo cronológico anterior (72 %), diferencia estadísticamente significativa (p = 0,03). Cuando se utilizó radioterapia se asoció ciclofosfamida a la dosis de 120-200mg/kg de peso del receptor. En los restantes se utilizó exclusivamente quimioterapia: ciclofosfamida a la dosis de 200mg/kg, a la que en un paciente se asoció busulfano a la dosis de 16mg/kg y en otro fludarabina a la dosis de 90mg/m2. Hubo también un incremento en la utilización de timoglobulina antitimocitaria (ATG) en el período 1990-2004, que se aplicó al 45 % de los pacientes frente al 17 % en el período anterior (p = 0,05). La dosis de ATG utilizada fue de 30mg/kg al día durante 3 días.
Características de los trasplantes
| Intervalo diagnóstico/TPH (días) | 73 (5-1.020) |
| Compatibilidad de sexo donante/receptor | 38 (61 %) |
| Compatibilidad de grupo ABO donante/receptor | 35 (56%) |
| Regímenes de acondicionamiento | |
| – Irradiación + CF | 27 |
| – Irradiación + CF + ATG | 3 |
| – CF + ATG | 20 |
| – CF | 12 |
| Profilazis EICH | |
| – Ciclosporina | 57 (97 %) |
| – Ciclosporina + Metotrexato | 5 |
ATG: globulina antitimocitaria; CF: ciclofosfamida; TPH: trasplante de progenitores hematopoyéticos.
La pauta de profilaxis de la EICH más usada fue la ciclosporina, que se utilizó en 57 casos; en 5 pacientes se asoció metotrexato a la ciclosporina. Todos los productos sanguíneos transfundidos a los enfermos fueron previamente irradiados.
Tratamiento estadístico de los datosEl estudio de la supervivencia estimada libre de eventos se realizó mediante el método de Kaplan-Meier. El análisis univariante se efectuó según el método de Cox. Se utilizó el test χ2 para la comparación de frecuencias. El límite de significación estadística para los valores de p se fijó en 0,05.
RESULTADOSUn total de 59 pacientes alcanzaron un injerto medular estable. En 2 hubo fracaso del injerto; estos pacientes, trasplantados durante el período 1982-1990, habían sido sometidos previamente al trasplante a tratamiento inmunosupresor con ciclosporina y ATG. Un paciente tuvo un rechazo del injerto 63 días después del TPH.
Un total de 20 niños desarrollaron una EICH aguda grado 2-4, 6 de los cuales evolucionaron a una EICH crónica, que en tres fue extensa. La incidencia de EICH aguda fue superior en el primer grupo cronológico respecto al segundo (el 48 % frente al 20 %; p = 0,06).
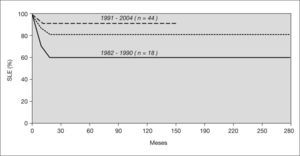
Hay 51 pacientes que están vivos y en remisión completa de su aplasia, con períodos de observación de entre 24 y 289 meses tras el TPH (mediana de 127 meses). La probabilidad de supervivencia actuarial libre de eventos a 5 años es del 82 %; el 90 % para los que recibieron el trasplante entre 1990 y 2004 y el 61 % para los que lo recibieron en 1982-1990 (p = 0,01) (fig. 1).
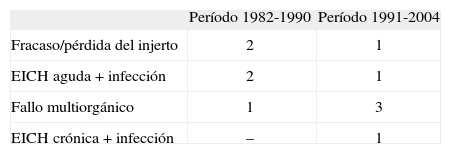
Un total de 11 pacientes fallecieron por las siguientes causas: fracaso o pérdida del injerto en 3, EICH aguda asociada a infección en 4, insuficiencia multiorgánica en 3 y EICH crónico más infección bacteriana por Pseudomonas aeruginosa a los 263 días postrasplante en 1. Las causas de fallecimiento se describen en la tabla 4. En total, fallecieron 5 pacientes en el primer período estudiado (26 % de los 18 casos) y 6 en el segundo (13 % de los 44 casos).
Dos pacientes con EICH crónico extenso presentan una esclerodermia y una bronquiolitis obliterante, respectivamente. Hasta el presente no se ha observado ninguna neoplasia secundaria en nuestra casuística.
Se efectuó un análisis univariante para determinar la influencia sobre la supervivencia de los siguientes parámetros: edad, sexo, tratamiento previo al TPH, número de transfusiones recibidas pretrasplante, intervalo entre diagnóstico y trasplante, compatibilidad de sexo donante/receptor y período cronológico del TPH. Los dos factores predictivos con significación estadística fueron el intervalo diagnóstico/trasplante y el período cronológico, siendo superior la supervivencia en los que recibieron el trasplante antes de 1 mes tras el diagnóstico y los que lo recibieron en el período 1990-2004 (en ambos, p = 0,03).
DISCUSIÓNNuestro estudio muestra que los resultados obtenidos con el TPH de donante familiar compatible han mejorado a lo largo del período analizado, lo que se corresponde con las observaciones de otros autores7,10. La supervivencia en niños que han recibido un trasplante de un donante familiar compatible alcanza actualmente el 90 % y convierte esta técnica en obligatoria para todos los pacientes que dispongan de un donante de esas características10. Además de los avances en la terapia de soporte y en el tratamiento de las infecciones, otros factores han contribuido a la obtención de esos mejores resultados. Los regímenes sin radioterapia, con utilización de ciclofosfamida y ATG, obtienen excelentes porcentajes de injerto medular con menor toxicidad y menor riesgo de desarrollo de EICH y de aparición de tumores secundarios11–14. Nuestra casuística confirma esas observaciones, ya que la disminución en la utilización de radioterapia y el incremento en la utilización de la combinación ciclofosfamida/ATG a lo largo del período estudiado se ha acompañado de un descenso en el fracaso del injerto y en la incidencia y gravedad de la EICH aguda. Actualmente hay consenso en no aplicar regímenes de acondicionamiento con irradiación en pacientes con AMA grave que van a recibir un trasplante de un donante familiar compatible2,10.
La AMA grave es una enfermedad potencialmente fatal que requiere una atención inmediata en un centro con experiencia en esta patología. La prontitud en la aplicación del TPH es esencial. El intervalo entre diagnóstico y la realización del TPH ha demostrado ser un importante factor predictivo en nuestros pacientes, con una mayor supervivencia en los pacientes tratados precozmente. Este dato ha sido ampliamente confirmado en la literatura médica4,7,8,10,15.
La irradiación de todos los productos sanguíneos transfundidos a los pacientes con AMA para lograr su desleucocitación es muy eficaz en la prevención del rechazo del injerto16.
Se ha comprobado que los pacientes con AMA sometidos a tratamiento inmunosupresor antes de la realización de un trasplante sufren un incremento en la incidencia de dicho rechazo17, como ocurrió en 2 de nuestros pacientes que recibieron el trasplante en el período 1984-1993.
Las complicaciones a largo plazo del TPH deben tenerse en cuenta. La aparición de una EICH crónica supone un incremento en el riesgo de riesgo de infecciones, de alteraciones dermatológicas, pulmonares, etc.7,18. Uno de nuestros pacientes con EICH crónica extensa falleció por infección y 2 viven con importantes secuelas. No hemos observado en nuestra casuística la aparición de neoplasias secundarias, que es otra de las complicaciones tardías referidas en la literatura científica, especialmente en los pacientes sometidos a regímenes de acondicionamiento con radioterapia14,19.
Finalmente, podemos señalar que en los pacientes que no disponen de un donante familiar compatible, los resultados obtenidos en los últimos años con trasplantes de donantes alternativos (donante familiar no compatible, donante compatible no familiar, cordón umbilical) son esperanzadores24,25.
Los autores expresan su agradecimiento por su colaboración en este trabajo a los doctores J. Cubells Rieró (Hospital Sant Pau), J.J. Ortega Aramburu (Hospital Vall d'Hebron), E. Monteagudo Montesinos (Hospital La Fe) y L. Madero López (Hospital Niño Jesús).
- Inicio
- Todos los contenidos
- Publique su artículo
- Acerca de la revista
- Métricas