El crecimiento extrauterino retrasado (CER) se asocia al déficit nutricional severo en las primeras semanas de vida, lo que podría, al igual que en el crecimiento intrauterino retrasado, condicionar alteraciones metabólicas en etapas posteriores.
Pacientes y métodosSe seleccionaron un grupo de 38 niños prepúberes con antecedentes de CER y un grupo control de 123 niños de edad y género similares. Se valoró la etapa perinatal en el grupo CER. Se evaluaron en ambos grupos los parámetros antropométricos, la presión arterial, la concentración sérica de marcadores bioquímicos del metabolismo hidrocarbonado y el perfil lipídico.
ResultadosEn el grupo CER se observaron valores de talla e índice de masa corporal significativamente menores que en el grupo control (p<0,001) y mayores niveles de presión arterial sistólica y diastólica (p<0,001). El 70% de los niños con CER se encontraron por debajo del percentil 50 para peso y talla, y el 55% por debajo del percentil 25 para el índice de masa corporal (p<0,001), así como el 46 y el 37% por encima del percentil 95 de presión arterial sistólica y diastólica, respectivamente (p<0,001). El grupo CER presentó mayores niveles de glucosa (p<0,001) y menor concentración de colesterol ligado a lipoproteínas de alta densidad (cHDL) (p<0,001) respecto del grupo control, aunque sin relevancia clínica.
ConclusionesLos niños con antecedentes de CER presentan alteraciones antropométricas, en la presión arterial y metabólicas ya en la prepubertad. Sería conveniente controlar la nutrición que reciben en la etapa perinatal y realizar un seguimiento en la infancia, ya que podrían aparecer alteraciones en el futuro.
Extrauterine growth restriction (EUGR) is associated with severe nutritional deficit during the first weeks of life, which, as intrauterine growth restriction, may lead to metabolic anomalies in later stages of life.
Patients and methodsA group of 38 prepuberty children with a history of EUGR were selected, along with a control group of 123 children with similar age and gender. Perinatal stage was assessed in the EUGR group. Anthropometric parameters, blood pressure, serum biochemical markers of carbohydrate metabolism, and lipid profile were measured in both groups.
ResultsThe EUGR group had height and body mass index values significantly lower than in the control group (P<.001) and higher systolic and diastolic blood pressure (P<.001). The majority (70%) of EUGR children were below the 50th percentile for weight and height, and 55% were below the 25th percentile for body mass index (P<.001), as well as 46% and 37% above the 95% percentile for systolic and diastolic blood pressure, respectively (P<.001). The EUGR group had higher glucose levels (P<.001) and lower high density lipoprotein cholesterol (HDLc) (P<.001) than the control group, although without clinical relevance.
ConclusionsChildren with a history of EUGR have anthropometric, blood pressure and metabolic alterations in the prepuberty stage. It would be desirable to control the nutrition they receive in the perinatal period, and follow them up in childhood as alterations may occur in the future.
El crecimiento extrauterino retrasado (CER) se refiere a recién nacidos (RN) pretérmino que desarrollan un déficit nutricional severo en las primeras semanas tras el nacimiento y que continúan con un crecimiento escaso1,2. En la actualidad, existe falta de consenso en la definición del término, aunque se considera frecuentemente CER al RN pretérmino con un crecimiento inferior al percentil (p) 101,3 o al p34 al alta de la unidad de neonatología (UN). Otros trabajos lo valoran independientemente del momento del alta2,5, o en la 356 o 367 semana de edad gestacional corregida (EGC).
Se ha descrito que existe una fuerte asociación entre el crecimiento intrauterino retrasado (CIR) y un mayor riesgo de presentar patología metabólica8, como dislipidemia, hipertensión arterial (HTA), resistencia a la insulina (RI), síndrome metabólico9-12 (SM), diabetes tipo 2 y enfermedad cardiovascular (ECV), en etapas posteriores de la vida1,13, e incluso precozmente en la etapa prepuberal14,15. El ambiente posnatal temprano también puede estar relacionado con estas patologías8, así como la prematuridad16 y el CER17. Todo ello se ha relacionado con el soporte nutricional del periodo neonatal11, aunque hasta el momento no se ha demostrado10.
La hipótesis de este trabajo es que los niños con antecedentes de CER podrían presentar factores de riesgo de patología metabólica o cardiovascular ya en la etapa prepuberal y, por ello, un mayor riesgo de enfermedad en el futuro. El objetivo ha sido valorar datos perinatales de los niños con antecedentes de prematuridad y CER para establecer una definición estricta, estudiar sus principales características antropométricas, presión arterial (PA) y marcadores bioquímicos metabólicos en la etapa prepuberal, y determinar la posible relación entre esta condición neonatal de CER y el aumento de riesgo metabólico en etapas posteriores de la infancia.
Pacientes y métodosPacientes y definición de crecimiento extrauterino retrasadoSe seleccionó un grupo de 38 niños de raza caucásica de ambos géneros, que cumplieron la definición de CER propuesta en este trabajo: RN pretérmino con peso al nacimiento >p10 y que en la semana 36 de EGC y al alta de la UN se encontraran con un peso <p3. Los niños se reclutaron desde la base de datos de la UN de un hospital de tercer nivel. Se establecieron los siguientes criterios de inclusión: niños con peso al nacimiento igual o inferior a 1.500g y sin presentar patología no asociada a esta condición neonatal, y en estado prepuberal. Se excluyó a aquellos sujetos que no cumplieron los criterios de CER y a los que presentaron alguna patología relacionada con alteraciones metabólicas o signos de pubertad. El grupo control lo formaron 123 niños caucásicos sanos prepúberes de ambos géneros y edad similar, y sin antecedentes patológicos de interés.
Diseño experimentalEs un estudio descriptivo, analítico y observacional, de tipo casos y controles. Para la selección del grupo CER se utilizaron las tablas percentiladas correspondientes para edad, género y EGC de A. Carrascosa18. Los datos perinatales de los niños con antecedentes de CER (gestación, parto, periodo neonatal, patología asociada, tratamiento, soporte hemodinámico y respiratorio, así como el aporte nutricional) se recogieron mediante revisión de las historias clínicas. A todos los participantes, grupos CER y control, se les realizó una historia completa recogiendo los antecedentes personales y familiares, realizando un examen físico completo, medida de los parámetros antropométricos y de la PA, y maduración sexual según los criterios de Tanner19 (todos los participantes se encontraron en un estadio prepuberal I). Este estadio fue validado mediante niveles séricos hormonales. Se analizaron los parámetros bioquímicos en ambos grupos. Los padres o tutores legales firmaron el consentimiento informado y los niños fueron informados verbalmente. Se siguieron los protocolos establecidos por el centro para acceder a los datos de las historias clínicas. El estudio fue aprobado por el comité de investigación y ética del hospital.
Medidas antropométricas y de presión arterialEl peso y la talla se midieron mediante técnicas estándar en un peso/tallímetro ADE RGT-200, de HEALTH SCALE®. El índice de masa corporal (IMC) se calculó como el cociente de peso (kg)/talla (m2). Para evaluar el desarrollo pondero-estatural de cada niño, se utilizaron tablas de crecimiento de la población infantil española20 basadas en un estudio longitudinal mixto y consensuadas para su utilización y no infraestimar el diagnóstico de obesidad. Se calculó el z-score para peso, talla e IMC en todos los participantes. La toma de PA sistólica (PAS) y de PA diastólica (PAD) se realizaron en reposo con un manómetro digital OMR® ON M+ 3 PLUS, por duplicado, en decúbito supino, y tomando el brazo izquierdo con un manguito de tamaño apropiado a la edad del sujeto. Se establecieron los percentiles de la PAS y de la PAD en función de la edad y el género de los sujetos21.
Análisis bioquímicoSe determinaron niveles séricos de marcadores bioquímicos relacionados con la patología metabólica (ácido úrico y ferritina), las enzimas hepáticas aspartato aminotransferasa, alanina aminotranferasa y gamma-glutamil transferasa (GGT), así como un perfil lipídico compuesto por las determinaciones de colesterol total, colesterol ligado a lipoproteínas de alta densidad (cHDL), colesterol ligado a lipoproteínas de baja densidad (cLDL), triglicéridos (TG), apolipoproteína A-1 y apolipoproteína B y los marcadores del metabolismo hidrocarbonado glucosa e insulina. Se calculó el índice HOMA de resistencia a la insulina (HOMA=insulina(μU/ml)×glucosa (mg/dl)/405) en niños con antecedentes de CER, comparándolos con los del grupo control. Se utilizaron los autoanalizadores Architect i2000SR y c16000 de Abbott Diagnostics®.
Análisis estadísticoSe realizaron análisis descriptivos para variables cuantitativas mediante el cálculo de media (m) y desviación estándar (DE); y para las variables cualitativas mediante el cálculo de recuentos (n) y proporciones (%). Se determinó la bondad del ajuste mediante la prueba de Shapiro-Wilk y se comprobó la homogeneidad de las varianzas mediante la prueba de Levene. Se compararon los valores medios de las variables cuantitativas entre los 2 grupos mediante pruebas t de Student y U de Mann-Whitney. La comparación de proporciones se realizó mediante la prueba de la χ2 para tablas de contingencia. Para valorar la asociación entre las variables cuantitativas se realizaron análisis de correlación. Los datos se analizaron con el paquete estadístico SPSS18® (PASW Statistic 18. Inc. Chicago, IL, EE. UU.).
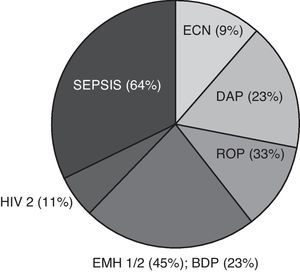
ResultadosAntecedentes perinatales del grupo crecimiento extrauterino retrasadoLa media de edad materna fue de 30±4 años. El 7% de las gestantes presentaron preclampsia y el 57% recibió corticoides prenatales. El 52% de los nacidos recibieron reanimación tipo 1 o 2. El 51 y el 73% de los neonatos mostraron un test de Apgar entre 7-10 al minuto y al minuto 5, respectivamente. En la tabla 1 se describen los resultados obtenidos en el periodo neonatal de nuestra serie en comparación con otros 6 trabajos publicados1,3,5,22-24. El peso en la semana 36 de EGC estuvo comprendido entre 1.400 y 1.920g. Las principales patologías asociadas a la prematuridad y al CER de la etapa neonatal se presentan en la figura 1.
Parámetros estudiados en el periodo neonatal de los niños con retraso del crecimiento extrauterino de nuestra serie en comparación con otros 6 trabajos publicados
| Parámetro | Ortiz-Espejo, 2011 | Sakurai5, 2008 | Costas22, 2005 | Bloom23, 2003 | Clark1, 2003 | Ernst24, 2003 | Olsen3, 2002 |
| EG (semanas) | 29 | 29 | 29 | 28 | 31 | 27 | 27 |
| Género masculino (%) | 71 | 50 | 51 | 60 | 54 | ||
| Peso al nacimiento (g) | 1.144±251 | 1.077 | 1.140 | 1.060 | 1.300 | 880 | 1.008 |
| NP (d) | 41±23 | 15 | 36±21 | 23±10 | |||
| Inicio NE (días) | 7±11 | 4 | 5±3 | ||||
| VM (%/días) | 70%/10±18 | 42,5±43 | 27% | ||||
| Surfactante (%) | 66 | 69 | 38 | ||||
| Oxígeno (%/días) | 100%/12 | 16% | 23 | 26 | 13% | ||
| Esteroides posnatales (%) | 29 | 14 | 9 | 29 | 24 | 79 | |
| Peso al alta (g) | 2.532±226 | 2.442 | 2.290 | ||||
| Estancia hospitalaria (días) | 81±32 | 70 | 57 | 47±31 | 72±22 |
EG: edad gestacional; NE: nutrición enteral; NP: nutrición parenteral; VM: ventilación mecánica.
Principales patologías asociadas a la prematuridad y al crecimiento extrauterino retrasado. Los datos son expresados como tipo de patología (%). BDP: broncodisplasia pulmonar; DAP: ductus arterioso permeable; ECN: enterocolitis necrotizante; EMH 1/2: enfermedad de membrana hialina grados 1 o 2; HIV: hemorragia intraventricular; ROP: retinopatía del prematuro.
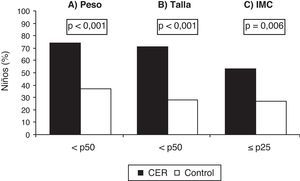
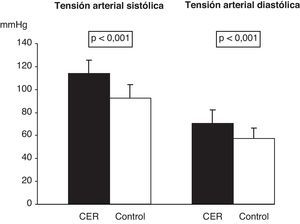
La distribución por edad y sexo se muestra en la tabla 2. En los sujetos del grupo CER se observaron valores globales de talla e IMC significativamente menores que en el grupo control (tabla 2). En relación con el z-score para peso, talla e IMC, los resultados obtenidos se presentan en la tabla 2. En la figura 2 se muestra que la mayoría de los niños con CER se sitúan por debajo del p50 para peso y talla, y un 52% por debajo del p25 para el IMC (p<0,001). Los niveles de PAS y de PAD fueron significativamente mayores en los niños del grupo CER respecto del grupo control (fig. 3). El 46 y el 37% de los niños con CER presentaban valores superiores al p95 de PAS y de PAD, respectivamente (p<0,001).
Datos demográficos y antropométricos recogidos en los niños con antecedentes de crecimiento extrauterino retrasado (grupo CER) y en los controles (grupo control)
| Parámetros | CER (n = 38) | Control (n = 123) | p |
| Edad (años) | 8,42±3,02 | 8,93±1,32 | 0,869 |
| Género (M/F) (%) | 71/29 | 48/52 | 0,021 |
| Peso (kg) | 26,66±10,17 | 29,98±5,07 | 0,059 |
| Z-Score peso | –0,446±0,972 | 0,080±0,603 | < 0,001 |
| Talla (cm) | 124,52±16,98 | 133,26±8,43 | 0,004 |
| Z-Score talla | –0,439±0,861 | 0,267±0,786 | < 0,001 |
| IMC (kg/m2) | 16,57±2,9 | 16,82±1,38 | 0,016 |
| Z-score IMC | –0,409±1,047 | –0,165±0,466 | 0,012 |
CER: crecimiento extrauterino retrasado; F: femenino. IMC: índice de masa corporal; M: masculino.
Los datos son expresados como porcentaje para el género y como media±DE para el resto de los parámetros, siendo p el grado de significación estadística obtenida mediante las pruebas de la chi al cuadrado para el género, de la t de Student para el peso y la talla, y de la U de Mann-Whitney para el resto de las variables. En negrita se muestran los resultados estadísticamente significativos.
Percentiles de peso (A), talla (B) e índice de masa corporal (C) en los niños con antecedentes de crecimiento extrauterino retrasado (grupo CER) y en los controles (grupo control). Los datos se expresan como porcentaje de niños (% niños), siendo p el grado de significación estadística obtenida mediante las pruebas de la chi al cuadrado para tablas de contingencia. Grupo CER (n = 38) y grupo control (n = 123). CER: crecimiento extrauterino retrasado; IMC: índice de masa corporal; p: percentil.
Presión arterial sistólica y diastólica de los niños con antecedentes de crecimiento extrauterino retrasado y del grupo control. Los datos son expresados como media±DE, siendo p el grado de significación estadística obtenida mediante la prueba de la U de Mann-Whitney. Grupo CER (n = 38) y grupo control (n = 123). CER: crecimiento extrauterino retrasado.
El grupo CER presentó mayores niveles séricos de glucosa y GGT, y menor concentración de ferritina y cHDL respecto de los controles, aunque sin llegar a concentraciones patológicas, y sin diferencias significativas en el resto de los parámetros medidos (tabla 3).
Parámetros bioquímicos recogidos en los niños con antecedentes de crecimiento extrauterino retrasado (grupo CER) y en los controles (grupo control)
| Parámetros | CER (n = 38) | Control (n = 123) | p |
| Ácido úrico (mg/dl) | 3,42±0,70 | 3,64±0,66 | 0,085 |
| AST (U/l) | 27,76±6,76 | 27,26±4,85 | 0,679 |
| ALT (U/l) | 18,39±5,85 | 17,41±5,50 | 0,224 |
| GGT (U/l) | 14,70±4,78 | 11,68±3,20 | 0,001 |
| Glucosa (mg/dl) | 87,66±7,56 | 83,05±6,73 | < 0,001 |
| Insulina (mU/l) | 5,53±3,35 | 5,36±2,49 | 0,629 |
| Índice HOMA | 1,22±0,76 | 1,12±0,58 | 0,956 |
| Colesterol total (mg/dl) | 163,26±24,70 | 170,44±27,04 | 0,147 |
| cHDL (mg/dl) | 56,76±12,27 | 66,67±12,28 | < 0,001 |
| TG (mg/dl) | 58,76±23,10 | 55,54±18,85 | 0,679 |
| cLDL (md/dl) | 94,37±21,47 | 92,41±24,64 | 0,659 |
| Apo A-1 (mg/dl) | 146,03±22 | 152,14±19,76 | 0,301 |
| Apo B (mg/dl) | 64,26±13,47 | 65,89±15,90 | 0,570 |
ALT: alanina aminotransferasa; Apo A-1: apolipoproteína A-1. Apo B: apolipoproteína B; AST: aspartato aminotransferasa; CER: crecimiento extrauterino retrasado; cHDL: colesterol ligado a lipoproteínas de alta densidad; cLDL: colesterol ligado a lipoproteínas de baja densidad; GGT: gamma-glutamil transferasa; HOMA: índice de resistencia a insulina; TG: triglicéridos.
Los datos son expresados como media±DE, siendo p el grado de significación estadística obtenida mediante las pruebas de la t de Student para ácido úrico y AST, y de la U de Mann-Whitney para el resto de las variables. En negrita se muestran los resultados estadísticamente significativos.
El IMC se correlacionó con los niveles séricos de ácido úrico (CC=0,366; p=0,026) y de TG (CC=0,408; p=0,011). La PAS presentó una asociación moderada con la glucosa (CC=0,356; p=0,031), la insulina (CC=0,349; p=0,034) y el índice HOMA (CC=0,370; p=0,024), mientras que la PAD se relacionó negativamente con el peso en la semana 36 de EGC (CC=–0,337; p=0,038). En relación con los marcadores del metabolismo hidrocarbonado, tanto la insulina como el índice HOMA se asociaron a los niveles de TG; (CC=0,449; p=0,005) y (CC=0,402; p=0,012), respectivamente. El IMC también se correlacionó moderadamente con la insulina (CC=0,624; p<0,001) y con el índice HOMA (CC=0,588; p<0,001).
DiscusiónHasta la actualidad, se ha considerado que los neonatos con CER, cuando alcanzan el crecimiento óptimo y son dados de alta de la UN, no presentan otra patología (salvo secuelas, en su caso, por la prematuridad) y que su desarrollo y enfermedad futura no están influenciados por el crecimiento, la nutrición y el metabolismo de la etapa perinatal. Sin embargo, en este estudio se ha observado por primera vez que los niños con antecedentes de CER presentan precozmente en la etapa prepuberal menor crecimiento, elevación de la PA, incluso algunos de ellos están en rango de HTA. De igual forma presentan cambios en algunos marcadores metabólicos como en la glucosa y en el cHDL respecto de un grupo control.
Los factores más importantes que influyen en el desarrollo del CER son el peso y la EG al nacimiento1-5. La media de EG es muy similar entre las diferentes publicaciones así como el peso al nacimiento y, al igual que en la literatura1-3,22-24, se ha observado en este trabajo una relación positiva entre el CER y el género masculino (tabla 1). La estancia hospitalaria2 y la presencia y severidad de patología concomitante también intervienen negativamente5,25. La ingesta de esteroides prenatales, la patología materna, la necesidad de reanimación al nacimiento y el test de Apgar observados en este trabajo fueron similares a los del resto de estudios publicados, y la sepsis y la enfermedad de membrana hialina se consideraron las patologías más frecuentes en la etapa perinatal1,3,5,22-24 (fig. 1). La necesidad de soporte respiratorio con ventilación mecánica y de oxigenoterapia también se asocia a la condición de CER2,5. La mayoría de los neonatos con CER de este estudio precisaron soporte ventilatorio, pero durante menos tiempo que el descrito en otros trabajos1,3 (tabla 1).
En relación con la nutrición recibida en la etapa perinatal, los neonatos precisaron nutrición parenteral más tiempo y comenzaron más tarde la nutrición enteral que en el resto de los trabajos revisados1,3,5,22-24 (tabla 1). Cuanto más adecuado es el soporte nutricional en los primeros días de vida del RN, menor será la incidencia de CER2,22,25. Aunque el soporte nutricional y la rápida ganancia de peso en la etapa neonatal de los niños CER presentan efectos beneficiosos a corto plazo, pueden tener también efectos negativos para el neonato, incluyendo cambios metabólicos que darían lugar a alteraciones y a patología metabólica en etapas posteriores25,26. De hecho, la correlación negativa obtenida entre la PAD y el peso en la semana 36 de EGC evidencian la relación existente entre la condición de CER y la elevación de la PA, factor de riesgo de patología metabólica, se evidencia ya en la etapa prepuberal en los niños de este estudio.
Al realizar diferentes estudios, en la definición de CER se han empleado tablas de antropometría y poblaciones variables, así como criterios de definición e inclusión diferentes, por lo que puede existir una falta de uniformidad en los trabajos de la literatura; de hecho, muchos de ellos no son comparables25. La mayoría coincide en la valoración del CER mediante las curvas de peso1-5,17,22-24, aunque siempre se utiliza una definición estática. En este trabajo, para evitar factores de confusión asociados, se propone una nueva definición más estricta y dinámica, teniendo en cuenta el percentil antropométrico al nacimiento, y la evolución de los parámetros de crecimiento tanto en la semana 36 de EGC como al alta de la UN. Además, se ha utilizado el p3 como punto de corte para definir el CER, al ser equivalente a –2 DE4, y no el p10 como se ha utilizado en la mayoría de los trabajos1-3,5-7. Así, en los niños prepúberes con antecedente de CER se ha observado, al igual que en este trabajo (tabla 2), que el escaso crecimiento de la etapa neonatal persiste en ocasiones durante la infancia3,22,27.
Los niños con antecedentes de CIR10,11 y de prematuridad28 también suelen mantener una talla e IMC menores que los nacidos con peso adecuado a su EG. De hecho, persisten diferencias significativas en estos parámetros en nuestros grupos de estudio tanto en las medias de valores absolutos como en las medidas z-score (tabla 2). El ambiente intrauterino y la vida posnatal temprana se han relacionado con el desarrollo de SM en etapas posteriores de la vida; incluso se ha descrito que el 50% del SM se atribuye a un ambiente intrauterino desfavorable9,13. Sin embargo, se desconoce la incidencia de este en los adultos que nacieron prematuros29 o que presentaron antecedentes de CER. Los prepúberes de nuestra serie no cumplieron criterios de SM30, pero presentaron factores de riesgo asociados (tablas 2 y 3, y figs. 2 y 3).
La elevación de la PA como criterio de SM también ha sido descrita en pacientes con antecedentes de patologías como el CIR9,12,31. Este hecho se ha relacionado con el rápido crecimiento posnatal9,12 y con el soporte nutricional que recibieron en la etapa neonatal32, aunque el mecanismo es aún desconocido31 y no todos los trabajos defienden estos hallazgos33. En este trabajo se describe por primera vez que los niños prepúberes con antecedentes de CER presentan mayores niveles de PA (fig. 3) respecto de los controles, incluso el 46 y el 37% de los sujetos para la PAS y la PAD, respectivamente, en rangos de HTA. La PAS se correlacionó positiva y moderadamente con la glucosa, la insulina y el índice HOMA, y ello podría indicar, como en otras patologías, una relación entre los distintos componentes del riesgo metabólico en los niños con estos antecedentes.
El IMC, que fue menor en estos niños con respecto al grupo control, también se asoció positivamente a los valores de TG, insulina e índice HOMA. En niños prepúberes con antecedentes de CIR15 o de prematuridad34 también se ha descrito un riesgo aumentado de presentar RI en etapas posteriores. De hecho, la malnutrición temprana y el soporte nutricional en la vida extrauterina se asocian a un deterioro del metabolismo insulínico y de la tolerancia a la glucosa en adultos11,35. Aunque en algunos de estos parámetros medidos no se han observado diferencias significativas, ello podría revaluarse aumentando el número de la muestra o analizando estos parámetros en niños de mayor edad o en la etapa de la adolescencia, cuando los cambios metabólicos podrían ser más evidentes. Igualmente, el ácido úrico, parámetro emergente del SM, en los niños prepuberales con antecedentes de CIR14, al igual que en los CER de este estudio (tabla 3), no mostró diferencias significativas respecto de los controles (p<0,085), probablemente debido a estos motivos.
El ambiente intrauterino y la exposición posnatal temprana en el ámbito nutricional también parecen ser determinantes en el desarrollo de dislipidemia en la etapa adulta9,35,36. Por ello, el CER podría ser considerado un factor de riesgo de alteraciones lipídicas en etapas posteriores, incluso con comienzo precoz en la infancia. En este trabajo se observó que los niños del grupo CER presentaban menores niveles de cHDL respecto de los controles sanos, aunque sin relevancia clínica y sin diferencias significativas en el resto de los parámetros del perfil lipídico evaluados (tabla 3). Los autores consultados en series de niños con antecedentes de CIR tampoco han encontrado diferencias significativas para otros marcadores lipídicos evaluados, como el colesterol total37. Sí se ha observado una relación positiva entre los TG con la insulina y el índice HOMA en estos niños con antecedentes de CER.
En conclusión, los niños con antecedentes de CER presentan un menor crecimiento y mayores niveles de PA que un grupo de niños sanos, así como algunas alteraciones metabólicas, ya en la etapa prepuberal. Ello se podría asociar a un riesgo aumentado de patología en etapas posteriores de la vida, como dislipidemia, HTA, SM, RI y ECV. Tras los resultados de este estudio, el CER debería ser considerado un problema clínico importante y se propone una especial atención al soporte nutricional recibido en los niños prematuros, para prevenir y tratar adecuadamente el CER inicial, minimizando el riesgo de patología metabólica posterior. También sería conveniente programar un seguimiento más estricto de estos niños durante la infancia y la adolescencia. Finalmente, sería de interés continuar la investigación de nuevos biomarcadores metabólicos en niños con antecedentes de CER y en diferentes etapas de la vida para evaluar realmente el riesgo de desarrollo de SM.
FinanciaciónEste trabajo ha sido financiado gracias al Premio Nutribén de Investigación Pediátrica en el 59.° Congreso Nacional de Pediatría, Gran Canaria, junio 2010.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.