La L-asparraginasa (L-ASP) es una de las piedras angulares del tratamiento de la leucemia linfoblástica aguda y del linfoma no Hodgkin. Es una enzima de origen bacteriano con capacidad de transformar la L-Asparragina en ácido aspártico; la depleción extracelular de este aminoácido inhibe la síntesis proteica en los linfoblastos induciendo su apoptosis. Numerosos estudios han demostrado que los tratamientos con L-ASP mejoran la supervivencia de estos pacientes, pero existen diferencias en las características de las 3 formulaciones disponibles en la actualidad. Este artículo revisa la dosificación, actividad y efectos secundarios de las 2 L-ASP derivadas de Escherichia coli (la nativa y la pegilada) y de la única derivada de Erwinia chrysanthemi (Erwinia ASP). A pesar de su indiscutible indicación en los últimos 50 años, siguen existiendo numerosos puntos de controversia, y su uso todavía sigue marcado por los efectos secundarios derivados de la inhibición de la síntesis proteica. La vida media corta de las formas nativas y la vía de administración intramuscular, la más utilizada hasta el momento, afecta la calidad de vida de estos pacientes por la frecuencia con la que han de acudir al centro hospitalario y las múltiples punciones que conlleva. Por ello, los estudios más recientes pretenden valorar otras alternativas como la formulación de vida media más larga (L-ASP pegilada) y la vía intravenosa, con resultados alentadores. AUn así, son necesarios más estudios para establecer cuál es la formulación y la vía de administración indicada en primera línea, la dosificación óptima y el manejo de los efectos adversos.
L-asparaginase (L-ASP) is one of the cornerstones of the treatment of acute lymphoblastic leukemia and non-Hodgkin lymphoma. It is an enzyme of bacterial origin capable of transforming L-asparagine to aspartic acid. The extracellular depletion of L-asparagine inhibits protein synthesis in lymphoblasts, inducing their apoptosis. Numerous studies have demonstrated that treatment with L-ASP improves survival of patients, but there are clear differences in the characteristics of the three currently available formulations. This article reviews the dosage, activity and side effects of the two L-ASP derived from Escherichia coli (native and pegylated), and the one derived from Erwinia chrysanthemi (Erwinia ASP). Despite its indisputable indication over the past50 years, there are still many points of contention, and its use is still marked by the side effects of the inhibition of protein synthesis. The short half-life of native forms, and the most frequently used parenteral administration by intramuscular injections, affects the quality of life of the patients. Therefore, recent studies claim to evaluate alternatives, such as the formulation of longer half-life pegylated L-ASP, and the use of intravenous formulations. There are encouraging results to date with both preparations. Still, further studies are needed to establish which should be the formulation and frontline indicated route of administration, optimal dosing, and management of adverse effects.
La leucemia linfoblástica aguda (LLA) es la enfermedad maligna más frecuente en niños. Su pronóstico ha mejorado sustancialmente en las últimas décadas gracias al desarrollo de fármacos y protocolos terapéuticos más eficaces, pero a pesar de estos avances terapéuticos hay un fracaso del tratamiento en el 15-20% de los pacientes, en la mayoría de los casos por recaídas.
Una de las dificultades en el tratamiento del cáncer es que los quimioterápicos convencionales, a las dosis necesarias para destruir las células malignas, a menudo tienen una toxicidad inaceptable para las células no tumorales. Esto ha hecho que aumente la demanda de tratamientos antitumorales más específicos. Una de las características diferenciales de estas células malignas son las alteraciones metabólicas. En concreto muchos tumores presentan deficiencias en la síntesis de aminoácidos, precisando un pool extracelular para poder realizar la síntesis proteica. Esta es la base de una modalidad de tratamiento selectivo antitumoral, que consiste en la depleción sistémica de aminoácidos para provocar la apoptosis de las células tumorales, con una menor afectación de las células sanas. Dentro de este grupo se encuentra la L-asparraginasa (L-ASP), una enzima de origen bacteriano con capacidad de transformar la L-asparragina en ácido aspártico. Esta depleción extracelular de asparragina inhibe la síntesis proteica en los linfoblastos e induce la apoptosis de la población celular neoplásica. Aunque este citostático ha sido una de las mayores contribuciones al tratamiento de la LLA y el linfoma no-Hodgkin (LNH) en los últimos 50 años, su uso todavía está marcado por los efectos secundarios, ya que la depleción de este aminoácido se asocia también a una menor síntesis de otras proteínas como la albúmina, la insulina y otras que intervienen en el proceso de la coagulación y fibrinólisis, originando toxicidades como trombosis, pancreatitis o hiperglucemia. Además, por su origen bacteriano, tiene la desventaja de las reacciones inmunes (hipersensibilidad y formación de anticuerpos), y la limitada distribución farmacocinética con una rápida eliminación de la circulación.
Numerosos estudios han demostrado que los tratamientos con L-ASP mejoran la supervivencia de pacientes con LLA y LNH, pero existen diferencias entre la dosificación, la actividad y los efectos secundarios de las formulaciones disponibles. En la actualidad se dispone de 3 preparaciones de L-ASP: 2 derivadas de Escherichia coli (E. coli), la nativa (E. coli ASP) y la pegilada (PEG-ASP); y una única de Erwinia chrysanthemi (Erwinia ASP). La asparraginasa recombinante, la intraeritrocitaria y erwinasa pegilada son formulaciones todavía en investigación. En la mayoría de los protocolos internacionales las de primera elección son las de E. coli, quedando la de Erwinia en segunda o tercera línea en los casos de hipersensibilidad.
Formulaciones, formas de administración, dosificación y equivalenciasFormulacionesL-ASP se ha encontrado en bacterias como E. coli, mycobacteria, bacillus o Erwinia, entre otras, pero no todas tienen actividad anticancerosa. En la actualidad las de E. coli y Erwinia chrysanthemi y sus derivados son las únicas preparaciones disponibles para uso médico.
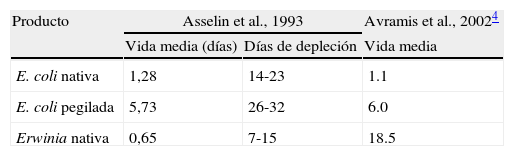
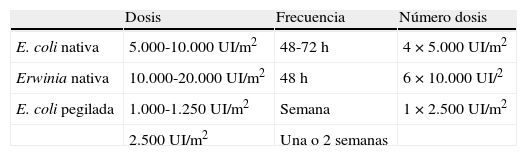
Asparraginasa de E. coli nativaEs la formulación de primera línea en la mayoría de los protocolos. Existen varios preparados comerciales (Asparaginasa Medac®, Crasnitin®, Elspar®, Paronal®, Leunase® y Kidrolase®), pero la disponibilidad varía mucho entre los distintos países. En España la más utilizada es Kidrolase®. Su vida media es 1,28±0,35 días (tabla 1), y aunque existen diferencias entre los distintos preparados, la dosis recomendada habitualmente es entre 5.000-10.000 UI/m2 cada 48h1.
Vida media L-ASP
| Producto | Asselin et al., 1993 | Avramis et al., 20024 | |
| Vida media (días) | Días de depleción | Vida media | |
| E. coli nativa | 1,28 | 14-23 | 1.1 |
| E. coli pegilada | 5,73 | 26-32 | 6.0 |
| Erwinia nativa | 0,65 | 7-15 | 18.5 |
Asselin BL et al. Comparative pharmacokinetic studies of three asparaginase preparations. J Clin Oncol. 1993 Sep;11(9):1780-6.
La forma derivada de Erwinia chrysanthemi (Erwinase®) está indicada en España, al igual que en muchos otros países, como tratamiento de segunda o tercera línea en casos de hipersensibilidad a las formas derivadas de E. coli. Según los protocolos utilizados en nuestro país, en caso de reacción alérgica a E. coli nativa la formulación de segunda línea puede ser Erwinia ASP o PEG-ASP. En este último caso Erwinia ASP pasaría a tercera línea.
Su vida media es más corta que las de E .coli (0,6±0,13 días) (tabla 1), y por tanto son necesarias dosis más altas y más frecuentes para conseguir una depleción sérica completa de asparragina. Las dosis recomendadas son 20.000 UI/m2, 3 veces/semana2.
Asparraginasa de E. coli pegiladaEs una forma modificada de la enzima L-ASP obtenida mediante una conjugación en forma covalente con unidades de monometoxipolietilenglicol (PEG)3. El preparado comercial, Oncaspar®, está disponible en la mayoría de los países, aunque en EE. UU. se ha aprobado como tratamiento de primera línea y en Europa como segunda o tercera en los casos de hipersensibilidad a las formas nativas de ASP.
El objetivo de esta preparación es por un lado disminuir la inmunogenicidad, y por otro reducir la frecuencia en la administración. Así, la incidencia de alergia y el desarrollo de anticuerpos es menor que con la nativa4,5 y su vida media es de 5,73±3,24 días (tabla 1).
Las dosis recomendadas son 1.000-2.500 UI/m2 cada una, o 2 semanas. La equivalencia de dosis entre las 3 formulaciones se describe en la tabla 2.
Nuevas formulacionesAsparraginasa de E. coli recombinanteCon esta nueva formulación se pretende obtener la enzima L-ASP a partir de una levadura recombinante para conseguir un producto con menos impurezas. El objetivo es aumentar la actividad de la enzima y disminuir los efectos secundarios provocados por la respuesta inmune frente a derivados de origen bacteriano, como son las disponibles en la actualidad.
En un estudio fase 1 el producto ha demostrado una alta actividad plasmática de la enzima, con una adecuada depleción de asparragina1. En otros estudios aleatorizados que comparan la recombinante con la nativa E. coli no se han encontrado diferencias en la farmacocinética, actividad de la enzima, depleción de asparragina, ni en la actividad antileucemica6,7.
Asparraginasa encapsulada en glóbulos rojosEn esta formulación (GRASPA®) se utilizan los eritrocitos como vehículo biocompatible y biodegradable para la L-ASP. Se ha visto que los eritrocitos la protegen de los anticuerpos, aumentando su vida media y reduciendo su inmunogenicidad y efectos adversos. En el estudio GRASPALL 2005-01 fase i/ii multicéntrico y aleatorizado, se concluyó que una dosis de 150 UI/kg de GRASPA® tenía resultados similares a 8 dosis de 10.000 UI/m2 de ASP E. coli nativa, con mejor perfil de seguridad, ya que el número de reacciones alérgicas y coagulopatías fue menor y el resto de efectos secundarios similares8.
EficaciaLa L-ASP se considera uno de los principales elementos del tratamiento de la LLA y el LNH en niños, y su relación con una mayor tasa de respuesta se ha demostrando en numerosos estudios que se resumen en la tabla 32.
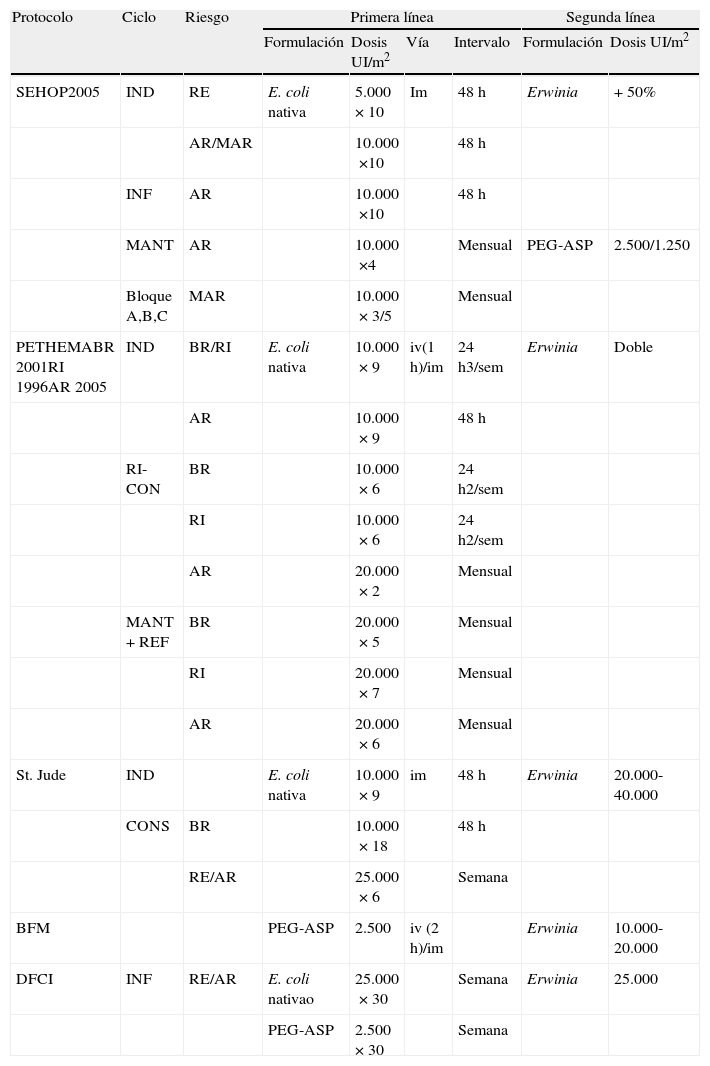
Asparraginasa en los diferentes protocolos actuales
| Protocolo | Ciclo | Riesgo | Primera línea | Segunda línea | ||||
| Formulación | Dosis UI/m2 | Vía | Intervalo | Formulación | Dosis UI/m2 | |||
| SEHOP2005 | IND | RE | E. coli nativa | 5.000 ×10 | Im | 48h | Erwinia | +50% |
| AR/MAR | 10.000 ×10 | 48h | ||||||
| INF | AR | 10.000 ×10 | 48h | |||||
| MANT | AR | 10.000 ×4 | Mensual | PEG-ASP | 2.500/1.250 | |||
| Bloque A,B,C | MAR | 10.000 ×3/5 | Mensual | |||||
| PETHEMABR 2001RI 1996AR 2005 | IND | BR/RI | E. coli nativa | 10.000 ×9 | iv(1h)/im | 24h3/sem | Erwinia | Doble |
| AR | 10.000 ×9 | 48h | ||||||
| RI-CON | BR | 10.000 ×6 | 24h2/sem | |||||
| RI | 10.000 ×6 | 24h2/sem | ||||||
| AR | 20.000 ×2 | Mensual | ||||||
| MANT+REF | BR | 20.000 ×5 | Mensual | |||||
| RI | 20.000 ×7 | Mensual | ||||||
| AR | 20.000 ×6 | Mensual | ||||||
| St. Jude | IND | E. coli nativa | 10.000 ×9 | im | 48h | Erwinia | 20.000-40.000 | |
| CONS | BR | 10.000 ×18 | 48h | |||||
| RE/AR | 25.000 ×6 | Semana | ||||||
| BFM | PEG-ASP | 2.500 | iv (2h)/im | Erwinia | 10.000-20.000 | |||
| DFCI | INF | RE/AR | E. coli nativao | 25.000 ×30 | Semana | Erwinia | 25.000 | |
| PEG-ASP | 2.500 ×30 | Semana | ||||||
AR: alto riesgo; BFM: Berlin-Frankfurt-Munster; BR: bajo riesgo; CONS: consolidación; DFCI: Dana-Farber Cancer Institute; IND: inducción; INF: intensificación; MANT: mantenimiento; MANT+REF: mantenimiento con refuerzo; MAR: muy alto riesgo; PETHEMA: Programa para el Estudio de la Terapéutica en Hemopatía Maligna; RE: riesgo estándar; RI: riesgo intermedio; RI-CON: reinducción consolidación; SEHOP: Sociedad Española Hematología y Oncología Pediátricas.
El objetivo del tratamiento es conseguir la depleción de asparragina en suero. Aunque no se ha conseguido determinar el valor mínimo eficaz, sí que se conoce que niveles de ASP>100U/l en suero corresponden a una depleción de asparragina con niveles por debajo de los cuantificables7. La actividad de la L-ASP es dosis dependiente tanto en sangre como en LCR. Aunque penetra en el LCR, los niveles bajan rápidamente por la existencia de un rápido flujo hacia el plasma. Por lo tanto, para una adecuada depleción de asparragina en el LCR son necesarios niveles de L-ASP en sangre>100U/l o dosis de ASP E. coli nativa de al menos 5.000UI/kg1. Sin embargo, algún estudio sugiere que niveles de 50U/l son suficientes para la depleción de asparragina tanto en suero como en LCR9.
Comparación entre tratamientos que incluyan o no L-asparaginasaExisten pocos estudios aleatorizados que comparen esquemas de tratamiento con o sin L-ASP. Entre ellos la Asociación Italiana de Hematología y Oncología Pediátrica (AIEOP) describió el aumento significativo de la supervivencia global (SG) y de la supervivencia libre de enfermedad (SLE) entre los pacientes tratados con dosis altas de L-ASP E. coli (25.000UI/m2/semana×20 semanas) frente a los pacientes no tratados con L-ASP (87,5% vs 78,7%; y 93,7% vs 88,6% respectivamente), así como un 40% menos de recaídas10.
Comparación entre tratamientos de diferente intensidadExisten estudios que apoyan el beneficio de los tratamientos más intensivos, como los realizados por el Dana-Faber Cancer Institut (DFCI) con dosis altas de L-ASP durante el tratamiento de intensificación (nativa 25.000UI/m2 o pegilada 2.500UI/m2/semana durante 30 semanas), con una SLE significativamente mayor que en estudios previos. Esta mejoría fue atribuida a la intensificación y prolongación del tratamiento con L-ASP, e incluso los pacientes que toleraban más de 25 dosis tenían mejor SLE que los que habían recibido 25 o menos11. Este estudio apoya uno similar realizado previamente por Amylon et al. con resultados superponibles12.
Sin embargo, no todos confirman este hecho y, en este sentido, cabe destacar 2 estudios. El de Rizzari et al., en el que no se observaron diferencias estadísticamente significativas entre pacientes que recibieron dosis estándar (10.000UI/m2×4 dosis durante las reinducciones) o altas dosis (25.000UI/m2/semana×20 semanas durante la reinducción y continuación)13; y el de Schrey et al. que concluyen que dosis reducidas de L-ASP de E. coli nativa de 5.000UI/m2 durante el tratamiento de inducción consiguen niveles de la enzima de 100U/l en más del 90% de los pacientes y, por tanto, es una estrategia a considerar en los diseños de protocolos futuros14.
Comparación entre formulacionesVarios estudios han comparado la eficacia de las L-ASP nativas derivadas de E. coli y de Erwinia con diferencias en los resultados posiblemente debidas a unas dosis y frecuencia insuficientes en el caso de ASP de Erwinia2,15.
Avramis et al., en un estudio aleatorizado que compara la L-ASP E. coli nativa y pegilada, recomienda la forma pegilada por su efecto más prolongado y la menor incidencia de anticuerpos silentes, con un perfil de eficacia y seguridad similar a la nativa. Además, el estudio farmacoeconómico muestra que el coste total de los pacientes con PEG-ASP, si se considera la reducción del número de dosis y visitas hospitalarias, es similar al de la nativa4.
Otros estudios aleatorizados conducidos por Moghabi et al.15 y Duval et al.16 demuestran que las formulaciones con vida media más corta, administradas a la misma dosis y frecuencia que las de vida media más larga, se relacionan con una peor SLE, aunque también con una menor toxicidad.
Un estudio de pacientes con recaída de LLA demuestra una mayor tasa de respuesta con PEG-ASP a dosis altas semanales que con E. coli nativa17.
Vías de administraciónLas vías de administración disponibles en la actualidad son la intravenosa (iv) y la intramuscular (im), y sus diferencias estriban fundamentalmente en la biodisponibilidad y en los efectos secundarios (reacciones alérgicas)1. Tradicionalmente la más utilizada ha sido la im por la preocupación de que la vía iv pudiera causar más reacciones alérgicas. Sin embargo, se debería tener en cuenta que la vía iv podría limitar la duración y gravedad de la reacción, ya que permite interrumpir la administración en el momento en que se inician los signos, mientras que con la vía im la reacción alérgica se mantiene hasta la degradación total de la dosis completa del fármaco18. Pero buscando la comodidad del paciente, cada vez se está estudiando más la posibilidad de cambiar a la vía iv.
El estudio de Pidaparti et al., en el que se compara el uso de PEG-ASP im frente a iv se describen con la vía im más reacciones locales, y más sistémicas con la iv, aunque no son más graves19. En otro estudio Rodríguez et al. comparan la administración de L-ASP nativa (E. coli y Erwinia) en infusión continua de 24-48h frente a la vía im. Describen buena tolerancia de la iv, sin reacciones alérgicas graves, y más reacciones leves con la vía im que con la iv.18
El otro punto a considerar es la biodisponibilidad, que se puede valorar midiendo tanto la actividad de la enzima como la proporción de pacientes que no alcanzan una depleción completa de asparragina. Teóricamente la administración iv produce un pico plasmático más alto, mientras que con la im el pico se alcanza de forma más lenta por su efecto depot. En este sentido, hay estudios que describen una actividad media de la enzima mayor con la vía im que con la iv14. Sin embargo, otros estudios obtienen resultados diferentes, como el de Silverman, con la administración de PEG-ASP 2.500UI/m2 en infusión iv de una hora durante la fase de inducción, concluyendo que tanto la tolerancia como la actividad de la enzima son buenas, con niveles plasmáticos que se mantienen por encima de 100U/l durante al menos 2 semanas11. Otros estudios que comparan Erwinia iv e im, tampoco encuentran diferencias significativas ni en la actividad de la enzima ni en la depleción de asparragina9,20.
Efectos adversosLos efectos adversos de la L-ASP están relacionados principalmente con reacciones inmunes, aunque también destacan otros como coagulopatía, pancreatitis, disfunción hepática y cerebral (tabla 4)1,21.
Efectos secundarios de L-ASP
| Reacciones inmediatas | 71% |
| Náuseas, vómitos | |
| Fiebre, escalofríos | |
| Reacciones hipersensibilidad | 13% |
| Urticaria | |
| Broncoespasmo | |
| Hipotensión | |
| Disminución síntesis proteica | 100% |
| Albúmina | |
| Hipoalbuminemia | |
| Insulina | |
| Hiperglucemia | |
| Factores coagulación | |
| Trombosis | |
| Hemorragia | |
| Lipoproteínas | |
| Hipertrigliceridemia | |
| Disfunción órganos | |
| Sistema nervioso central | 33% |
| Cefalea | |
| Desorientación | |
| Coma | |
| Convulsión | |
| Depresión | |
| Páncreas | 15% |
| Pancreatitis aguda/crónica | |
| Hígado | 97% |
| Hipertransaminasemia | |
| Riñón | 68% |
| Azoemia | |
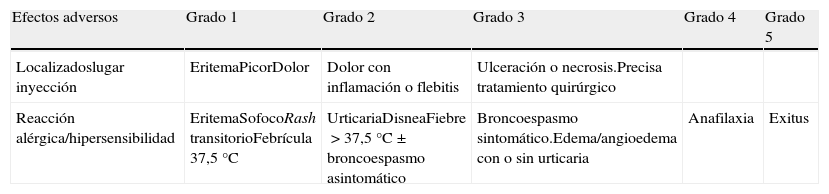
Es el efecto adverso descrito con mayor frecuencia, con una incidencia según diferentes estudios entre el 13-60%2,15,22. Producida por anticuerpos específicos contra ASP generados por la exposición a proteínas bacterianas. Varían de localizadas a sistémicas con grados entre 1 y 5, siendo las más frecuentes las grado 1 y 2 (tabla 5)21,23.
Evaluación de reacciones locales y de hipersensibilidad
| Efectos adversos | Grado 1 | Grado 2 | Grado 3 | Grado 4 | Grado 5 |
| Localizadoslugar inyección | EritemaPicorDolor | Dolor con inflamación o flebitis | Ulceración o necrosis.Precisa tratamiento quirúrgico | ||
| Reacción alérgica/hipersensibilidad | EritemaSofocoRash transitorioFebrícula 37,5°C | UrticariaDisneaFiebre>37,5°C±broncoespasmo asintomático | Broncoespasmo sintomático.Edema/angioedema con o sin urticaria | Anafilaxia | Exitus |
Fuente: Cancer Therapy Evaluation Program's Common Terminology for Clinical Adverse Events23.
Se han descrito con mayor frecuencia y gravedad en aquellos pacientes que habían recibido previamente L-ASP, sobre todo después de la segunda o tercera dosis, incluso meses después de su administración2,24,25. También se ha relacionado más con el uso de ASP E. coli nativa que con la forma pegilada y Erwinia ASP4,26. En el Protocolo DFCI 91-01, PEG-ASP se asoció con una menor incidencia de reacciones de grado intermedio, y no presentó diferencias en la incidencia de las graves cuando se comparó con la forma nativa11. Por otro lado, en el Protocolo CCG-1961 un 54% de los pacientes presentaron una reacción alérgica a PEG-ASP. Dado que todos ellos habían recibido previamente L-ASP nativa, los autores proponían utilizar PEG-ASP desde el inicio del tratamiento27.
El riesgo de hipersensibilidad se ha visto reducido cuando se ha combinado con corticoides (dexametasona/prednisona) o con otro tratamiento inmunosupresor21.
Para su manejo se recomiendan corticoides y adrenalina según el grado. Los casos de reacciones graves requieren interrumpir el tratamiento, o cambiar a otra formulación. Algunos autores proponen el uso concomitante con corticoides para prevenir reacciones alérgicas, por la inmunosupresión que producen28.
Los anticuerpos anti-ASP no siempre producen clínica de hipersensibilidad, pero sí que pueden producir, en cambio, una rápida inactivación de ASP, y dar lugar a una reducción de su efecto antileucémico. Esto se conoce como «inactivación silente» y puede ocurrir hasta en un 30% de los pacientes2,22 (tabla 6). No todos los estudios coinciden en que el desarrollo de anticuerpos anti-ASP puedan provocar resistencia al tratamiento. Estas discrepancias sobre el factor pronóstico de estos anticuerpos se pueden explicar por la eficacia de los regímenes terapéuticos de forma global y el uso de formulaciones alternativas en los casos de reacciones alérgicas, que pueden mitigar el efecto adverso de la hipersensibilidad silente2,22.
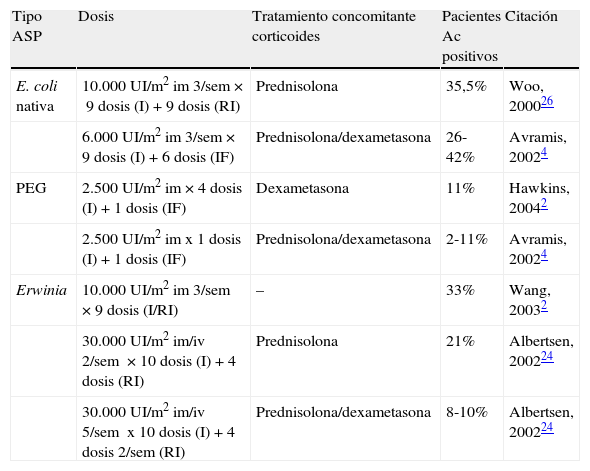
Incidencia de anticuerpos inducidos por los 3 principales tipos de ASP. 2
| Tipo ASP | Dosis | Tratamiento concomitante corticoides | Pacientes Ac positivos | Citación |
| E. coli nativa | 10.000 UI/m2 im 3/sem×9 dosis (I)+9 dosis (RI) | Prednisolona | 35,5% | Woo, 200026 |
| 6.000 UI/m2 im 3/sem×9 dosis (I)+6 dosis (IF) | Prednisolona/dexametasona | 26-42% | Avramis, 20024 | |
| PEG | 2.500 UI/m2 im×4dosis (I)+1 dosis (IF) | Dexametasona | 11% | Hawkins, 20042 |
| 2.500 UI/m2 imx1dosis (I)+1 dosis (IF) | Prednisolona/dexametasona | 2-11% | Avramis, 20024 | |
| Erwinia | 10.000 UI/m2 im 3/sem ×9 dosis (I/RI) | – | 33% | Wang, 20032 |
| 30.000 UI/m2 im/iv 2/sem ×10 dosis (I)+4 dosis (RI) | Prednisolona | 21% | Albertsen, 200224 | |
| 30.000 UI/m2 im/iv 5/sem x10 dosis (I)+4 dosis 2/sem (RI) | Prednisolona/dexametasona | 8-10% | Albertsen, 200224 |
I: inducción; IF: intensificación; RI: reinducción; Sem: semana.
Fuente: Pieters et al.,2
El desarrollo de anticuerpos frente a ASP E. coli nativa puede tener reacción cruzada con la pegilada, pero no con la de Erwinia29. Esta posible reacción cruzada no es una contraindicación absoluta para el uso de PEG-ASP en pacientes que inicialmente han recibido la forma nativa y han presentado una reacción de hipersensibilidad.
La vía de administración determina los síntomas clínicos, con una mayor incidencia de reacciones cutáneas locales con la vía im que con la iv30.
Según algunos estudios la incidencia entre los diferentes grupos de edades es similar31, mientras que otros sugieren que lactantes y niños pequeños desarrollan anticuerpos y reacciones de hipersensibilidad con menos frecuencia que adolescentes y adultos21.
CoagulopatíaLa coagulopatía es debida al efecto de la L-ASP sobre la síntesis proteica. Los datos encontrados con mayor frecuencia son la reducción de plasminógeno, fibrinógeno, antitrombina iii y factores ix y x con prolongación del tiempo parcial de tromboplastina activada (TTPa); aunque también se han descrito déficits de proteína C y S28. Estos déficits de proteínas, tanto pro como antitrombóticas, incrementan el riesgo de sangrado así como el de trombosis, aunque las complicaciones hemorrágicas son mucho menos frecuentes que las trombóticas32.
Los tromboembolismos (TE) son muy raros en la edad pediátrica, pero en estos pacientes aparecen por la confluencia de 3 factores, como son la enfermedad primaria (cáncer), los relacionados con el paciente (edad y trombofilia hereditaria) y los adquiridos (tratamiento con L-ASP y corticoides, colocación de catéteres venosos centrales o infecciones). Según los estudios se describen incidencias entre el 5 y 36%32,33. Esta variación se debe a la heterogeneidad en el diseño de los estudios, con divergencias en la definición de la enfermedad o en los métodos diagnósticos utilizados. Así, las incidencias más bajas corresponden a estudios retrospectivos que valoran únicamente a los pacientes sintomáticos32. Las más altas a los prospectivos que incluyen también a los pacientes clínicamente asintomáticos, pero con oclusiones radiológicas significativas, que son la gran mayoría33. Algo similar ocurre en la descripción de las localizaciones de los TE, en los estudios retrospectivos que valoran los casos sintomáticos predominan las del SNC (>50%)32, mientras que en los prospectivos, donde incluyen los asintomáticos, las trombosis venosas profundas (TVP) en miembros superiores (95%)33.
Entre los factores relacionados con el paciente destacan la edad, con predominio en adolescentes y adultos31. No existe consenso en cuanto al riesgo trombótico asociado a factores trombofílicos hereditarios en estos pacientes. Existen diversos estudios que determinan los factores trombofílicos en los pacientes con trombosis y, mientras que unos los establecen como un factor de riesgo34, otros no encuentran relación33,35.
Dentro de los factores adquiridos se deben considerar el tratamiento, fundamentalmente L-ASP y corticoides. La mayoría de los eventos ocurren durante la fase de inducción, en la que la enfermedad está activa y el tratamiento es más intensivo, y se relacionan con L-ASP a dosis más bajas y durante periodos de tiempo más largos28,33. Además, también se han descrito más eventos trombóticos durante la inducción en los pacientes que recibían prednisona frente a los que recibían dexametasona, y una reducción de los TE cuando se administraba prednisona y ASP separados, aunque esta disminución no alcanzó significación estadística36. Una cuarta parte de los eventos sintomáticos son trombosis relacionadas con el catéter venoso central, lo que sugiere que se trate de un importante factor local33.
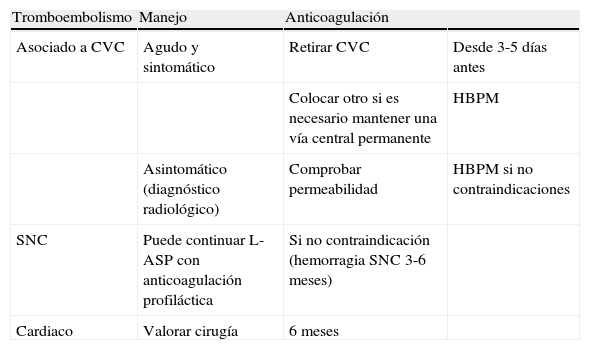
En el manejo de los TE se debe tener muy en cuenta el equilibrio entre el beneficio y el riesgo del tratamiento, ya que ser conservador puede conducir a la extensión del trombo, y un tratamiento agresivo a complicaciones hemorrágicas por la toxicidad del tratamiento quimioterápico concomitante. En los casos en los que se prescriba la anticoagulación, la trombopenia no debe suponer una contraindicación, ya que se puede controlar con transfusiones de concentrado de plaquetas manteniendo un nivel plasmático superior a 50.000.
Cuando el TE es agudo y sintomático, y está asociado a un CVC, el manejo depende de la necesidad de mantener la vía central. Si es necesario mantener una vía central, lo aconsejable es retirar el catéter afectado, después de algunos días de anticoagulación, y colocar otro cambiando la localización. El tratamiento anticoagulante con heparina de bajo peso molecular (HBPM) se debe considerar en los casos de TE importantes y en los que se deba conservar la vía central37.
Las recomendaciones para los TE en el SNC incluyen tratamiento anticoagulante con HBPM sin estar consensuado el uso concomitante de concentrado de antitrombina iii (AT III). Estos pacientes podrían continuar con el tratamiento con L-ASP con profilaxis secundaria anticoagulante con o sin concentrado AT III37.
La hipofibrinogenemia es una complicación frecuente que debe manejarse con cautela. En la actualidad no está claro si se deben monitorizar los niveles de fibrinógeno. La administración de crioprecipitado o concentrado de fibrinógeno también es discutida. Mientras algunos autores aconsejan su administración sistemática cuando sus niveles sean bajos, otros solo la consideran cuando haya sangrado, por el riesgo de trombosis que conlleva28.
En las tablas 7 y 8 se resumen la presentación clínica, diagnóstica y manejo de los TE.
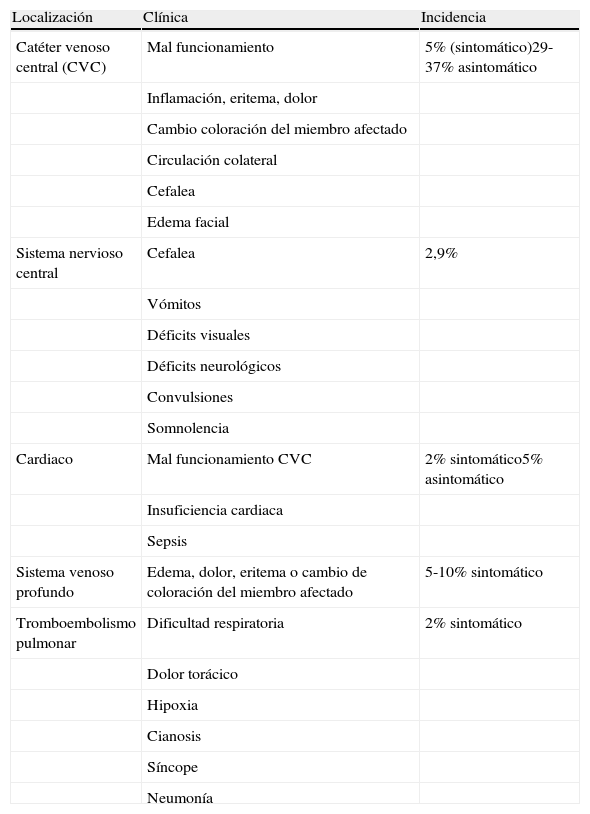
Presentación clínica y diagnóstico de tromboembolismo
| Localización | Clínica | Incidencia |
| Catéter venoso central (CVC) | Mal funcionamiento | 5% (sintomático)29-37% asintomático |
| Inflamación, eritema, dolor | ||
| Cambio coloración del miembro afectado | ||
| Circulación colateral | ||
| Cefalea | ||
| Edema facial | ||
| Sistema nervioso central | Cefalea | 2,9% |
| Vómitos | ||
| Déficits visuales | ||
| Déficits neurológicos | ||
| Convulsiones | ||
| Somnolencia | ||
| Cardiaco | Mal funcionamiento CVC | 2% sintomático5% asintomático |
| Insuficiencia cardiaca | ||
| Sepsis | ||
| Sistema venoso profundo | Edema, dolor, eritema o cambio de coloración del miembro afectado | 5-10% sintomático |
| Tromboembolismo pulmonar | Dificultad respiratoria | 2% sintomático |
| Dolor torácico | ||
| Hipoxia | ||
| Cianosis | ||
| Síncope | ||
| Neumonía |
Fuente: Zalewska-Szewczyk et al.29
Estrategias en el manejo de tromboembolismos
| Tromboembolismo | Manejo | Anticoagulación | |
| Asociado a CVC | Agudo y sintomático | Retirar CVC | Desde 3-5 días antes |
| Colocar otro si es necesario mantener una vía central permanente | HBPM | ||
| Asintomático (diagnóstico radiológico) | Comprobar permeabilidad | HBPM si no contraindicaciones | |
| SNC | Puede continuar L-ASP con anticoagulación profiláctica | Si no contraindicación (hemorragia SNC 3-6 meses) | |
| Cardiaco | Valorar cirugía | 6 meses |
Fuente: Earl28.
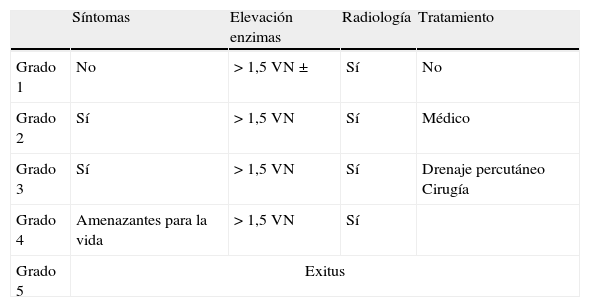
Se han descrito casos de pancreatitis en un 2-18% de los pacientes tratados. La incidencia es tan variable por las diferencias en los criterios diagnósticos28,38. En la tabla 9 se detalla la clasificación teniendo en cuenta los síntomas (dolor abdominal, náuseas, vómitos), determinación de enzimas pancreáticas (amilasa y lipasa) y hallazgos radiológicos (edema, necrosis, pseudoquistes). Los estudios que describen incidencias más bajas solo han incluido los grados 3-54, mientras que las incidencias más altas corresponden a la valoración de todos los grados (1-5)39. La mayoría de los casos son grados bajos con sintomatología leve y discreta elevación de enzimas que se resuelven con tratamiento sintomático28. Ocurre después de una media de 12 días (2-39) tras L-ASP E. coli nativa y 26 días (1-71) tras PEG-ASP39. Se describe con mayor frecuencia en adolescentes que en niños más pequeños. Se ha observado con las 3 formulaciones, aunque la menos relacionada con esta complicación es la de Erwinia, y la descrita con más frecuencia es PEG-ASP28,39. Suele aparecer en las primeras semanas de tratamiento y puede ser recurrente si se continúa el tratamiento con L-ASP tras un primer episodio, lo que sugiere una predisposición genética.
Criterios diagnósticos para los efectos adversos pancreáticos (CTCAE v3.0)
| Síntomas | Elevación enzimas | Radiología | Tratamiento | |
| Grado 1 | No | >1,5 VN± | Sí | No |
| Grado 2 | Sí | >1,5VN | Sí | Médico |
| Grado 3 | Sí | >1,5VN | Sí | Drenaje percutáneo Cirugía |
| Grado 4 | Amenazantes para la vida | >1,5VN | Sí | |
| Grado 5 | Exitus | |||
VN: valor normal.
Fuente: Knoderer et al.39
El tratamiento se basa inicialmente en medidas de soporte y seguimiento de posibles complicaciones. Con tratamientos como el octeótrido, un análogo sintético de la somatostatina, o la infusión continua arterial local de un inhibidor de la proteasa existe menos experiencia, y han sido utilizados ocasionalmente en niños con pancreatitis graves con resultados alentadores39–41. En cuanto a si se debe continuar el tratamiento con L-ASP, la mayoría de los autores recomienda reintroducirla, ya que en los casos en los que se ha interrumpido la SLE ha sido menor. Para evitar las recurrencias se aconseja que el paciente esté clínicamente asintomático un mínimo de 48h, con valores de amilasa y lipasa plasmáticos y estudios de imagen normales y, según algunos autores, se debería cambiar la formulación de L-ASP28,39. Si el paciente presentara un segundo episodio de pancreatitis aguda se aconseja suspender definitivamente la administración de L-ASP. Como secuelas a largo plazo se han descrito pancreatitis crónica y diabetes mellitus insulino-dependientes39.
HiperglucemiaProducida por la disminución en la síntesis proteica, en este caso de insulina. Es más frecuente en adolescentes, obesos, y cuando se administra conjuntamente con corticoides. Se recomienda insulina en los casos graves, sin interrumpir el tratamiento previsto con L-ASP28.
HepatotoxicidadEn la mayoría de los casos es leve y transitoria. La formulación con la que más se ha asociado es la PEG-ASP, y la que la presenta con menor frecuencia es Erwinia ASP. Es importante descartar alteraciones hepáticas secundarias a otras causas como la propia enfermedad primaria (LLA/LNH) o una hepatitis infecciosa. Se recomienda seguimiento de la función hepática antes, durante y después de la administración de L-ASP. En caso de toxicidad hepática con grados 3-4 de la clasificación World Health Organization (WHO) se debe valorar ajustar las dosis de quimioterapia concomitante como vincristina o antraciclinas28.
DiscusiónLa inclusión de L-ASP en los protocolos de tratamiento de LLA es beneficiosa para la curación, pero el debate se encuentra en la formulación, dosificación, vía de administración óptima y manejo de los efectos secundarios.
Tanto las formulaciones L-ASP E. coli nativa como PEG-ASP se plantean como tratamiento de primera línea en los Protocolos de LLA pediátricos, y la L-ASP Erwinia como alternativa en los casos de hipersensibilidad. Algunos estudios, comparando su uso en primera línea, se decantan por la formulación pegilada, por la reducción en la frecuencia de administración y la menor inmunogenicidad, con un coste similar a la nativa en el estudio farmacoeconómico global4,15,17.
Existe menos consenso en cuanto a la dosificación, existiendo tanto estudios que demuestran el beneficio de tratamientos intensivos con altas dosis y frecuencia10–12, como los que defienden que no hay diferencias significativas entre dosis estándar y altas13,14.
La vía de administración puede influir en la biodisponibilidad y en la toxicidad del fármaco. Tradicionalmente la más utilizada ha sido la im porque se ha asumido que así la actividad media de la enzima era mayor, y que causaba menos reacciones alérgicas. Pero cada vez se realizan más estudios con L-ASP iv, buscando mejorar la calidad de vida de estos pacientes, que han demostrado que no hay diferencias significativas ni en la tolerancia ni en la actividad de la enzima, y que las reacciones alérgicas no son más graves9,11,20.
Para monitorizar la actividad de la enzima se recomienda la determinación de los niveles de L-ASP séricos, por las dificultades técnicas para medir los niveles de asparragina. En cuanto a los valores, unos estudios defienden que niveles de ASP>100U/l corresponden a una depleción de asparragina con niveles por debajo de los cuantificables7, y otros incluso sugieren que niveles de 50U/l son suficientes para la depleción tanto en suero como en LCR9.
La hipersensibilidad es el efecto secundario más frecuente, que limita en muchos casos el uso de este fármaco. Por ello se está planteando utilizar PEG-ASP desde el tratamiento de inducción, ya que es la menos inmunogénica y las reacciones graves con esta formulación las han presentado pacientes que inicialmente habían recibido L-ASP nativa27. También se plantea el beneficio del uso concomitante con corticoides u otro inmunosupresor para prevenir reacciones alérgicas28.
Aunque la mayoría de autores no recomienda el estudio de anticuerpos silentes anti-ASP porque no siempre causan la inactivación de la enzima2, Willer et al. plantean un algoritmo terapéutico tras una reacción alérgica, basado en el nivel de estos anticuerpos42.
La coagulopatía es el segundo efecto adverso en frecuencia, y su manejo también es controvertido. Pocos son los estudios que describen la trombofilia hereditaria como un factor de riesgo32. La mayoría no relacionan los factores protrombóticos congénitos con un mayor riesgo de trombosis, y es el anticoagulante antifosfolípido el factor asociado a más riesgo de coagulopatía, pero sin alcanzar la significación estadística33. En cuanto a su relación con los corticoides, se han descrito más eventos trombóticos en los pacientes que recibían prednisona frente a los que recibían dexametasona, y una reducción de los TE cuando se administraba prednisona y ASP separados, aunque sin alcanzar la significación estadística36. El manejo de los accidentes TE en el SNC constituye el tercer punto de controversia. En concreto, se discute la posible indicación de profilaxis primaria en las fases iniciales del tratamiento en pacientes de riesgo. Esto implicaría la identificación de dichos pacientes con screening de factores protrombóticos, tratamiento sustitutivo si está indicado, y posibilidad de continuar el tratamiento con L-ASP tras un episodio de TE asociando profilaxis secundaria anticoagulante. Por último, la hipofibrinogenemia es una complicación frecuente que debe manejarse con cautela, y en la actualidad no hay datos concluyentes que justifiquen la monitorización sistemática de los niveles de fibrinógeno o el empleo indiscriminado de crioprecipitado en caso de hipofibrinogenemia debido al riesgo asociado de trombosis28.
A pesar de que la asociación entre la administración de L-ASP y pancreatitis se describió hace más de 3 décadas, sigue siendo complicado identificar a los pacientes de riesgo. La aparición de esta complicación parece obedecer a una predisposición individual sin una causa aclarada. Dado que la L-ASP se considera un elemento esencial en el tratamiento de la LLA y que muchos de los episodios de pancreatitis no son graves, parece recomendable reanudar el tratamiento empleando formulaciones alternativas de L-ASP tras la recuperación clínica, analítica y radiológica del episodio28,39. Estudios recientes proponen en los casos graves tratamiento con octeótrido, o con un inhibidor de proteasa en infusión continua arterial local. Aunque la experiencia es escasa, y son necesarios más estudios, los resultados son alentadores39–41.
Con este artículo pretendemos recopilar la información disponible en la actualidad en la literatura para garantizar el uso óptimo de la L-ASP. A pesar de que la eficacia de este fármaco ha sido ampliamente demostrada, siguen existiendo puntos controvertidos en su manejo y es complicado en la actualidad establecer determinadas recomendaciones. Serán necesarios más estudios para establecer cuál es la formulación y la vía de administración indicada de primera línea, la dosificación (posible beneficio de tratamientos intensivos frente al estándar) y el manejo de los efectos adversos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.