Tras más de 50 años de recorrido, los programas de cribado neonatal constituyen uno de los avances más significativos que se han producido en salud pública y en el ámbito asistencial pediátrico y neonatal, beneficiando a casi 350.000 niños/año en España. Tras la inclusión en 2003 del cribado de hipoacusia congénita y en 2014 del cribado de 7 enfermedades congénitas por la prueba del talón en el programa poblacional de cribado neonatal del Sistema Nacional de Salud, se han ido produciendo avances significativos en estos últimos años. Ello se manifiesta con la implementación del cribado de cardiopatías congénitas críticas, aprobado en enero de 2024 en la Comisión Nacional de Salud Pública del Consejo Interterritorial del Sistema Nacional de Salud y en el cribado neonatal de enfermedades congénitas en prueba de talón con la incorporación de nuevas entidades por los avances en la utilización de pruebas de segundo nivel y las evidencias científicas generadas. Los neonatólogos y pediatras en general debemos conocer este nuevo presente, así como hacia dónde vamos con un posible avance más rápido con el cribado genómico neonatal.
After more than 50 years of experience, newborn screening programs represent one of the most significant advancements in public health, particularly in pediatric and neonatal care, benefiting almost 350 000 children annually in España. Following the inclusion of congenital hearing loss screening in 2003 and screening for 7congenital diseases by newborn blood spot test in 2014 as part of the population-wide neonatal screening program of the National Health System, significant advances have been achieved in recent years. This progress is evident in the implementation of screening for critical congenital heart diseases, approved in January 2024 by the National Public Health Commission of the Interterritorial Council of the National Health System, as well as screening for congenital diseases through the newborn blood spot test, with the incorporation of new conditions enabled by advances in second-tier testing and emerging scientific evidence. Neonatologists and pediatricians must keep abreast of these developments and where the field is heading, as even more rapid progress may take place with the advent of genomic newborn screening.
El cribado neonatal poblacional es un proceso de detección precoz de trastornos congénitos que, sin una sintomatología aparente, pudieran causar graves problemas físicos, mentales o del desarrollo y en los que un diagnóstico y tratamiento precoces mejoran significativamente su pronóstico. El objetivo es realizarlo al 100% de los neonatos.
El cribado neonatal no es solo un análisis: se trata de un programa que ha de estar centrado en el interés del niño y el sistema de salud debe garantizar el diagnóstico, el tratamiento y el seguimiento clínico de los niños detectados precozmente a través del cribado. Su práctica generalizada ha significado uno de los grandes logros de salud pública y también asistenciales de la Pediatría en general y de la Neonatología en particular1.
Historia del cribado neonatalEn el ámbito mundialEn 1958 el primer programa de cribado neonatal de ámbito mundial se inició en la ciudad de Cardiff (Reino Unido) para la fenilcetonuria (PKU) cuando, al comprobar previamente que estos pacientes se beneficiaban de una dieta precoz restringida en fenilalanina, se llevó a cabo una búsqueda de ácido fenilpirúvico en la orina en todos los neonatos a las 3semanas de vida. En 1963, se publicó en Pediatrics la prueba de Guthrie para el cribado de PKU, al demostrar la utilidad de la muestra de sangre capilar en un papel de filtro especial para la determinación de fenilalanina, lo que sentó las bases metodológicas y conceptuales de los programas de cribado neonatal2. En 1970 se incorporó la detección del hipotiroidismo congénito.
En la década de 1990, a raíz de los hallazgos de Millington de la Universidad de Duke en Estados Unidos3, se incorporó la espectrometría de masas en tándem (MS/MS) en los programas de cribado neonatal, con lo que surgió el cribado ampliado, pues permite, mediante al análisis de aminoácidos y acilcarnitinas en la propia tarjeta de Guthrie, la detección de varias enfermedades simultáneamente. Es la herramienta más poderosa que ha aparecido en los últimos 25 años en el campo del cribado neonatal, por tratarse de un sistema de gran versatilidad, sensibilidad y alta capacidad de análisis que ha permitido ampliar el cribado al realizar la medida simultánea de varios metabolitos y hacer realidad el concepto ideal para el cribado de: una muestra - un análisis - múltiples diagnósticos.
En EspañaEl cribado neonatal se inició en 1968 para la PKU, cuando el Prof. Federico Mayor Zaragoza lo puso en marcha desde la Universidad de Granada. En los años siguientes otros centros de toda España siguieron esta iniciativa. En 1978, el Ministerio de Sanidad estableció el Programa de Detección Precoz Neonatal de Fenilcetonuria e Hipotiroidismo Congénito con la publicación del Real Decreto de 2176/1978 del 25 de agosto. A partir de 1979 se organizó el Plan Nacional de Prevención de la Subnormalidad, integrado dentro del Real Patronato de Educación y Atención a Deficientes. Con su apoyo se crearon varios laboratorios de cribado neonatal y, así, en 1980, existían ya 10 centros de cribado (actualmente hay 15) y la cobertura del programa era del 25% de los recién nacidos (RN). En 1982 se transfirieron presupuestos a las comunidades autónomas (CCAA), de las que pasaban a depender dichos programas.
Durante los años siguientes, se produjeron algunos avances, como la implementación de nuevos cribados, como el de la hiperplasia suprarrenal congénita. Pero, sin duda, el avance tecnológico más importante aplicado al cribado neonatal fue la introducción por parte de algunas CCAA de la MS/MS para la detección de enfermedades metabólicas hereditarias, a partir del año 2000. Galicia fue la primera comunidad autónoma en iniciar el cribado neonatal ampliado por MS/MS en junio del 20004.
El Programa de Detección Precoz de la Hipoacusia Congénita en Recién Nacidos fue aprobado en 2003 por el Consejo Interterritorial del Sistema Nacional de Salud (SNS). Mediante dicho programa se busca cribar a todos los RN durante el primer mes de vida5,6.
Tipos de cribado neonatal. Situación actualCribado neonatal de enfermedades congénitas en prueba de talónPreviamente recibía el nombre de cribado endocrinometabólico. Se lleva a cabo a las 24-72 h de vida, después de toma normal de alimento, mediante la determinación sanguínea que se impregna en un papel de filtro absorbente denominado genéricamente «tarjeta de Guthrie», que cumpla con las normas del National Committee for Clinical Laboratory Standars (2014/07 de MUNKTELL).
El objetivo es detectar enfermedades cuyo tratamiento se pueda iniciar en los primeros 10-15 días de vida si la detección es mediante marcadores bioquímicos, como sucede habitualmente, y en los primeros 30 días de vida si es por marcadores genéticos.
¿Cómo realizar la toma de muestra? La punción del talón es el procedimiento habitual de toma de muestras para las pruebas de cribado neonatal. La punción debe realizarse en la porción lateral de la superficie plantar del talón para evitar dañar nervios, tendones o incluso el cartílago. Asimismo, debe haberse masajeado el pie previamente para aumentar el flujo sanguíneo en la zona y desinfectado con clorhexidina acuosa al 2% o alcohol de 70̊ aplicado en una gasa. Para que la muestra sea óptima las manchas de sangre que se obtienen deben contener al menos 75μL (13mm de diámetro aproximadamente) y deben dejarse secar a temperatura ambiente y fuera de la luz solar directa.
Esta punción para obtener la muestra de sangre para el cribado les supone dolor a nuestros neonatos. Las medidas que se han mostrado eficaces para amortiguarlo son, según una revisión sistemática de la Biblioteca Cochrane, la lactancia materna durante el procedimiento o la administración de soluciones de glucosa o sacarosa. Otras intervenciones no farmacológicas podrían potenciar estas medidas, como son el contacto visual, la estimulación táctil, el contacto piel con piel, el uso del chupete o de la succión no nutritiva7,8.
La venopunción en el dorso de la mano es un procedimiento realizado en algunos neonatos para la recogida de la muestra sanguínea9. Aunque presenta alguna ventaja, como un menor riesgo de que la muestra se hemolice o coagule, la obtención de un mayor volumen de muestra y posiblemente menos dolor, puede haber falsos negativos con esta determinación, por lo que en general no es aconsejada.
En 3CCAA en España (Galicia, Murcia, Extremadura) se realiza de forma simultánea la toma de muestra de orina, que se recoge en el mismo papel absorbente, colocándolo en el pañal. Permite complementar la información de la muestra de sangre y ampliar horizontes a nuevos diagnósticos.
En la tabla 1 se reflejan las enfermedades que forman parte del programa poblacional de cribado neonatal del SNS y en la tabla 2 las repercusiones principales y medidas de actuación frente a estas enfermedades. La realidad es que hay diferencias entre las CCAA y mientras 5 de ellas (Asturias, Cantabria, Castilla-León, País Vasco, Valencia) criban las 11 entidades recomendadas por el SNS, las 12 restantes realizan un cribado neonatal de un mayor número de entidades10-12 incluyendo, por ejemplo, 24 en el panel principal de Murcia o 37 en el panel principal de Galicia. En Europa y Estados Unidos el cribado neonatal tampoco es homogéneo.
Enfermedades para cribado en el período neonatal por la prueba del talón que forman parte de la cartera común básica de servicios asistenciales del Sistema Nacional de Salud (SNS)
| Por la Orden SSI/2065/2014, de 31 de octubre forman parte de la cartera común básica de servicios asistenciales del SNS para el cribado neonatal |
| ° Hipotiroidismo congénito |
| ° Fenilcetonuria |
| ° Fibrosis quística |
| ° Deficiencia de acil-coenzima A deshidrogenasa de cadena media |
| ° Deficiencia de 3-hidroxi-acil-coenzima A deshidrogenasa de cadena larga |
| ° Acidemia glutárica tipo I |
| ° Anemia falciforme |
| Por la Orden SND/606/2024, de 13 de junio, se incorporan 4enfermedades al programa de cribado neonatal |
| ° Enfermedad de la orina con olor a jarabe de arce |
| ° Homocistinuria |
| ° Déficit de biotinidasa |
| ° Hiperplasia suprarrenal congénita |
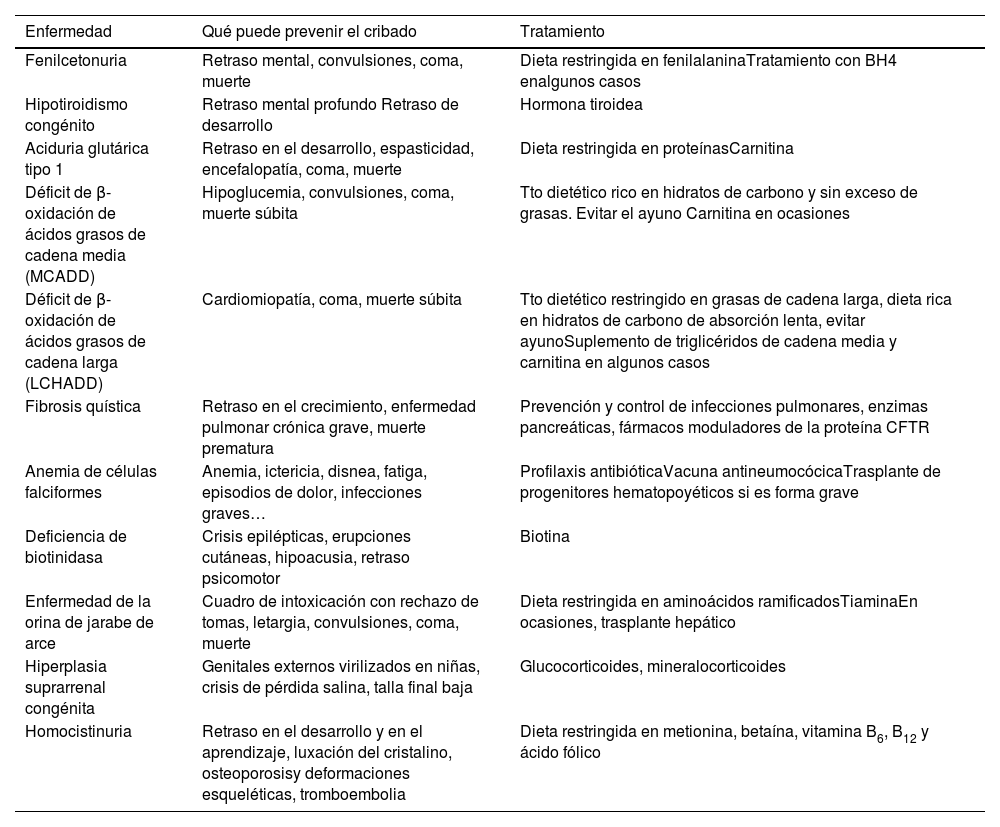
Enfermedades congénitas en prueba de talón recomendadas en España en el momento actual, qué se puede prevenir y cómo debemos actuar
| Enfermedad | Qué puede prevenir el cribado | Tratamiento |
|---|---|---|
| Fenilcetonuria | Retraso mental, convulsiones, coma, muerte | Dieta restringida en fenilalaninaTratamiento con BH4 enalgunos casos |
| Hipotiroidismo congénito | Retraso mental profundo Retraso de desarrollo | Hormona tiroidea |
| Aciduria glutárica tipo 1 | Retraso en el desarrollo, espasticidad, encefalopatía, coma, muerte | Dieta restringida en proteínasCarnitina |
| Déficit de β-oxidación de ácidos grasos de cadena media (MCADD) | Hipoglucemia, convulsiones, coma, muerte súbita | Tto dietético rico en hidratos de carbono y sin exceso de grasas. Evitar el ayuno Carnitina en ocasiones |
| Déficit de β-oxidación de ácidos grasos de cadena larga (LCHADD) | Cardiomiopatía, coma, muerte súbita | Tto dietético restringido en grasas de cadena larga, dieta rica en hidratos de carbono de absorción lenta, evitar ayunoSuplemento de triglicéridos de cadena media y carnitina en algunos casos |
| Fibrosis quística | Retraso en el crecimiento, enfermedad pulmonar crónica grave, muerte prematura | Prevención y control de infecciones pulmonares, enzimas pancreáticas, fármacos moduladores de la proteína CFTR |
| Anemia de células falciformes | Anemia, ictericia, disnea, fatiga, episodios de dolor, infecciones graves… | Profilaxis antibióticaVacuna antineumocócicaTrasplante de progenitores hematopoyéticos si es forma grave |
| Deficiencia de biotinidasa | Crisis epilépticas, erupciones cutáneas, hipoacusia, retraso psicomotor | Biotina |
| Enfermedad de la orina de jarabe de arce | Cuadro de intoxicación con rechazo de tomas, letargia, convulsiones, coma, muerte | Dieta restringida en aminoácidos ramificadosTiaminaEn ocasiones, trasplante hepático |
| Hiperplasia suprarrenal congénita | Genitales externos virilizados en niñas, crisis de pérdida salina, talla final baja | Glucocorticoides, mineralocorticoides |
| Homocistinuria | Retraso en el desarrollo y en el aprendizaje, luxación del cristalino, osteoporosisy deformaciones esqueléticas, tromboembolia | Dieta restringida en metionina, betaína, vitamina B6, B12 y ácido fólico |
Tto: tratamiento.
¿Qué técnica se emplea? Actualmente, la prueba es de carácter bioquímico (metabolitos, hormonas, proteínas) y permite la detección de un biomarcador en sangre u orina, como son los niveles de metabolitos en las enfermedades metabólicas hereditarias (mediante espectrometría de masas en tándem MS/MS), la tripsina inmunorreactiva en el caso de la fibrosis quística, los niveles de TSH para detectar el hipotiroidismo congénito y la determinación de HbA en la detección de la anemia falciforme. Es genómico en la atrofia muscular espinal (AME) y como prueba de segundo nivel en la fibrosis quística.
Cribado de hipoacusia congénita¿Qué enfermedades abarca? Hipoacusias neonatales, la mayoría de las cuales son neurosensoriales, y un 50-60% de estas son de causa genética.
¿Qué técnica se emplea? Las pruebas objetivas de audición consideradas útiles como cribado son:
1. Los potenciales auditivos automatizados evalúan la actividad de la vía auditiva desde el nervio auditivo, en su extremo distal, hasta el mesencéfalo. Tienen una sensibilidad del 97-100% y una especificidad del 86-96%. Un estímulo auditivo de duración breve (chasquidos o tonos) produce la activación de la vía y genera unos potenciales eléctricos, detectables a través de electrodos situados en el cuero cabelludo, similares a los utilizados en electroencefalografía. La prueba se realiza con el RN tranquilo, colocando unos terminales de estimulación acústica (auriculares) y 3electrodos (en el hombro, parte posterior del cuello y frente). El equipo emite unos sonidos especiales, denominados clics, con una frecuencia e intensidad determinada a través de los auriculares y los electrodos captan la respuesta cerebral a estos estímulos. Duración media de la prueba: 3-5min por oído. El resultado es automático y no requiere interpretación. El equipo da 2posibles resultados: pasa la prueba (cribado negativo) y no pasa la prueba (cribado positivo). La prueba se puede realizar a las pocas horas del nacimiento.
2. Las otoemisiones acústicas es la segunda opción, y que consideramos menos recomendada, pues no exploran toda la vía auditiva al estudiar la actividad coclear, pero no la retrococlear; es decir esta prueba no detecta la neuropatía auditiva. Su especificidad es del 87-99% y disminuye en las 48 primeras h de vida, por lo que es aconsejable realizarla más tarde. Se emplea menos tiempo en esta prueba, entre 1 y 3 min.
¿Cuándo se debe realizar? El mayor beneficio derivado del cribado auditivo vendría dado por la detección precoz de la sordera de moderada a grave en los casos congénitos antes de los 3meses de edad. Los resultados del tratamiento, en términos de adquisición del lenguaje y de incorporación a la sociedad de los niños afectados, dependen de lo precoz que sea el diagnóstico. Es decir, la rehabilitación precoz mejora el pronóstico tanto desde el punto de vista de la audición final como de la comunicación13.
Por ello, a todos los RN se les debe aplicar el cribado auditivo en su primer mes de vida. La complejidad y coste de los equipos de cribado hace que sea estratégicamente deseable hacerlo durante los primeros días de vida, mientras el niño está en la maternidad, ya que en España casi todos los niños nacen en maternidades. Esto, además, permite unificar la metodología y formar adecuadamente al personal que tiene el encargo de realizar la prueba.
En los RN grandes prematuros se realizará un cribado con potenciales auditivos u otoemisiones antes de los 3meses de edad corregida.
Cribado de cardiopatía congénita críticaEn enero de 2024 fue aprobado en la Comisión Nacional de Salud Pública del Consejo Interterritorial del SNS. Se realiza por pulsioximetría para medir la saturación de oxígeno del RN ≥ 34 semanas de gestación en las primeras 24 h de vida14.
¿Qué enfermedades abarca? Este cribado se adopta con la intención de reducir el riesgo del diagnóstico tardío de defectos cardíacos congénitos críticos, definidos como aquellos que precisan intervención invasiva o dan lugar a fallecimiento en los primeros 30 días de edad.
¿Qué técnica se emplea y cómo se realiza? La pulsioximetría en 2localizaciones, en la mano derecha y en uno de los pies. El valor de corte para la positividad es una saturación de O2<90% en cualquiera de las extremidades; es dudoso cuando en cualquiera de las localizaciones (mano derecha o uno de los pies) es entre el 90 y el 94% o con una diferencia entre ambas superior al 4%.
Necesidad de segundas muestras en el cribado neonatal de enfermedades congénitasEn el cribado neonatal de enfermedades congénitas en prueba de talón en la mayoría de las ocasiones se realiza una única determinación. No obstante, hay situaciones de riesgo en las que se debe hacer una segunda determinación para disminuir lo máximo posible el número de falsos negativos (tabla 3).
Situaciones especiales en las que debe tomarse una segunda muestra en la prueba del talón
| Situación | Momento de 2.ª toma de muestra |
|---|---|
| Prematuros de menos de 34 semanas/ Bajo peso (<2.000g de peso al nacer) | Entre la segunda y cuarta semana de vida |
| Gemelos monocigóticos | Entre la segunda y cuarta semana de vida |
| Recién nacidos con enfermedad muy grave al nacimiento | 1.ª muestra en el momento del ingreso, 2.a a las 48-72 h de vida según los resultados |
| Transfusiones previas al cribado | 1.a Toma de muestra a las 48-72 h de la transfusión, 2.a a los 120 días |
| Alimentación parenteral | A las 48-70 h después de haber iniciado la alimentación enteral, con independencia de la edad del niño en ese momento |
En el cribado de hipoacusia congénita, en el caso de no superar el cribado con los potenciales auditivos automatizados, no será necesaria una segunda prueba y pueden ser derivados a la confirmación diagnóstica mediante la realización de potenciales evocados auditivos de tronco. Sin embargo, si se usan las otoemisiones, especialmente si se realizan antes de las 72h de edad del niño (en el primer y segundo día de vida el conducto auditivo externo suele estar ocupado por detritus), han de repetirse al menos una vez antes de derivar a la fase diagnóstica.
En el cribado de cardiopatías congénitas críticas, la recomendación en los casos dudosos es repetir la prueba solo una vez a los 30 a 60 min y, si persisten estos valores, indicar la evaluación inmediata del RN.
Nuevos pasos en el cribado neonatal en EspañaActualmente, el Ministerio de Sanidad está haciendo una evaluación para ampliar la cartera común hasta más de 20 enfermedades. Algunos de los factores que han influido en promover la incorporación de nuevas entidades han sido, por un lado, la utilización de pruebas de segundo nivel, que mejoran la eficiencia de la prueba de cribado y, por otro, las evidencias científicas generadas en relación con las enfermedades complementarias que incluyen algunos programas.
En enero de 2024, se aprobó la inclusión de la tirosinemia tipo I al Programa de Cribado Neonatal en la Comisión de Salud Pública del Consejo Interterritorial del SNS. Actualmente, está en tramitación la norma para su incorporación en la cartera común de servicios del SNS tras la aprobación de la Comisión de Prestaciones, Aseguramiento y Financiación y del Consejo Interterritorial del SNS. Otras entidades como las acidemias metilmalónicas, propiónica, acidemia isovalérica, AME, etc., se están evaluando para su posible inclusión.
Hay que tener presente que la revolución tecnológica en los programas de cribado neonatal con la MS/MS, sumada a los avances tecnológicos que han tenido lugar en los diferentes métodos inmunológicos, de electroforesis capilar y otras metodologías, hacen que hoy en día se pueda llevar a cabo la detección bioquímica de más de 60 enfermedades mediante cribado neonatal15. Cabe mencionar que algunos de los biomarcadores o de los ensayos empleados no tienen toda la especificidad deseada y generan falsos positivos. Por ello ha sido necesario implementar pruebas de segundo nivel o segundos marcadores con el fin de disminuir los falsos positivos. Las pruebas de segundo nivel se realizan en la muestra inicial de sangre impregnada en papel de aquellos RN que hayan presentado un resultado alterado en el cribado neonatal y solo en este caso será necesario llevar a cabo esta prueba de segundo nivel para identificar o descartar una enfermedad16. Solo algunas entidades, como las inmunodeficiencias combinadas graves o la AME, requieren pruebas genéticas para su detección, aunque hemos de añadir que algunas CCAA y también algunos países utilizan directamente pruebas genéticas para la detección de la fibrosis quística. Sin embargo, la aplicación generalizada de las técnicas de secuenciación masiva, unida a la reducción de sus costes, va a dar lugar a cambios en los programas de cribado17.
Si tenemos presente lo siguiente:
- •
Hay más de 7.000 enfermedades raras y el 80% son de base genética.
- •
El retraso promedio actual en algunos casos para lograr el diagnóstico de enfermedades congénitas de base genética es de 6 años.
- •
La arquitectura molecular de las enfermedades congénitas genéticas es cada vez más conocida.
- •
El menor coste de las técnicas de secuenciación masiva.
- •
La oportunidad de asesoramiento genético a las familias.
- •
El desarrollo más rápido de nuevas terapias.
Hay posibilidades de un avance más rápido en el cribado neonatal con el cribado genómico neonatal, que podría aclarar el defecto molecular subyacente en muchas más entidades. En nuestro conocimiento, actualmente hay 34 grupos en todo el mundo que están explorando la secuenciación genómica como una forma de ampliar el cribado neonatal para identificar a los RN con trastornos genéticos tratables, la mayoría de ellos en fase incipiente18-22. Estos estudios piloto se desarrollan en Estados Unidos de América, Australia, Reino Unido, Qatar, Grecia, Francia, Alemania y Bélgica. En la Unión Europea se está llevando a cabo un proyecto multicéntrico, coordinado por Italia (Screen4Care), en el que participan diferentes países.
Un innovador estudio piloto de cribado genómico neonatal (CRINGENE) complementario al cribado bioquímico y aprobado por el ISCIII con fondos europeos, se va a llevar a cabo en España en 2.500 RN de 9 CCAA en el período 2025-2026. Se emplearán técnicas genómicas para la detección precoz y tratamiento de unas 300 enfermedades, que beneficiarán a los neonatos. Ello supondrá un impulso en la Neonatología,que situaría a España a la vanguardia de los estudios internacionales que se están llevando a cabo para abordar campos muy innovadores y estratégicos.
ConclusionesLos avances tecnológicos y de marcadores metabolómicos sumados a la mayor evidencia ya generada en más enfermedades susceptibles de cribado hacen que el cribado neonatal poblacional esté avanzando sustancialmente en estos últimos años, con un futuro muy prometedor con la incorporación de las técnicas de secuenciación masiva. Todo ello es de gran interés para los pediatras.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.