El tratamiento de las malformaciones pulmonares congénitas (MPC) es controvertido, ya que la mayoría de ellas cursan de forma asintomática. El objetivo principal de este estudio fue analizar el impacto de la presencia de sintomatología previa en el curso intra y postoperatorio en los pacientes intervenidos de MPC mediante cirugía mínimamente invasiva (CMI).
Material y métodosEstudio retrospectivo de los pacientes con MPC tratados con CMI en nuestro centro desde el 1 de octubre de 2003 hasta el 31 de octubre de 2023. Se analizaron las siguientes variables: datos demográficos, tipo y tamaño de la lesión, localización, desplazamiento mediastínico, sintomatología, tiempo quirúrgico, conversión a cirugía abierta, días con drenaje torácico, estancia hospitalaria y complicaciones postoperatorias.
ResultadosSe incluyeron 116 pacientes, 98 (84,4%) asintomáticos y 18 (15,5%) sintomáticos: 10 (55,5%) de tipo infeccioso y 8 dificultad respiratoria. El tipo histológico más común fue el correspondiente a malformación congénita de la vía aérea pulmonar (35,5%) seguido de secuestro intralobar (27,3%), y los lóbulos inferiores fueron los más afectados (78,4%). El tamaño de la lesión en la TC fue significativamente más grande en el grupo de pacientes que desarrollaron sintomatología (p=0,027) y la tasa de conversión a cirugía abierta fue también mayor en este grupo. No se identificaron más complicaciones postoperatorias en el grupo de pacientes con síntomas previos.
ConclusionesNo se demostró un aumento significativo de las complicaciones postoperatorias en el grupo de pacientes con clínica previa. Las lesiones más voluminosas detectadas en las pruebas de imagen tienen un riesgo significativamente mayor de desarrollar sintomatología y son candidatas a una cirugía precoz.
The management of congenital lung malformations (CLMs) is controversial because most of them are asymptomatic. The aim of our study was to analyze the association of preoperative symptoms with surgical outcomes in patients with CLMs treated by means of minimally invasive surgery (MIS).
Patients and methodsRetrospective study of patients with CLM treated with MIS in our hospital between 2003 and 2023. We recorded data on the following variables: demographic characteristics, size, type and location of the lesion, mediastinal shift, clinical symptoms, surgical time, conversion to open surgery, duration of chest drainage (days), length of stay and postoperative complications.
ResultsThe sample included 116 patients, 98 (84.4%) asymptomatic and 18 (15.5%) with clinically significant symptom: infectious in 10 (55.5%) and respiratory distress in eight. The most frequent histopathological type was congenital pulmonary airway malformation (35.5%), followed by intralobar sequestration (27.3%), and the lower lobes were most commonly involved (78.4%). Larger lesion size on the CT scan was significantly associated with the development of symptoms (P=.027) and with an increased frequency of conversion to open surgery. However, the incidence of postoperative complications was not greater in the symptomatic group.
ConclusionsPostoperative complications were not significantly more frequent in the symptomatic group of patients. Larger lesion size on imaging was associated with a significantly increased probability of developing symptoms, so these patients may benefit from early surgical resection.
Las malformaciones pulmonares congénitas (MPC) incluyen un grupo variado de anomalías entre las que destacan, por su frecuencia, las denominadas malformaciones congénitas de la vía aérea pulmonar (MCVAP) con una incidencia estimada de 1-5/10.000 nacimientos1–6. El tratamiento de estas lesiones es controvertido ya que la mayoría de ellas son asintomáticas por lo que algunos autores recomiendan un tratamiento expectante5,7–11. Sin embargo, la resección quirúrgica electiva sigue siendo la actitud terapéutica preferida por la mayoría de los grupos atendiendo al riesgo de malignización (sobre todo en algunos tipos de MCVAP) y la posible aparición de complicaciones infecciosas o respiratorias pudiendo ocurrir hasta en un 30% de los casos. En los pacientes sintomáticos existe un consenso generalizado en cuanto a la necesidad de un tratamiento quirúrgico precoz con exéresis de la lesión12–22.
El objetivo principal de este estudio es analizar el posible impacto de la presencia de sintomatología previa en el curso intra y postoperatorio en los pacientes intervenidos de MPC mediante cirugía mínimamente invasiva (CMI). Además, pretendemos identificar posibles factores que puedan influir en el desarrollo de sintomatología en este grupo de pacientes. Nuestra hipótesis de trabajo se fundamenta en que los pacientes con MPC y clínica previa pueden presentar mayor número de complicaciones, durante o después de la cirugía, que los asintomáticos, por lo que la detección temprana de determinadas características de la lesión, podrían ayudar a seleccionar aquellos casos que eventualmente puedan desarrollar síntomas en su evolución y beneficiarse de una cirugía precoz.
Material y métodosDiseño del estudioSe realizó un estudio retrospectivo, a partir de una base de datos recogida de forma prospectiva, de los pacientes diagnosticados de algún tipo de MPC en periodo prenatal, entre el 1 de octubre de 2003 y el 31 de octubre de 2023, en un hospital de referencia de tercer nivel. Los datos del estudio se recopilaron y gestionaron mediante las herramientas de captura de datos electrónicos Research Electronic Data Capture (REDCap) de nuestro centro. REDCap es una aplicación segura basada en la web diseñada para respaldar la captura de datos para estudios de investigación y que proporciona: 1) una interfaz intuitiva para la entrada de datos validados; 2) pistas de auditoría para rastrear la manipulación de datos; 3) procedimientos de exportación automatizados para descargas de datos sin interrupciones a paquetes estadísticos comunes, y 4) procedimientos para importar datos de fuentes externas.
Recogida de datosSe incluyeron todos los pacientes con diagnóstico de MPC e intervenidos quirúrgicamente en nuestro centro entre el 1 de octubre de 2003 y el 31 de octubre de 2023 (20 años). La cohorte se dividió en 2 grupos dependiendo de la existencia, o no, de manifestaciones clínicas relacionadas con la MPC, recogiéndose las siguientes variables: datos demográficos, tipo y tamaño de la lesión, localización, desplazamiento mediastínico, sintomatología, tiempo quirúrgico, conversión a cirugía abierta, días con drenaje torácico, estancia hospitalaria, y complicaciones postoperatorias. Hemos considerado sintomatología de tipo infeccioso la debida a neumonías diagnosticadas en el mismo hemitórax que la malformación pulmonar. Además, se consideraron pacientes con síntomas respiratorios aquellos que precisaron algún tipo de soporte respiratorio (invasivo o no invasivo) previo a la cirugía. En los casos con diagnóstico prenatal de MPC y curso asintomático en el periodo posnatal, se realizó una tomografía computarizada (TC) torácica, con contraste intravenoso, entre el tercer y octavo mes de vida. En los pacientes con lesiones sugerentes de malignidad en la ecografía prenatal (MCVAP tipo 4 o blastoma pleuropulmonar según la clasificación de Stocker)23, sintomatología respiratoria relevante o neumotórax en el periodo neonatal, la TC se efectuó de manera precoz durante el primer mes de vida. Todos los pacientes fueron intervenidos mediante CMI por el mismo grupo de cirujanos. La técnica de lobectomía toracoscópica ha sido ampliamente descrita en la literatura y sigue los principios básicos de la cirugía torácica abierta24. Al concluir el procedimiento quirúrgico se colocó un drenaje torácico y se realizó una radiografía de tórax de control en la unidad de cuidados intensivos.
Análisis estadísticoLas variables cuantitativas se expresaron como mediana y rango, y las de tipo categórico como número y porcentajes. Para el análisis estadístico se empleó la prueba de Kruskal-Wallis con el fin de detectar diferencias en las variables continuas entre los grupos. En el caso de las variables categóricas se utilizó la prueba de Chi-cuadrado o, cuando la frecuencia de aparición lo requería, la prueba exacta de Fisher. Se ha empleado el paquete Stata® versión 16 (Stata Corp. 2019, College Station TX, EE. UU.). Valores de p<0,05 se consideraron significativos en todos los análisis.
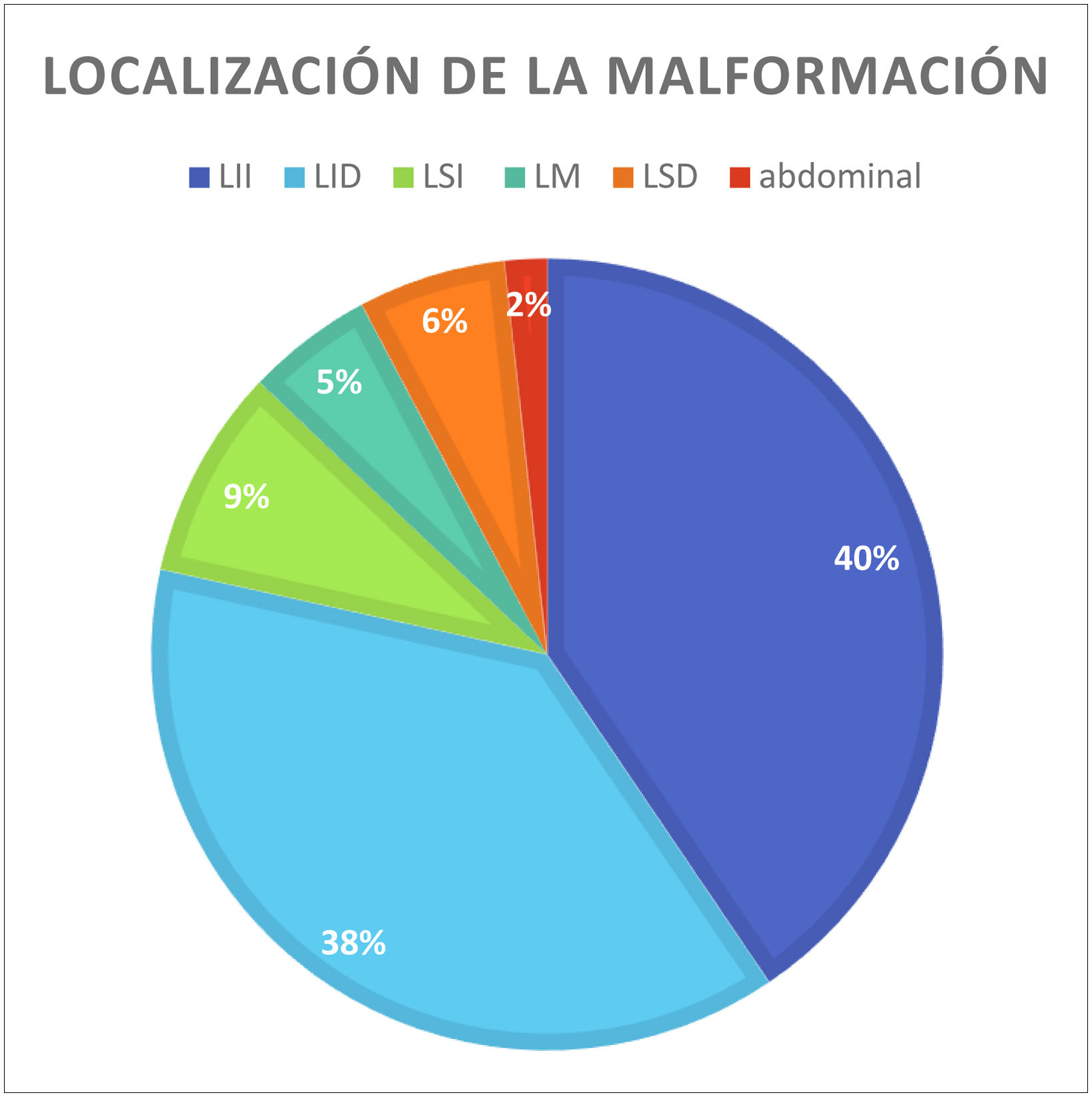
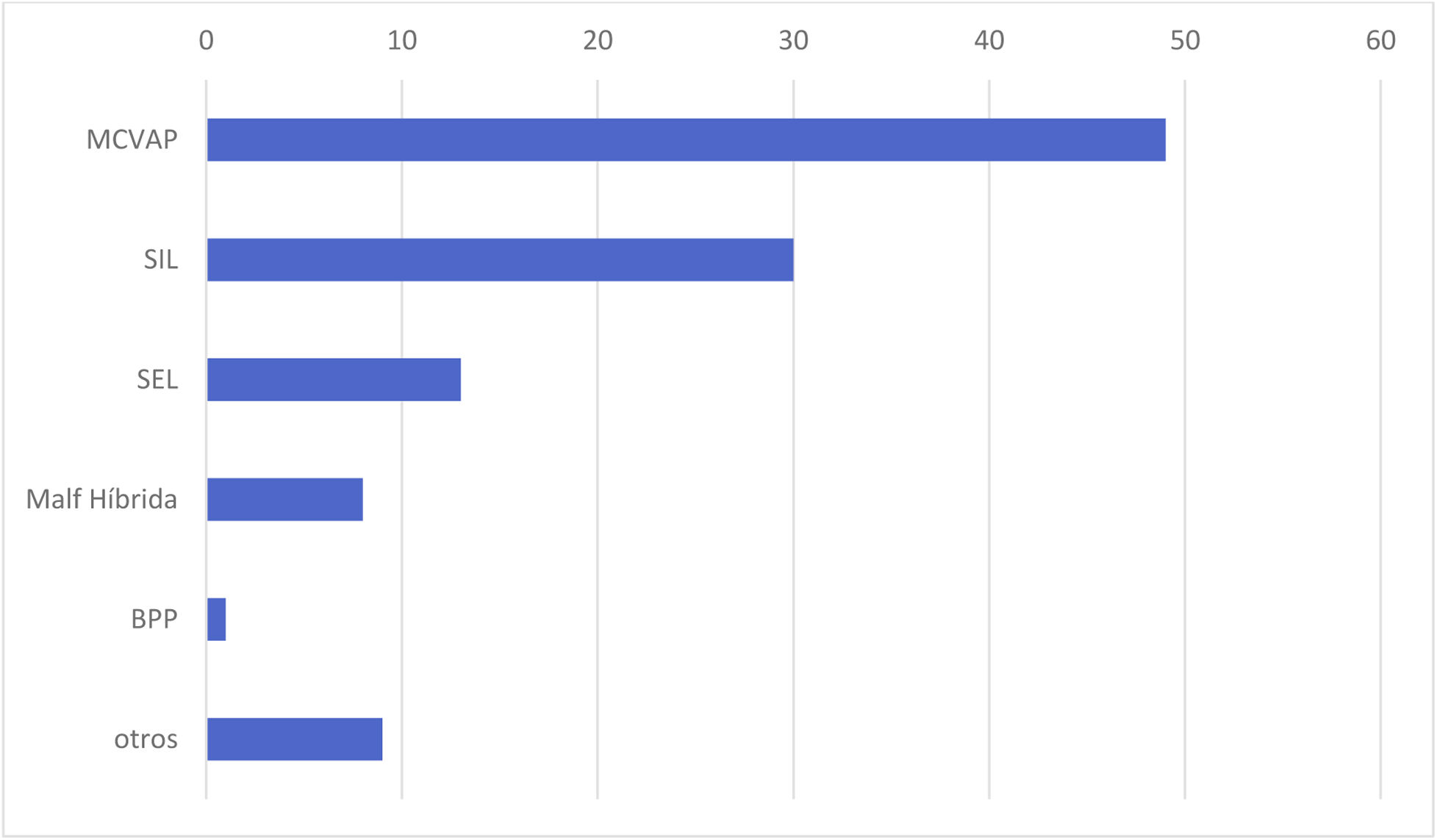
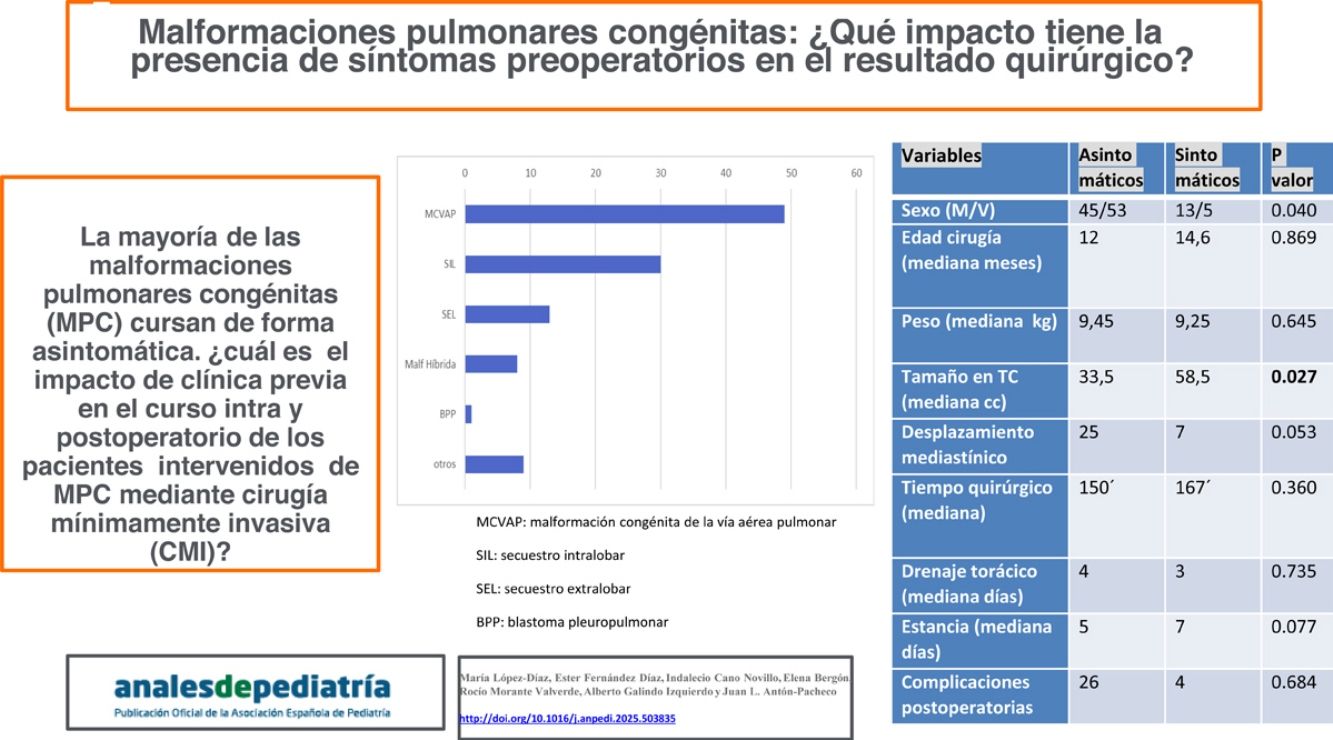
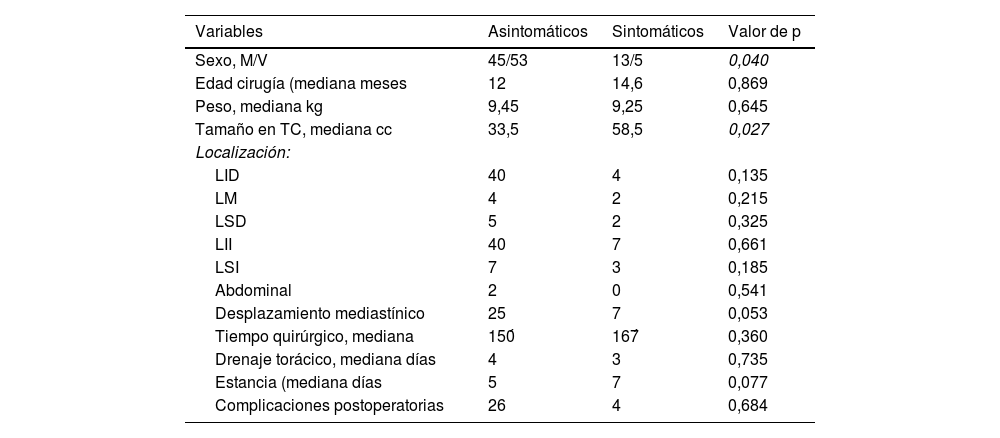
ResultadosEl estudio incluyó a 116 pacientes, 98 (84,4%) asintomáticos y 18 (15,5%) con clínica relacionada con la malformación pulmonar y manifestada antes de la cirugía. En este grupo, 10 pacientes (55,5%) presentaron sintomatología de tipo infeccioso y 8 clínica de dificultad respiratoria (2 pacientes con ventilación mecánica, 3 con soporte no invasivo tipo CPAP y 3 con oxigenoterapia). Las niñas presentaron clínica con mayor frecuencia que los varones en nuestro estudio (p=0,040) y la localización más frecuente fue en los lóbulos pulmonares inferiores (78,4%) (fig. 1). El tipo histológico más común fue el correspondiente a MCVAP (35,5%) seguido de secuestro intralobar (27,3%) y secuestro extralobar (11,8%) (fig. 2). Focalizando en los pacientes sintomáticos la distribución histológica fue la siguiente: MCVAP (9 casos), secuestro intralobar4, secuestro extralobar2, hiperinsuflación lobar congénita2 y blastoma pleuropulmonar1 (fig. 3). Considerando las variables analizadas en ambas cohortes de pacientes, sintomáticos y no sintomáticos, hemos detectado que el tamaño de la lesión en la TC fue significativamente más grande en el grupo de pacientes que desarrollaron sintomatología (p=0,027) (fig. 4). Aunque no alcanzó significación estadística, el desplazamiento mediastínico en la ecografía prenatal de los pacientes sintomáticos fue también más frecuente. Con respecto al eventual impacto de la presencia de clínica previa en el curso intra y postoperatorio, la tasa de conversión a cirugía abierta fue mayor en los pacientes sintomáticos sin repercutir de una manera significativa en la duración de la estancia hospitalaria (tabla 1). Por otra parte, no se identificaron un mayor número de complicaciones postoperatorias en el grupo de pacientes con síntomas previos (tabla 1). Los tipos de complicaciones recogidas en nuestro estudio fueron: sangrado, fuga aérea persistente, enfisema subcutáneo severo, fiebre mantenida y sepsis.
Variables estudiadas en cada cohorte de pacientes
| Variables | Asintomáticos | Sintomáticos | Valor de p |
|---|---|---|---|
| Sexo, M/V | 45/53 | 13/5 | 0,040 |
| Edad cirugía (mediana meses | 12 | 14,6 | 0,869 |
| Peso, mediana kg | 9,45 | 9,25 | 0,645 |
| Tamaño en TC, mediana cc | 33,5 | 58,5 | 0,027 |
| Localización: | |||
| LID | 40 | 4 | 0,135 |
| LM | 4 | 2 | 0,215 |
| LSD | 5 | 2 | 0,325 |
| LII | 40 | 7 | 0,661 |
| LSI | 7 | 3 | 0,185 |
| Abdominal | 2 | 0 | 0,541 |
| Desplazamiento mediastínico | 25 | 7 | 0,053 |
| Tiempo quirúrgico, mediana | 150́ | 167́ | 0,360 |
| Drenaje torácico, mediana días | 4 | 3 | 0,735 |
| Estancia (mediana días | 5 | 7 | 0,077 |
| Complicaciones postoperatorias | 26 | 4 | 0,684 |
Los valores estadísticamente significativos están en cursiva.
Mientras que hay un consenso generalizado en cuanto a la necesidad de resección quirúrgica en los pacientes con MPC que presentan clínica respiratoria o infecciosa, existe disparidad de criterios cuando el curso es asintomático7–11. Esta falta de consenso es todavía más acusada cuando se trata de establecer el momento óptimo para la exéresis quirúrgica de la lesión. Aunque el desarrollo reciente de técnicas de CMI ha permitido la realización de resecciones pulmonares con seguridad en los pacientes cada vez más pequeños, el momento ideal para la cirugía está todavía por definir. Diversos autores han comparado los resultados quirúrgicos obtenidos en los pacientes asintomáticos pertenecientes a diferentes grupos de edad, siempre por debajo del año de vida, no habiendo encontrando diferencias significativas en cuanto al curso postoperatorio y la aparición de complicaciones4,13. Por otra parte, también se ha investigado sobre el eventual impacto de la presencia de sintomatología preoperatoria en los resultados posquirúrgicos. Aspirot et al.25 demostraron un aumento significativo de las complicaciones postoperatorias y estancia hospitalaria en los casos con clínica previa. Sin embargo, otros autores no han detectado un impacto relevante en este sentido21,26. En nuestro estudio no se evidenció un aumento significativo de las complicaciones postoperatorias en los pacientes con sintomatología previa, pero si existió una mayor tasa de conversión por dificultades técnicas en este grupo, sin un incremento significativo del tiempo quirúrgico. Con frecuencia, los pacientes que han sufrido una neumonía previa en el lóbulo donde asienta la lesión exhiben adherencias tisulares y adenopatías cisurales en la cirugía. Esto implica una disección más dificultosa, lenta y con más riesgo de sangrado, que eventualmente puede modificar el abordaje inicial y convertirlo en una cirugía abierta, como ocurrió en 2 pacientes de nuestra serie27,28. Dado que la sobreinfección de las MPC puede oscilar entre el 10 y el 30% en el primer año de vida, diversos autores recomiendan la exéresis quirúrgica de la lesión durante este periodo para evitar eventuales procesos infecciosos que puedan comprometer el resultado esperado de un abordaje mínimamente invasivo5,13,18,29,30. Aunque con nuestra casuística no se puede establecer una significación estadística, sí se podría inferir que con una muestra mayor una intervención precoz probablemente tendría un impacto positivo en el índice de conversión a cirugía abierta. Otro argumento a favor de la cirugía precoz radica en la posible transformación maligna de algunas MCP y más concretamente de las MCVAP31. No existe una evidencia clara sobre si el tumor ya existe desde el principio o se produce una transformación histológica de las lesiones quísticas, pero en cualquier caso, la incidencia es muy baja21. En nuestra serie, solo un paciente presentó una histología maligna tipo BPP lo que representa una tasa del 0,86% que está en sintonía con las publicadas por otros grupos13,32.
Por otra parte, hemos analizado el posible impacto de algunos hallazgos o características prenatales de la malformación en el desarrollo de sintomatología posnatal. La presencia de hidrops y/o desplazamiento mediastínico están descritos en la literatura como factores de mal pronóstico, junto con un volumen grande de la lesión detectados en la ecografía prenatal33–35. En nuestro estudio, el tamaño de la lesión determinada mediante TC posnatal fue significativamente mayor en el grupo sintomático pero el desplazamiento mediastínico, habitualmente producido por una lesión voluminosa, detectado en la ecografía prenatal no llego a alcanzar significación estadística probablemente debido a lo reducido de la muestra. Aunque la información obtenida mediante el diagnóstico por imagen es muy útil y cada vez más precisa, la correlación entre ecografía fetal y TC posnatal no pasa actualmente de ser discreta36. Hay que destacar la relativa baja incidencia de malformaciones híbridas (MCVAP+secuestro) en nuestra cohorte. Esto es probablemente debido a que lesiones inicialmente consideradas híbridas en la TC diagnóstica se convertían posteriormente en secuestro intralobar en el estudio anatomo-patológico. Un mayor conocimiento y precisión adquirido en los últimos años en las técnicas histológicas puede ser responsable de ello.
Existen ciertas limitaciones en nuestro trabajo de investigación. En primer lugar, su carácter retrospectivo y un tamaño muestral relativamente pequeño lo que puede limitar la realización de análisis estadísticos más complejos como ocurre con la tasa de conversión a cirugía abierta. Además, en el grupo de pacientes sintomáticos hemos incluido 2 subtipos diferentes: aquellos con clínica de dificultad respiratoria junto con los que presentaban sintomatología de tipo infeccioso. Aunque estas 2 variantes de manifestaciones clínicas pueden tener eventualmente un impacto algo distinto en el curso intra y postoperatorio, la mayoría de los trabajos publicados los fusionan ya que constituyen un grupo bien diferenciado con respecto a los pacientes asintomáticos26,37.
En conclusión, aunque los resultados obtenidos en nuestro estudio no demuestran un aumento significativo de las complicaciones postoperatorias en el grupo de pacientes con clínica previa, ciertos aspectos como el índice de conversión a cirugía abierta podrían demostrar que una intervención precoz sería beneficiosa. Además, las lesiones más voluminosas detectadas en la ecografía prenatal y confirmadas en la TC torácica posnatal tienen un riesgo significativamente mayor de desarrollar sintomatología, por lo que son también candidatas a una resección quirúrgica antes de cumplir el año de vida.
Responsabilidades éticasEste trabajo fue aprobado por el Comité de Ética e Investigación de nuestra institución (código 21/393) y todos los pacientes estudiados contaron con un consentimiento informado de los padres o tutores para la cirugía y toma de material video-fotográfico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.