El objetivo de este estudio es describir cómo el ejercicio físico afecta el control metabólico, las necesidades de insulina y el consumo de carbohidratos en niños usuarios de un sistema híbrido de circuito cerrado.
MétodosDiseño de estudio transversal. Se reclutaron 21 niños y adolescentes diagnosticados con diabetes tipo 1. Durante el estudio, los participantes fueron monitoreados durante un periodo de siete días para recopilar datos completos sobre estos factores.
ResultadosNueve participantes (42,9%) habían activado el modo de ejercicio, para elevar temporalmente la glucosa objetivo a 150mg/dL. La hemoglobina glicosilada (HbA1c) osciló entre 5,5% y 7,9% (mediana 6,5%, rango intercuartílico [IQR] 0,75). El porcentaje de tiempo dentro del rango de 70-180mg/dL fue similar; sin embargo, hubo una mayor duración de la hiperglucemia y más autocorrecciones en los días en que se realizó ejercicio. El porcentaje de tiempo en hiperglucemia grave (> 250mg/dL) fue 2,7 mayor durante el ejercicio vs. los días sin ejercicio (p=0,02). En particular, los episodios de hipoglucemia no aumentaron durante los días de práctica de ejercicio, en comparación con los días sin ejercicio.
ConclusionesEl sistema híbrido de circuito cerrado fue efectivo y seguro en niños y adolescentes diagnosticados con diabetes tipo 1 durante ejercicios físicos competitivos en la vida real.
The aim of the study was to describe how physical exercise affects metabolic control, insulin requirements and carbohydrate intake in children who use hybrid closed-loop systems.
MethodsCross-sectional study design. The sample included 21 children and adolescents diagnosed with type 1 diabetes. During the study, participants were monitored for a period of 7 days to gather comprehensive data on these factors.
ResultsNine participants (42.9%) had switched to exercise mode to raise the target glucose temporarily to 150mg/dL. The HbA1c values ranged from 5.5% to 7.9% (median, 6.5%; IQR, 0.75). The percentage of time within the target range of 70-180mg/dL was similar; however, there was an increased duration of hyperglycaemia and more autocorrections on exercise days. The time spent in severe hyperglycaemia (> 250mg/dL) increased by 2.7% in exercise compared to non-exercise days (P=.02). It is worth noting that hypoglycaemic episodes did not increase during the exercise days compared with non-exercise days.
ConclusionThe hybrid closed-loop system was effective and safe in children and adolescents with type 1 diabetes during the performance of competitive sports in real life.
La diabetes tipo 1 continúa siendo una de las enfermedades crónicas más prevalentes en la población infantojuvenil. En 2022, 1,52 millones de niños y adolescentes menores de 20 años tenían diabetes a nivel mundial1.
Numerosos estudios han demostrado el efecto positivo del ejercicio físico en el manejo de la diabetes tipo 1. Cuando se combina con una dosificación óptima de la insulina y una dieta equilibrada, el ejercicio regular contribuye significativamente al control adecuado de la glucemia en niños con diabetes tipo 1. La actividad física aumenta la sensibilidad a la insulina, con efectos durante su práctica que a menudo persisten tras haber finalizado2. No obstante, los niveles de glucosa pueden variar dependiendo de la cantidad, tipo e intensidad del ejercicio. En situaciones de alto estrés, como las competiciones deportivas, la secreción de hormonas contrarreguladoras puede ocasionar un aumento de la glucemia. Por otro lado, una vez que disminuye el estrés, hay un descenso considerable en los niveles de glucosa, lo que complica todavía más la participación de los atletas con diabetes tipo 1 en deportes de competición3. Por tanto, se requieren nuevas estrategias para reducir la carga del manejo de la diabetes.
Los sistemas híbridos de asa cerrada que facilitan el control de la diabetes tipo 1 podrían ofrecer una estrategia de gestión prometedora para niños y adolescentes4. Este tipo de sistema, también conocido como páncreas artificial, utiliza algoritmos que ajustan la administración de insulina en tiempo real con base en datos de monitorización continua de glucosa (CGM). Diseñados para mantener los niveles dentro del rango de glucosa objetivo (70-180mg/dL), estos sistemas minimizan el riesgo de hipoglucemia e hiperglucemia5. Aunque utilizan la CGM en combinación con la administración automatizada de insulina guiada por los datos de glucemia, se denominan híbridos porque no son completamente automáticos. La administración de bolos preprandiales de insulina según el consumo esperado de carbohidratos sigue siendo necesaria con estos sistemas6.
El uso de sistemas híbridos de asa cerrada también podría ser apropiado para el ejercicio aeróbico prolongado siempre y cuando se eleve la glucosa objetivo (150mg/dL) entre 45 y 90 minutos antes del inicio de la actividad física2. Aunque la evidencia en atletas adultos es considerable2,7, no hay suficientes datos sobre el uso de estos sistemas en la población pediátrica, por lo que su empleo durante la actividad física es controvertido. Sin embargo, un estudio realizado por Ekhlaspour et al.8 encontró resultados positivos en niños y adolescentes (n=48) de seis a 18 años con diabetes tipo 1, en los que el uso de tecnología Control-IQ (un sistema híbrido de asa cerrada avanzado) se asoció a una mejora en el control glucémico y una frecuencia menor de episodios de hipoglucemia durante la práctica de deportes de invierno de competición. Ampliando estos hallazgos, una revisión publicada por Boughton et al.9 sugería que los sistemas híbridos de asa cerrada podrían ofrecer ventajas en comparación con las terapias convencionales para el control metabólico, requiriéndose, no obstante, estudios adicionales debido a las limitaciones inherentes al diseño del estudio y las características de la muestra. Los expertos también han recalcado los beneficios del sistema avanzado MiniMed 780G (Medtronic Iberica S.A., Madrid, España) en comparación con sistemas híbridos de asa cerrada previos10, con énfasis en la capacidad de adaptar los requerimientos de insulina para niños y adolescentes11. Aunque estas prestaciones son prometedoras, sigue sin haber evidencia robusta centrada específicamente en las posibles ventajas de los sistemas híbridos de asa cerrada para niños y adolescentes durante la práctica de actividad física. Por lo tanto, el objetivo del estudio fue caracterizar el impacto de la actividad física sobre el control metabólico, los requerimientos de insulina y el consumo de carbohidratos en niños y adolescentes con diabetes tipo 1 del uso de sistemas híbridos de asa cerrada en la vida real.
MétodosParticipantesSe reclutó a niños y adolescentes diagnosticados de diabetes tipo 1 a través de la unidad de endocrinología pediátrica y diabetes infantil de un hospital terciario universitario en España. Los criterios de inclusión fueron: a) menor de 18 años; b) haber utilizado el sistema híbrido de asa cerrada MiniMed 780G en modo automático durante un mínimo de un mes; c) práctica de ejercicio físico extracurricular; d) capacidad de dar consentimiento informado o, en pacientes menores de 16 años, firma de consentimiento informado por parte del tutor legal. Los criterios de exclusión fueron: a) haber usado el sistema automático menos de un mes.
La muestra incluyó a todos los pacientes manejados en la unidad de endocrinología pediátrica y diabetes infantil que cumplieron los criterios de inclusión y aceptaron participar.
El estudio fue aprobado por el Comité de Ética de la Investigación del Principado de Asturias (ref. 2022.086).
Diseño del estudioEstudio de diseño transversal. Se invitó a participar a cada uno de los niños y adolescentes con diabetes tipo 1 manejados en la unidad que cumplían los criterios de inclusión durante una visita de rutina o mediante una llamada de teléfono realizada por una enfermera educadora en diabetes (octubre 2021-junio 2022). Se obtuvo el consentimiento informado firmado por los padres en pacientes menores de 16 años. Para los adolescentes de 16 a 18 años de edad, se obtuvo el consentimiento informado firmado por los padres y el asentimiento firmado por el paciente antes de llevar a cabo la evaluación basal.
Evaluación de datosEl objetivo primario fue evaluar el impacto del ejercicio en el control metabólico, los requerimientos de insulina y el consumo de carbohidratos en pacientes pediátricos con diabetes tipo 1 que usaban sistemas híbridos de asa cerrada en la vida real. Se recogieron datos basales de los historiales de los pacientes para las siguientes variables: demográficas (edad y sexo), antropométricas (peso, altura y masa grasa), relacionadas con la enfermedad (tiempo transcurrido desde el diagnóstico de diabetes, tiempo que llevaban utilizando el sistema híbrido de asa cerrada y tipo de insulina) y la variación anual en la hemoglobina glicosilada (HbA1c) venosa. Se recogieron datos sobre las características del ejercicio extracurricular, como el tipo de actividad (aeróbica, anaeróbica o combinada)12, su duración y su frecuencia semanal. Asimismo, se registraron las conductas pertinentes de los participantes en referencia a las recomendaciones de consenso actuales, incluyendo si desconectaban la bomba durante el ejercicio y si programaban un objetivo de glucosa temporal (150mg/dL) antes, durante y/o después del ejercicio13. Además, los participantes fueron sometidos a un periodo de monitorización de siete días tras la evaluación basal, durante el que mantuvieron su terapia con insulina rutinaria y su práctica habitual de ejercicio extracurricular. Transcurridos los siete días, se descargaron informes detallados que incluían la dosis de insulina diaria total (TDI), la proporción de insulina administrada en forma de bolos, el tiempo en rango (TIR), el tiempo en hipoglucemia leve y grave, el tiempo en hiperglucemia leve y grave, el coeficiente de variación (CoV), los niveles medios de glucosa, las autocorrecciones de insulina y el consumo de carbohidratos de la plataforma de datos de Medtronic (CareLinkTM).
Se consideraron las siguientes variables dependientes: TDI, proporción de bolos, TIR, tiempo en hipoglucemia leve (69-54mg/dL) y grave (< 54mg/dL), tiempo en hiperglucemia leve (181-250mg/dL) y grave (> 250mg/dL), nivel medio de glucosa, autocorrecciones de insulina e ingesta de carbohidratos.
Análisis estadísticoLos datos basales se han expresado como frecuencias absolutas y porcentajes o como mediana y rango intercuartílico (IQR) según correspondiese. Para las variables cuantitativas, se comprobó la normalidad de la distribución mediante la prueba de Kolmogorov-Smirnov y se emplearon las pruebas no paramétricas apropiadas. Se llevó a cabo un análisis univariante mediante la prueba de Wilcoxon para evaluar las diferencias en los valores medianos en relación con la variable «ejercicio».
Los análisis se realizaron con el paquete estadístico de IBM SPSS Statistics (International Business Machines Corporation IBM, Armonk, EE.UU.), versión 27.0. El nivel de significación se fijó en p ≤ 0,05 para todas las pruebas.
ResultadosCaracterísticas de los participantesSe contactó con 40 niños y adolescentes con diabetes tipo 1 que utilizaban sistemas de infusión continua de insulina (SICI). De este total, el 35% (n=14) no cumplía los criterios de inclusión y el 12,5% (n=5) rechazó participar. La muestra final incluyó 21 pacientes (52,4% mujeres) con una edad mediana de 11,0 años (IQR 3,5 años). El tiempo transcurrido desde el diagnostico de diabetes tipo 1 osciló entre los 0,8 y los 13,3 años. Nueve participantes (42,9%) cambiaron a modo ejercicio para elevar temporalmente el objetivo de glucosa a 150mg/dL: tres durante el ejercicio, tres tras el ejercicio y tres tanto durante como después del ejercicio. Cinco participantes desconectaron sus bombas durante la actividad física. La HbA1c osciló entre 5,5% y 7,9% (mediana 6,5%; IQR 0,75). La tabla 1 resume las características basales de la muestra.
Características demográficas y de tratamiento de los participantes (n=21)
| Variable | Participantes |
|---|---|
| Años de edad, mediana (IQR) | 11,0 (3,5) |
| Sexo | |
| Varón, % (n) | 47,6% (10) |
| Mujer, % (n) | 52,4% (11) |
| Estado ponderal (IMC) | |
| Bajo peso, % (n) | 4,8% (1) |
| Normopeso, % (n) | 71,4% (15) |
| Sobrepeso, % (n) | 23,8% (5) |
| Obesidad, % (n) | 0% (0) |
| Tipo de insulina | |
| Insulina glulisina, % (n) | 9,5% (2) |
| Insulina lispro, % (n) | 19,0% (4) |
| Insulina aspart, % (n) | 42,9% (9) |
| Insulina aspart de acción rápida, % (n) | 28,6% (6) |
| Años desde el diagnóstico, mediana (IQR) | 6,0 (5,0) |
| Meses de uso de MiniMed 780G, mediana (IQR) | 12,0 (5,5) |
| Uso de MiniMed 780G durante el ejercicio, % (n) | 76,2% (16) |
| % HbA1c, mediana en los últimos 6 meses (IQR) | 6,5 (0,8) |
| % GMI, mediana (IQR) | 6,7 (0,4) |
| TDI en unidades/día, mediana (IQR) | 31,0 (24,5) |
| Bolos, mediana (IQR) (%) | 63,0 (11,5%) |
| Basal, mediana (IQR) (%) | 37,0 (11,5%) |
| Porcentaje de TIR, mediana (IQR) | 75,0 (9,5) |
| Porcentaje en hipoglucemia leve, mediana (IQR) | 2,0 (2,5) |
| Porcentaje en hipoglucemia grave, mediana (IQR) | 0 (1,0) |
| Porcentaje en hiperglucemia leve, mediana (IQR) | 17,0 (7,5) |
| Porcentaje en hiperglucemia grave, mediana (IQR) | 4,0 (4,5) |
| Porcentaje CoV, mediana (IQR) | 37,0 (5,5) |
| Glucosa, mediana (IQR) (mg/dL) | 144,0 (18,0) |
| Autocorrecciones de insulina | 19,0 (13,0) |
| Ingesta de carbohidratos en g/día, mediana (IQR) | 166,0 (59,0) |
CoV: coeficiente de variación; GMI: indicador de gestión de glucosa; HbA1c: hemoglobina glicosilada; IMC: índice de masa corporal; IQR: rango intercuartílico; TDI: insulina diaria total; TIR: tiempo en rango.
Las actividades realizadas por nuestros pacientes fueron: baloncesto (cuatro), atletismo (dos), entrenamiento en gimnasio (dos), voleibol (dos), esquí (uno), danza (dos), fútbol (dos), natación sincronizada (uno), natación (uno), patinaje artístico (uno), balonmano (uno), pádel (uno) y judo (uno).
Cabe destacar que en el 90,5% de los pacientes el tipo de ejercicio fue combinado, con elementos tanto aeróbicos como anaeróbicos. Solo dos reportaron actividades exclusivamente aeróbicas. El 38,1% declaró la práctica de deportes de competición. La frecuencia mediana de la actividad física fue de tres días a la semana (IQR 2) y el tiempo total dedicado al ejercicio fue de cuatro horas a la semana (IQR 2,9).
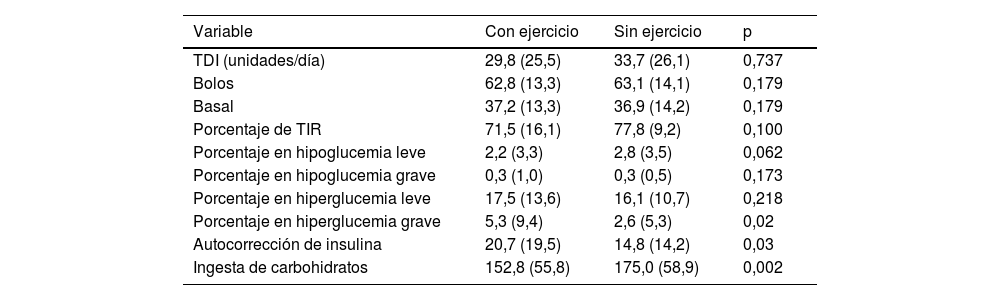
Diferencias entre los días de ejercicio y sin ejercicioEl porcentaje de tiempo en hiperglucemia severa fue 2,7 veces mayor (p=0,02) y el porcentaje de insulina administrado en autocorrecciones fue 5,9 veces mayor (p=0,03) en los días en los que los pacientes hicieron ejercicio. Por el contrario, la ingesta de carbohidratos se redujo en 22,2g en los días que hicieron ejercicio (p=0,002). No se encontraron diferencias en el porcentaje de tiempo en hipoglucemia ni en ninguna otra variable (tabla 2).
Diferencias entre los días con ejercicio y sin ejercicio
| Variable | Con ejercicio | Sin ejercicio | p |
|---|---|---|---|
| TDI (unidades/día) | 29,8 (25,5) | 33,7 (26,1) | 0,737 |
| Bolos | 62,8 (13,3) | 63,1 (14,1) | 0,179 |
| Basal | 37,2 (13,3) | 36,9 (14,2) | 0,179 |
| Porcentaje de TIR | 71,5 (16,1) | 77,8 (9,2) | 0,100 |
| Porcentaje en hipoglucemia leve | 2,2 (3,3) | 2,8 (3,5) | 0,062 |
| Porcentaje en hipoglucemia grave | 0,3 (1,0) | 0,3 (0,5) | 0,173 |
| Porcentaje en hiperglucemia leve | 17,5 (13,6) | 16,1 (10,7) | 0,218 |
| Porcentaje en hiperglucemia grave | 5,3 (9,4) | 2,6 (5,3) | 0,02 |
| Autocorrección de insulina | 20,7 (19,5) | 14,8 (14,2) | 0,03 |
| Ingesta de carbohidratos | 152,8 (55,8) | 175,0 (58,9) | 0,002 |
IQR: rango intercuartílico; TDI: insulina diaria total; TIR: tiempo en rango
Valores expresados como mediana (IQR); n=21.
Los resultados del estudio demuestran los beneficios del uso de sistemas híbridos de asa cerrada en niños y adolescentes con diabetes tipo 1 durante la actividad física. Nuestros hallazgos ponen de relieve los beneficios en niños y adolescentes que hacen ejercicio o deportes, especialmente con respecto al control metabólico, los requerimientos de insulina y la ingesta de carbohidratos. Un ensayo aleatorio en niños y adolescentes con diabetes tipo 1 encontró resultados similares con el uso de un sistema híbrido de asa cerrada, independientemente del tipo de insulina administrado14. Es importante tener en cuenta que estos beneficios van más allá del entorno experimental controlado, como demuestra nuestro estudio, en el que intrínsecamente no era posible controlar rigurosamente las variables tales como la intensidad de la actividad física y medidas autorreportadas (como la ingesta de carbohidratos).
La frecuencia de los episodios hipoglucémicos no aumentó en los días en los que los participantes hicieron ejercicio en comparación con los días en los que no lo hicieron, hallazgo crucial en cuanto a la seguridad. El TIR fue similar en los días con ejercicio y sin este. Por otro lado, en los días en los que hicieron ejercicio se observó una disminución en la ingesta de carbohidratos, a pesar de lo cual hubo un aumento en el tiempo en hiperglucemia y en las autocorrecciones de insulina. Globalmente, e independientemente de la actividad física, estos hallazgos están en línea con lo descrito en la literatura previa sobre el uso de sistemas híbridos de asa cerrada en niños diagnosticados de diabetes tipo 115–17.
El valor elevado del TIR observado en nuestros pacientes tanto en días que hicieron ejercicio como en días que no lo hicieron fue destacable. Este hallazgo es consistente con la literatura previa y podría ser el resultado más relevante para la población infantojuvenil, especialmente en comparación con la terapia de bomba aumentada con sensor con suspensión predictiva18. Otros estudios apoyan estos hallazgos. Bassi et al.19 observaron mejoras similares en el TIR en un estudio en niños y adultos con el uso del MiniMed 780 comparado con el sistema Tandem Control-IQ (Tandem Diabetes Care, Inc., San Diego, EE.UU.). Otro estudio en un grupo etario similar encontró un TIR alto en usuarios del MiniMed 780, con un aumento aproximado del 5% con tan solo 28 días de uso20. También cabe destacar la mejora significativa en el TIR observada en adolescentes en otro estudio, del 42,1% basal al 78,8% a las 12 semanas del uso de un sistema híbrido de asa cerrada15. Debido a que no hay estudios previos que analizaran explícitamente el ejercicio en la vida real como variable independiente, las posibles comparaciones son limitadas. En todo caso, con base en nuestros resultados y la evidencia actual, es razonable suponer que el sistema MiniMed 780 puede conseguir un TIR superior en niños y adolescentes.
El miedo a la hipoglucemia, un obstáculo fundamental mencionado por niños, adolescentes y padres, frecuentemente restringe su participación en deportes y otros tipos de actividad física3,21,22. A pesar de ello, nuestro estudio no encontró diferencias significativas en el tiempo en hipoglucemia entre los días con y sin ejercicio. Esto sugiere que el uso de sistemas híbridos de asa cerrada durante la actividad física, como indican estudios anteriores, podría ser una solución clave para abordar esta preocupación y promover el ejercicio17,23. El fomento de la actividad física es crucial en niños y adolescentes con diabetes tipo 1, dada la evidencia sobre sus beneficios. Por ejemplo, una revisión realizada por Aljawarneh et al.24 concluyó que el ejercicio puede realzar la sensibilidad a la insulina, reducir sus requerimientos y regular los niveles de glucosa. Por otro lado, King et al.25 demostraron que el ejercicio regular mejoraba los niveles de HbA1c en niños. Tradicionalmente, los individuos con diabetes tipo 1 consumen carbohidratos adicionales antes de hacer ejercicio para prevenir la hipoglucemia, lo que supone un obstáculo importante a la práctica de actividad física26. Sin embargo, nuestros hallazgos sugieren que el uso de sistemas híbridos de asa cerrada reduce significativamente la frecuencia de los episodios de hipoglucemia durante el ejercicio. Es probable que esto se deba a que el algoritmo de estos sistemas es altamente adaptativo, con un ajuste constante de la insulina administrada (y por lo tanto del requerimiento de carbohidratos) con base en factores individuales como los perfiles glucémicos, los ritmos biológicos, los niveles de actividad física o la ingesta alimentaria13. Además, la programación de una glucosa objetivo temporal de 150mg/dL durante la actividad física puede indicar al algoritmo la necesidad de limitar la administración de bolos de insulina, previniendo la hipoglucemia de manera proactiva y reduciendo la necesidad carbohidratos adicionales.
Los sistemas de asa cerrada requieren abordajes estratégicos para la gestión de la diabetes tipo 1, incluyendo una consideración cuidadosa del momento y la duración de la actividad física y de la ingesta de carbohidratos27. Aunque algunas estrategias implican la desconexión temporal de la bomba, en general se recomienda mantener el SICI conectado durante el ejercicio, ya que permite que el algoritmo aprenda y se adapte27,28. En consonancia con esta recomendación, el 76% de los pacientes optaron por mantener sus dispositivos conectados durante la actividad física. Llama la atención que menos de la mitad de los participantes reportaron el uso del objetivo temporal de 150mg/dL para prevenir la hipoglucemia, lo que subraya la importancia de las recomendaciones personalizadas basadas en el tipo de ejercicio y las respuestas individuales. Nuestro estudio encontró un aumento significativo en el tiempo en hiperglucemia en los días de actividad física. Es probable que esto se deba a que el 90,5% de los participantes practicaban actividades que combinaban ejercicio aeróbico y anaeróbico, que se han asociado a un aumento en los niveles de hormonas contrarreguladoras y, por lo tanto, pueden causar hiperglucemia29. Por otro lado, estudios previos han demostrado que los niños y adolescentes que usan sistemas híbridos de asa cerrada tienen menos episodios de hiperglucemia en comparación con los que usan otros tipos de SICI30. Esto sugiere que, si los participantes no hubieran utilizado el sistema híbrido de asa cerrada, habríamos observado una frecuencia mayor de episodios de hiperglucemia. Aunque no era uno de los objetivos primarios del estudio, confirmamos que el uso de sistemas híbridos de asa cerrada ofrece ventajas adicionales para los padres, quienes han reportado sentirse más seguros confiando el cuidado de sus hijos a otras personas31 con el uso de sistemas híbridos de asa cerrada, así como una necesidad menor de servicios de atención sanitaria32. Por último, hemos de mencionar que, más allá de la seguridad y la eficacia, los resultados autorreportados por los pacientes muestran un aumento en la satisfacción y la calidad de vida con el uso de sistemas híbridos de asa cerrada avanzados33.
En cuanto a las limitaciones del estudio, cabe destacar su realización en un único centro, el reducido número de participantes y la brevedad del seguimiento. Otra de las limitaciones es que la actividad física y la ingesta de carbohidratos se evaluaron con base en datos autorreportados, lo que podría introducir un sesgo de memoria. Por otro lado, hemos de enfatizar que el estudio se llevó a cabo en condiciones del mundo real. Aunque no se obtuvieron datos objetivos sobre la intensidad de la actividad física y la ingesta de carbohidratos, el sistema híbrido de asa cerrada resultó efectivo para la prevención de la hipoglucemia.
ConclusionesEn conclusión, nuestro estudio demuestra la efectividad y seguridad de los sistemas híbridos de asa cerrada en pacientes pediátricos con diabetes tipo 1 durante la práctica de deportes de competición. Debemos resaltar que no se observó un aumento en los episodios de hipoglucemia, uno de los obstáculos y de los motivos de preocupación que a menudo limita la práctica de actividad física. Estudios multicéntricos de mayor tamaño con sistemas híbridos de asa cerrada permitirían hacer comparaciones con base en el tipo de actividad física realizada y abrir áreas apasionantes para la investigación futura.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento a los participantes y sus familias.