La obesidad en la población pediátrica y su efecto en la génesis de las enfermedades metabólicas constituye un gran problema de salud pública. Uno de los objetivos del estudio de ámbito europeo PRE-STARt en Euskadi es evaluar la efectividad de un programa de promoción de la salud, dirigido a adolescentes con factores de riesgo asociados al desarrollo de diabetes mellitus tipo 2 (DMT2).
Pacientes y métodosEnsayo clínico con doble grupo aleatorizado de adolescentes de 12 a 14 años con exceso ponderal. El grupo intervención recibió un programa multidisciplinar durante 24 meses, de 11 sesiones grupales (ocho al inicio, tres de refuerzo) junto con sus tutores. El grupo control continuó el seguimiento habitual por los equipos de pediatría de Atención Primaria. Se plantean modelos longitudinales para estudiar la evolución de medidas antropométricas y hábitos de vida desde el momento basal, a los 3, 6, 12 y 24 meses.
ResultadosParticiparon 92 personas en el estudio, igualmente distribuidas por grupo. Se observaron mejoras estadísticamente significativas en varios resultados: evolución del índice de masa corporal; aumento del consumo de frutas y verduras; disminución del consumo de snacks y de bebidas azucaradas; y aumento del número de días por semana en los que realizan más de una hora de ejercicio físico.
ConclusionesLos resultados confirman la efectividad del programa multidisciplinar, tanto en la evolución del índice de masa corporal como en la mejora de los hábitos alimentarios y de actividad física, todos ellos factores de riesgo en la génesis de enfermedades metabólicas futuras, como la DMT2.
Obesity in the child population and its effect in the development of metabolic diseases are a public health issue. One of the aims of the European Project PRE-STARt in Euskadi, is the evaluation of the effectiveness of a multidisciplinary health promotion program directed at adolescents with risk factors associated with the development of type 2 Diabetes Mellitus (T2DM).
Patients and methodsRandomised clinical trial with two groups of 12-14 year-old overweight adolescents. The intervention group took part in a multidisciplinary program for 24 months. This program was based on 11 group sessions (8 main sessions and 3 additional support ones) for adolescents and their guardians. The control group received usual care at primary care level. Longitudinal regression models were adjusted to assess the evolution of anthropometric measures and living habits at baseline, 3, 6, 12, and 24 months in both groups.
ResultsThere were 92 participants, equally distributed by group. Statistically significant differences were observed between intervention and control groups in several results: evolution of the body mass index; increase in the consumption of fruits and vegetables; decrease in the consumption of snacks and sweetened drinks; and increase in the number of days per week with more than one hour of physical activity.
ConclusionsThe results confirm the effectiveness of this multidisciplinary program, both in the evolution of the body mass index, and in the improvement of the eating and physical activity habits, all of them risk factors for the future development of metabolic diseases, such as T2DM.
La diabetes mellitus tipo 2 (DMT2) es una enfermedad crónica grave que conduce a múltiples complicaciones. Se estima que es la tercera causa de mortalidad en todo el mundo1, y sigue aumentando, constituyendo ya una epidemia2,3.
La DMT2 ha pasado de ser una enfermedad observada en adultos a presentarse en grupos de edad más jóvenes, asociada principalmente al aumento en la prevalencia de obesidad y sedentarismo4. Se ha observado un aumento de la prevalencia de DMT2 en adultos jóvenes y adolescentes con diferente incidencia, según áreas geográficas5,6, siendo cada vez más diagnosticada en menores de 30 años7–9. En España, los datos son escasos y parciales, con incidencia menor que otros países de nuestro entorno10–12. Hasta el 2002, la DMT2 no era considerada como una enfermedad pediátrica. Fue entonces cuando la OMS comenzó a dar recomendaciones para su detección precoz13. Además, el paso de intolerancia a la glucosa (ITG) a DMT2 es un proceso que se acelera en la juventud14. Por todo ello, se propugna intervenir de manera precoz a este grupo de población3,15,16.
Investigaciones observacionales han demostrado que un 80-90% de los casos de DMT2 son el resultado de un estilo de vida poco saludable17,18. Durante las dos últimas décadas se han realizado ensayos controlados aleatorizados para la prevención de la DMT2 en varios países y poblaciones19,20, demostrándose que la intervención basada en cambios en el estilo de vida puede reducir el riesgo de progresión de ITG a DMT221. Asimismo, se demuestra que las intervenciones efectivas deben de ser multidisciplinares, intensivas y dirigidas por profesionales con formación específica para ello22–25.
Varias revisiones sistemáticas26–30 y guías de práctica clínica16,31 destacan las claves más eficaces de las estrategias de abordaje de la obesidad en los jóvenes: combinación de cambios en comportamientos sedentarios, dietéticos y conductuales, participación de los padres y tutores, y mejorar el conocimiento y la motivación de los niños valorando el estado emocional.
Los puntos anteriores, combinados con las lecciones aprendidas en los programas de prevención del riesgo de diabetes en otros países y la necesidad de mejorar la evidencia existente25,32,33, han servido de base para poner en marcha el proyecto de ámbito europeo PRE-STARt34, intervención multidisciplinar de promoción de estilo de vida saludable para adolescentes con factores de riesgo asociados con el desarrollo de DMT2. El objetivo de este trabajo es evaluar la eficacia tras 24 meses de seguimiento del programa PRE-STARt, en Euskadi en términos de frenar el ascenso del índice de masa corporal (IMC) en adolescentes de 12 a 14 años y en los hábitos de vida (alimentación y ejercicio). Los resultados del proyecto europeo a nivel global están en fase de revisión.
Pacientes y métodosDiseño del estudioSe trata de un ensayo clínico con grupo control y asignación aleatoria por clúster, con un seguimiento de dos años de duración. El proyecto fue aprobado por el comité de ética de Euskadi (ref. CEIC 2014194).
ParticipantesEn el estudio fueron incluidos adolescentes de 12 a 14 años, identificados desde los servicios de pediatría de Atención Primaria del Sistema Vasco de Salud, Osakidetza, que presentasen un exceso ponderal, sobrepeso si su IMC era era superior a la media entre 1 y 2 DE (desviación estándar), según su edad y sexo, y obesidad superior a 2 DE, según las tablas de la OMS35. Se excluyeron aquellas personas que tenían diagnosticada diabetes de cualquier tipo u obesidad secundaria.
Veintiséis pediatras de Atención Primaria fueron asignados aleatoriamente al grupo intervención (GI) o grupo control (GC), de modo que todos sus pacientes fueron incorporados en el grupo correspondiente. Tras obtener su consentimiento para participar en el estudio, fueron incluidos en el mismo. El seguimiento de ambos grupos se llevó a cabo por sus equipos de Atención Primaria de referencia. El GC recibió el seguimiento habitual establecido por Osakidetza, con pautas de alimentación y ejercicio saludables, reconduciendo los hábitos familiares, pero con la limitación del tiempo que caracteriza a estas consultas. El GI recibió una intervención multidisciplinar intensiva, grupal, de promoción de hábitos de vida saludables junto con sus padres o tutores.
IntervenciónLa intervención la realizaron dos dietistas-nutricionistas con formación y experiencia en programas de intervención en niños con sobrepeso.
El programa utilizó técnicas cognitivo-conductuales y psicodinámicas para trabajar los principios básicos de una alimentación saludable, posibilitar el autocontrol, mejorar la imagen corporal, aumentar la comunicación, facilitar la resolución de conflictos y la asertividad, mejorar la autoestima, aumentar la actividad física, disminuir el sedentarismo y facilitar cambios emocionales en el entorno familiar. Además, se posibilitó un espacio donde pudieron analizar y expresar sus emociones en relación con el tema del exceso de peso y sus consecuencias.
La intervención se centró en los y las adolescentes y su entorno familiar, es decir, los cambios se propusieron a toda la familia, fomentando así la adherencia al programa. El fin era conseguir cambios en los hábitos de estilo de vida a largo plazo.
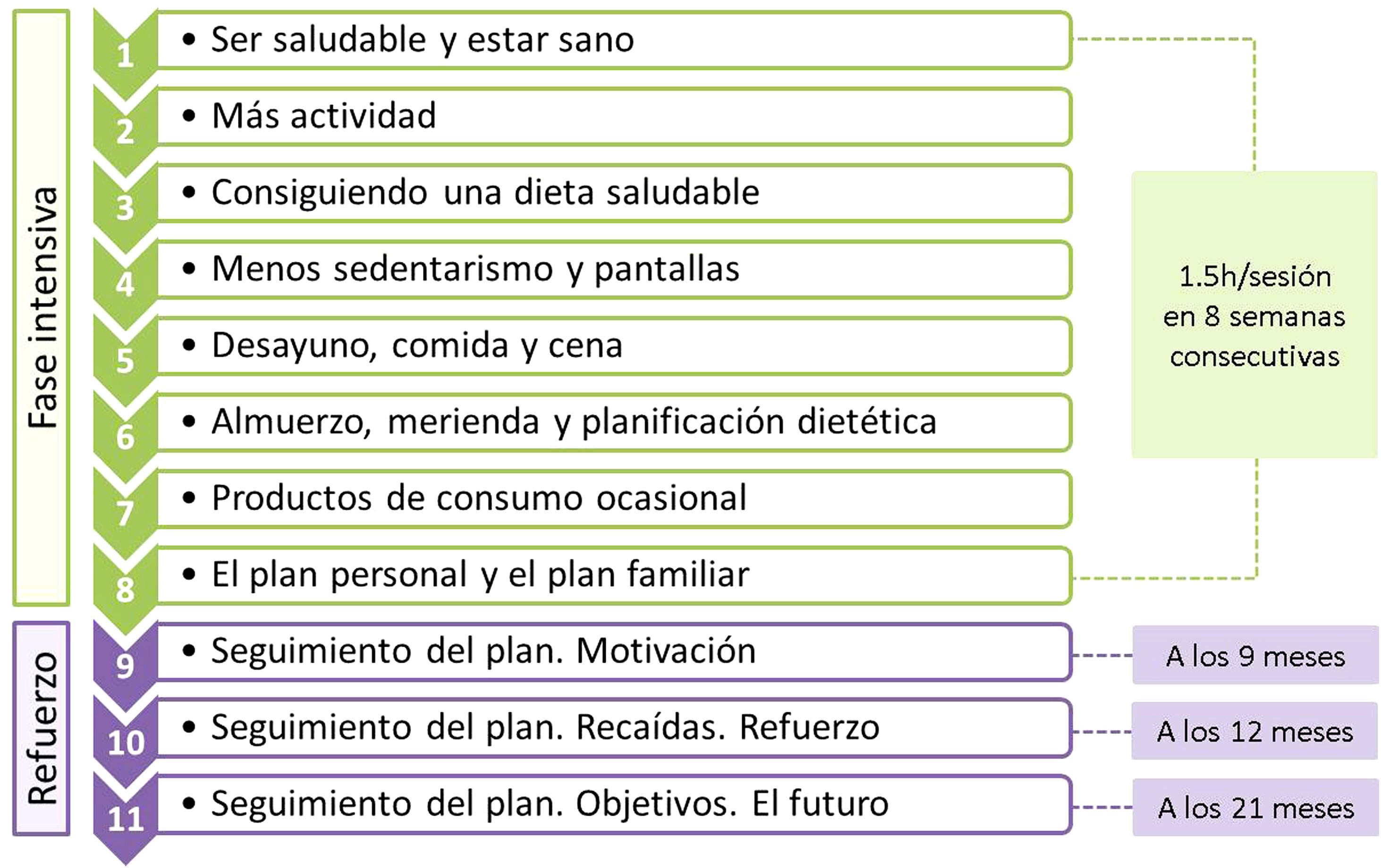
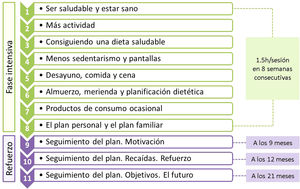
El programa se estructuró en 11 sesiones, con un total de 16,5 horas, divididas en dos fases: fase intensiva con sesiones de hora y media semanal durante ocho semanas consecutivas y fase de refuerzo con tres sesiones a los 9, 12, y 21 meses (fig. 1). En cada sesión se formaron dos grupos simultáneos de trabajo, uno compuesto por adolescentes (12 por grupo) y otro por sus padres o tutores (unas 20 personas por grupo). Todas las sesiones se realizaron fuera de horario y entorno escolar.
VariablesLa variable principal para la evaluación de la eficacia del programa es el IMC y Z-score del IMC. En cada visita, al momento basal a los 3, 6, 12 y 24 meses, se midieron parámetros antropométricos (peso, talla, perímetro de cintura, perímetro braquial y cuello), y parámetros clínicos como la frecuencia cardiaca, la presión arterial sistólica y diastólica (media de las dos últimas mediciones de un total de tres, en el brazo derecho con medidor oscilométrico homologado en posición sentada, tras un reposo de al menos cinco minutos) y la valoración del desarrollo puberal (estadios de Tanner). También se valoraron el modelo alimentario (raciones de consumo de frutas, verduras, ingesta de refrescos y snacks) y el nivel de actividad física (número de días a la semana en el que se realiza actividad más de 1 h/día), mediante cuestionarios. En el momento basal se midieron variables sociodemográficas (edad, sexo, etnia), antecedentes familiares (DMT2, enfermedad cardiovascular, hipertensión arterial y sobrepeso), relativas al embarazo (semanas de gestación, presencia o no de diabetes gestacional), antecedentes personales (peso al nacimiento, valoración de bajo peso al nacer con respecto a su edad gestacional [PEG], lactancia materna y duración), además de parámetros analíticos (glucemia, hemoglobina glicada HbA1c, triglicéridos, colesterol total, colesterol HDL).
Tamaño muestralEl proyecto europeo PRE-STARt constaba de dos fases. La primera consistió en el desarrollo y validación de una herramienta para la identificación de adolescentes de entre 12 y 14 años, con alto riesgo de desarrollar DMT2 a lo largo de la vida34. Para esta fase, el tamaño muestral planteado fue de 100 participantes por región, con un total de cinco regiones europeas. La segunda fase del proyecto estaba dirigida a evaluar la intervención en una submuestra de la muestra inicial. Se planteó realizar la evaluación en el momento basal, a los tres meses y a los seis meses. En Euskadi, se decidió prorrogar el seguimiento hasta los 12 y 24 meses. Por ello, se realizó un nuevo cálculo muestral para la elección de la submuestra.
El objetivo principal era encontrar una diferencia mínima de 0,5 puntos en el Z-score respecto al IMC entre los dos grupos, con una desviación estándar de 1,3. Por lo tanto, considerando un nivel de significación de 0,05, una potencia de 90 y una tasa de pérdidas de seguimiento del 20% para un estudio con medidas repetidas (coeficiente de correlación entre las medidas de 0,9), se necesitarían 36 participantes por grupo, un total de 72. El cálculo se realizó con la calculadora de tamaño muestral Granmo v7.12 (Institut Municipal d’Investigació Mèdica, Barcelona, España).
Análisis estadísticoLas variables categóricas se muestran mediante frecuencias y porcentajes (%); las variables continuas con distribución normal mediante su media y DE, y mediante la mediana y el primer y tercer cuartil (Q1, Q3), en caso contrario. Las diferencias entre los GI y GC (pruebas independientes) o para las diferencias pre-post (pruebas pareadas), se miden mediante la prueba de χ2 para las variables categóricas independientes, y el test de McNemar para variables dependientes; para las variables continuas con distribución normal se ha aplicado el test t de Student, para datos pareados en caso de muestras relacionadas; y para las variables continuas que no sigan una distribución normal, la prueba no paramétrica de Wilcoxon, suma de rangos para variables independientes y rangos con signos para variables relacionadas entre sí.
Además, se han planteado modelos longitudinales por intención de tratar para observar el efecto de la intervención a lo largo del tiempo. Dada la estructura jerárquica de los datos, se han planteado modelos mixtos de regresión, ajustados por variables influyentes. En estos modelos se ha incluido el centro de salud y el individuo como efectos aleatorios. El efecto de la intervención se estudia mediante la interacción entre el grupo, GI o GC, y el tiempo de seguimiento. El tiempo se ha incluido de forma continua, y en los casos en los que el efecto de la intervención es más acentuado en puntos intermedios del seguimiento, se ha incluido de forma cuadrática. Los modelos finales se presentan mediante la estimación de la diferencia entre el GI respecto del GC, para cada punto en el tiempo de seguimiento. Los resultados se presentan mediante el p-valor del coeficiente de interacción entre grupo y tiempo, y también mediante el coeficiente de correlación intraclase (CCI) a nivel del centro. Los análisis se han realizado con el software libre R v.3.4 (R Foundation for Statistical Computing, Viena, Austria).
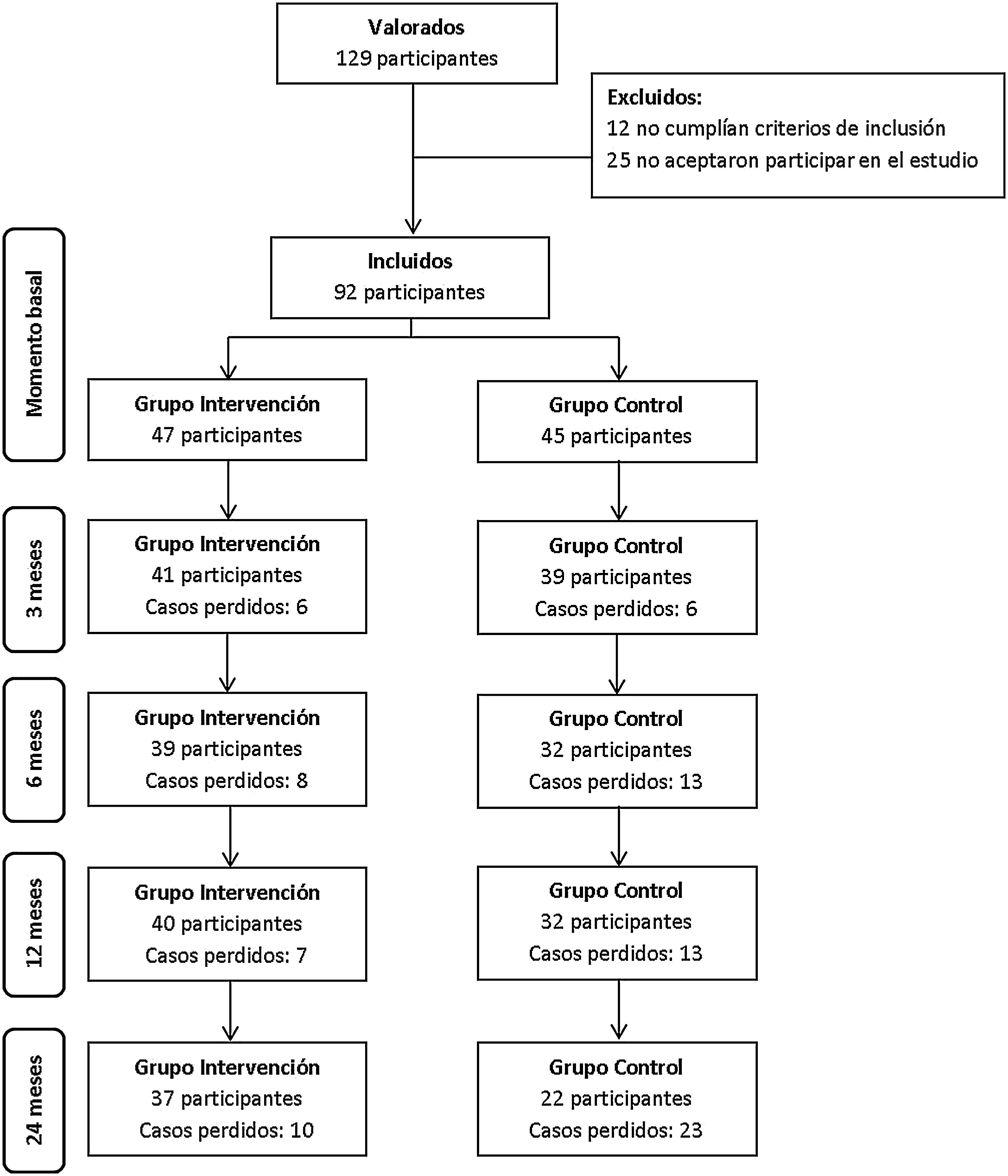
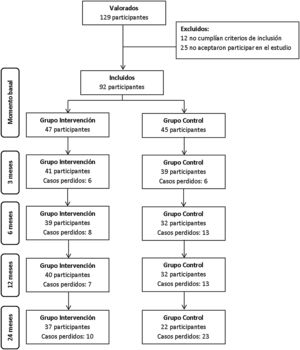
ResultadosUn total de 92 participantes fueron incluidos en el estudio, 47 en el GI y 45 en el GC. A lo largo de los dos años de seguimiento hubo 21% de casos perdidos en el GI y 51% en el GC, con diferencias significativas (p-valor 0,006). El flujograma se muestra en la fig. 2.
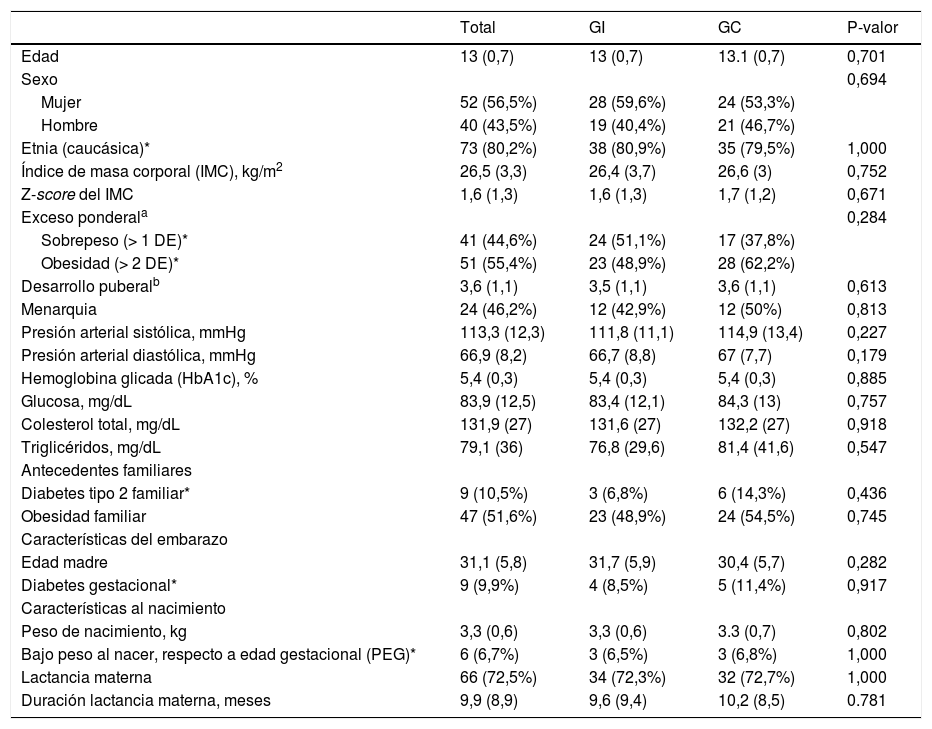
Las características basales de los participantes se muestran en la tabla 1. No se observan diferencias entre los grupos GI y GC. La edad media de los participantes es de 13 años (DE 0,7), y la distribución por sexo es similar, siendo un poco mayor el porcentaje de mujeres (56%). Un 80% son de procedencia caucásica. La media del IMC en el momento basal es de 26,5 (DE 3,3), sin diferencias entre grupos. Tampoco hay diferencias de la presencia de factores de riesgo para DMT2 entre los dos grupos36.
Descripción basal de la muestra total (n = 92) y diferenciado por grupo, grupo intervención (GI, n = 47) y grupo control (GC, n = 45)
| Total | GI | GC | P-valor | |
|---|---|---|---|---|
| Edad | 13 (0,7) | 13 (0,7) | 13.1 (0,7) | 0,701 |
| Sexo | 0,694 | |||
| Mujer | 52 (56,5%) | 28 (59,6%) | 24 (53,3%) | |
| Hombre | 40 (43,5%) | 19 (40,4%) | 21 (46,7%) | |
| Etnia (caucásica)* | 73 (80,2%) | 38 (80,9%) | 35 (79,5%) | 1,000 |
| Índice de masa corporal (IMC), kg/m2 | 26,5 (3,3) | 26,4 (3,7) | 26,6 (3) | 0,752 |
| Z-score del IMC | 1,6 (1,3) | 1,6 (1,3) | 1,7 (1,2) | 0,671 |
| Exceso ponderala | 0,284 | |||
| Sobrepeso (> 1 DE)* | 41 (44,6%) | 24 (51,1%) | 17 (37,8%) | |
| Obesidad (> 2 DE)* | 51 (55,4%) | 23 (48,9%) | 28 (62,2%) | |
| Desarrollo puberalb | 3,6 (1,1) | 3,5 (1,1) | 3,6 (1,1) | 0,613 |
| Menarquia | 24 (46,2%) | 12 (42,9%) | 12 (50%) | 0,813 |
| Presión arterial sistólica, mmHg | 113,3 (12,3) | 111,8 (11,1) | 114,9 (13,4) | 0,227 |
| Presión arterial diastólica, mmHg | 66,9 (8,2) | 66,7 (8,8) | 67 (7,7) | 0,179 |
| Hemoglobina glicada (HbA1c), % | 5,4 (0,3) | 5,4 (0,3) | 5,4 (0,3) | 0,885 |
| Glucosa, mg/dL | 83,9 (12,5) | 83,4 (12,1) | 84,3 (13) | 0,757 |
| Colesterol total, mg/dL | 131,9 (27) | 131,6 (27) | 132,2 (27) | 0,918 |
| Triglicéridos, mg/dL | 79,1 (36) | 76,8 (29,6) | 81,4 (41,6) | 0,547 |
| Antecedentes familiares | ||||
| Diabetes tipo 2 familiar* | 9 (10,5%) | 3 (6,8%) | 6 (14,3%) | 0,436 |
| Obesidad familiar | 47 (51,6%) | 23 (48,9%) | 24 (54,5%) | 0,745 |
| Características del embarazo | ||||
| Edad madre | 31,1 (5,8) | 31,7 (5,9) | 30,4 (5,7) | 0,282 |
| Diabetes gestacional* | 9 (9,9%) | 4 (8,5%) | 5 (11,4%) | 0,917 |
| Características al nacimiento | ||||
| Peso de nacimiento, kg | 3,3 (0,6) | 3,3 (0,6) | 3.3 (0,7) | 0,802 |
| Bajo peso al nacer, respecto a edad gestacional (PEG)* | 6 (6,7%) | 3 (6,5%) | 3 (6,8%) | 1,000 |
| Lactancia materna | 66 (72,5%) | 34 (72,3%) | 32 (72,7%) | 1,000 |
| Duración lactancia materna, meses | 9,9 (8,9) | 9,6 (9,4) | 10,2 (8,5) | 0.781 |
Los datos se representan mediante frecuencias y porcentajes, o mediante media y desviación estándar (DE).
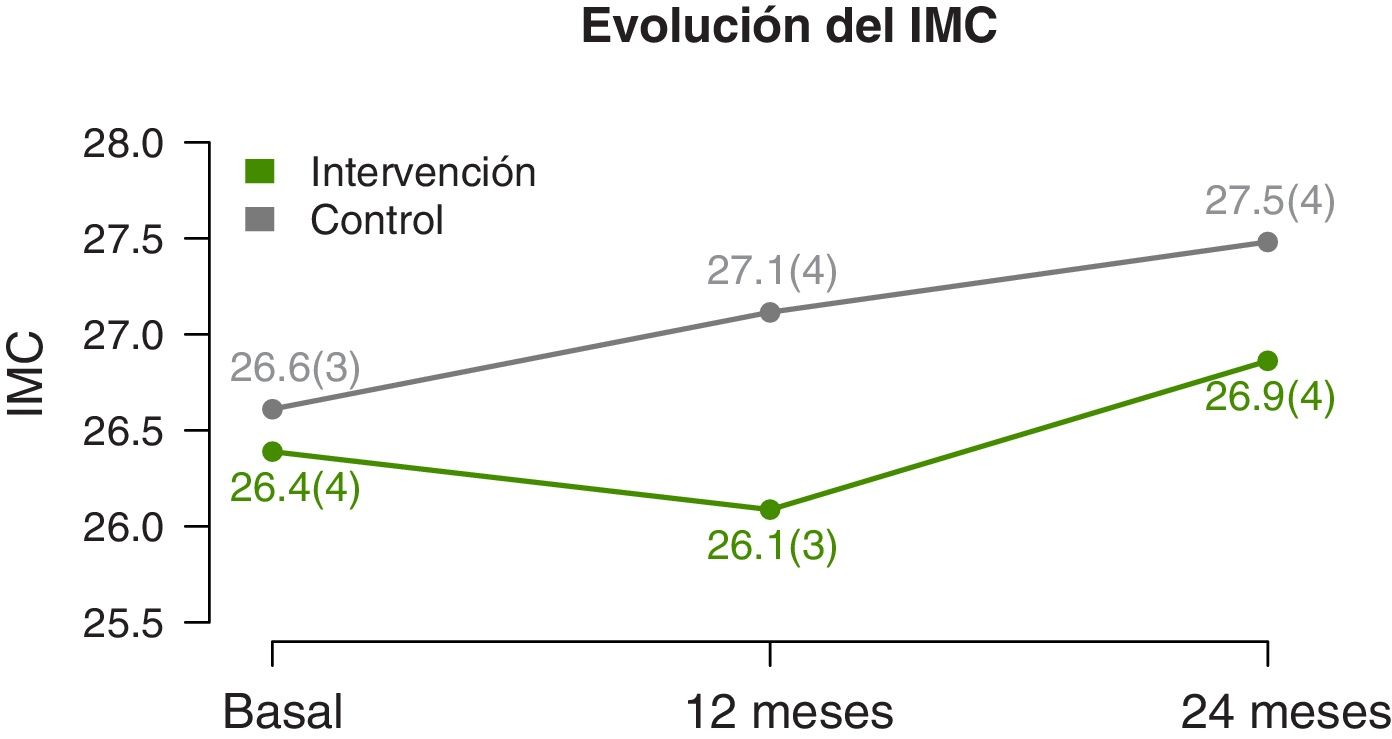
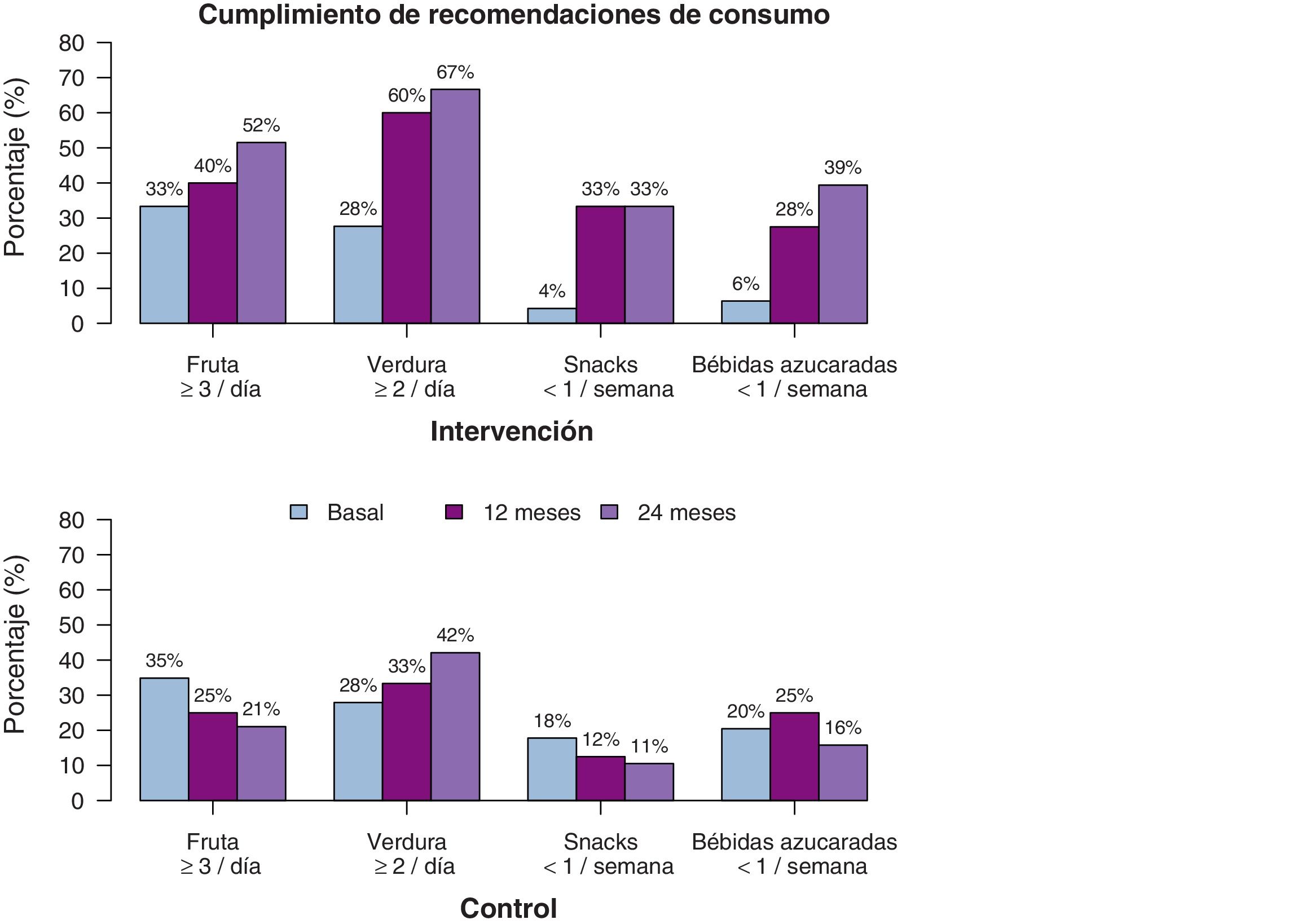
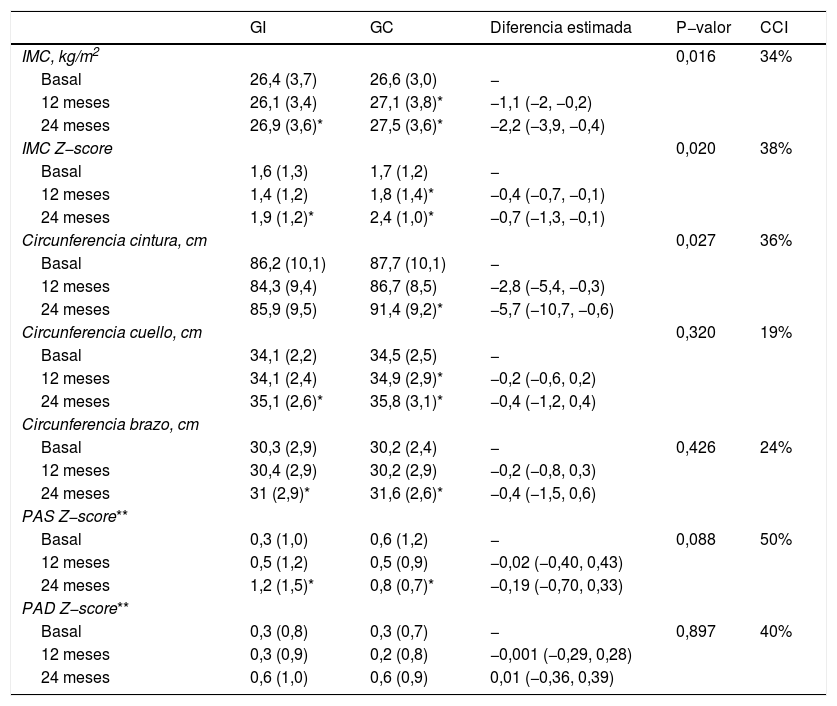
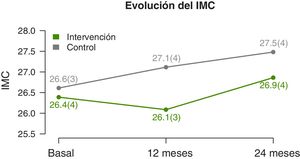
Se observan diferencias significativas en la evolución del IMC y Z-score del IMC (tabla 2). A los 12 meses disminuyen en el GI y aumentan en el GC. Y a los dos años se observa un ascenso en ambos grupos, pero inferior en el GI (fig. 3). La circunferencia de cintura aumenta significativamente en el GC, mientras que el GI se mantiene. No hay diferencias significativas en la evolución de la circunferencia de cuello y de brazo. Tampoco existen diferencias en la evolución del Z-score de la presión arterial.
Evolución del IMC y las medidas antropométricas a lo largo del seguimiento y diferencias entre el grupo intervención (GI, n = 47) y grupo control (GC, n = 45)
| GI | GC | Diferencia estimada | P−valor | CCI | |
|---|---|---|---|---|---|
| IMC, kg/m2 | 0,016 | 34% | |||
| Basal | 26,4 (3,7) | 26,6 (3,0) | − | ||
| 12 meses | 26,1 (3,4) | 27,1 (3,8)* | −1,1 (−2, −0,2) | ||
| 24 meses | 26,9 (3,6)* | 27,5 (3,6)* | −2,2 (−3,9, −0,4) | ||
| IMC Z−score | 0,020 | 38% | |||
| Basal | 1,6 (1,3) | 1,7 (1,2) | − | ||
| 12 meses | 1,4 (1,2) | 1,8 (1,4)* | −0,4 (−0,7, −0,1) | ||
| 24 meses | 1,9 (1,2)* | 2,4 (1,0)* | −0,7 (−1,3, −0,1) | ||
| Circunferencia cintura, cm | 0,027 | 36% | |||
| Basal | 86,2 (10,1) | 87,7 (10,1) | − | ||
| 12 meses | 84,3 (9,4) | 86,7 (8,5) | −2,8 (−5,4, −0,3) | ||
| 24 meses | 85,9 (9,5) | 91,4 (9,2)* | −5,7 (−10,7, −0,6) | ||
| Circunferencia cuello, cm | 0,320 | 19% | |||
| Basal | 34,1 (2,2) | 34,5 (2,5) | − | ||
| 12 meses | 34,1 (2,4) | 34,9 (2,9)* | −0,2 (−0,6, 0,2) | ||
| 24 meses | 35,1 (2,6)* | 35,8 (3,1)* | −0,4 (−1,2, 0,4) | ||
| Circunferencia brazo, cm | |||||
| Basal | 30,3 (2,9) | 30,2 (2,4) | − | 0,426 | 24% |
| 12 meses | 30,4 (2,9) | 30,2 (2,9) | −0,2 (−0,8, 0,3) | ||
| 24 meses | 31 (2,9)* | 31,6 (2,6)* | −0,4 (−1,5, 0,6) | ||
| PAS Z−score** | |||||
| Basal | 0,3 (1,0) | 0,6 (1,2) | − | 0,088 | 50% |
| 12 meses | 0,5 (1,2) | 0,5 (0,9) | −0,02 (−0,40, 0,43) | ||
| 24 meses | 1,2 (1,5)* | 0,8 (0,7)* | −0,19 (−0,70, 0,33) | ||
| PAD Z−score** | |||||
| Basal | 0,3 (0,8) | 0,3 (0,7) | − | 0,897 | 40% |
| 12 meses | 0,3 (0,9) | 0,2 (0,8) | −0,001 (−0,29, 0,28) | ||
| 24 meses | 0,6 (1,0) | 0,6 (0,9) | 0,01 (−0,36, 0,39) |
Los datos se representan mediante media y desviación estándar, o mediante su correspondiente intervalo de confianza del 95%, en el caso de las diferencias. En los modelos de regresión se incluyen, además, los seguimientos de tres y seis meses, y cada modelo ha sido ajustado por variables influyentes.
Indica diferencias estadísticamente significativas (p-valor < 0,05) entre ese momento respecto al momento basal, dentro del correspondiente grupo.
Z-score de la presión arterial, según valores del National High Blood Pressure Education Program Working Group on High Blood Pressure in Children and Adolescents40, para lo cual se han introducido los Z-score de la talla, según valores de los Centers for Disease Control and Prevention y del National Center for Health Statistics41.
CCI: coeficiente de correlación intraclase; PAS: presión arterial sistólica; PAD: presión arterial diastólica.
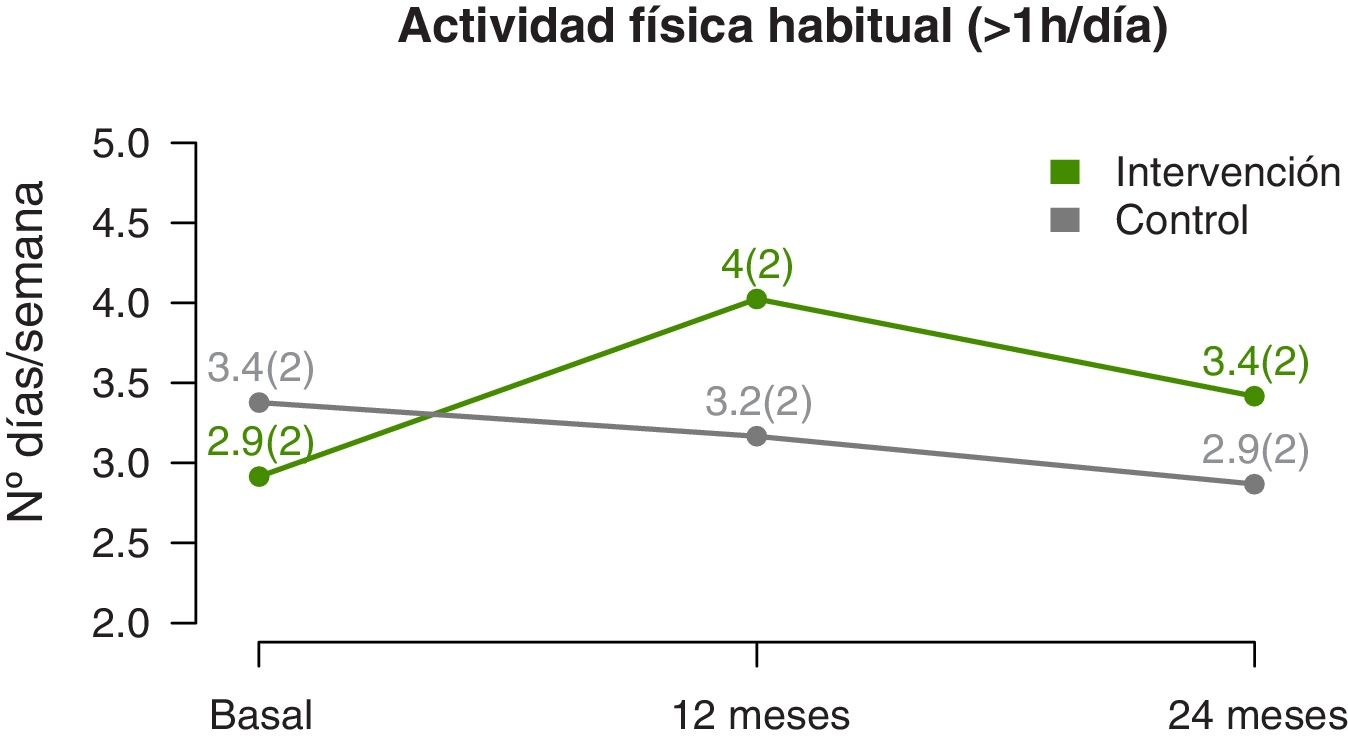
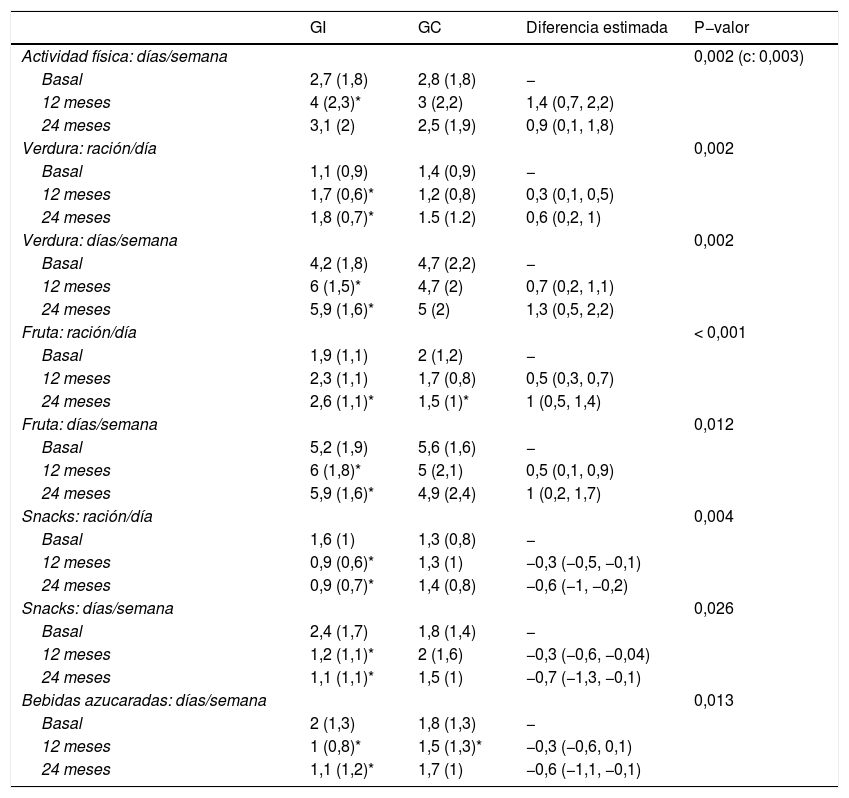
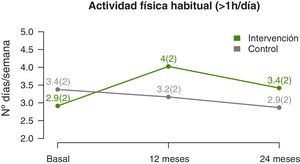
La evolución del nivel de actividad física muestra que el número medio de días por semana en los que realizan más de una hora de ejercicio físico aumenta significativamente (p-valor lineal 0,002) en los participantes del GI, con respecto del GC (fig. 4), con una diferencia más acentuada en la mitad del seguimiento que al final (p-valor cuadrático 0,003) (tabla 3). La estimación a los 12 meses indica una diferencia de casi un día y medio de ejercicio a la semana en el GI, respecto del GC.
Evolución en la actividad física y el consumo de alimentos a lo largo del seguimiento, y diferencias entre el grupo intervención (GI, n = 47) y grupo control (GC, n = 45)
| GI | GC | Diferencia estimada | P−valor | |
|---|---|---|---|---|
| Actividad física: días/semana | 0,002 (c: 0,003) | |||
| Basal | 2,7 (1,8) | 2,8 (1,8) | − | |
| 12 meses | 4 (2,3)* | 3 (2,2) | 1,4 (0,7, 2,2) | |
| 24 meses | 3,1 (2) | 2,5 (1,9) | 0,9 (0,1, 1,8) | |
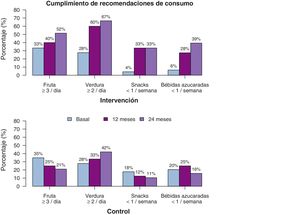
| Verdura: ración/día | 0,002 | |||
| Basal | 1,1 (0,9) | 1,4 (0,9) | − | |
| 12 meses | 1,7 (0,6)* | 1,2 (0,8) | 0,3 (0,1, 0,5) | |
| 24 meses | 1,8 (0,7)* | 1.5 (1.2) | 0,6 (0,2, 1) | |
| Verdura: días/semana | 0,002 | |||
| Basal | 4,2 (1,8) | 4,7 (2,2) | − | |
| 12 meses | 6 (1,5)* | 4,7 (2) | 0,7 (0,2, 1,1) | |
| 24 meses | 5,9 (1,6)* | 5 (2) | 1,3 (0,5, 2,2) | |
| Fruta: ración/día | < 0,001 | |||
| Basal | 1,9 (1,1) | 2 (1,2) | − | |
| 12 meses | 2,3 (1,1) | 1,7 (0,8) | 0,5 (0,3, 0,7) | |
| 24 meses | 2,6 (1,1)* | 1,5 (1)* | 1 (0,5, 1,4) | |
| Fruta: días/semana | 0,012 | |||
| Basal | 5,2 (1,9) | 5,6 (1,6) | − | |
| 12 meses | 6 (1,8)* | 5 (2,1) | 0,5 (0,1, 0,9) | |
| 24 meses | 5,9 (1,6)* | 4,9 (2,4) | 1 (0,2, 1,7) | |
| Snacks: ración/día | 0,004 | |||
| Basal | 1,6 (1) | 1,3 (0,8) | − | |
| 12 meses | 0,9 (0,6)* | 1,3 (1) | −0,3 (−0,5, −0,1) | |
| 24 meses | 0,9 (0,7)* | 1,4 (0,8) | −0,6 (−1, −0,2) | |
| Snacks: días/semana | 0,026 | |||
| Basal | 2,4 (1,7) | 1,8 (1,4) | − | |
| 12 meses | 1,2 (1,1)* | 2 (1,6) | −0,3 (−0,6, −0,04) | |
| 24 meses | 1,1 (1,1)* | 1,5 (1) | −0,7 (−1,3, −0,1) | |
| Bebidas azucaradas: días/semana | 0,013 | |||
| Basal | 2 (1,3) | 1,8 (1,3) | − | |
| 12 meses | 1 (0,8)* | 1,5 (1,3)* | −0,3 (−0,6, 0,1) | |
| 24 meses | 1,1 (1,2)* | 1,7 (1) | −0,6 (−1,1, −0,1) |
Los datos se representan mediante media y desviación estándar, o mediante su correspondiente intervalo de confianza del 95%, en el caso de las diferencias. En los modelos de regresión se incluyen, además, los seguimientos de tres y seis meses, y cada modelo ha sido ajustado por variables influyentes.
Respecto a las variables de alimentación, también se observan diferencias significativas (tabla 3), pero en este caso, la diferencia es lineal, no se da el efecto cuadrático, lo que indica que el efecto se mantiene a lo largo del tiempo. El consumo de frutas y verduras aumenta significativamente en el GI, tanto los días por semana como las raciones al día. La estimación a los dos años de seguimiento indica que los participantes del GI consumen hasta un día más de frutas y verduras por semana, respecto al GC, y también una ración más de fruta, y media de verdura al día. Respecto a alimentos desaconsejados, el consumo de snacks y de bebidas azucaradas disminuye, tanto en su consumo semanal, como diario, observándose a los dos años una diferencia estimada de más de media ración al día entre el GI y el GC. En la fig. 5 se muestra el porcentaje de participantes que cumplen con las recomendaciones dietéticas. Además, se ha estudiado el efecto que han tenido en conjunto en la evolución del IMC, los cambios en los hábitos alimenticios y de ejercicio físico, y se observa que todos ellos se asocian con la disminución del IMC con coeficientes similares, excepto el consumo de verduras y frutas (p-valor 0,485 y 0,905, respectivamente).
DiscusiónEl estudio europeo PRE-STARt está dirigido a tratar el exceso ponderal como principal factor de riesgo asociado al desarrollo de DMT2.
El abordaje convencional del sobrepeso, realizado en nuestro medio por un único profesional, pediatra o enfermera, basado en recomendar modificaciones en las pautas de alimentación y fomentar la actividad física, con escaso tiempo, fracasa tempranamente y no proporciona resultados favorables23,28.
Actualmente, la mayor evidencia de efectividad en el abordaje del exceso ponderal la proporcionan programas de intervención multidisciplinar e intensivos22,23,28, realizados por profesionales con formación específica y experiencia en este tipo de programas; programas que se dirigen a lograr cambios conductuales a nivel individual y familiar, para mejorar la salud física y emocional. La intervención realizada en este estudio responde a las recomendaciones actuales de intervención de ámbito familiar recomendadas en la literatura24.
Los resultados a los dos años de evolución muestran un cambio significativo del GI, respecto al GC en el IMC y el Z-score. La intervención ha conseguido frenar el ascenso del IMC, teniendo en cuenta que a la edad de los pacientes de nuestro estudio se presenta un aumento fisiológico de su IMC.
Otro resultado importante está relacionado con el consumo de alimentos. El GI aumenta el consumo de frutas y verduras y reduce el de snacks y refrescos, respecto al GC. Algunos estudios constatan cambios en el IMC, en relación con cambios dietéticos parciales25, como por ejemplo, su disminución al reducir el consumo de bebidas azucaradas37. En el presente estudio, la reducción en la ingesta de snacks y refrescos tiene un efecto significativo y similar en la disminución del IMC, mientras que el aumento de consumo de frutas y verduras no tiene el mismo impacto, aunque son conocidos sus beneficios en salud38.
Las intervenciones combinadas, que incluyen medidas sobre alimentación y actividad física, obtienen mejores resultados que las intervenciones aisladas25. En relación con la actividad física, la diversidad encontrada en la orientación de las actividades ofrecidas y los métodos de valoración dificulta los análisis para identificar qué método es más eficaz39. Nuestro estudio también confirma los cambios significativos en el GI en relación con el GC en número de días a la semana que realizan más de una hora de ejercicio activo.
En gran parte de los estudios se destaca la poca adherencia a los tratamientos, poniendo de manifiesto la conveniencia de una formación específica y reglada del personal que las realiza25. En nuestro estudio constatamos un bajo número de abandonos a lo largo de los dos años de seguimiento en el GI, en relación con el GC, teniendo en cuenta que precisamente es en el GI en el que la exigencia es mayor con gran implicación familiar. Además, se han encontrado diferencias significativas en el IMC, alimentación y actividad física en la fase inicial, y lo que es más importante, su mantenimiento a los dos años de seguimiento. Lo cual nos hace pensar que el cambio de hábitos se podría mantener en el futuro, con el consiguiente beneficio de disminuir los factores de riesgo modificables para la génesis de DMT2, sobre todo para aquellos niños que presentan factores no modificables desde el nacimiento.
Otro aspecto positivo es que la selección de los participantes y la realización de la intervención y las valoraciones se han hecho en el ámbito de Atención Primaria, a diferencia de otros estudios que se llevan a cabo en ámbitos comunitarios y escolares25,33. Todo esto gracias al sistema sanitario público universal y gratuito dotado de equipos pediátricos para toda la población, con el que contamos.
La principal limitación la constituye el procedimiento de selección de sujetos. A pesar de tratarse de un estudio aleatorizado, la decisión final de participar en el mismo, y más en una intervención intensiva como esta, hace que el grupo intervención pueda incluir a un mayor porcentaje de sujetos motivados para el cambio. No obstante, la comparabilidad de los grupos en el momento basal, demuestra que no se ha incurrido en un sesgo de selección. Otra limitación viene determinada por las pérdidas observadas en el grupo control, aunque en este caso, es posible que los sujetos que abandonaron el seguimiento incluyan a la población con peores resultados de salud. Además, dado que la muestra es mayor a la planteada por el cálculo muestral, considerando 50% de pérdidas, se mantiene una potencia estadística de 80%. Otra limitación es que todos los participantes del GI y GC habían iniciado su desarrollo puberal (estadios de Tanner entre 2 y 5), por tanto, no podemos aportar datos sobre la diferente respuesta a la intervención con niños prepuberales. Sería interesante conocer las diferencias de respuesta a la intervención en dos grupos diferenciados, prepuberales y puberales, primero por la edad más precoz, y segundo, por los efectos físicos y emocionales de la pubertad a la hora de hacer una intervención intensiva multidisciplinar.
No se ha constatado ningún efecto adverso en la muestra intervenida, respecto a trastorno de conducta alimentaria y/o trastornos emocionales.
ConclusiónLos resultados del presente estudio confirman la efectividad de un programa multidisciplinar a los dos años de seguimiento, adaptado a nuestras características socioculturales, para el grupo de adolescentes del estudio PRE-STARt, frenando el ascenso del IMC y mejorando hábitos alimentarios y de actividad física, factores asociados con el desarrollo de enfermedades metabólicas futuras como la DMT2.
Un programa de estas características constituye una estrategia más para el abordaje de la obesidad y el sedentarismo en la población infanto-juvenil y para la prevención de enfermedades metabólicas. La obesidad en la edad pediátrica es hoy en día uno de los más serios problemas de salud pública, por lo que precisa ser abordada con el desarrollo de estrategias de prevención y detección de factores de riesgo desde el nacimiento, y por tanto, los equipos de pediatría de Atención Primaria tienen un papel muy importante en esta tarea.
FinanciaciónFinanciado por la Comisión Europea, mediante Call for tender (referencia núm. SANCO/2013/C1/004).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos al Instituto de Investigación en Servicios de Salud Kronikgune, a la Unidad de Investigación en Atención Primaria-OSIs Gipuzkoa, a los equipos de pediatría en Atención Primaria de Osakidetza en Gipuzkoa, y a todos los adolescentes y familias que han participado en este proyecto.
Kronikgune: Olatz Albaina, Itziar Vergara, Maider Mateo-Abad, Irati Erreguerena, Sara Ponce, Ane Fullaondo, Esteban de Manuel Keenoy. Dietistas-nutricionistas: Amaia Perales, Garbiñe Aizpuru. Pediatras en Atención Primaria-Osakidetza: Elena Alustiza, Irene Ozcoidi, Sara García, Carmen Solórzano, Sagrario Fuentes, Lourdes Aramburu, Carmen Gómez, María Teresa Labiano, Maite Callén, Esther Galicia, Begoña Peña, Pilar Aizpurua, Izaskun Miner, María José Caballero, Andrea Di Michele, Florencia Insua, Iratxe Fernández, Oihana Gómez, Elena Busselo, Maider Delgado, Inmaculada Merino, María José Reguilón, Lourdes Mancisidor, Victor Ormaetxea, Edorta Zapirain; Amagoia Andrés. Enfermeras en Atención Primaria-Osakidetza: Elena Galardi, Ana Bueno.