Las miopatías inflamatorias autoinmunes tienen un espectro clínico muy amplio y, en función de los diferentes autoanticuerpos implicados, pueden condicionar un peor pronóstico con afectación de diferentes órganos. Los anticuerpos anti-SRP aparecen en menos del 1% de los niños diagnosticados de esta enfermedad, siendo de mal pronóstico, condicionando una miopatía necrosante con mala respuesta al tratamiento corticoideo y afectación multisistémica con una elevada morbimortalidad.
Presentamos el caso de una paciente de 11 años que refería un cuadro progresivo de debilidad muscular y mialgias de 3 meses de evolución, sin poder subir escalones ni levantarse desde el suelo en la última semana. No presentaba antecedentes personales ni familiares de interés. En la exploración destacaba una disminución importante de la fuerza en la musculatura axial cervical, la cintura pélvica, la cintura escapular y la musculatura dorsolumbar, y en ocasiones presentaba atragantamientos con los líquidos, con una puntuación en la Childhood Myositis Assessment Scale de 9/52. Su peso era de 52kg y su superficie corporal de 1,51 m2. El análisis sanguíneo mostró una CPK elevada, de 11.426U/L (26-192), aldolasa 94,2UI/L (1-7,5), LDH 1.513U/L (120-300), ALT 137UI/L (5-31) y AST 193U/L (10-31).
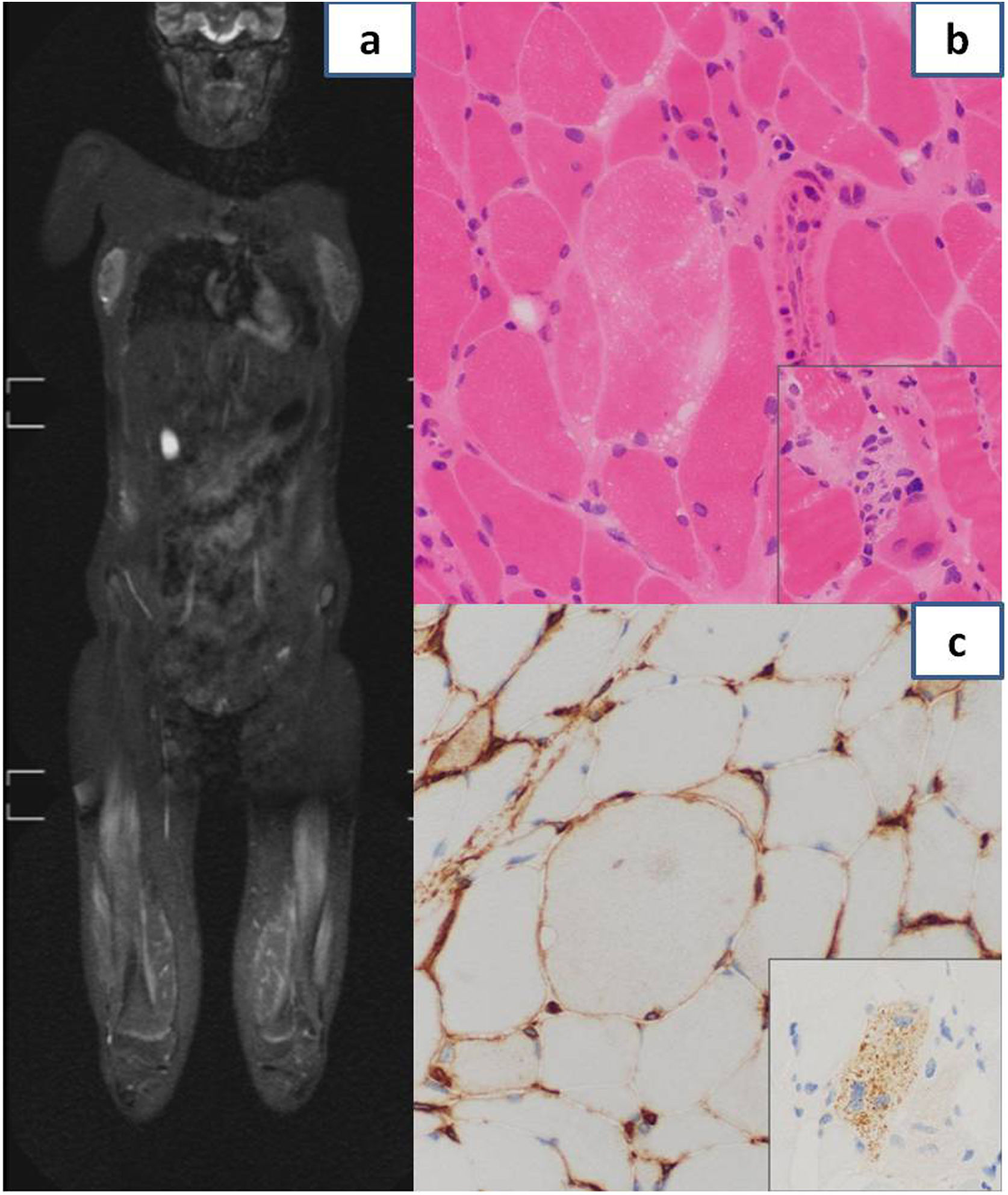
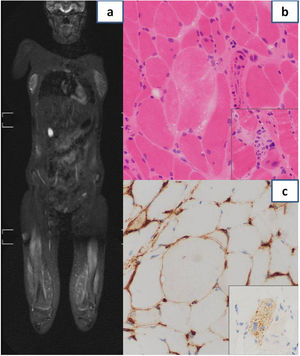
Durante su ingreso se realizó un amplio diagnóstico diferencial, descartando causas infecciosas, neurológicas, metabólicas, tóxicas, endocrinológicas y neoplásicas. En el estudio de autoinmunidad destacaron anticuerpos anti-SRP-54 y anti-SSA/Rol 52Kd positivos. El electromiograma mostró afectación miopática inflamatoria importante y en la resonancia magnética nuclear presentaba afectación muscular con patrón miofascial, parcheado, multifocal, bilateral y simétrico, con edema de predominio en la cintura pélvica y la musculatura proximal de los miembros inferiores (fig. 1 a). Ante la sospecha de miositis inflamatoria autoinmune se inició corticoterapia sistémica a altas dosis, sin respuesta clínica ni analítica inicialmente (bolos intravenosos de metilprednisolona a 125mg/día durante 5 días y posteriormente prednisona a 60mg/día). La biopsia muscular mostró cambios miopáticos con algunas fibras necróticas y regenerativas, y escasa inflamación. Se observó expresión inmunohistoquímica sarcolémica focal de HLA-I y expresión citoplasmática granular difusa de p62 en salpicadas fibras, todo ello compatible con una miositis necrosante autoinmune (fig. 1b y c). Debido a la posible afectación multisistémica, se llevaron a cabo múltiples estudios que incluyeron: valoración cardiológica con ecocardiografía, con buena función biventricular sin insuficiencias valvulares, espirometría y test de difusión, con adecuada función pulmonar, y valoración de la deglución por tránsito digestivo superior, con videofluoroscopia normal. Debido a la refractariedad al tratamiento corticoideo, precisó añadir inmunoglobulinas intravenosas (1g/kg), metotrexato (6,6mg/m2/semanal: 10mg) y rituximab (375mg/m2; primera dosis: 500mg y segunda dosis a los 15 días), junto con terapia física intensiva, con descenso progresivo de las enzimas musculares. Actualmente, 2 años después del diagnóstico, recibe metotrexato semanal (5mg) e inmunoglobulinas intravenosas mensuales (1g/kg), permaneciendo estable clínica y analíticamente. La paciente no ha presentado nueva sintomatología, sin experimentar disfagia y con estudio cardiaco y pulmonar sin complicaciones, con mejoría significativa de la fuerza muscular, siendo independiente en sus actividades diarias (Childhood Myositis Assessment Scale 45/52).
a: Resonancia magnética nuclear que muestra afectación muscular con patrón miofascial, parcheado, multifocal, bilateral y simétrico, con importante afectación de cuádriceps, isquiotibiales y aductores. b: Anatomía patológica de biopsia muscular: se aprecia variabilidad en el tamaño de las fibras musculares y una fibra necrótica centrada en la imagen sin inflamación significativa. El recuadro incluye una imagen de miofagocitosis. c: Anatomía patológica de biopsia muscular: se observa positividad sarcolémica focal de HLA-I. El recuadro muestra la positividad granular citoplasmática difusa frente a p62 en una fibra muscular.
Ante un paciente con debilidad muscular e hiperCKemia se debe establecer un amplio diagnóstico diferencial que incluye etiologías infecciosas, neurológicas, metabólicas, tóxicas, endocrinológicas, neoplásicas y autoinmunes. El estudio de autoinmunidad puede dar información sobre el pronóstico del paciente y las posibles alteraciones de la biopsia muscular. Las miopatías inflamatorias de peor pronóstico son las miopatías necrosantes, las cuales se asocian a los anticuerpos SRP y HMGCR.
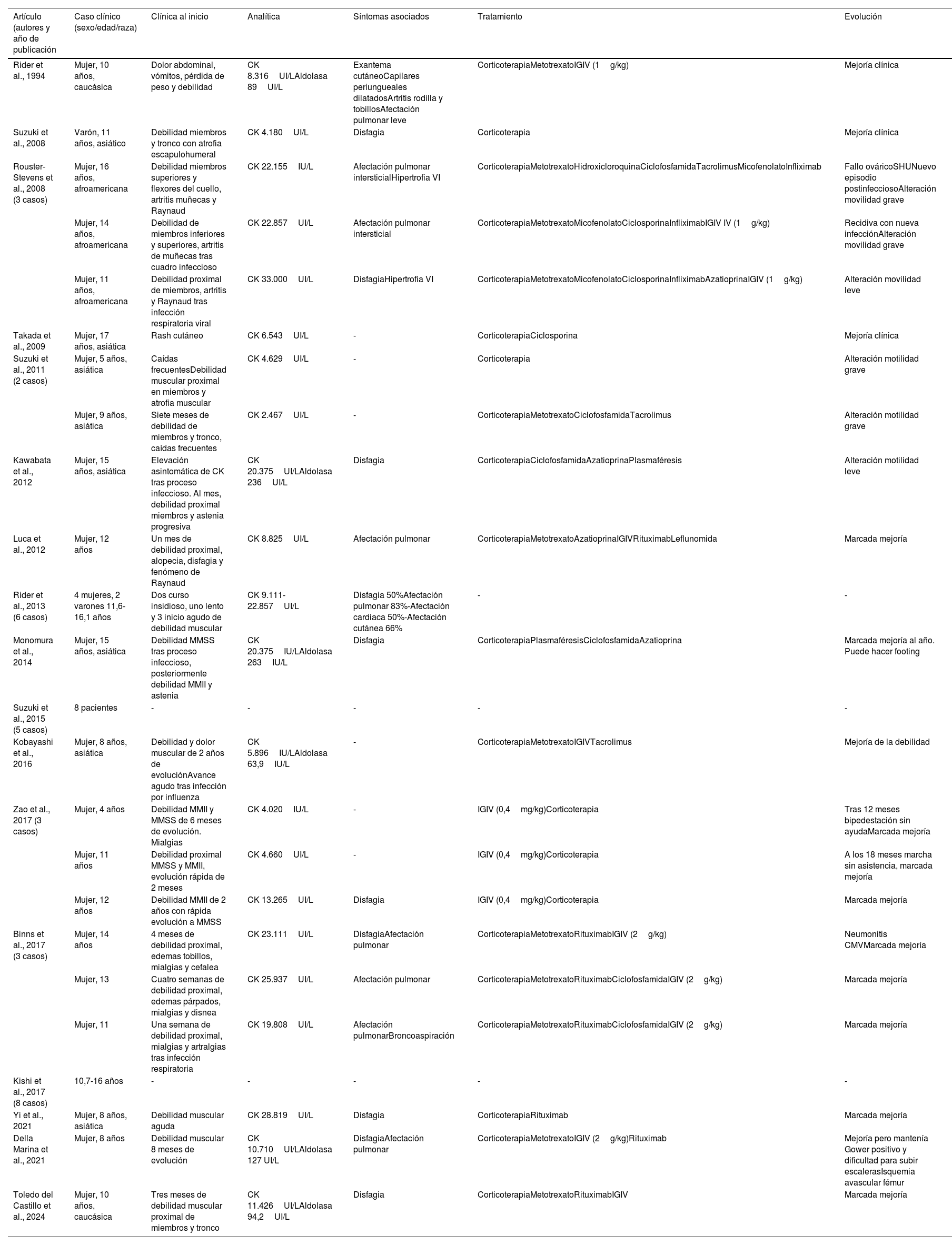
Actualmente, en la literatura científica solo hay notificados 40 casos de pacientes pediátricos diagnosticados de miositis necrosante autoinmune anti-SRP (revisión de PubMed hasta julio de 2023). En la tabla 1 se recogen las características clínicas, el tratamiento y la evolución de estos pacientes.
Revisión de la literatura de los casos pediátricos diagnosticados de miositis necrosante anti-SRP
| Artículo (autores y año de publicación | Caso clínico (sexo/edad/raza) | Clínica al inicio | Analítica | Síntomas asociados | Tratamiento | Evolución |
|---|---|---|---|---|---|---|
| Rider et al., 1994 | Mujer, 10 años, caucásica | Dolor abdominal, vómitos, pérdida de peso y debilidad | CK 8.316UI/LAldolasa 89UI/L | Exantema cutáneoCapilares periungueales dilatadosArtritis rodilla y tobillosAfectación pulmonar leve | CorticoterapiaMetotrexatoIGIV (1g/kg) | Mejoría clínica |
| Suzuki et al., 2008 | Varón, 11 años, asiático | Debilidad miembros y tronco con atrofia escapulohumeral | CK 4.180UI/L | Disfagia | Corticoterapia | Mejoría clínica |
| Rouster-Stevens et al., 2008 (3 casos) | Mujer, 16 años, afroamericana | Debilidad miembros superiores y flexores del cuello, artritis muñecas y Raynaud | CK 22.155IU/L | Afectación pulmonar intersticialHipertrofia VI | CorticoterapiaMetotrexatoHidroxicloroquinaCiclofosfamidaTacrolimusMicofenolatoInfliximab | Fallo ováricoSHUNuevo episodio postinfecciosoAlteración movilidad grave |
| Mujer, 14 años, afroamericana | Debilidad de miembros inferiores y superiores, artritis de muñecas tras cuadro infeccioso | CK 22.857UI/L | Afectación pulmonar intersticial | CorticoterapiaMetotrexatoMicofenolatoCiclosporinaInfliximabIGIV IV (1g/kg) | Recidiva con nueva infecciónAlteración movilidad grave | |
| Mujer, 11 años, afroamericana | Debilidad proximal de miembros, artritis y Raynaud tras infección respiratoria viral | CK 33.000UI/L | DisfagiaHipertrofia VI | CorticoterapiaMetotrexatoMicofenolatoCiclosporinaInfliximabAzatioprinaIGIV (1g/kg) | Alteración movilidad leve | |
| Takada et al., 2009 | Mujer, 17 años, asiática | Rash cutáneo | CK 6.543UI/L | - | CorticoterapiaCiclosporina | Mejoría clínica |
| Suzuki et al., 2011 (2 casos) | Mujer, 5 años, asiática | Caídas frecuentesDebilidad muscular proximal en miembros y atrofia muscular | CK 4.629UI/L | - | Corticoterapia | Alteración motilidad grave |
| Mujer, 9 años, asiática | Siete meses de debilidad de miembros y tronco, caídas frecuentes | CK 2.467UI/L | - | CorticoterapiaMetotrexatoCiclofosfamidaTacrolimus | Alteración motilidad grave | |
| Kawabata et al., 2012 | Mujer, 15 años, asiática | Elevación asintomática de CK tras proceso infeccioso. Al mes, debilidad proximal miembros y astenia progresiva | CK 20.375UI/LAldolasa 236UI/L | Disfagia | CorticoterapiaCiclofosfamidaAzatioprinaPlasmaféresis | Alteración motilidad leve |
| Luca et al., 2012 | Mujer, 12 años | Un mes de debilidad proximal, alopecia, disfagia y fenómeno de Raynaud | CK 8.825UI/L | Afectación pulmonar | CorticoterapiaMetotrexatoAzatioprinaIGIVRituximabLeflunomida | Marcada mejoría |
| Rider et al., 2013 (6 casos) | 4 mujeres, 2 varones 11,6-16,1 años | Dos curso insidioso, uno lento y 3 inicio agudo de debilidad muscular | CK 9.111-22.857UI/L | Disfagia 50%Afectación pulmonar 83%-Afectación cardiaca 50%-Afectación cutánea 66% | - | - |
| Monomura et al., 2014 | Mujer, 15 años, asiática | Debilidad MMSS tras proceso infeccioso, posteriormente debilidad MMII y astenia | CK 20.375IU/LAldolasa 263IU/L | Disfagia | CorticoterapiaPlasmaféresisCiclofosfamidaAzatioprina | Marcada mejoría al año. Puede hacer footing |
| Suzuki et al., 2015 (5 casos) | 8 pacientes | - | - | - | - | - |
| Kobayashi et al., 2016 | Mujer, 8 años, asiática | Debilidad y dolor muscular de 2 años de evoluciónAvance agudo tras infección por influenza | CK 5.896IU/LAldolasa 63,9IU/L | - | CorticoterapiaMetotrexatoIGIVTacrolimus | Mejoría de la debilidad |
| Zao et al., 2017 (3 casos) | Mujer, 4 años | Debilidad MMII y MMSS de 6 meses de evolución. Mialgias | CK 4.020IU/L | - | IGIV (0,4mg/kg)Corticoterapia | Tras 12 meses bipedestación sin ayudaMarcada mejoría |
| Mujer, 11 años | Debilidad proximal MMSS y MMII, evolución rápida de 2 meses | CK 4.660UI/L | - | IGIV (0,4mg/kg)Corticoterapia | A los 18 meses marcha sin asistencia, marcada mejoría | |
| Mujer, 12 años | Debilidad MMII de 2 años con rápida evolución a MMSS | CK 13.265UI/L | Disfagia | IGIV (0,4mg/kg)Corticoterapia | Marcada mejoría | |
| Binns et al., 2017 (3 casos) | Mujer, 14 años | 4 meses de debilidad proximal, edemas tobillos, mialgias y cefalea | CK 23.111UI/L | DisfagiaAfectación pulmonar | CorticoterapiaMetotrexatoRituximabIGIV (2g/kg) | Neumonitis CMVMarcada mejoría |
| Mujer, 13 | Cuatro semanas de debilidad proximal, edemas párpados, mialgias y disnea | CK 25.937UI/L | Afectación pulmonar | CorticoterapiaMetotrexatoRituximabCiclofosfamidaIGIV (2g/kg) | Marcada mejoría | |
| Mujer, 11 | Una semana de debilidad proximal, mialgias y artralgias tras infección respiratoria | CK 19.808UI/L | Afectación pulmonarBroncoaspiración | CorticoterapiaMetotrexatoRituximabCiclofosfamidaIGIV (2g/kg) | Marcada mejoría | |
| Kishi et al., 2017 (8 casos) | 10,7-16 años | - | - | - | - | - |
| Yi et al., 2021 | Mujer, 8 años, asiática | Debilidad muscular aguda | CK 28.819UI/L | Disfagia | CorticoterapiaRituximab | Marcada mejoría |
| Della Marina et al., 2021 | Mujer, 8 años | Debilidad muscular 8 meses de evolución | CK 10.710UI/LAldolasa 127 UI/L | DisfagiaAfectación pulmonar | CorticoterapiaMetotrexatoIGIV (2g/kg)Rituximab | Mejoría pero mantenía Gower positivo y dificultad para subir escalerasIsquemia avascular fémur |
| Toledo del Castillo et al., 2024 | Mujer, 10 años, caucásica | Tres meses de debilidad muscular proximal de miembros y tronco | CK 11.426UI/LAldolasa 94,2UI/L | Disfagia | CorticoterapiaMetotrexatoRituximabIGIV | Marcada mejoría |
CK: creatina cinasa; CMV: citomegalovirus; IGIV: inmunoglobulina intravenosa; MMII: miembros inferiores; MMSS: miembros superiores; VI: ventrículo izquierdo.
Es importante diferenciar esta entidad de otras miopatías inflamatorias idiopáticas en la edad pediátrica debido a su escasa respuesta a tratamientos convencionales, con afectación sistémica que puede conllevar una importante morbimortalidad con recaídas frecuentes. Debe sospecharse ante una debilidad proximal importante con ausencia o mínimas lesiones cutáneas y valores de CK por encima de 10.000UI/L (20-50 veces por encima de los valores normales)1.
Los casos publicados en la literatura coinciden en la escasa respuesta a metotrexato/ciclofosfamida asociados a corticoides. Los artículos más recientes muestran mejores resultados con el tratamiento pautado mensual con inmunoglobulina intravenosa 1-2g/kg, asociado a corticoides y metotrexato, además de rituximab y fisioterapia intensiva. El uso de fármacos anticélulas B, principalmente rituximab, está mostrando buenos resultados en pacientes adultos con esta enfermedad, recomendándose en la literatura actual como parte de una terapia precoz intensiva en esta afección2–5. Otros fármacos que han sido empleados en la literatura son azatioprina, micofenolato de mofetilo, tacrolimus, ciclosporina y abatacept, aunque con evidencia limitada2.
El pronóstico de esta enfermedad es peor en edades tempranas, existiendo una rápida sustitución de las fibras musculares afectadas por grasa, por lo que terapias iniciales intensivas parecen ser la mejor opción para evitar la discapacidad3.
En conclusión, se debe sospechar una miositis necrosante ante una paciente con debilidad muscular proximal de rápida evolución con elevación significativa de CK para realizar un diagnóstico precoz e instaurar un tratamiento intensivo desde fases iniciales dada la refractariedad a los tratamientos habituales y el mal pronóstico al comenzar en edades tempranas. La realización de resonancia magnética, y sobre todo la biopsia muscular, en casos graves y refractarios, son útiles no solo para la orientación diagnóstica, sino también por su valor pronóstico.
Presentación previa en congresos: García L, Toledo B, Rodríguez FJ, Nieto JC, Trives L, Vila S, et al. Miositis inflamatoria, anticuerpos que marcan el pronóstico (segundo premio a los mejores casos clínicos). Comunicación oral en el 68.o Congreso de la AEP, celebrado en Palma de Mallorca del 2 al 4 de junio de 2022.