El objetivo de este documento es revisar las recomendaciones actuales en el manejo del hijo de madre con patología autoinmune tiroidea. En este 2017 se ha publicado la guía de la Asociación Americana de Tiroides para el diagnóstico y manejo de la enfermedad tiroidea durante el embarazo y el posparto. En dicha guía se establecen 97 recomendaciones y se propone un algoritmo de diagnóstico y tratamiento del hipotiroidismo gestacional. También en este último año se ha publicado una amplia revisión sobre el abordaje fetal y neonatal del hijo de madre con enfermedad de Graves. Se insiste en la trascendencia de la determinación de anticuerpos maternos frente al receptor de TSH en la segunda mitad del embarazo para estratificar adecuadamente el riesgo en el neonato.
The objective of this document is to review the current recommendations in the management of the foetus and the newborn child born to mothers with autoimmune thyroid disease. In 2017, the American Thyroid Association published guidelines for the diagnosis and management of thyroid disease during pregnancy and post-partum. In this guide, 97 recommendations were made, and an algorithm for the diagnosis and treatment of gestational hypothyroidism was proposed. Also, in this last year, a wide review was been published on the foetal and neonatal approach of the child of a mother with Graves’ disease. The importance of the determination of maternal antibodies against thyrotropin receptor in the second half of pregnancy is stressed, in order to adequately stratify the risk in the neonate.
En los últimos años se ha producido un avance notable en el conocimiento de los trastornos tiroideos en la gestación, lo que ha llevado a la publicación reciente de guías para la práctica clínica por parte de la Asociación Americana de Tiroides (ATA)1, Asociación Europea de Tiroides (ETA)2 y de la Sociedad Española de Endocrinología y Nutrición (SEEN)3. Desde el año 2012, la ATA y la ETA, así como el grupo de trabajo de Trastornos por deficiencia de yodo y disfunción tiroidea de la SEEN recomiendan el cribado de disfunción tiroidea en la práctica totalidad de las embarazadas1-3. Esta recomendación ha producido un aumento de la detección de alteraciones de la función tiroidea en el embarazo, lo que conlleva un incremento de los tratamientos y seguimientos en las gestantes y sus recién nacidos.
El desarrollo de la función tiroidea fetal requiere de una correcta evolución de la embriogénesis y diferenciación y maduración de la glándula tiroides, así como de la integridad del eje hipotálamo-hipofisario-tiroideo y de los sistemas que controlan el metabolismo de la hormona tiroidea. A su vez, la adecuación de todos estos procesos va a depender de múltiples factores fetales y maternos, siendo determinante la función y autoinmunidad tiroideas materna, así como la ingesta materna de yodo.
A lo largo de la gestación, la tiroxina (T4) transferida de la madre protegerá el cerebro fetal. Ya en el inicio del embarazo está presente en los fluidos embrionarios y posteriormente, mediada la gestación y ya establecida la secreción tiroidea fetal, su transferencia al feto continuará contribuyendo en el desarrollo neurológico4-6.
En áreas con deficiencia de yodo grave, las mujeres no tendrán reservas suficientes de yodo y estarán hipotiroxinémicas ya en la crítica primera etapa del neurodesarrollo fetal. Las mujeres con ingesta adecuada de yodo, antes y durante el embarazo, tendrán depósitos intratiroideos suficientes adaptándose sin problema a los requerimientos de la gestación. Asegurar el aporte suficiente de yodo en la gestante es una prioridad a pesar de que en un pequeño porcentaje de mujeres el uso de suplementos yodados se ha asociado con una activación de la autoinmunidad tiroidea. En la actualidad se recomienda la ingesta de 250μg diarios de yodo en todas las embrazadas, exceptuando las hipertiroideas o las tratadas con levotiroxina7.
Al hablar de autoinmunidad tiroidea materna nos referimos a la detección de anticuerpos antitiroideos en la embarazada. En mujeres en edad reproductiva la prevalencia de anticuerpos contra la peroxidasa tiroidea (TPO-Ab) y/o tiroglobulina (Tg-Ab) alcanza un 8-14% según las series. Su presencia en la gestante se ha asociado con un mayor riesgo de desarrollar hipotiroidismo materno durante el embarazo4,8-10. Se han publicado múltiples estudios y la posible repercusión en la función tiroidea en el feto y en el recién nacido. Tanto los anticuerpos Tg-Ab como los TPO-Ab de tipo IgG pueden atravesar libremente la barrera placentaria, lo que explica que más del 95% de los recién nacidos hijos de madre con tiroiditis autoinmune de Hashimoto presenten anticuerpos circulantes10.
La prevalencia de hipertiroidismo materno por enfermedad de Graves en el embarazo es mucho menor, situándose en el 0,1-2,7%. Los anticuerpos estimulantes del receptor de TSH de larga duración (anticuerpos anti-TSHR o TRAb) causantes de esta enfermedad atraviesan libremente la placenta en la segunda mitad de la gestación, pudiendo causar enfermedad de Graves neonatal transitoria hasta en un 2-20% en estudios de cohortes.
Hijo de madre con tiroiditis autoinmune de HashimotoLa patología tiroidea más prevalente en mujeres en edad fértil es la tiroiditis autoinmune de Hashimoto, que es del 2,5%.
Consecuencias maternas y fetalesLa presencia de TPO-Ab y/o Tg-Ab durante el embarazo se ha asociado de forma independiente con resultados de baja fertilidad, aborto recurrente, parto prematuro, o diabetes gestacional11-13. Algunos autores han referido un peor neurodesarrollo14, hipoacusia y TDAH en los nacidos de madres con anticuerpos positivos15-20. Estas alteraciones podrían estar mediadas directamente por la autoinmunidad aun sin la presencia concomitante de un hipotiroidismo materno, aunque el mecanismo fisiopatogénico no estaría claramente definido.
En los últimos años se han intentado establecer protocolos de cribado de función y autoinmunidad tiroideas para así asegurar su normalidad desde las primeras etapas de la gestación. Establecer los valores normales de función tiroidea en el embarazo es un reto debido a la multitud de cambios adaptativos durante esta etapa de la vida. En las primeras 10 semanas la TSH disminuye por el aumento de la βHCG (efecto tirotrópico) y de la deiodinasa tipo 3 placentaria; posteriormente, al caer la βHCG, la TSH aumentará, al tiempo que disminuye la FT4.
En las últimas guías, se recomienda el cribado precoz de función tiroidea en el embarazo, siendo la determinación de TSH la prueba inicial a realizar. El tratamiento con levotiroxina estará definido por cifras de TSH iguales o superiores a 10mUI/l o por la asociación de valores de TSH de entre 2,5-10mUI/l con T4L bajas. El hipotiroidismo subclínico gestacional se considerará con cifras de TSH por encima del límite superior de referencia para el trimestre específico del embarazo. En este sentido se recomienda establecer percentiles poblacionales propios por trimestres de gestación, considerando para su determinación exclusivamente embarazadas con adecuada ingesta de yodo y con TPO-Ab negativos1-4,21,22. De no disponer de percentiles propios se considera adecuado establecer el límite superior para TSH en el embarazo en 4mUI/l1. A la hora de establecer cuáles son los valores bajos de T4 en la embarazada, muchos autores consideran adecuado el uso de T4 total (T4T) ante la mayor variabilidad de la T4L. Así, la Asociación Europea de Tiroides recomienda que el rango de referencia de T4T en el embarazo sea el resultado de multiplicar las cifras referentes para población general por 1,5 (se determina que los valores normales de T4T en la gestación son un 50% mayores)2.
Consecuencias neonatalesEn un pequeño porcentaje de embarazadas con tiroiditis autoinmune de Hashimoto existirán anticuerpos bloqueantes y, más raramente, estimulantes del receptor de la TSH. Estos anticuerpos se consideraban causa de hipotiroidismo congénito transitorio. Sin embargo, estudios recientes demuestran que los TPO-Ab y los Tg-Ab no parecen ser bloqueantes para la glándula tiroidea del niño23-25.
Se describe que alrededor de un 25% de los neonatos mostrarán un leve aumento del valor de TSH o incluso un hipotiroidismo subclínico. Concretamente, más de un 75% al 3.er día de vida presenta cifras de leve hipertirotropinemia (TSH<15μUI/ml) que desaparece en pocos días o semanas (>70% lo normalizan poco antes del mes de vida); la mayoría de estos pacientes evolucionan hacia una normalización espontánea23,24,26,27. Es excepcional (un caso descrito en la literatura) la aparición de hipertiroidismo en el recién nacido por anticuerpos estimuladores del tiroides presentes en la madre afecta de Hashimoto. Por lo tanto, no parece que la función tiroidea del feto ni del recién nacido pueda verse comprometida permanentemente ante la presencia de anticuerpos antitiroideos.
Manejo del recién nacido hijo de madre con tiroiditis de HashimotoDurante los últimos años se han publicado estudios en los cuales se recomendaba el seguimiento de estos niños con protocolos en los que se precisaban múltiples muestras de sangre y varias visitas al hospital28. El beneficio de este tipo de seguimiento es difícil de justificar en la actualidad y según nuestra experiencia y la revisión de los estudios recientes no estaría justificado23-27.
En hijos de madres con tiroiditis de Hashimoto, el cribado de hipotiroidismo congénito neonatal a las 48h de vida es una prueba suficiente y no invasiva para asegurar la normalidad de la función tiroidea neonatal.
La presencia de hipotiroidismo en la embarazada no debe implicar un abordaje diferente en el cribado de la función tiroidea del recién nacido.
Hijo de madre con enfermedad de Graves-BasedowLos hijos de gestantes con enfermedad de Graves están expuestos a presentar una morbimortalidad significativa, y precisan un protocolo de identificación y manejo apropiado28. En las últimas revisiones y guías de sociedades científicas más recientes, se hacen sugerencias sobre el abordaje de este problema, ya que reconocen que la falta de consenso o evidencia no permite hacer recomendaciones expresas29.
Los anticuerpos causantes de enfermedad de Graves son anticuerpos estimulantes del receptor de TSH de larga duración (anti-TSHR o TRAb), son inmunoglobulinas de clase G, capaces de cruzar libremente la placenta en la segunda mitad de la gestación2,29, habiendo:
- -
Anticuerpos estimulantes del receptor de la TSH, que se unen al receptor de las células foliculares y producen secreción autónoma de hormonas tiroideas.
- -
Anticuerpos bloqueantes del receptor de la TSH, que se unen al receptor de la TSH pero no inician la cascada de señales intranucleares.
Actualmente hay dos métodos para medir los niveles de TRAb. Los métodos de segunda generación miden las inmunoglobulinas y no distinguen entre anticuerpos estimulantes del receptor de la TSH o bloqueantes, pero son comunes y baratos. Los de tercera generación, que están menos disponibles, son más laboriosos y caros, los cuales sí distinguen entre anticuerpos bloqueantes y estimulantes. Estos se correlacionan bien con el riesgo de hipertiroidismo neonatal29.
Una madre afecta, o con antecedentes de enfermedad de Graves ya tratada, puede tener un niño sano, con hipertiroidismo fetal y/o neonatal, o con hipotiroidismo30. La coexistencia de anticuerpos bloqueantes y estimulantes también puede retrasar el inicio del hipertiroidismo30-33.
Los niveles de TRAb en una mujer con enfermedad de Graves pueden persistir elevados durante años después de su curación, sea mediante tiroidectomía, antitiroideos o yodo radiactivo. Se deben medir entre las semanas 20 y 24 de gestación6; si son negativos, se puede considerar al recién nacido de bajo riesgo, pero si son positivos el neonato se debe considerar de alto riesgo2,29,34
Consecuencias fetalesHipertiroidismo fetalSuele aparecer en el 3.er trimestre de la gestación. Sus signos y síntomas son taquicardia, insuficiencia cardiaca, hidrops no inmune, bocio, retraso de crecimiento intrauterino, parto prematuro, avance en la maduración esquelética y craneosinostosis. En estos casos sintomáticos se puede tratar la gestante con fármacos antitiroideos2,32.
Riesgo de malformaciones congénitas: secundarias al tratamiento con antitiroideos- •
Metimazol (MMI)/carbimazol: pueden producir aplasia cutis, embriopatía con facies dismórfica, atresia de coanas, atresia esofágica, defectos de la pared abdominal, umbilicocele, alteraciones del tracto urinario, defectos ventriculares septales, especialmente si han estado expuestos en el 1.er trimestre de la gestación2,33.
- •
El propiltiuracilo (PTU), además de hepatotoxicidad para la madre, puede producir malformaciones congénitas menores, como quistes en cara y cuello, anomalías del tracto urinario2,33,35.
- •
La ATA recomienda que si la mujer con enfermedad de Graves estaba estable al comienzo del embarazo, se intente suspender el tratamiento durante el 1.er trimestre. Si no fuera posible, es mejor utilizar PTU en este periodo y, dado su riesgo de fallo hepático, cambiar a MMl en los trimestres 2.o y 3.o de gestación2,33. El feto es más sensible a los antitiroideos que la madre, por lo que hay que administrar la mínima dosis necesaria para mantener las hormonas tiroideas maternas ligeramente por encima del rango normal2,6. Las mujeres con hipertiroidismo necesitan un estrecho seguimiento endocrinológico, incluir niveles de TRAb, y control ecográfico del tiroides fetal en el 3.er trimestre2,29.
- •
El PTU y el MMl se secretan en la leche materna a niveles muy bajos, no afectan el tiroides del neonato, y son fármacos seguros durante la lactancia2.
Los síntomas y signos de enfermedad de Graves neonatal son muy variados y pueden durar 3-4 meses o más. Los recién nacidos pueden tener bocio, compresión traqueal, bajo peso, edema periorbital, retracción palpebral, hipertermia, diarrea, irritabilidad, piel roja y caliente, dificultad para la alimentación, curva de peso plana, taquicardia, insuficiencia cardiaca, hipertensión, esplenomegalia, colestasis, trombocitopenia e hiperviscosidad. Estos síntomas son poco específicos, y pueden confundirse con infección connatal o sepsis. Si no se identifica y maneja adecuadamente, puede llegar a tener una mortalidad del 20%2,29,34.
Las complicaciones neonatales son mayores si la madre sigue hipertiroidea en la segunda mitad del embarazo, pues para el desarrollo del sistema nervioso central del feto es esencial que los niveles de hormonas tiroideas permanezcan normales. Si los hijos de madres con enfermedad de Graves están eutiroideos al nacimiento, su inteligencia es normal habitualmente, pero si, por el contrario, habían tenido hipertiroidismo neonatal, su neurodesarrollo puede estar afectado33.
Hipotiroidismo neonatalLos signos de hipotiroidismo también pueden darse en los nacidos de madres con enfermedad de Graves32,36.
- -
Hipotiroidismo central transitorio. Si la madre en el embarazo padece un hipertiroidismo mal controlado, los niveles altos de hormonas tiroideas impiden el normal crecimiento y maduración de la glándula tiroidea fetal y del eje hipotálamo-hipofisario- tiroideo. Esta situación es transitoria y mejora normalmente en 3-19 meses31,33.
- -
Hipotiroidismo primario o hipertirotropinemia transitorios:
En el nacimiento podemos encontrar un hipertiroidismo franco, pero lo más habitual es que su presentación se retrase.
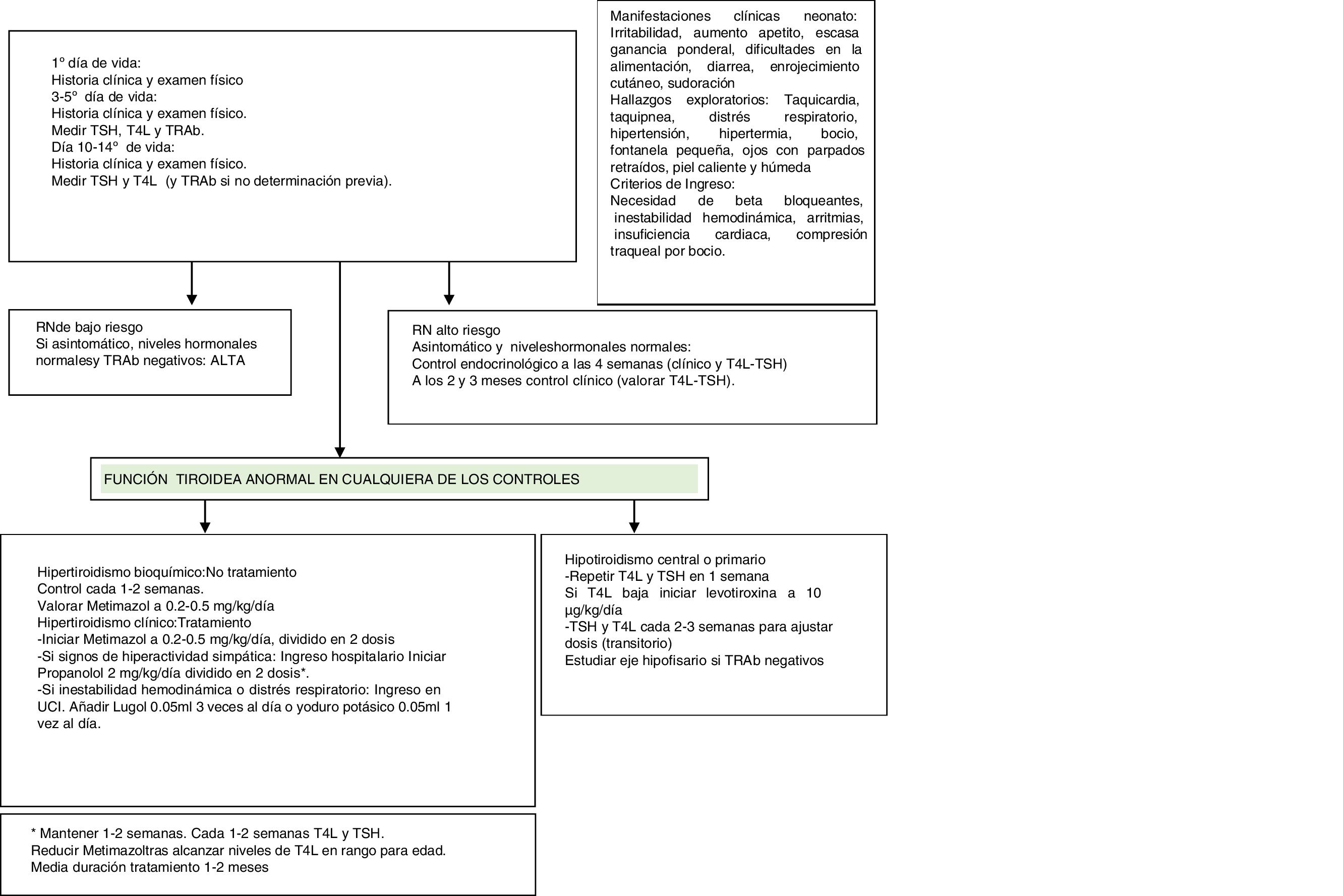
Actitud ante el recién nacido de madre con enfermedad de Graves o hipertiroidismo (actual o pasado).
Embarazada: medir niveles de TRAb en el 2.o-3.er trimestre. Informar al neonatólogo.
Si los TRAb son positivos o desconocidos: RN de alto riesgo.
Si los TRAb son negativos: RN de bajo riesgo.
Recién nacido: determinar TRAb en sangre de cordón (no útil tiroideas) y control.
La presencia de TRAb en sangre de cordón se correlaciona estrechamente con el riesgo de desarrollar un hipertiroidismo neonatal en las siguientes 2 semanas36. Sin embargo, los niveles de TSH y T4L en sangre de cordón no tienen valor predictivo sobre el riesgo de hipertiroidismo neonatal, ya que simplemente reflejan la situación tiroidea fetal:
- •
Neonato de bajo riesgo: habitualmente no necesitan seguimiento después de las 2 semanas de vida (una vez comprobado que están sanos y la función tiroidea es normal)29.
- •
Neonato de alto riesgo: en los niños cuyas madres no tomaban antitiroideos el diagnóstico se suele hacer entre el 1.er y 3.er día de vida, mientras que entre los hijos de las que sí tomaban, el hipertiroidismo aparece entre el 5.o y 15.o día (la duración del MMI es de 3 días, mientras que la del PTU es de 24h)2,29,32. El 95% de los niños que desarrollan hipertiroidismo neonatal lo hacen durante el primer mes de vida (sobre todo en las 2 primeras semanas).
En el recién nacido, la T4L y la TSH se deben medir entre los días 3-5.o de vida (o antes si hay sintomatología) y repetir entre los días 10-14.o (utilizar valores de referencia específicos por edades). Si no hay anomalías tras la 2.a semana de vida, puede bastar el control clínico a las 4 semanas, 2.o y 3.er mes (y opcionalmente también analítico), para identificar posibles comienzos tardíos29.
Indicaciones de comenzar el tratamiento en el neonato- •
Hipertiroidismo solo bioquímico: en una proporción significativa de recién nacidos de riesgo se encuentra sin síntomas. No hay consenso sobre si deben tratarse, pero se recomienda hacerles un estrecho seguimiento. Hay autores que proponen iniciar el tratamiento si la T4L es >35pmol/l entre los 2-14 días, para prevenir el hipertiroidismo neonatal. Otros consideran que no se deben tratar los asintomáticos con T4L entre 43 y 154pmol/l (solo tratar si hay sintomatología o bocio)2,29,36.
- •
Hipertiroidismo bioquímico con sintomatología clínica: sí hay consenso de tratarlo cuando comienza la sintomatología, para evitar la insuficiencia cardiaca y secuelas a largo plazo, como discapacidad intelectual2,29,34.
- -
Tanto MMI como PTU inhiben la peroxidasa tiroidea y por tanto la síntesis de hormonas tiroideas. El PTU además inhibe la desiodación periférica de T4 a T3, pero por el riesgo de producir fallo hepático, su uso debe restringirse a tratamientos cortos durante las tormentas tiroideas, en caso de intolerancia al MMI o secuelas graves como la agranulocitosis2,33,38. Los efectos clínicos y bioquímicos de los antitiroideos tardan unos días, hasta que se agotan los depósitos de hormonas tiroideas. Administrar MMI cuando comienzan los síntomas clínicos en el contexto de hipertiroidismo bioquímico, con dosis de 0,2 a 0,5mg/kg/día, en 2-3 dosis, hasta un máximo de 1mg/kg/día29.
- -
Realizar controles analíticos semanales hasta que se estabiliza y cada 1-2 semanas.
- -
Si hay hiperactividad simpática (taquicardia, hipertensión, ICC o dificultad para alimentarse) añadir durante 1-2 semanas propranolol a 2mg/kg/día en 2 dosis. Estos niños deben ingresar en el hospital para su monitorización29.
- -
En casos graves o refractarios se debe añadir yoduro potásico en solución de Lugol. La primera dosis se debe administrar una hora después de la primera dosis de MMI, para evitar que se use este yodo en la síntesis de más hormonas tiroideas (una gota de solución de Lugol [0,05ml] cada 8h o una gota al día de yoduro potásico en solución).
- -
Si hay inestabilidad hemodinámica, distrés respiratorio o fallo cardiaco se debe añadir un ciclo corto de glucocorticoides orales, que inhiben la síntesis de hormona tiroidea y la deionidación periférica de T4 a T3 (prednisolona a 2mg/kg/día en 2 dosis)29.
Los efectos secundarios del MMI se observan en el 28% de los niños; la mayoría son leves, como discreta elevación de las enzimas hepáticas, leucopenia transitoria, síntomas gastrointestinales, rush cutáneo, artralgias o mialgias. En el 0,5% pueden aparecer problemas graves, como agranulocitosis, síndrome de Stevens Johnson, daño hepático o vasculitis38.
Duración del tratamiento en hipertiroidismo neonatalEl hipertiroidismo neonatal es autolimitado ya que dura lo que tardan en aclararse los anticuerpos circulantes, cuya vida media es de 12 días. A los 6 meses se han normalizado casi todos, habiendo casos de persistencia hasta de 12 meses. La duración del tratamiento habitual es de entre 1-2 meses. La dosis se debe ir reduciendo en proporción a los niveles de T4L. La decisión de suspender el tratamiento se toma considerando a la vez la situación clínica y los niveles de T4L29.
Manejo clínico del recién nacido con hipotiroidismo neonatalEstos casos habitualmente se diagnostican entre los días 4-30.o de vida31,33. Debe iniciarse tratamiento con levotiroxina a 10μg/kg/día, con controles cada 2-4 semanas para ir bajando la dosis.
Habitualmente mejora poco a poco entre los 3 y 19 meses de edad, aunque muchos autores prefieren esperar hasta los 3 años para intentar retirar el tratamiento2,29.
Recomendaciones finales (tabla 1)
Recomendaciones
| • Un porcentaje alto de la población de las mujeres embarazadas presenta enfermedad tiroidea autoinmune, por lo que es aconsejable preguntar a la madre o pedir informes previos sobre su diagnóstico |
| • Los TPO-Ab y los Tg-Ab no parecen ser bloqueantes para la glándula tiroidea del niño. Los nacidos de madres con anticuerpos antitiroideos con hipotiroidismo tratados con tiroxina no necesitan una evaluación tiroidea diferente al cribado neonatal |
| • En hijos de madres con tiroiditis de Hashimoto, el cribado de hipotiroidismo congénito neonatal a las 48h de vida es una prueba suficiente y no invasiva para asegurar la normalidad de la función tiroidea neonatal. Por ello, la presencia de hipotiroidismo en la embarazada no debe implicar un abordaje diferente en el cribado de función tiroidea del recién nacido |
| • Los hijos de mujeres con enfermedad de Graves, presente o pasada, tienen riesgo de desarrollar hipertiroidismo fetal o neonatal de serias consecuencias para su salud. También pueden presentar hipotiroidismo transitorio o malformaciones congénitas secundarias a la medicación materna. Tanto estas gestantes como sus hijos en los primeros meses de vida necesitan un seguimiento cuidadoso. La determinación de TRAb en la gestación o en sangre de cordón es muy útil para discriminar los recién nacidos de alto o bajo riesgo de desarrollar hipertiroidismo |
| • Está indicado el seguimiento de los hijos de madre con enfermedad de Graves, pasada o activa, con o sin tratamiento, especialmente si tiene anticuerpos persistentes |
| • Se debe iniciar y apoyar la lactancia materna en todos los recién nacidos de madre con patología autoinmune, incluso si su madre está tomando MMI, PTU o tiroxina. La única contraindicación sería el tratamiento con yodo radioactivo durante la lactancia |
Los autores declaran no tener ningún conflicto de intereses