El ictus arterial isquémico infantil es una patología mucho menos conocida que en adultos debido a su menor frecuencia y a su diferente etiología. Sin embargo, es también una patología grave con una alta incidencia de secuelas severas y perennes, que sobrepasan el 50% de los casos.
El manejo agudo del ictus arterial isquémico pediátrico posnatal (IAIPP) ha cambiado drásticamente en los últimos años, fundamentalmente en lo referente a los tratamientos de recanalización (trombólisis y terapias endovasculares). Estos tratamientos, que antes no se recomendaban en la edad infantil, se están afianzando cada vez más en la práctica diaria. Aunque los estudios realizados en niños no tienen un grado de evidencia alto por ser retrospectivos y porque el número de casos es bajo, soportan la idea de que dichos tratamientos son igual de seguros y eficaces que en los adultos siempre que se realicen con unos criterios de inclusión y exclusión determinados y dentro de un tiempo determinado desde el inicio de los síntomas (ventana terapéutica).
En este artículo se revisa, a la luz de los conocimientos actuales, el manejo agudo del IAIPP.
Debido a que la eficacia de estos tratamientos está íntimamente ligada al inicio precoz de los mismos, es necesaria la existencia de un código ictus infantil como ampliación del código ictus que se aplica a los adultos. Ha empezado a implantarse en España desde el año 2019 aunque todavía hay importantes zonas del país donde aún no se aplica.
In children, arterial ischemic stroke is a much less understood disease compared to in adults due to its lower frequency and different aetiology. However, it is also a serious disease, with a high incidence of severe and permanent sequelae that exceeds 50% of total cases.
The acute management of postnatal arterial ischaemic stroke (MNAIS) has changed drastically in recent years, chiefly on account of recanalization treatments (thrombolysis and endovascular therapies). These treatments, which used to not be recommended in childhood, are increasingly implemented in everyday clinical practice. Although the evidence from studies carried out in children is not of high quality due to their retrospective design and the small number of reported cases, they support the hypothesis that these treatments are as safe and effective as they are in adults as long as appropriate eligibility criteria are applied and they are used within a certain time from the onset of symptoms (therapeutic window).
This article reviews the MNAIS based on the current scientific evidence.
Since the efficacy of these treatments is highly dependent on their early initiation, a paediatric stroke code needs to be in place as an extension of the stroke code applied to adults. It has started to be introduced in Spain since 2019, although there are still large areas of the country where it has yet to be applied.
La incidencia del ictus en la infancia es menor que el ictus en adultos (2-13 casos/100.000/año frente a 150-200 casos/100.000/año)1. La del ictus arterial isquémico pediátrico posnatal (IAIPP) en menores de 16 años es de 1,60 casos/100.000/año2.
Sin embargo, no debe considerarse una enfermedad rara y sus efectos a menudo son devastadores: es una de las 10 primeras causas de muerte en la infancia, las secuelas neurológicas permanentes oscilan en torno al 50-60% en los ictus isquémicos y 33-50% en los hemorrágicos y conlleva una alta carga social y económica, mayor que en los adultos dada su mayor esperanza de vida1.
Sus etiologías son variadas y diferentes a la de los adultos (tabla 1), aunque en los adolescentes el consumo de drogas y tabaco puede influir en su aparición.
Etiologías más frecuentes del ictus arterial isquémico posnatal
| Cardiopatías congénitas o adquiridas | Los ictus suelen ser de origen cardioembólico. Son frecuentes poscirugía y en niños que usan dispositivos de asistencia ventricular o en el transcurso de infecciones |
| Arteriopatía cerebral focal (ACF) | Estenosis arterial segmentaria del territorio anterior que comúnmente afecta a la arteria carótida distal, la arteria cerebral media (ACM) proximal o la arteria cerebral anterior (ACA)Se subdivide en ACF inflamatoria (AC-i), ACF-disección (ACF-d) y ACF indeterminada. Probablemente los dos primeros subgrupos representan un continuum de una misma entidad |
| Enfermedad y síndrome de moyamoya | Estenosis u oclusión bilateral de la porción supraclinoidea de la arteria carótida interna o de los segmentos A1 de la ACA o M1 de la ACM clásicamente de forma bilateral (aunque puede no haberse desarrollado la bilateralidad cuando el niño tiene el ictus), existiendo una circulación colateral anómala de la base del cerebro en la vecindad de las lesiones oclusivas o estenóticas con apariencia angiográfica típica que recuerda al humo de un cigarrillo –en japonés moyamoya–. Puede ser aislada (a veces genéticamente determinada), o secundaria, que puede presentarse en diversas entidades (neurofibromatosis, drepanocitosis, tras radioterapia o en síndrome de Down) |
| Disección arterial | Se produce por un desgarro de la pared vascular que permite la entrada de sangre entre las capas íntima y media de la pared arterial, disecándolas y formando un hematoma intramural, estrechando la luz del vaso y reduciendo el flujo sanguíneo. Se divide en cervical (carotídea o vertebral) e intracraneal. Puede producirse tras un traumatismo (muchas veces aparentemente banal), pero otras veces aparece de forma espontánea. El riesgo aumenta en niños con colagenopatías o elastinopatías (Marfan, síndrome de Loeys-Dietz y síndrome de tortuosidad arterial) |
| Drepanocitosis | El principal mecanismo del ictus es la adherencia de los eritrocitos al endotelio vascular y hemólisis, causando agregación plaquetaria, aumento del tono y trombosisPueden producir infartos clínicos o silentes, hemorragia cerebral y síndrome de moyamoya |
| Otras enfermedades de origen genético | Factores trombofilia (en general son factores favorecedores más que patogénicos por sí mismos)Enfermedades metabólicas: acidurias orgánicas, enfermedades mitocondriales (melas)Mutaciones ACTA 2Mutación NOTCH 3 (CADASIL)Mutación ABCC6 (pseudoxantoma elástico)Mutación COL4A y enfermedades relacionadasMutación JAG1 (síndrome Alagille)Mutación ATP7A (E Menkes)Mutación SLC2A10 (síndrome arterial tortuosidad)Mutación GLA (E Fabry)Mutación ELN (S Williams)Mutación NF1 (neurofibromatosis)Mutación TSC1 y TSC 2 (esclerosis tuberosa)Displasia fibromuscularSíndrome de PhacesOtras mutaciones genéticas específicas |
En los últimos 20 años el pronóstico del ictus del adulto, especialmente el ictus arterial isquémico, ha mejorado sustancialmente debido a la instauración de los tratamientos de recanalización, de la creación del código ictus y unidades de ictus. Pero estos tratamientos se están aplicando en niños desde hace muy poco tiempo y el código ictus pediátrico solo se ha iniciado en España (Madrid) hace 3 años3.
Es por ello por lo que nos ha parecido útil revisar y actualizar en este artículo el tratamiento del IAIPP.
Fisiopatología del ictus isquémico arterialCuando se produce una obstrucción en una arteria cerebral se produce un descenso del flujo sanguíneo cerebral, con disminución de ATP, oxígeno y glucosa. Esto provoca una disminución de la producción de energía y la aparición de una cascada de sucesos (cascada metabólica) con alteración de la bomba Na+/K+ATPasa, acumulación de neurotransmisores y otras aminas, aumento tóxico de radicales libres, calcio, agua e hidrogeniones. Además, se produce una significativa respuesta inflamatoria. Todo ello lleva a la muerte celular. En la zona directamente afectada por la obstrucción vascular o zona core dicha muerte celular se produce en muy poco tiempo y es prácticamente irreversible. En la zona cerebral adyacente o zona de penumbra, las células inicialmente están intactas pero si no se restablece dicho flujo en las horas siguientes sufrirán las consecuencias de la cascada metabólica descrita1.
Evaluación y medidas iniciales del ictus arterial isquémico pediátrico posnatal (IAIPP)Cuando un niño con sospecha de ictus llega a urgencias hay que:
- -
Realizar una sucinta historia que destaque la hora en que comenzó la sintomatología y el grado de discapacidad previo. Para su determinación se utiliza la escala de Rankin modificada (tabla 2). Dicha escala da una puntuación que oscila entre 0, asintomático y 6, muerte. También se utiliza para valorar el grado de afectación después del ictus.
Tabla 2.Escala de Rankin modificada
Nivel Categoría Descripción 0 Asintomático 1 Muy leve Pueden realizar tareas y actividades habituales sin limitaciones 2 Leve Incapacidad para realizar algunas actividades previas, pero pueden valerse por sí mismos, sin necesidad de ayuda 3 Moderada Requieren algo de ayuda, pero pueden caminar solos 4 Moderadamente grave Dependientes para las actividades básicas de la vida diaria, pero con necesidad de supervisión continua (necesidades personales sin ayuda) 5 Grave Totalmente dependientes. Requieren asistencia continua 6 Muerte - -
Efectuar una evaluación clínica. La escala National Institute of Health Stroke Score (NIHSS) permite realizar una evaluación neurológica y ayuda a la toma de decisiones. Consta de 14 ítems. Según la puntuación se considera: 0 puntos, no síntomas de ictus; entre 1 y 4, ictus leve; entre 5 y 15, ictus moderado; entre 15-20, ictus moderado/grave; y mayor de 20, ictus grave. Esta escala se ha adaptado y validado para utilizarla en niños entre los 4 meses y los 18 años años (pedNIHSS).
- -
Realizar analítica básica de urgencia que incluya la glucemia.
Están encaminados a mantener y mejorar la viabilidad del área de penumbra y el flujo cerebral a través de colaterales. Se iniciará lo antes posible sin esperar confirmación diagnóstica.
Comprende:
- 1)
Reposo absoluto en cama. Se discute si es mejor que el enfermo tenga la cabeza horizontal o elevada a 30° (teóricamente habría mayor flujo sanguíneo cerebral en la primera). En un reciente metaanálisis en adultos no hay datos claros sobre si es mejor una postura sobre la otra4. Si se sospechase hemorragia intracraneal es preferible que esté la cabeza levantada porque así disminuye la presión intracraneal.
- 2)
Dieta absoluta inicial (24h en general). Se debe confirmar la capacidad de deglución normal para iniciar la ingesta.
- 3)
Controlar la hipertermia. La fiebre aumenta el metabolismo cerebral favoreciendo la cascada metabólica.
- 4)
Mantener una oxigenación normal. No hay evidencia de que el oxígeno suplementario mejore el ictus isquémico. Se administrará por lo tanto oxígeno solo si el nivel de conciencia es bajo o si la saturación es menor del 95%.
- 5)
Mantener una glucemia normal evitando así la glucólisis anaerobia. Evitar administrar sueros glucosados a partir de los 2 años a menos que se constate una hipoglucemia.
- 6)
Tratar urgentemente las crisis epilépticas con fármacos antiepilépticos.
- 7)
Tratar la deshidratación.
- 8)
Valorar si procede controlar la presión arterial. Este es un tema controvertido:
El incremento del flujo sanguíneo derivado del aumento de la presión arterial puede ser perjudicial dado que favorece la cascada metabólica referida y la aparición de hemorragia.
Pero por otro lado, dicho incremento de flujo sanguíneo es beneficioso porque mejora la irrigación de la zona de penumbra a través de colaterales.
Por último, hay que tener en cuenta que el estrés y la ansiedad pueden favorecer un incremento transitorio de la presión arterial.
Por lo tanto, el tratamiento de la hipertensión debe realizarse tan solo en casos muy concretos.
- 9)
Es conocido que la anemia por déficit de hierro favorece la aparición de ictus en niños previamente sanos. Por este motivo debe tratarse la misma si la hemoglobina está por debajo de 10g/dl.
Para demostrar la existencia de un ictus isquémico en niños es necesario una confirmación radiológica, a diferencia de los adultos donde basta tener una clínica compatible y un TAC sin hemorragias (aunque no se vean signos de infarto) para iniciar los tratamientos de recanalización. Esto se debe a que en los niños hay muchas entidades que simulan una clínica de ictus y son mucho más frecuentes que este. El TAC es la técnica más asequible en urgencias y es diagnóstica en el caso de ictus hemorrágico. Sin embargo, es muy frecuente que en el caso de los ictus isquémicos el TAC sea normal en las primeras horas, por lo que un resultado normal no excluye el diagnóstico.
La resonancia magnética cerebral (RM) es la técnica de elección en la infancia. No solamente no emplea radiaciones ionizantes, sino que con esta prueba el diagnóstico puede establecerse transcurrida tan solo media hora después del comienzo de la sintomatología. En su defecto puede utilizarse TAC con angio-TAC.
Se deben realizar protocolos específicos de RM5. En nuestro centro se realizan las siguientes secuencias en el orden reflejado a continuación:
- •
DWI (secuencia de difusión). Detecta si hay infarto isquémico en 25 segundos.
- •
FLAIR.
- •
3D-TOF Polígono Willis (angio-RM).
- •
SWI (secuencia de susceptibilidad magnética) para valorar deoxihemoglobina y vasos con poco flujo, así como la existencia de hemosiderina (hemorragia). Si se confirma la existencia de un ictus isquémico se realizará una secuencia 2D-TOF de troncos supraaórticos para valorar bien todo el árbol vascular. Para la valoración de las arteriopatías puede ser de utilidad, sobre todo si la afectación es en un gran vaso, la realización de secuencias específicas de RM cerebral para ver el estado de las paredes vasculares (vessel wall image [VWI]).
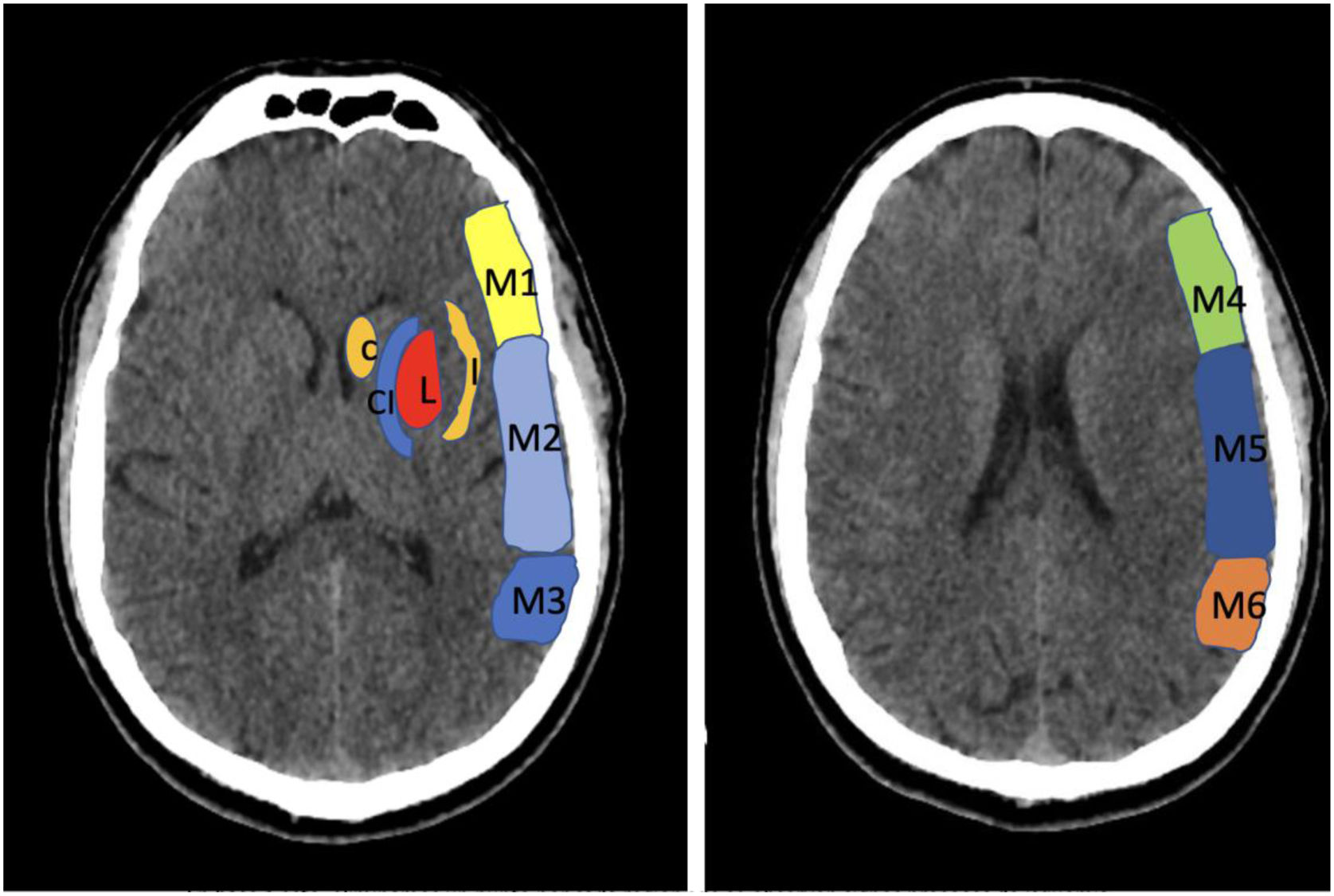
Para cuantificar la extensión del infarto y valorar así diferentes opciones terapéuticas se utiliza la escala Alberta Stroke Program Early CT Score (ASPECTS) (fig. 1).
Escala ASPECTS (Alberta Stroke Programme Early CT Score). Se utiliza para cuantificar la extensión del ictus. Puede utilizarse el TAC o de la RM (secuencia de difusión) en el ictus isquémico de la circulación anterior. El análisis se hace sobre dos cortes axiales; el primero a nivel del tálamo y ganglios basales (Plano A), y el segundo adyacente al borde superior de los ganglios basales, sin visualizarlos (Plano B). En estos dos planos, se ha dividido el territorio de la arteria cerebral media en 10 regiones, valorando cada región en un punto. Estas regiones son: M1: región cortical anterior de la ACM; M2: región cortical lateral al ribete insular; M3 : región cortical posterior de la ACM; M4, M5, M6 : región cortical anterior, lateral y posterior de la ACM, aproximadamente 2 cm por encima de M1, M2, M3, respectivamente. (Plano B); L ó Pu : núcleo lenticular (putamen); Ca : núcleo caudado; CI : cápsula interna; Ins: ribete insular.
Para valorar la utilidad y riesgo de las terapias de recanalización pasada la ventana terapéutica pueden utilizarse secuencias de perfusión de TAC y RM que veremos posteriormente.
Tratamientos de recanalizaciónTrombólisis intravenosaTras la demostración en 1995, en el estudio NINDS, de la utilidad del activador tisular del plasminógeno recombinante (rTPA) o alteplasa intravenosa como tratamiento recanalizador6 y demostrarse tras el estudio ECASS7 que la mayor eficacia y seguridad se obtenía si se realizaba dentro de las 4,5h siguientes al inicio de los síntomas, se empezó a usar este procedimiento de forma generalizada en adultos.
Las guías de manejo del ictus infantil inicialmente no recomendaban su uso en niños. Sin embargo, la publicación de numerosos casos de ictus infantiles donde el tratamiento con trombólisis intravenosa era seguro y eficaz determinó la confección de un estudio prospectivo, «Thrombolysis in Pediatric stroke» (TIPS)8, para conocer la seguridad, la dosis y viabilidad de la alteplasa intravenosa en el niño. Desgraciadamente hubo que suspenderlo por falta de reclutamiento de casos. Sin embargo, recientemente el estudio TIPSTERS9, que evaluó a 26 niños con ictus a los que se les había aplicado trombólisis intravenosa en centros reclutados para el estudio TIPS, demostró la buena tolerabilidad de este tratamiento. Ninguno de los casos presentó hemorragia sintomática. Otros estudios realizados posteriormente también comprobaron su buena tolerabilidad10,11.
En alguna de las nuevas guías pediátricas incluyen la posibilidad de su uso siempre que se demuestre la existencia de una obstrucción arterial. Sin embargo, en los recientes estudios referidos9–11 solo se requiere la existencia de un infarto compatible con obstrucción vascular para realizar el tratamiento. Los criterios de inclusión y exclusión, basados en los protocolos de ictus en adultos, se muestran en la tabla 3.
Criterios de inclusión y exclusión de trombólisis
| Criterios de inclusión: la respuesta debe ser SÍ a todos los ítems siguientes: |
|---|
| Edad ≥2 años |
| Intervalo entre el inicio de los síntomas y la administración del tratamiento<4,5h (es obligado conocer la hora de inicio de los síntomas) |
| Rankin previo ≤2. Valorar>2 según calidad de vida, y soporte social o familiar |
| Diagnóstico clínico y radiológico de ictus isquémico con una puntuación NIHSS≥4 (se considerarán puntuaciones<4 en casos de plejía de extremidad, afasia grave o hemianopsia |
| No hemorragia intracraneal |
| Obtención del consentimiento informado de los padres. En circunstancias especiales puede ser testigo u otros familiares o personas responsables |
| Criterios de exclusión: si se responde SÍ a cualquiera de las cuestiones es criterio de exclusión: |
|---|
| Edad menor de 2 años |
| Rankin>2 con mala calidad de vida, o sin soporte social o familiar |
| Ictus isquémico>4,5h, hora de inicio indeterminada o ictus del despertar |
| Hemorragia intracraneal en TC |
| Sospecha clínica o signos de hemorragia subaracnoidea |
| Historia de hemorragia intracraneal previa o MAV o aneurismas o tumores intracraneales conocidos |
| Síntomas menores o mejoría franca sin déficit incapacitante antes de la infusión Déficit leve (PedNIHSS<4) al inicio de la infusión de tPA. (UK PedNIHSS 4-24, TIPS PedNIHSS 4-24). Se considerará para tratamiento con NIHSS<4 si plejía de un miembro o afasia grave o hemianopsia |
| PedNIHSS>25 |
| TAS persistente>15% por encima p95 para la edad (en sedestación o decúbito) |
| Hipodensidad franca extensa en TC |
| Ictus, TCE grave o cx intracraneal previa en los últimos 3 meses |
| Neoplasia<6 meses esperanza de vida o con aumento de riesgo de hemorragia |
| Ictus debido a endocarditis bacteriana, drepanocitosis, meningitis, embolismo (médula ósea, aéreo, graso), enfermedad de moyamoya |
| Hemorragia gastrointestinal o genitourinaria<21 días, neoplasia gastrointestinal |
| Diátesis hemorrágica significativa: no se excluyen disfunciones plaquetarias leves, enfermedad de Von Willebrand leve u otras diátesis hemorrágicas leves |
| Cirugía mayor o biopsia parenquimatosa los últimos 10 días |
| Punción arterial en un lugar no comprensible o PL en los 7 días anteriores. Cateterismo cardiaco a través de una arteria compresible no es contraindicación |
| Diagnóstico previo de vasculitis primaria del SNC o arteritis secundaria |
| Trauma craneal grave en 3 meses (cuidado con traumas asociados al ictus) |
| HBPM en dosis anticoagulantes en las últimas 24h |
| Disección arteria intracraneal |
| Si recibe anticoagulantes orales, si INR>1,4 (1,7 en adultos). Si ha recibido heparina en las últimas 4h, debe tener un PTTA normal |
| Toma de dabigatrán o apixabán o rivaroxabán en 48h previas (salvo disponible antídoto) |
| Plaquetas<100.000 (no necesario esperar sin sospecha), PT>15segundos (INR>1,4) o PTT por encima del límite superior para el rango de su edad |
| Embarazo o posparto<14 días, valorar con el ginecólogo |
| Ictus en paciente con infarto miocárdico agudo o pericarditis |
HBPM: heparina de bajo peso molecular; MAV: malformación arteriovenosa; NIHSS: National Institute of Health Stroke Score; pedNIHSS: Escala NIHSS pediátrica; PTTA: tiempo tromboplastina parcial activada; RM: resonancia magnética cerebral; TC: TAC cerebral; TCE: traumatismo craneoencefálico.
En adultos se han realizado estudios donde se aplicó este tratamiento a enfermos que sobrepasaban la ventana terapéutica, siempre conociendo el volumen de core y penumbra, como veremos luego12,13, pero no hay estudios similares en niños.
Terapias endovascularesSu objetivo es la eliminación del coágulo mediante la introducción de un microcatéter en la arteria femoral o radial al que se le hace llegar hasta la arteria ocluida. Allí se pueden infundir fármacos para disolver el coágulo, pero en la actualidad se prefiere la introducción de dispositivos para extraerlo (trombectomía mecánica).
Varios grandes ensayos en adultos14–20 así como un metaánalisis21 demostraron el beneficio de esta técnica en las primeras 6h tras oclusión de la carótida interna intracraneal (ACI) o del segmento M1 de la arteria cerebral media (ACM). Existía un riesgo de hemorragia intracraneal sintomática del 4,4% pero no se evidenció un incremento de mortalidad comparado con el grupo control.
Las terapias endovasculares no contraindican la trombólisis y es muy habitual utilizar ambos tratamientos (en los estudios mencionados, 5 de cada 6 pacientes a los que se les hizo terapia endovascular tenían realizada trombólisis previamente).
Existían menos estudios sobre el uso de las terapias endovasculares en los ictus de la circulación posterior fundamentalmente por obstrucción de la arteria basilar. Pero recientemente se han publicado dos ensayos clínicos en adultos22,23 donde se confirma también la efectividad y seguridad de la trombectomía en estos casos.
Al igual que ocurría con la trombólisis, inicialmente las guías de manejo del ictus pediátrico no recomendaban usar las terapias endovasculares en la edad infantil debido a la escasez de estudios. Sin embargo, la publicación de numerosos casos con buena respuesta y escasas complicaciones hizo que las nuevas guías24–26 ya no se posicionasen en contra y refieren que «es razonable usarla» cuando el pedNIHSS es igual o mayor de 6, existe obstrucción de un gran vaso, el niño es mayor, han pasado menos de 6h y tras el acuerdo del neuropediatra y radiólogo neurointervencionista.
En 2020 el estudio observacional multicéntrico Save ChildS Study27 y un reciente metaanálisis28 demostraron que la seguridad del tratamiento en niños no era menor que en los adultos.
Por todo ello el criterio mayoritario es realizar terapias endovasculares a los niños con ictus siguiendo criterios de inclusión y exclusión similares básicamente a los de los adultos (tabla 4).
Criterios de inclusión y exclusión de trombectomía mecánica
| Criterios de inclusión. Se deben cumplir todos los criterios: |
|---|
| Escala Rankin modificada previa al ictus ≤2 |
| Puntuación en la escala NIHSS≥6 |
| Puntuación en la escala ASPECTS (TC craneal simple) ≥6 |
| Oclusión aislada de arteria carótida interna intracraneal o arteria cerebral media proximal (segmento M1) |
| Tiempo de evolución del ictus<6h. Valorar de manera individualizada en casos de >6h y en afectación territorio posterior |
| Edad<2 años (no es un criterio absoluto, se valorará) |
| Obtención del consentimiento informado específico del paciente o de sus familiares |
| Criterios de exclusión. No se debe cumplir ninguno de los siguientes: |
|---|
| Enfermedad concomitante grave o con mal pronóstico vital a corto plazo |
| Hemorragia cerebral aguda o transformación hemorrágica franca en el mismo territorio vascular. Sospecha HSA |
| En infartos de circulación posterior cuando existan: signos clínicos indicativos de lesión extensa irreversible (coma prolongado o abolición completa y persistente de reflejos de tronco) o datos de lesión extensa establecida en tronco del encéfalo en neuroimagen |
| Coma prolongado (>6h) o abolición completa y persistente de reflejos de tronco |
| Plaquetas<60.000 mm3 o alteraciones significativas de la coagulación |
ASPECTS: Alberta Stroke Programme Early CT Score; HAS: hemorragia subaracnoidea; NIHSS: National Institute of Health Stroke Score.
Al igual que ocurría con la trombólisis, se ha estudiado la realización de las terapias endovasculares fuera de la ventana terapéutica.
Para ello es necesario conocer la diferencia de volumen entre la zona de penumbra (zona isquémica pero rescatable) y la región infartada (zona core). Esta diferencia es lo que se llama mismatch. Si el core es pequeño y la penumbra grande, esto es, hay un mismatch significativo, significaría que hay una zona amplia potencialmente rescatable y podría así realizarse una trombectomía pasadas las 6h. Hay varios métodos para calcular el core y la penumbra. Los más perfectos son la utilización de técnicas de perfusión cerebral que se pueden hacer tanto en TAC como en RM.
En adultos se llevaron a cabo dos grandes estudios29,30 en enfermos a los que se les hizo terapia endovascular en ictus isquémicos que comenzaron entre 6-24h y 6-16h. En ambos estudios era condición necesaria la existencia de un mismatch significativo. En los dos se constató de forma clara la eficacia y seguridad de la terapia endovascular.
En niños, una prolongación del estudio mencionado Save Childs Study31 estudió 20 pacientes a los que se les realizó trombectomía previa confirmación de mismatch significativo pasadas las 6h. Los resultados fueron excelentes con un Rankin medio de 2 a los 3 meses y 0 a los 24 meses, siendo muy leves las complicaciones. En otro estudio con 38 casos32 el 84,2% tuvo un pronóstico favorable (NIHSS score ≤4, Rankin modificado ≤1).
Un tema controvertido es a partir de qué edad puede realizarse una terapia endovascular. En el estudio ya mencionado Save Childs Study se afirma que los menores de 6 años tienen peor pronóstico. Sin embargo, actualmente, dados los avances en los dispositivos empleados por los neurorradiólogos, pensamos que no debe excluirse en la actualidad ninguna edad de forma rígida. De hecho, recientemente se han publicado varios casos de lactantes (uno de ellos en España) y recién nacidos a los que se les ha aplicado una trombectomía con buen resultado33–36. Evidentemente, los clínicos y los neurorradiólogos deben estudiar conjuntamente cada caso de forma individual para decidirse a usar estos procedimientos.
Terapias agudas en ictus de origen tromboembólico por cardiopatíasLas embolias cerebrales se producen fundamentalmente en niños con cardiopatías, sobre todo congénitas.
La realización de las terapias de recanalización, fibrinólisis y terapias endovasculares estarían indicadas siguiendo los protocolos de inclusión y exclusión referidos.
Terapias agudas en arteriopatíasEn las arteriopatías, al estar inflamadas o lesionadas las paredes vasculares, el uso de la trombólisis o trombectomía es más controvertido ya que hay mayor riesgo de disección, vasoespasmo y rotura.
Probablemente la secuencia vessel wall imaging (VWI) de RM para ver la pared vascular pueda ayudar a tomar decisiones.
Arteriopatía cerebral focal (ACF)En las arteriopatías cerebrales focales no hay inconveniente para realizar trombólisis siguiendo los criterios de inclusión y exclusión referidos.
En relación con la trombectomía mecánica, hay pocos estudios donde se exprese claramente los resultados en enfermos con ACF.
En el estudio Save ChildS Study27 se incluyeron solo 7 niños con arteriopatías probablemente por las razones aducidas. En otro reciente estudio multicéntrico37 sobre tratamientos de recanalización para IAIPP en niños en Francia, en donde había 17 niños con arteriopatía cerebral focal, no vieron complicaciones significativas pero la reoclusión o persistencia de estenosis mayor del 50% fue muy elevada.
Por lo tanto, aunque no se puede descartar de entrada la realización de trombectomía, neurorradiólogos y clínicos deben valorar conjuntamente cada caso de forma individual.
Disección cerebralTambién aquí los tratamientos de recanalización tienen riesgos teóricos. Al hacer trombólisis intravenosa hay riesgo de hematoma intradural. En relación con la trombectomía, hay peligro de entrar en la falsa luz de la disección pudiendo incluso perforar la arteria.
La guía ESO38 (adultos) puede ayudar a la toma de decisiones.
Enfermedad y síndrome de moyamoyaEn principio, si un enfermo con esta entidad tiene un ictus no se recomiendan ni la fibrinólisis ni la trombectomía ya que los vasos intracraneales son friables y el riesgo de sangrado es alto. Sin embargo, recientemente se realizó una revisión sistemática39 donde se refieren 10 casos a los que se les realizó trombólisis, trombectomía o ambos procedimientos con buen resultado. Concluyen que podría realizarse este procedimiento previa selección de casos.
Drepanocitosis (anemia de células falciformes)En esta entidad el principal mecanismo que produce un infarto cerebral es la adherencia de los eritrocitos al endotelio vascular y hemólisis, causando agregación plaquetaria y aumento del tono vasomotor, llegando al final a la trombosis. El tratamiento de elección en los niños afectos de drepanocitosis que tienen un ictus isquémico es, aparte de recibir oxígeno suplementario, empezar inmediatamente con una exanguinotransfusión si la Hb es menor de 8,5g/l (idealmente en menos de 2h del comienzo de los síntomas) para alcanzar un valor de Hb>10g/l. Es preferible la exanguinotransfusión versus la transfusión simple para alcanzar una HbS menor del 15-20%. Si la Hb es mayor de 8,5g/l la exanguinotransfusión es mejor para disminuir la posibilidad de un síndrome de hiperviscosidad.
En adultos mayores de 18 años la Sociedad Americana de Hematología no excluye la realización de trombólisis en las primeras 4,5h siguiendo los criterios de inclusión y exclusión para trombólisis mientras no se retrase la terapia de transfusión o exanguinotransfusión. Sin embargo, no se recomienda la tPA intravenosa en niños menores de 18 años (Recomendación condicional basada en que hay pocos estudios en niños)40.
Código ictus pediátricoEl ictus, por todo lo dicho, es una urgencia médica. Cada minuto se pierden 1,9 millones de neuronas. Esta fue la razón de la creación del código ictus (sea este isquémico o hemorrágico), para dar prioridad a los enfermos con esta patología. Sin embargo, este código no se aplicaba a los menores de 18 años. Las razones aducidas eran la escasez de casos, que los afectados parecían recuperarse mejor que los adultos, y que los tratamientos de recanalización no se debían aplicar a los casos pediátricos porque no había estudios que avalasen estos procedimientos en esta franja etaria. Estos argumentos, como se ha podido constatar en este artículo, no se sostienen en la actualidad.
Por ello, tras años de gestiones, en 2019 se consiguió que se ampliase el código ictus a los niños menores de 18 años en la Comunidad de Madrid, que fue la primera comunidad autónoma en aplicarlo como una extensión del código ictus3. En la actualidad se está extendiendo a otras regiones y esperamos que pronto pueda aplicarse en todo el territorio español.
En el código ictus se distinguen dos etapas: código ictus extrahospitalario, desde que se inician los síntomas hasta que el paciente llega al hospital, y el código ictus intrahospitalario, desde la llegada del niño al hospital hasta que se diagnostica y trata. Para lograr una mayor eficacia se recomienda se cumplan unos tiempos que se muestran en la tabla tabla 5.
Código ictus pediátrico. Tabla de tiempos deseables
| Desde el inicio de síntomas hasta la puerta del hospital | Menos de 120min |
| Desde la activación del código ictus hasta la puerta del hospital | Menos de 60min |
| Desde la llegada a urgencias hasta la realización de la neuroimagen, y menos de 5min después para confirmar o descartar la existencia de ictus | Menos de 20min |
| Desde el inicio de la neuroimagen hasta la confirmación diagnóstica | Menos de 5min |
| Inicio síntomas-aguja (trombólisis intravenosa) menos de 120min en trombólisis intravenosa y menos de 200min en tratamiento endovascular | Menos de 120min |
| Llegada puerta-aguja (trombólisis intravenosa) | Menos de 45min |
| Inicio síntomas-tratamiento endovascular | Menos de 200min |
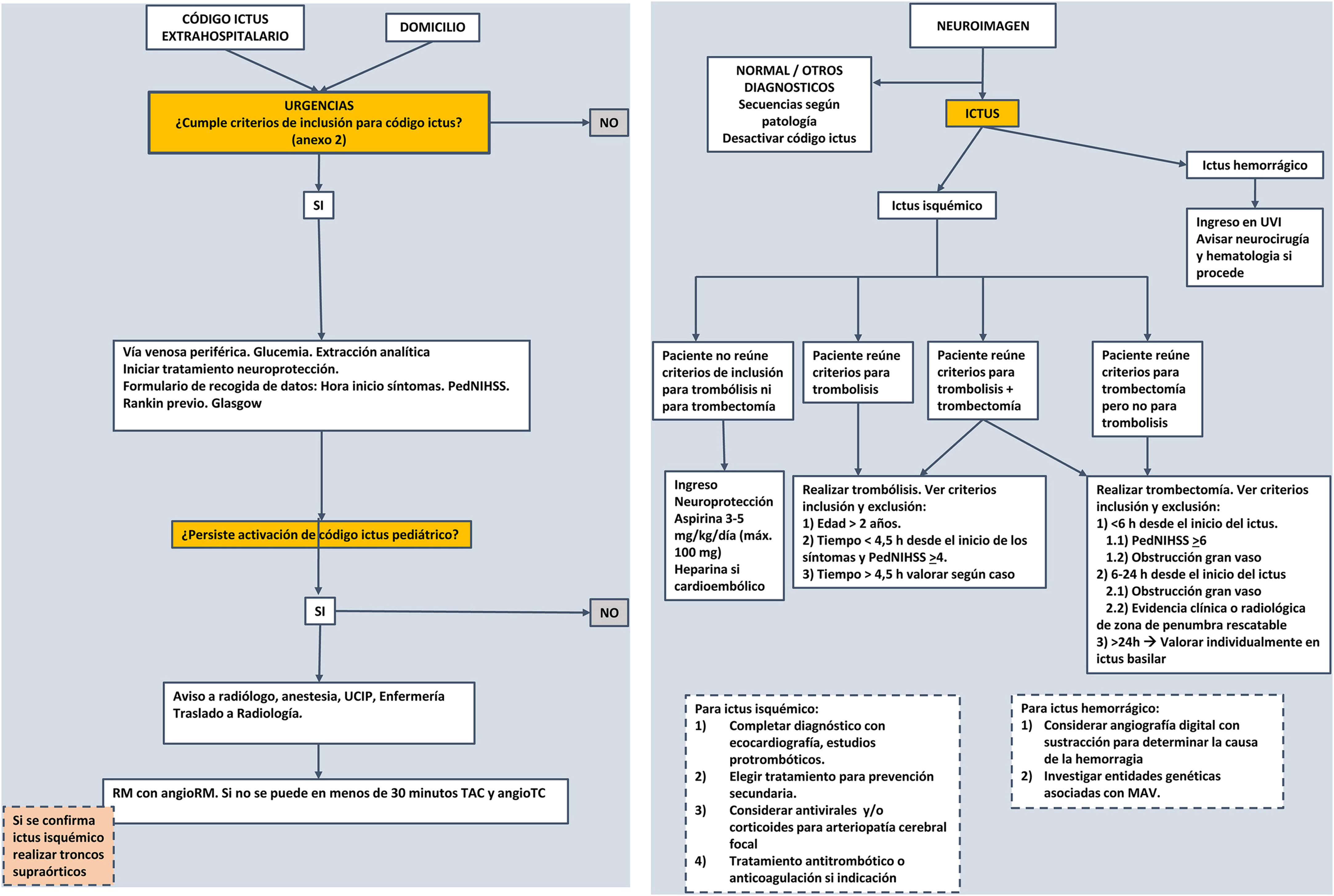
El manejo del IAIPP ha cambiado de forma notable en los últimos años. La actitud nihilista que se tenía en relación con la del ictus de adultos no se sostiene en la actualidad porque los tratamientos agudos de recanalización pueden y deben usarse en los niños, aunque con ciertas precauciones. Debido a que estos tratamientos son más eficaces mientras más precozmente se instauren, debería aplicarse el código ictus a todos los niños que tengan una sintomatología compatible. Es necesario confeccionar protocolos de actuación como el reflejado en la figura 2 que resumen las acciones a realizar ante cualquier caso de sospecha de un ictus pediátrico,
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.