El seudohipoparatiroidismo (PHP) incluye entidades caracterizadas por la ausencia de respuesta tisular a la acción de la hormona paratiroidea y, en consecuencia, la presencia de hiperfosfatemia e hipocalcemia en grado variable. La obesidad de inicio temprano es una característica de los pacientes con PHP1A.
Este artículo plantea la necesidad de establecer unos criterios comunes que orienten el manejo nutricional de estos pacientes. La disminución de su gasto energético implica adaptar el contenido calórico de su alimentación. Reducir el consumo de alimentos ricos en fósforo inorgánico ayuda a manejar la hiperfosfatemia. El consejo nutricional dirigido debe formar parte de la estrategia terapéutica de los niños y adolescentes con PHP, ya que contribuye a modular los desequilibrios en el metabolismo fosfocálcico característicos de estos pacientes.
Pseudohypoparathyroidism (PHP) is a spectrum of diseases characterized by insensitivity of target tissues to the action of parathyroid hormone and, consequently, by the presence of hyperphosphatemia and hypocalcaemia of varying severity. Early-onset obesity is a feature of PHP type 1A.
This article discusses the need to establish uniform criteria to guide the nutritional management of patients with PHP. A decrease in energy expenditure calls for an adjustment of the energy content of the diet. Reducing the intake of foods rich in inorganic phosphorus helps manage hyperphosphataemia. Targeted nutrition should be part of the treatment plan of children and adolescents with PHP, since it contributes to modulating the calcium and phosphorus metabolism imbalances characteristic of these patients.
El término seudohipoparatiroidismo (PHP) (OMIM#103580 en el caso de PHP tipo 1A, OMIM#603233 para PHP1B y OMIM#612462 para PHP1C) engloba a un conjunto de enfermedades raras que se caracterizan por la resistencia tisular a la acción de la hormona paratiroidea (PTH). Todas ellas comparten alteraciones (epi)genéticas en el locus GNAS, cuyo principal producto es la subunidad α de la proteína estimulante G (Gs). Defectos en esta proteína alteran la vía de señalización desde el receptor acoplado a Gsα al medio intracelular, comprometiendo así diversas acciones biológicas. La nueva clasificación engloba estas formas de PHP como iPPSD2, si presentan alteraciones genéticas, e iPPSD3 en el caso de alteración de la metilación1.
Los pacientes desarrollan hiperfosfatemia e hipocalcemia junto con la elevación de PTH. Estas entidades pueden aparecer asociadas a un fenotipo (osteodistrofia hereditaria de Albright) que incluye talla baja, cara redondeada, cuello corto, braquidactilia y osificaciones ectópicas2.
El tratamiento incluye realizar una intervención nutricional específica que contribuya a modular tanto las alteraciones bioquímicas propias de esta enfermedad como a regular el metabolismo energético. Surge la necesidad, por tanto, de establecer una guía con base bibliográfica que sostenga las recomendaciones nutricionales que trasladaremos a pacientes y a cuidadores de niños y niñas con PHP.
Balance energéticoLa subunidad α de la proteína Gs está implicada en la traducción de la señal del receptor de la melanocortina 4 (MC4R) en las células dorsomediales del hipocampo, participando en las vías que regulan el gasto energético y el apetito3. La disminución de la actividad de dicha proteína provoca un balance energético positivo por reducción del gasto energético en reposo4-6 y disminución de la termogénesis inducida por los alimentos1.
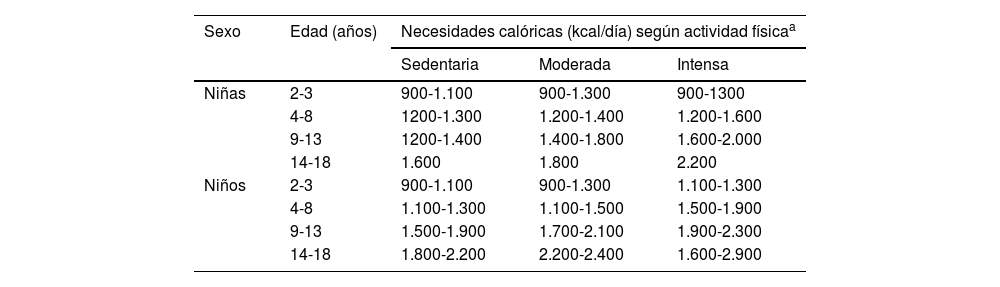
La ganancia de peso se inicia de forma precoz y es más acusada en la infancia y en la adolescencia2,7. Por este motivo, es necesario realizar una intervención nutricional temprana y continuada que limite el aporte energético de la alimentación8. En términos generales, con relación a la alimentación, se recomienda realizar una reducción aproximada del 10% en el requerimiento energético estimado según edad y sexo para población general, según se especifica en la tabla 19. Sin embargo, la intervención debe ser individualizada, ya que siempre debemos tener presentes las características del paciente y evitar el posible efecto negativo sobre el crecimiento y desarrollo.
Requerimientos energéticos según la edad, el sexo y nivel de actividad física
| Sexo | Edad (años) | Necesidades calóricas (kcal/día) según actividad físicaa | ||
|---|---|---|---|---|
| Sedentaria | Moderada | Intensa | ||
| Niñas | 2-3 | 900-1.100 | 900-1.300 | 900-1300 |
| 4-8 | 1200-1.300 | 1.200-1.400 | 1.200-1.600 | |
| 9-13 | 1200-1.400 | 1.400-1.800 | 1.600-2.000 | |
| 14-18 | 1.600 | 1.800 | 2.200 | |
| Niños | 2-3 | 900-1.100 | 900-1.300 | 1.100-1.300 |
| 4-8 | 1.100-1.300 | 1.100-1.500 | 1.500-1.900 | |
| 9-13 | 1.500-1.900 | 1.700-2.100 | 1.900-2.300 | |
| 14-18 | 1.800-2.200 | 2.200-2.400 | 1.600-2.900 | |
Actividad física sedentaria: actividades de la vida diaria. Moderada: actividad física diaria como caminar a ritmo rápido, bicicleta, natación (30-60 min en al menos 3 sesiones semanales). Actividad física intensa: práctica de deportes como fútbol, baloncesto, atletismo (3-5 sesiones semanales de al menos 60 min de duración).
Adaptado de: Palomo Atance et al.9.
La actividad física propuesta debe estar adaptada a la adiposidad y la condición física del niño o niña, con el fin de facilitar la adherencia, incrementándose progresivamente a medida que esta mejore. El objetivo es realizar actividad física moderada o vigorosa durante un mínimo de 60 min diarios, pudiendo repartirse en 2o más sesiones10.
MacronutrientesHidratos de carbonoLos niños y niñas con PHP1A muestran alteración en la tolerancia oral a la glucosa que puede preceder a la obesidad11 y se ha relacionado con la pérdida de la función de la proteína Gsα en las células que expresan el receptor MC4R3.
En general, los hidratos de carbono deben formar parte de la dieta habitual y proporcionar el 50% de la energía diaria. Se priorizará el consumo de hidratos de carbono complejos con índice glucémico bajo9. Se recomienda consumir entre 4-6 raciones diarias de cereales (pan, pasta, arroz, harina), en este caso, reduciendo el consumo de cereales integrales con elevado contenido en fósforo12. Se recomienda incluir al menos 2raciones diarias de verduras y hortalizas y al menos 3 raciones de fruta9. Los lácteos deben distribuirse en 2, o como máximo 3raciones diarias, priorizando semidesnatados o desnatados con el fin de controlar la ingesta energética y aportando, de esta manera, calcio dietético sin exceso de fósforo13.
LípidosLos lípidos proporcionarán aproximadamente el 30% de la energía diaria, limitando las grasas saturadas al 7-10% de las calorías totales y el colesterol a 300mg/día. Los alimentos ricos en ácidos grasos mono y poliinsaturados son los que deben formar parte de la dieta, evitando la ingesta de grasas trans (presentes principalmente en los precocinados y procesados) y reduciendo la de ácidos grasos saturados (mantequilla, carnes grasas, embutidos, aceites de palma y coco). Se utilizará aceite de oliva para cocinar o para añadir a los alimentos en crudo9.
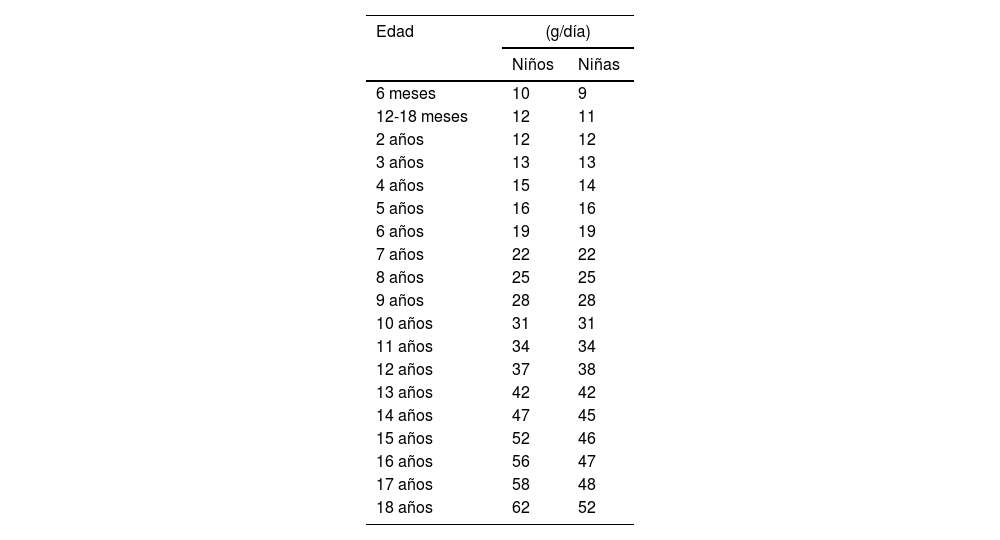
ProteínasLa ingesta de proteínas se limitará a cubrir las necesidades establecidas para la edad y que se especifican en latabla 214.
Recomendaciones diarias de proteínas, adaptadas de los valores nutricionales de referencia
| Edad | (g/día) | |
|---|---|---|
| Niños | Niñas | |
| 6 meses | 10 | 9 |
| 12-18 meses | 12 | 11 |
| 2 años | 12 | 12 |
| 3 años | 13 | 13 |
| 4 años | 15 | 14 |
| 5 años | 16 | 16 |
| 6 años | 19 | 19 |
| 7 años | 22 | 22 |
| 8 años | 25 | 25 |
| 9 años | 28 | 28 |
| 10 años | 31 | 31 |
| 11 años | 34 | 34 |
| 12 años | 37 | 38 |
| 13 años | 42 | 42 |
| 14 años | 47 | 45 |
| 15 años | 52 | 46 |
| 16 años | 56 | 47 |
| 17 años | 58 | 48 |
| 18 años | 62 | 52 |
Adaptado de: EFSA NDA Panel (EFSA Panel on Dietetic Products, Nutrition and Allergies), 201214.
Es importante tener presente que el consumo excesivo de proteínas, sobre todo las de origen animal, incrementa la excreción urinaria de calcio y, en consecuencia, el riesgo de litiasis renal15, suponiendo asimismo una fuente importante de fosfato.
FibraLa fibra se encuentra en los alimentos en 2formas: soluble e insoluble. La fibra soluble es fermentable por la microbiota del tracto gastrointestinal y su fuente principal son las frutas, los cereales (cebada y avena) y las legumbres. La fibra insoluble no fermentable está presente principalmente en el salvado de trigo, arroz y centeno, y en los vegetales16. La dieta de los niños y niñas con PHP debe contener fibra soluble e insoluble en relación de 1:3, teniendo en cuenta que cuanto menor edad tenga el niño o niña esta relación debe modificarse para aumentar el aporte de fibra soluble17. La cantidad recomendada de fibra diaria para menores de 2 años es de 9 g diarios. A partir de los 2 años, se puede calcular sumando 5 a la edad del niño o niña, por ejemplo, para un niño de 5 años la cantidad recomendada sería de 10 a 15 g17. Cabe destacar que la fibra dietética disminuye la biodisponibilidad de calcio, por lo que, en el caso de los niños y niñas con PHP, el aporte de fibra debe ser adaptado a cada edad y situación clínica. La tabla 1s (anexo) recoge las principales fuentes de fibra soluble e insoluble12.
MicronutrientesCalcioEl manejo de la resistencia a la PTH y de la hipocalcemia que manifiestan algunos niños y niñas con PHP implica iniciar tratamiento con metabolitos activos/análogos de la vitamina D y suplementos orales de calcio, dependiendo del aporte de la dieta2. Además, la alimentación debe contener diariamente alimentos ricos en calcio como los lácteos, legumbres y pescados. Sin embargo, el aporte dietético de calcio puede verse reducido al limitar el consumo de los alimentos ricos en fósforo, la mayoría de ellos con alto contenido en calcio. Es preciso tener presente que los alimentos que contienen elevada cantidad de ácido oxálico (presente en espinacas, acelgas, remolacha), ácido fítico (granos de cereales), fibra alimentaria, cafeína, taninos (té y cacao) y sodio reducen la biodisponibilidad de calcio y deben reducirse.
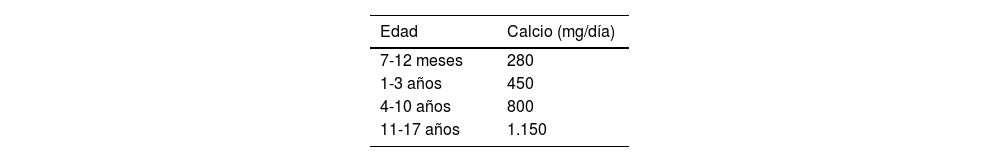
La ingesta de calcio no debe exceder la cantidad recomendada para cada edad18 (tabla 3), dado que el exceso de calcio puede interferir en la absorción de hierro, cinc y otros minerales, además de provocar hipercalciuria y litiasis renal.
Recomendaciones diarias de ingesta de calcio en función de la edad
| Edad | Calcio (mg/día) |
|---|---|
| 7-12 meses | 280 |
| 1-3 años | 450 |
| 4-10 años | 800 |
| 11-17 años | 1.150 |
mg: miligramos.
Elaborado a partir de EFSA NDA Panel (EFSA Panel on Dietetic Products, Nutrition and Allergies), 201518.
En la tabla 2s (anexo) se recogen las principales fuentes dietéticas de calcio12.
FósforoLimitar el aporte de fósforo de la dieta constituye uno de los pilares del manejo nutricional de los niños y niñas con PHP. El fósforo se encuentra en los alimentos en 2formas diferentes: el fósforo orgánico y el inorgánico.
El fósforo inorgánico forma parte de los aditivos que se utilizan para procesar los alimentos19. Este tiene gran impacto en la fosfatemia porque se absorbe el 90-100% del ingerido. Los productos ricos en fósforo inorgánico deben ser eliminados de la alimentación, por lo que es fundamental instruir a las familias para que reconozcan los aditivos ricos en fósforo en el etiquetado de los alimentos20 (tabla 4). En general, los productos congelados, precocinados, de preparación instantánea, quesos procesados, embutidos, bollería, salchichas, cereales de desayuno y bebidas de cola contienen niveles alto de fósforo inorgánico.
Aditivos alimentarios que contienen fósforo
| Ácido fosfórico | E338 |
| Fosfatos | E339, E340, E341, E343 |
| Difosfatos | E450 |
| Trifosfatos | E451 |
| Polifosfatos | E452 |
| Emulgentes (lecitina) | E322 |
| Fosfato de amonio | E442 |
| Fosfato de ácido de sodio y aluminio | E541 |
| Potenciadores del sabor | E626-E635 |
Adaptado de: Lou-Arnal et al.20.
El fósforo orgánico está presente de forma natural en las proteínas de origen animal (carnes, pescados, huevos, lácteos) y vegetal (legumbres, semillas y frutos secos). Impacta menos en la fosfatemia porque se absorbe entre el 30-60% del que se consume. Las proteínas animales deben estar presentes en la alimentación diaria por su elevado valor biológico, pero cabe destacar que el fósforo de origen animal tiene mayor biodisponibilidad que el vegetal. Se aconseja el consumo de carne de ave, cortes magros de cerdo o vacuno, clara de huevo y lácteos, sin que exceda la cantidad de proteínas determinada para cada edad. Por el contrario, las carnes procesadas, precocinadas o tratadas mediante curación deben ser completamente eliminadas de la dieta. El etiquetado nutricional de estos productos no exige a los fabricantes especificar el contenido de fósforo utilizado en el procesado, por lo que el contenido total y especialmente la fracción de fósforo inorgánico puede ser mucho mayor que la referida en la información nutricional del producto o en las tablas de composición de alimentos19,20.
Los pescados contienen cantidades variables de fósforo con alta biodisponibilidad. Se recomienda una ingesta de 3 raciones de pescados semanales de las que 1-2 deben ser azules, priorizando el consumo de aquellos con menor ratio fósforo/proteína, es decir, aquellos con menor cantidad de fósforo por gramo de proteína (menos de 16mg de fósforo por gramo proteico)13. Los que cumplen esta condición son, entre otros, merluza, mero, bacalao, raya, dorada, rodaballo y boquerón. Además del boquerón, otros pescados azules como el jurel y el salmón, también cumplen con esta recomendación, son una fuente importante de ácidos grasos polinsaturados y tienen un bajo contenido en mercurio. Por el contrario, sardina, trucha, pez espada, rape deben ser limitados.
Los mariscos y moluscos de elección son los langostinos, berberechos, almejas, pulpo, calamar y chipirón, siempre que no estén congelados ni hayan sido procesados.
El huevo entero y los lácteos tienen una elevada ratio fósforo/proteína, sobre todo los procesados, por lo que se debe optar por el queso blanco desnatado, el requesón, la leche semidesnatada y la clara de huevo.
Durante los últimos años se ha producido un incremento notable en el consumo de bebidas vegetales, en relación con la presencia de alergias/intolerancias alimentarias, con la elección de una dieta vegana o por modas o tendencias. Las bebidas de soja tienen una ratio fósforo/proteína significativamente inferior a la leche de vaca. Sin embargo, debe tenerse en cuenta que estas bebidas procesadas pueden contener aditivos con fósforo y alto contenido en azúcares añadidos, por lo que debe revisarse su etiquetado13.
El fósforo que aportan legumbres y frutos secos tiene menor biodisponibilidad que el de origen animal. Sin embargo, se recomienda escoger, al igual que en el caso de la proteína animal, los productos con menor ratio fósforo/proteína, como las lentejas, guisantes y garbanzos. En general, conviene limitar el consumo de frutos secos ya que contienen gran cantidad de fósforo con una ratio fósforo/proteína elevada, pero teniendo en cuenta la importancia de su aporte en ácidos grasos poliinsaturados.
Los cereales y los alimentos integrales duplican o en ocasiones triplican el contenido en fósforo con respecto a sus correspondientes refinados y tienen una ratio fósforo/proteína alta. Por este motivo, se priorizará el consumo de pan blanco y cereales refinados, combinados con alimentos de origen vegetal, proteínas o aceite de oliva con el objetivo de enlentecer la absorción de los primeros y disminuir su índice glucémico.
En la tabla 3s (anexo) se incluyen tablas de composición de alimentos ricos en fósforo con referencia a la ratio fósforo/proteína13.
Distribución de los alimentosLas pirámides nutricionales y el plato de Harvard con pequeñas modificaciones son modelos prácticos y visuales que sirven de ayuda para instruir a las familias y a los niños y las niñas en la elección y elaboración de menús recomendados y equilibrados21. Estos modelos son aplicables a los niños y niñas con PHP, con la salvedad de escoger cereales no integrales y recordar que, manteniendo la proporción indicada de alimentos proteicos, se debe dar preferencia a aquellos con menor contenido en fósforo.
El tamaño de las raciones debe ser adecuado a la edad, el sexo, la composición corporal, el grado de actividad física y la situación de salud/enfermedad del niño o niña. Otro modelo educativo que puede ser útil es el mostrado en la tabla 4s (anexo) que incluye las raciones y la cantidad por ración (en gramos o en medida culinaria) de cada grupo de nutrientes en función de la edad del infante22.
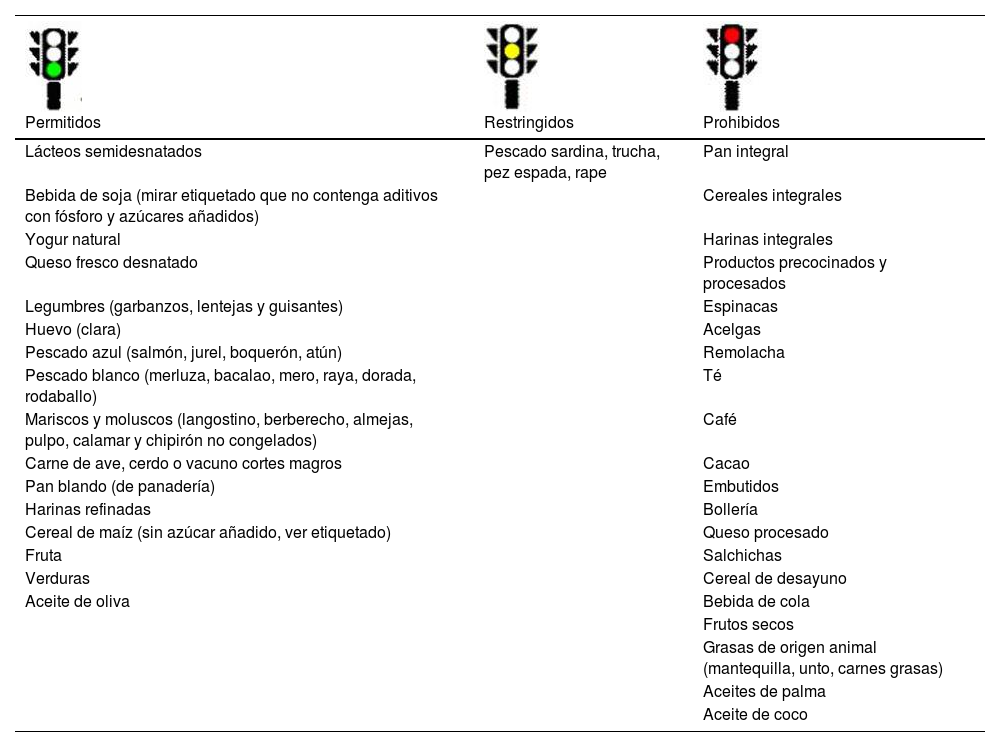
En la tabla 5 se muestra una lista con los alimentos permitidos, restringidos y prohibidos, y en la tabla 5s (anexo) y la tabla 6 un ejemplo de menú para 3 días y una lista con opciones de desayunos, comidas y cenas y meriendas adecuadas, siguiendo las recomendaciones tanto energéticas, como de micro y macronutrientes para niños con PHP9,23.
Lista de alimentos permitidos, restringidos y prohibidos en niños y niñas con seudohipoparatiroidismo
| Permitidos | Restringidos | Prohibidos |
|---|---|---|
| Lácteos semidesnatados | Pescado sardina, trucha, pez espada, rape | Pan integral |
| Bebida de soja (mirar etiquetado que no contenga aditivos con fósforo y azúcares añadidos) | Cereales integrales | |
| Yogur natural | Harinas integrales | |
| Queso fresco desnatado | Productos precocinados y procesados | |
| Legumbres (garbanzos, lentejas y guisantes) | Espinacas | |
| Huevo (clara) | Acelgas | |
| Pescado azul (salmón, jurel, boquerón, atún) | Remolacha | |
| Pescado blanco (merluza, bacalao, mero, raya, dorada, rodaballo) | Té | |
| Mariscos y moluscos (langostino, berberecho, almejas, pulpo, calamar y chipirón no congelados) | Café | |
| Carne de ave, cerdo o vacuno cortes magros | Cacao | |
| Pan blando (de panadería) | Embutidos | |
| Harinas refinadas | Bollería | |
| Cereal de maíz (sin azúcar añadido, ver etiquetado) | Queso procesado | |
| Fruta | Salchichas | |
| Verduras | Cereal de desayuno | |
| Aceite de oliva | Bebida de cola | |
| Frutos secos | ||
| Grasas de origen animal (mantequilla, unto, carnes grasas) | ||
| Aceites de palma | ||
| Aceite de coco |
Opciones de desayunos, comidas, cenas y meriendas para niños y niñas con seudohipoparatiroidismo
| Desayunos |
| Tostadas de pan blanco (de panadería) con tomate y aceite de oliva |
| Tostadas de pan blanco (de panadería) con requesón y miel |
| Tostadas de pan blanco (de panadería) con aguacate |
| Tostadas de pan blanco (de panadería) con atún al natural |
| Revuelto de claras de huevo |
| Tortitas de harina blanca o harina de maíz con arándanos |
| Yogur natural con fruta y hojuelas de maíz |
| Leche semidesnatada o bebida de soja (mirar el etiquetado) |
| Comida y cena |
| Pescado (3 a 4 veces por semana) |
| Ternera (1 vez por semana) |
| Pollo o pavo a la plancha, o al horno, o cocido con vegetales y arroz blanco o pasta o patata o pan blanco (de panadería) |
| Evitar: espinacas, acelgas, remolacha |
| Postre: yogur natural, fruta |
| Meriendas |
| Fruta |
| Palomitas de maíz caseras (sin aceite y sal) |
| Hummus casero |
| Bocadillo de atún, o queso fresco desnatado, o tortilla de clara de huevo con aguacate |
En conclusión, los principios a considerar para adaptar alimentación de los niños y niñas con PHP son los siguientes:
- 1.
Es necesario controlar el aporte energético total diario y promocionar la actividad física para evitar el desarrollo de sobrepeso y/u obesidad y comorbilidades asociadas como las alteraciones en el metabolismo hidrocarbonado.
- 2.
La dieta debe estar basada en alimentos naturales, incluyendo diariamente vegetales, hidratos de carbono y proteínas de alto valor biológico en proporción adecuada.
- 3.
La ingesta se distribuirá en 4 o 5 tomas de alimento diarias, evitando ingerir alimentos fuera de los horarios de las comidas principales.
- 4.
Los alimentos se cocinarán al vapor, hervidos, estofados o a la plancha, evitando freír y rebozar.
- 5.
Es fundamental limitar el aporte de fósforo de la dieta, sobre todo el de origen inorgánico por su elevado impacto en la fosfatemia del paciente.
- 6.
Pacientes y cuidadores deben saber interpretar el etiquetado nutricional para reconocer las fuentes de fósforo.
- 7.
Se limitará el aporte de los alimentos ricos en calcio que contengan elevada cantidad de fósforo.
- 8.
Los alimentos procesados, precocinados o congelados y las bebidas azucaradas o carbonatadas deben ser eliminadas de la dieta.
- 9.
Se pondrá énfasis en la importancia de que el niño o niña se mantenga activo y realice al menos 60 min de actividad física diaria.
La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
María José Alcázar Villar, Luis Antonio Castaño González, Diego de Sotto Esteban, Silvia Marín del Barrio, José María Martos Tello, Lorena Miñones Suarez, Eduard Mogas Viñals, Guiomar Pérez de Nanclares Leal, Lourdes Rey Cordo, Isolina Riaño Galán.
Autores Comité de Nutrición y Lactancia Materna de la AEP
Rosaura Leis Trabazo, Cristina Campoy Folgoso, Rafael Galera Martínez, Encina Gallego Mayo, Mercedes Gil Campos, David González Jiménez, Juan Rodríguez Delgado y Miguel Sáenz de Pipaón.
Nutricionistas
Olaya Fernández Seijas (Hospital Clínico Universitario de Santiago), Lucía Rivas Rodríguez (Hospital Clínico Universitario de Santiago), Belén Sarto Guerri (Hospital Vall d’Hebron) y Rocío Vázquez Cobela (Hospital Clínico Universitario de Santiago).