Se ha descrito una elevada prevalencia de síntomas gastrointestinales (GI) en los niños y adolescentes con trastornos del espectro del autismo (TEA). Además, se ha relacionado la presencia de dichos síntomas con mayor gravedad de la clínica TEA. Sin embargo, la frecuencia de síntomas GI en niños y adolescentes con TEA es muy variable a lo largo de los estudios y no se conoce su verdadera prevalencia. Por tanto, el objetivo del presente trabajo fue estimar la prevalencia de síntomas GI en niños y adolescentes con TEA.
Material y métodoSe realizó un metaanálisis siguiendo las directrices PRISMA. Se llevó a cabo una búsqueda sistemática rápida de nuevos estudios clínicos y observacionales desde agosto de 2012 en PubMed. Los análisis estadísticos se realizaron con el software R.
ResultadosDe 91 artículos potencialmente elegibles, solo 8 cumplieron nuestros criterios de inclusión. La prevalencia de síntomas GI osciló entre el 0 y el 69%, con una prevalencia general estimada del 33% (IC del 95%: 13-57%), cifra superior a la reportada por un metaanálisis previo para la población general pediátrica. Esta diferencia es todavía mayor al comparar específicamente los estudios que emplean la versión pediátrica del cuestionario ROMA III (QPGS-ROME III).
ConclusionesEstos resultados confirman la hipótesis de que existe una prevalencia superior de síntomas GI funcionales en el TEA frente a sus coetáneos neurotípicos.
A high prevalence of gastrointestinal (GI) symptoms has been described in children and adolescents with autism spectrum disorder (ASD). In addition, there is evidence that presence of GI symptoms is associated to greater severity of ASD. However, the frequency of GI symptoms in children and adolescents with ASD varies widely across studies, and their true prevalence is unknown. Therefore, the objective of this study was to estimate the prevalence of GI symptoms in children and adolescents with ASD.
Material and methodWe conducted a meta-analysis following the PRISMA guidelines. We carried out a rapid systematic search for recent clinical and observational studies published from August 2012 in PubMed. The statistical analyses were performed with the software R.
ResultsOf 91 potentially eligible articles, only 8 met our inclusion criteria. The prevalence of GI symptoms ranged between 0% and 69%, with an estimated general prevalence of 33% (95% CI, 13%-57%), higher than that reported by a previous meta-analysis for the general paediatric population. This difference is even greater in the specific comparison of studies that applied the paediatric version of the ROME III questionnaire (QPGS-ROME III).
ConclusionsThe results confirmed the hypothesis that there is a higher prevalence of functional GI symptoms in paediatric patients with ASD compared to their neurotypical peers.
Los trastornos del espectro del autismo (TEA) son un grupo de desórdenes generalizados del desarrollo caracterizados por la presencia de deficiencias persistentes en la comunicación e interacción sociales y patrones de comportamiento repetitivos1. Fueron descritos por primera vez en 1943 en una serie de 11niños, de entre 2 y 5 años, por el psiquiatra Leo Kanner, quien apuntó que 6de ellos presentaban «dificultades para la alimentación desde el inicio de la vida». Desde entonces, multitud de estudios han explorado la relación entre el TEA, los síntomas gastrointestinales (GI) y la alimentación, postulando la existencia de anomalías en la función GI de estos niños2-4. En 2009, se reunieron expertos de la Sociedad Norteamericana de Gastroenterología, Hepatología y Nutrición Pediátrica, que trabajaron conjuntamente en una revisión de la literatura publicada en 2012, que reflejaba que la prevalencia de trastornos GI en series de niños y adolescentes TEA publicadas hasta entonces oscilaba entre un 9 y un 91%4. Además, algunos estudios demuestran que los niños con síntomas GI exhiben una sintomatología más grave tanto de la clínica definitoria del trastorno como de otros síntomas (p. ej., trastornos del sueño, ansiedad, agresividad, hipersensibilidad a estímulos)3,5,6, que podrían responder a un intento del niño por comunicar su malestar, y muchas veces suponen el primer indicador de la clínica GI7. En este sentido, la evidencia sugiere que la interacción entre los síntomas GI y neuropsicológicos del TEA responde a mecanismos distintivos frente a los niños y adolescentes con desarrollo neurotípico (NT) a través del eje intestino-cerebro8,9 y algunos autores han propuesto que la comorbilidad de trastornos GI funcionales con el TEA sea considerado un síndrome de superposición que pudiera beneficiarse de terapias nutricionales o dirigidas a la microbiota10.
Sin embargo, la gran amplitud del rango de estimaciones de prevalencia traduce cierta falta de concordancia entre los estudios y ha teñido de incertidumbre muchas de las hipótesis que se sustentan en estas estimaciones. A este respecto, un metaanálisis de 2014 demostró que existía un incremento del riesgo de presentar síntomas GI funcionales en estos pacientes, siendo los más frecuentes la diarrea, el estreñimiento y el dolor abdominal11, si bien la prevalencia estimada de estos trastornos en niños y adolescentes con TEA sigue siendo una incógnita a día de hoy.
Consecuentemente, este metaanálisis tiene como objetivo proporcionar una estimación de la prevalencia de síntomas GI en niños y adolescentes con TEA utilizando técnicas estadísticas adecuadas por primera vez en la literatura científica.
Material y métodoEste metaanálisis siguió las directrices PRISMA12 para realizar y reportar metaanálisis (tabla suplementaria 1, anexo).
Estrategia de búsquedaSe realizó una búsqueda sistemática rápida de nuevos estudios clínicos y observacionales desde que se publicara la revisión de Coury et al. (01/08/2012)4 hasta la actualidad en PubMed vía Medline. La estrategia de búsqueda fue la siguiente: (Asperger's OR Autism OR Autism spectrum disorder OR Autistic OR Pervasive developmental disorder OR PDD-NOS) AND (Abdominal pain/abdomen OR bloating OR Celiac OR Colitis OR Constipation OR Diarrhea OR Digestion OR Digestive disorders OR Disaccharidase OR Endoscopy OR colonoscopy OR Esophagitis OR Functional gastrointestinal disorder OR Gastroenterology OR Gastritis OR Gastrointestinal OR Gluten OR Gastroesophageal reflux OR Irritable Bowel Disease OR náusea OR reflux OR Vomiting).
Criterios de inclusiónSe seleccionaron aquellos trabajos originales que: 1) reportaran datos sobre la prevalencia de los síntomas GI o suficientes datos para calcularla; 2) en una muestra representativa de niños o adolescentes con TEA; 3) cuyo diagnóstico de TEA hubiera sido verificado mediante un instrumento validado; 4) que estuvieran publicados en inglés o español, y 5) que tuvieran el texto completo disponible.
Se excluyeron estudios que preseleccionaran niños y adolescentes con comorbilidad GI, aquellos cuya muestra no incluyera niños o adolescentes con TEA (p. ej., enfermedad celíaca, trastorno pediátrico de la alimentación, esofagitis eosinofílica), o que no fueran representativos de este grupo de pacientes para la estimación de la prevalencia de trastornos GI (p. ej., niños con TEA que habían acudido a Urgencias por estreñimiento o que habían sido tratados mediante una intervención terapéutica antes de evaluar los síntomas GI).
Extracción de datosPara la extracción de datos, empleamos un formulario prediseñado con los siguientes ítems: país, tamaño muestral, proporción de mujeres, rango y media de edad, instrumentos empleados para la verificación del diagnóstico de TEA y la evaluación de la función GI.
Evaluación de la calidad metodológicaPara evaluar la calidad de los estudios, se utilizó una herramienta de riesgo de sesgo para la revisión sistemática de estudios específicos de prevalencia13. La calidad se evaluó en función de 8 criterios, cada uno con una puntuación de 0 a 1. En este sistema de evaluación metodológica, se otorgó un punto por cada uno de los siguientes criterios presentados: 1) se utilizó una muestra aleatoria o una población completa; 2) hubo un marco de muestreo no sesgado (es decir, datos censales); 3) el tamaño de la muestra era adecuado (> 30 sujetos); 4) se utilizaron mediciones estándar; 5) los resultados fueron medidos por evaluadores imparciales; 6) la tasa de respuesta era adecuada (> 70%) y se describían las pérdidas; 7) se informaba de los intervalos de confianza y el análisis de subgrupos, y 8) se describían los sujetos del estudio. La puntuación total podía oscilar entre 0 (mala calidad) y 8 (alta calidad). En función de la puntuación total, los estudios se calificaron como de bajo riesgo de sesgo (6-8), moderado (4-5) o alto (0-3).
Análisis estadísticoLos datos se combinaron mediante el método de la varianza inversa genérica con un modelo de efectos14, con transformación de proporción de doble arcoseno para tener en cuenta la variabilidad y heterogeneidad de las tasas de prevalencia entre los estudios incluidos15. Varios estudios16 han demostrado que este ajuste puede reducir la posibilidad de falsos positivos, especialmente cuando el número de estudios es pequeño. Los principales resultados se exponen como una proporción con su correspondiente intervalo de confianza del 95% (IC del 95%) junto a los resultados de heterogeneidad estadística17.
La heterogeneidad entre los estudios se evaluó mediante la Q de Hedges, con una significación estadística establecida en p < 0,10 y se cuantificó con el estadístico I2 con su IC del 95%18. Valores entre 25-50% se consideran bajos, 50-75% moderados y 75% o más altos19, e implican que las diferencias en los resultados para la misma asociación exposición-enfermedad no pueden explicarse completamente mediante la variación del muestreo. Realizamos análisis de subgrupos para explorar las fuentes de heterogeneidad esperadas en metaanálisis de estudios observacionales19 y un análisis de sensibilidad para determinar la influencia de cada estudio individual en el resultado general omitiendo los estudios uno por uno17. No se realizó una metarregresión, ya que, con menos de 10 estudios, el poder estadístico era insuficiente20.
Para evaluar posibles sesgos de publicación, empleamos el estadístico N de seguridad, que es más preciso que los gráficos de embudo convencionales para metaanálisis de estudios de proporciones21, recomendado cuando hay menos de 10 estudios22. Indica la cantidad de estudios no significativos, no publicados (o faltantes) que sería necesario agregar al metaanálisis para reducir un resultado global estadísticamente significativo a no significativo, por lo que habrá confianza en los resultados combinados si este número es grande en relación con el número de estudios observados21. Para la representación gráfica del sesgo de publicación, empleamos el gráfico de Doi y el índice de Luis Furuya-Kanamori (LFK), que están especialmente indicados para los metaanálisis de estudios de proporciones, y tienen mayor sensibilidad y potencia que el diagrama de embudo y la regresión de Egger23. En cuanto a su interpretación, la asimetría en el gráfico de Doi implica la posibilidad de un de sesgo de publicación, y el índice LFK proporciona una medida cuantitativa donde una puntuación dentro de ± 1 equivale a «no asimetría», ± 2 indica «asimetría menor» y superior a ± 2 indica «asimetría importante».
Todos los análisis estadísticos fueron llevados a cabo con el software R con los paquetes metaprop, metafor y dmetar para metaanálisis (https://www.r-project.org). Los valores de p se expresan para 2colas, y se fija en 0,05 un resultado como estadísticamente significativo, excepto cuando se indique lo contrario.
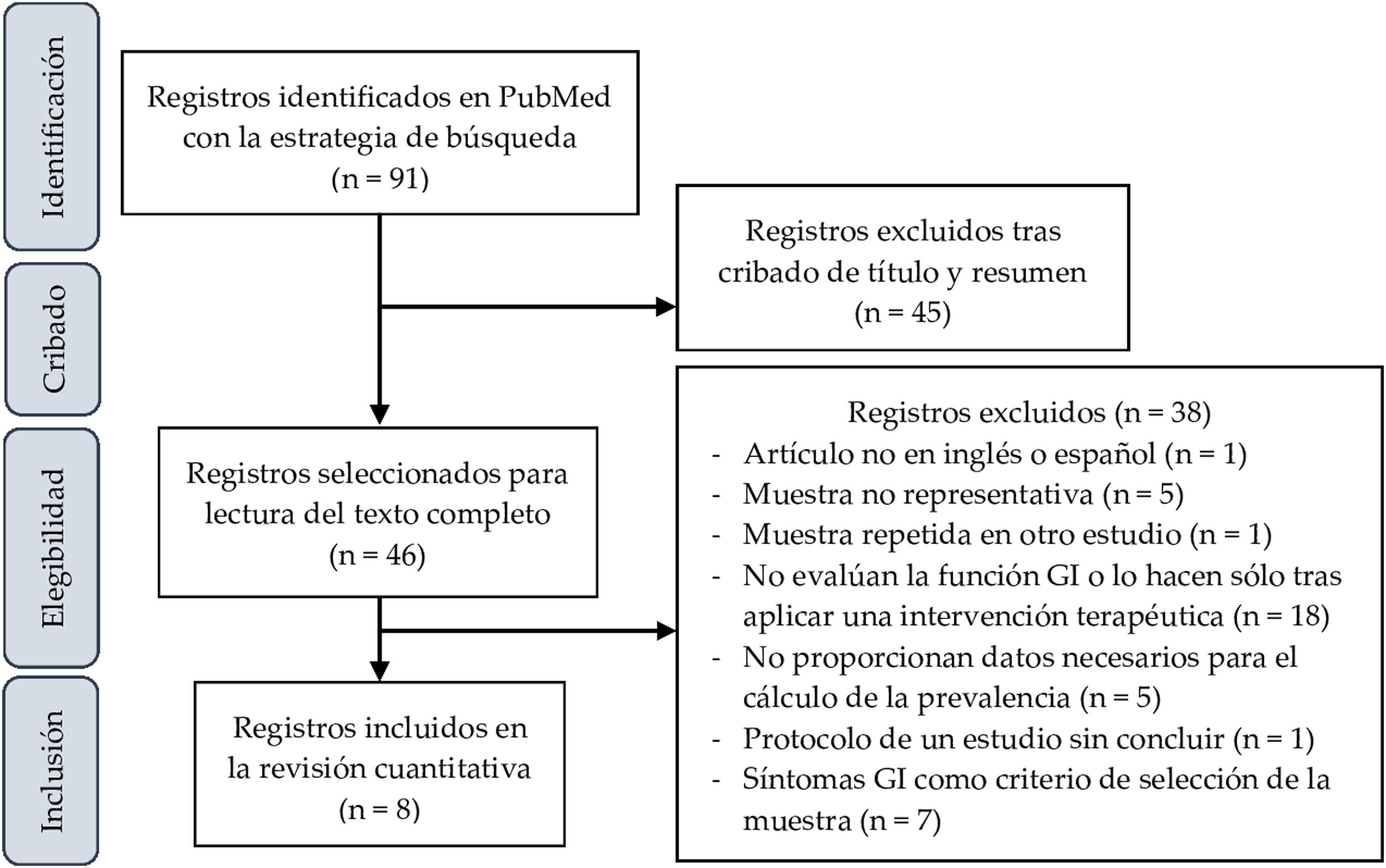
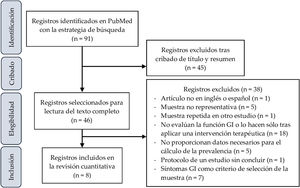
ResultadosSelección de estudiosLa figura 1 corresponde al diagrama de selección de artículos. La búsqueda inicial produjo 1.666 resultados, que se redujeron a 91 al aplicar los siguientes filtros: Clinical Study, Clinical Trial, Comparative Study, Controlled Clinical Trial, Multicenter Study, Observational Study, Pragmatic Clinical Trial, Randomized Controlled Trial, 2012/08/01-2022/3/14.
Tras la lectura de sus títulos y resúmenes, 46 trabajos fueron seleccionados para la lectura del texto completo, tras lo cual 38 fueron excluidos por distintas razones reseñadas en la figura 1. Finalmente, 8 artículos fueron incluidos para el análisis cuantitativo de la prevalencia de síntomas GI en los niños y adolescentes con TEA.
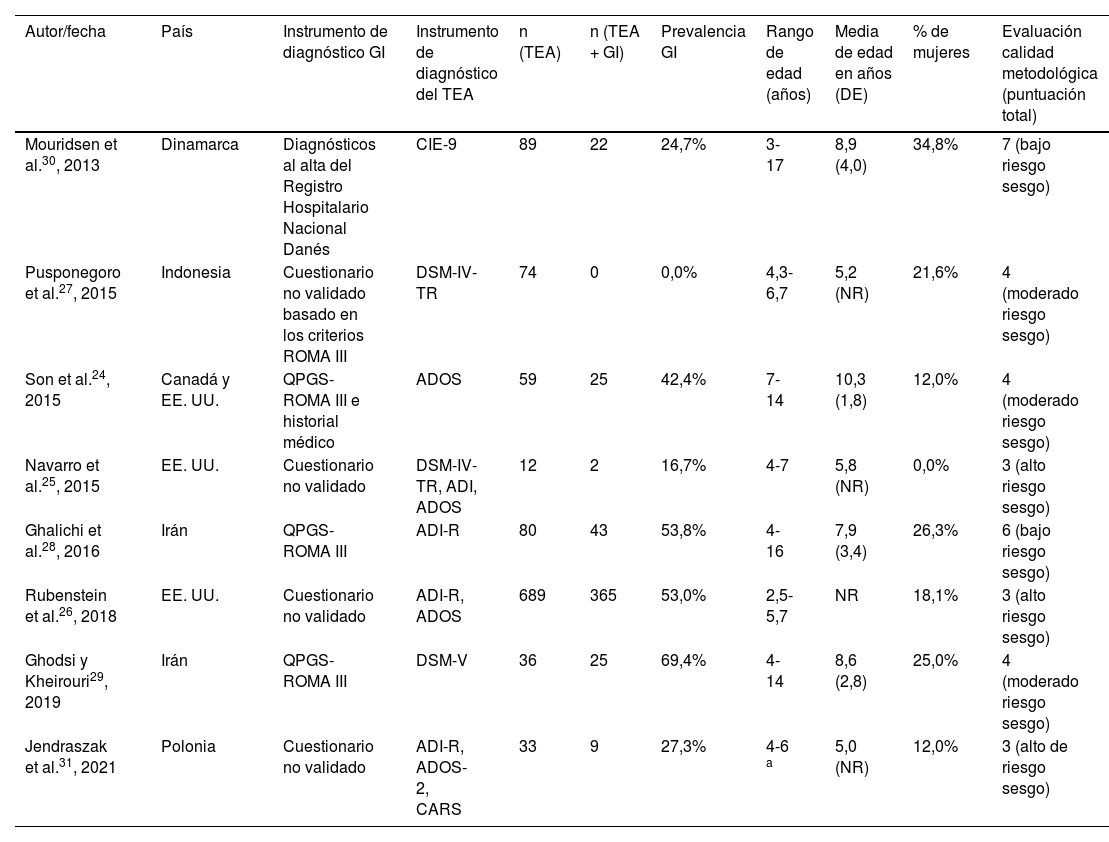
Descripción de los estudios incluidosEn la tabla 1 se recogen las principales características de los 8 estudios incluidos en la revisión cuantitativa. Un 37,5% de los estudios se llevó a cabo en América24-26, otro 37,5%, en Asia27-29 y el 25% restante, en Europa30,31. El tamaño de la muestra osciló entre 12 y 689 niños, con un tamaño medio de 134, cantidad que se redujo a 54,7 niños tras la exclusión del estudio más grande31. La edad media fue de 7,7 años, tras ajustar por el tamaño muestral de cada uno de los 7 estudios que aportaron esta información24,25,27-30. Finalmente, la proporción de mujeres en los estudios osciló entre 0 y 34,8%, con un total de 19,85% de niñas y jóvenes en sus muestras combinadas.
Características de los estudios incluidos en la revisión cuantitativa
| Autor/fecha | País | Instrumento de diagnóstico GI | Instrumento de diagnóstico del TEA | n (TEA) | n (TEA + GI) | Prevalencia GI | Rango de edad (años) | Media de edad en años (DE) | % de mujeres | Evaluación calidad metodológica (puntuación total) |
|---|---|---|---|---|---|---|---|---|---|---|
| Mouridsen et al.30, 2013 | Dinamarca | Diagnósticos al alta del Registro Hospitalario Nacional Danés | CIE-9 | 89 | 22 | 24,7% | 3-17 | 8,9 (4,0) | 34,8% | 7 (bajo riesgo sesgo) |
| Pusponegoro et al.27, 2015 | Indonesia | Cuestionario no validado basado en los criterios ROMA III | DSM-IV-TR | 74 | 0 | 0,0% | 4,3-6,7 | 5,2 (NR) | 21,6% | 4 (moderado riesgo sesgo) |
| Son et al.24, 2015 | Canadá y EE. UU. | QPGS-ROMA III e historial médico | ADOS | 59 | 25 | 42,4% | 7-14 | 10,3 (1,8) | 12,0% | 4 (moderado riesgo sesgo) |
| Navarro et al.25, 2015 | EE. UU. | Cuestionario no validado | DSM-IV-TR, ADI, ADOS | 12 | 2 | 16,7% | 4-7 | 5,8 (NR) | 0,0% | 3 (alto riesgo sesgo) |
| Ghalichi et al.28, 2016 | Irán | QPGS-ROMA III | ADI-R | 80 | 43 | 53,8% | 4-16 | 7,9 (3,4) | 26,3% | 6 (bajo riesgo sesgo) |
| Rubenstein et al.26, 2018 | EE. UU. | Cuestionario no validado | ADI-R, ADOS | 689 | 365 | 53,0% | 2,5-5,7 | NR | 18,1% | 3 (alto riesgo sesgo) |
| Ghodsi y Kheirouri29, 2019 | Irán | QPGS-ROMA III | DSM-V | 36 | 25 | 69,4% | 4-14 | 8,6 (2,8) | 25,0% | 4 (moderado riesgo sesgo) |
| Jendraszak et al.31, 2021 | Polonia | Cuestionario no validado | ADI-R, ADOS-2, CARS | 33 | 9 | 27,3% | 4-6 a | 5,0 (NR) | 12,0% | 3 (alto de riesgo sesgo) |
6-GSI: índice de gravedad gastrointestinal de 6 ítems.
ADI: entrevista para el diagnóstico del autismo (-R: revisada);. ADOS: escala de observación para el diagnóstico del autismo; CIE-9: Clasificación Internacional de Enfermedades, 9.ª edición; DSM: Manual diagnóstico y estadístico de los trastornos mentales; GI: gastrointestinal; NR: no reportado; QPGS-ROMA III: Cuestionario pediátrico de síntomas GI, versión ROMA III; 6-GSI: índice de gravedad gastrointestinal de 6 ítems.
En 7 de 8estudios, el diagnóstico de TEA de los niños fue verificado por médicos, psiquiatras o psicólogos en el momento del reclutamiento con diferentes instrumentos de diagnóstico validados25-31. Esto se hizo a través de una entrevista directa con el niño o los padres en todos los estudios menos uno, donde 2psiquiatras revisaron los registros psiquiátricos de los niños para asegurarse de que cumplieran con los criterios de diagnóstico de la 9.ª edición de la Clasificación Internacional de Enfermedades (CIE-9)30. Un único estudio que no verificó el diagnóstico en el momento del reclutamiento se incluyó en nuestra síntesis porque recopilaba su muestra de una base de datos de niños con TEA evaluados exhaustivamente por un médico con una amplia batería de medidas de diagnóstico, incluido la Escala de observación para el diagnóstico del autismo (ADOS)24.
El método elegido para la evaluación de la función GI mostró gran heterogeneidad entre los estudios. Solo el 37,5% de ellos utilizó la versión pediátrica del cuestionario ROMA III (QPGS-ROME III)24,28,29, instrumento ampliamente recomendado para el diagnóstico de trastornos GI funcionales31. En un estudio se utilizó una variación de este cuestionario (12,5%)27 y en otro se evaluaron diagnósticos al alta de enfermedades GI en el registro nacional de salud, clasificados según la CIE30. El 37,5% restante de los estudios utilizó cuestionarios heterogéneos no validados que investigaban varios síntomas GI25,26,31. Los ítems más replicados incluidos en la evaluación fueron estreñimiento o heces duras, que fue investigado específicamente por el 87,5% de los estudios24-29,31, dolor abdominal (75%)24-29 vómitos o náuseas (75%)24-29, distensión abdominal/flatulencia/aerofagia/exceso de gases (75%)24,27-29,31 y diarrea o heces blandas (62,5%)24-27,31. Además, algunos estudios incluyeron categorías más inespecíficas («otros»)26,30.
Cabe señalar que el único estudio que investigó enfermedades GI diagnosticadas no restringió su búsqueda a aquellas con un origen funcional30 y tampoco lo hizo otro estudio que evaluó problemas tanto funcionales como no funcionales, como enfermedades del páncreas e hígado, celiaquía e intolerancia a la lactosa31.
En cuanto a la calidad de los estudios, 2fueron clasificados como de riesgo de sesgo bajo28,30 y 3como de riesgo elevado25,26,31. La principal limitación presente en todos los estudios fue la ausencia de reporte de intervalos de confianza para la prevalencia y análisis de subgrupos, así como la ausencia de marco de muestreo censal con la excepción de Mouridsen et al.30 (tabla 1, tabla suplementaria 2 [anexo]).
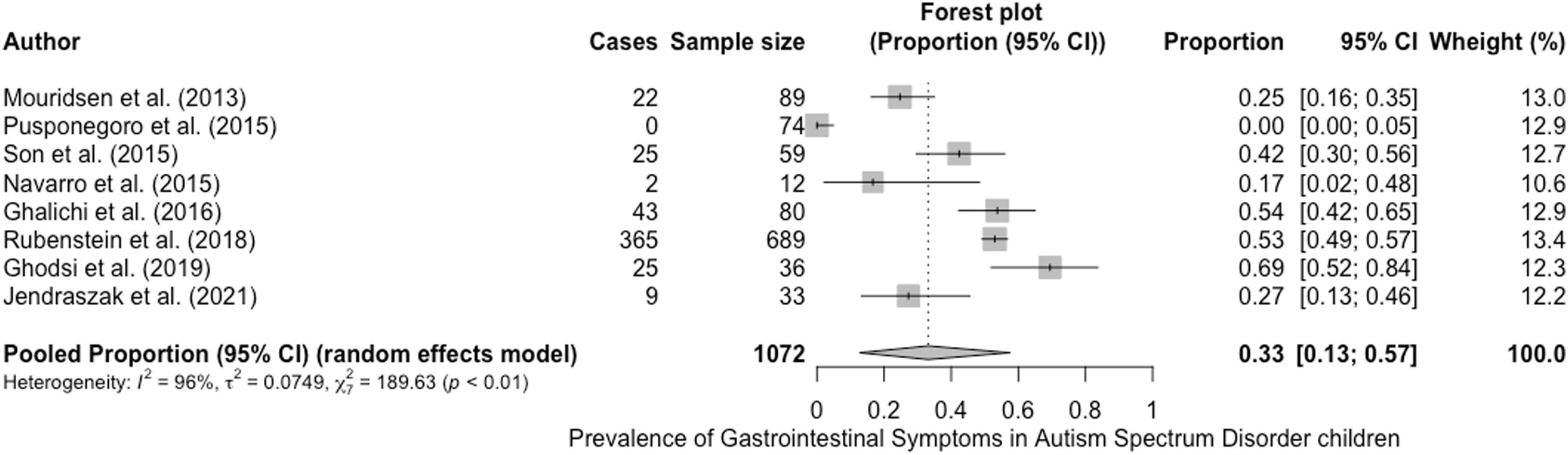
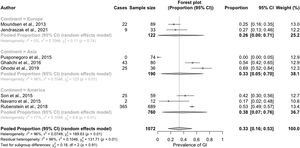
La prevalencia de síntomas GI osciló entre el 027 y el 69%29 (tabla 1) (fig. 2). Nuestra prevalencia general estimada de síntomas GI fue del 33% (IC del 95%: 13-57%), con una heterogeneidad significativa entre los estudios (test Q: p < 0,01; I2 = 96%)
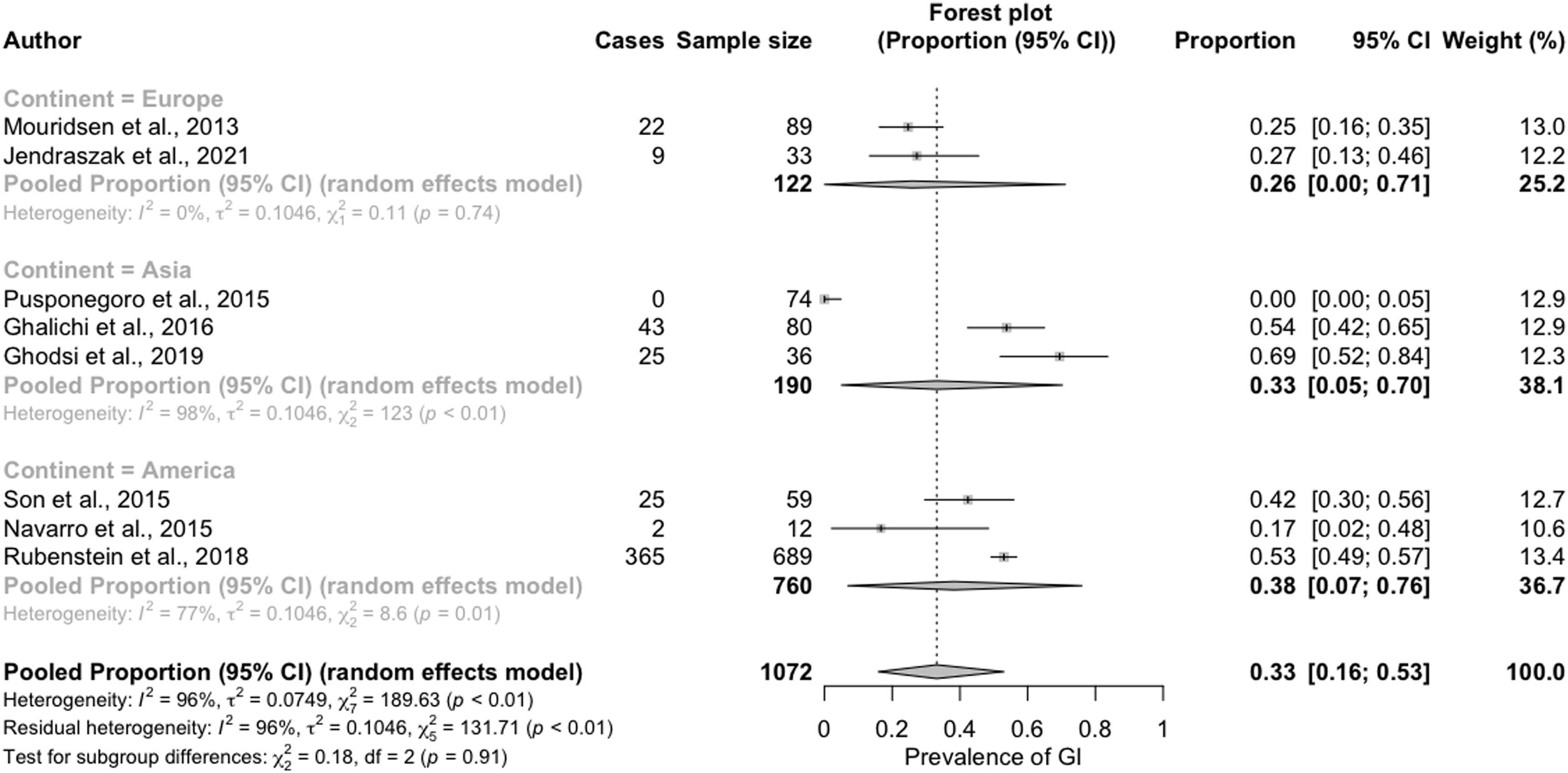
El análisis de subgrupos para identificar las fuentes de heterogeneidad encontró una mayor prevalencia de síntomas GI para los estudios realizados en América (38% [IC del 95%: 7-6%]) o Asia (33% [IC del 95%: 5-70%]) en comparación con los de Europa (26% [IC del 95%: 0-71%]). Esta diferencia, sin embargo, no alcanzó la significación estadística (fig. 3).
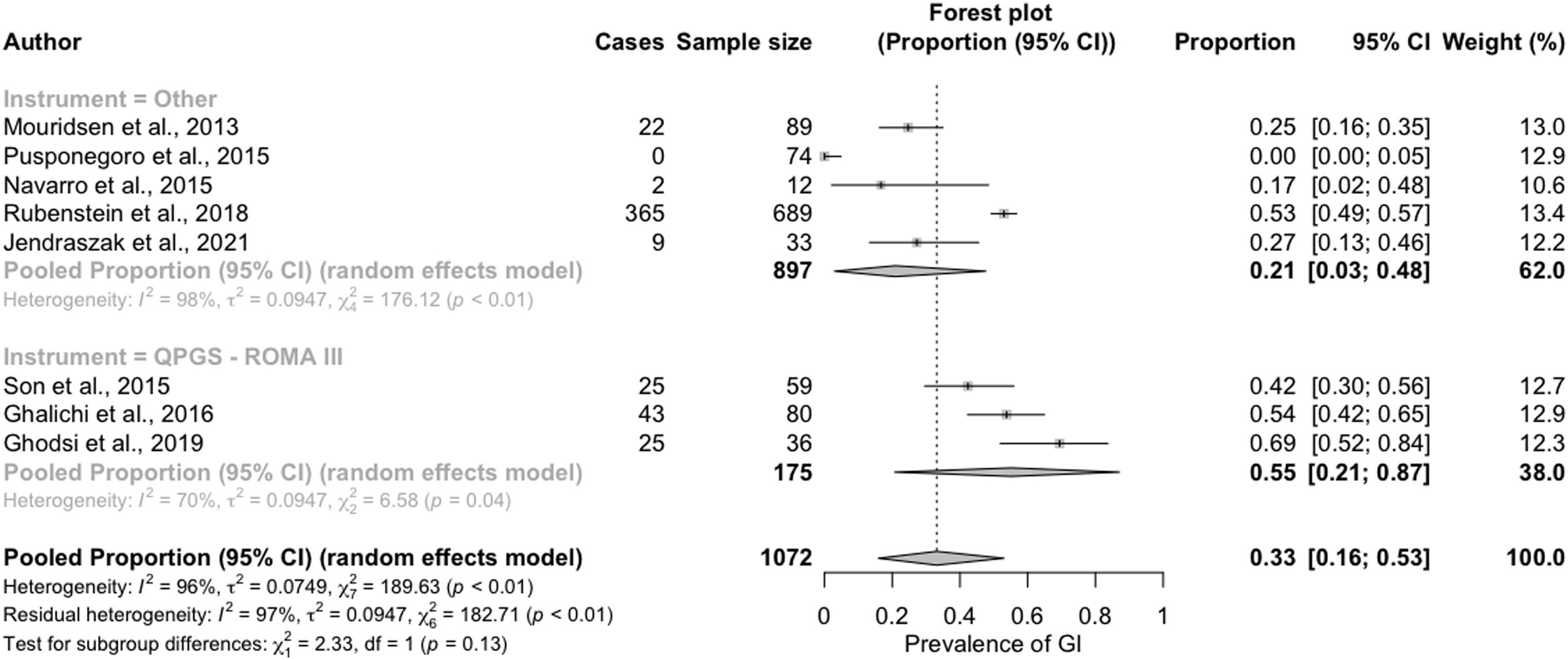
También observamos una mayor prevalencia de síntomas GI en los estudios que utilizaron el QPGS-ROMA III (55% [IC del 95%: 21-87%]) con respecto a los que utilizaron otras medidas de diagnóstico (21% [IC del 95%: 3-48%]) (fig. 4).
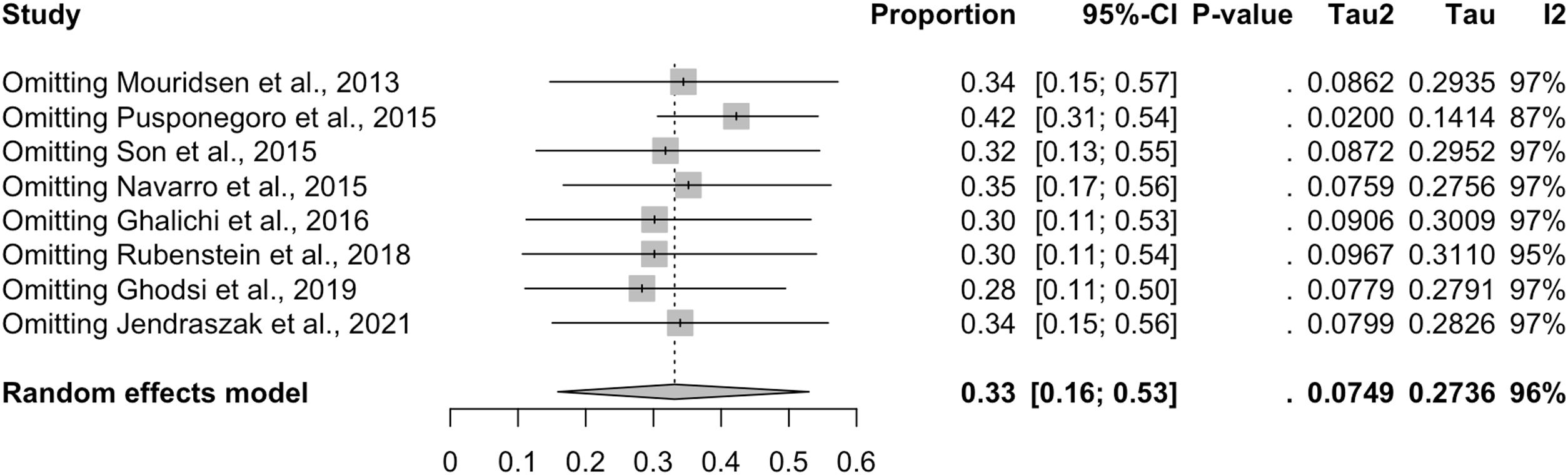
La exclusión de los estudios del análisis uno por uno no cambió sustancialmente la prevalencia combinada de síntomas GI, que varió entre el 28% (IC del 95%: 9-53%), con Ghodsi y Kheirouri29 excluido, y el 42% (IC del 95%: 26-59%), con Pusponegoro et al.27 excluido (fig. 5). Esto indica que ningún estudio individual tuvo un impacto desproporcionado en la prevalencia general de los síntomas GI.
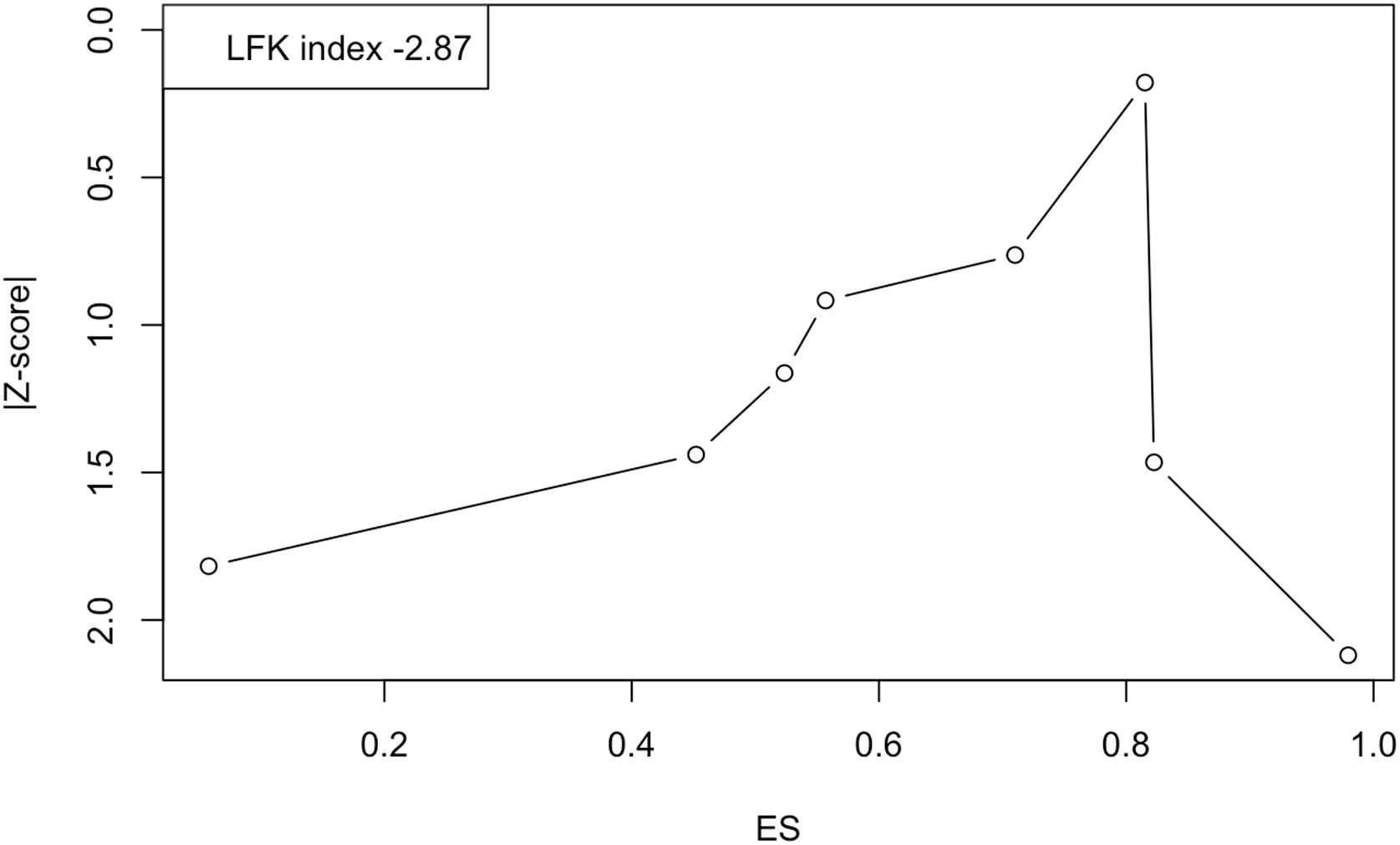
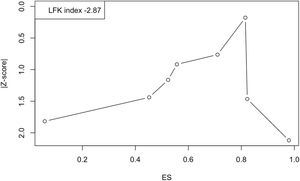
Finalmente, la figura 6 muestra el gráfico Doi y el índice LFK de –2,87, lo que indica una «asimetría importante» y, por ende, la probable presencia de sesgo de publicación. Sin embargo, el valor del estadístico N de seguridad fue de 730, lo que indica que se necesitarían 730 estudios con resultados nulos para reducir la prevalencia global observada a la no significación.
DiscusiónLa prevalencia de síntomas GI en niños con TEA estimada por este metaanálisis es de un 33% (IC del 95%: 13-57%), cifra superior a la reportada por un metaanálisis del 2015 para la población general pediátrica de entre 4 y 18 años (13,5% [IC del 95%: 11,8-15,3%])32. Aunque esta comparación está limitada porque 2estudios en nuestro metaanálisis incluyen a niños menores de 4 años26,30, un estudio de 2018 demostró que no existían diferencias significativas en la prevalencia de síntomas GI entre los niños de 0-3 y 4-18 años33. Estos hallazgos refrendan los resultados del metaanálisis previo de 2014, que estimó una odds ratio de 4,42 para el riesgo de síntomas GI en niños y adolescentes con TEA frente a sus coetáneos NT11.
Otra limitación de nuestro trabajo es que existe cierta disimilitud entre los criterios de evaluación GI de los estudios recogidos, puesto que algunos trabajos excluyen organicidad25,26,31 y otros no lo hacen30. De hecho, los cuestionarios de ROMA III, recomendados por la Sociedad Española de Pediatría Gastroenterología, Hepatología y Nutrición Pediátrica para diagnóstico de trastornos GI funcionales en la población pediátrica, establecen específicamente como criterio diagnóstico la «ausencia de evidencia de enfermedad orgánica» en todas las definiciones34. Esta afirmación se eliminó en la versión más reciente de los criterios, ROMA IV, y se reemplazó por «después de una evaluación médica adecuada, los síntomas no pueden atribuirse a otra afección médica»35.
Por ello, consideramos especialmente relevante destacar que la diferencia en la prevalencia de síntomas GI fue mayor al comparar específicamente aquellos estudios que emplean los criterios QPGS-ROMA III, estimándose en un 55% (IC del 95%: 21-87%) para los niños y adolescentes con TEA frente a un 16,4% (IC del 95%: 13,5-19,4%) en la población general pediátrica32.
Así pues, recomendamos el uso de cuestionarios validados para el diagnóstico de trastornos GI funcionales en esta población, ya que podría facilitar el análisis agregado de los resultados en el futuro. Asimismo, dado que se ha postulado la presencia de síntomas GI como modulador en la etiopatogénesis del TEA36 y su respuesta a distintas terapias nutricionales, consideramos que puede ser relevante realizar un análisis disgregado por la presencia de sintomatología GI al analizar el efecto de estas intervenciones, como ya han hecho algunos autores37, para determinar si su eficacia sobre la gravedad del TEA está mediada por la presencia de sintomatología GI o es independiente de la misma.
Finalmente, es relevante señalar que una de las principales limitaciones del trabajo es que, al tratarse de una revisión sistemática rápida, la búsqueda fue realizada únicamente en una base de datos, aplicando filtros restrictivos que muy probablemente hayan condicionado la pérdida de estudios que habrían cumplido nuestros criterios de selección. Por todo esto, el número de estudios incluidos es reducido y no ha sido posible realizar un análisis disgregado por síntomas. Sin embargo, PubMed es la mayor base de datos de literatura médica38 y existe evidencia de que metaanálisis de pocos estudios pueden establecer conclusiones válidas39, lo que subraya el valor del presente trabajo, especialmente en el contexto de gran variabilidad de prevalencias en los estudios existentes que hace que su interpretación, sin un análisis cuantitativo, sea meramente especulativa. Adicionalmente, hemos advertido una elevada heterogeneidad entre los resultados de los diferentes estudios incluidos lo que podría comprometer la pertinencia de combinar dichos resultados mediante técnicas meta-analíticas. No obstante, como destaca Cuijppers (2016), integrar los resultados de múltiples estudios en un metaanálisis tiene varias ventajas: dado que se combinan los estudios individuales, el poder estadístico para detectar (la ausencia de) efectos es mayor que en el caso de los estudios individuales. Esto permite realizar una estimación más precisa y exacta del verdadero efecto. Dado que los estudios que se incluyen en un metaanálisis se examinan sistemáticamente, también es posible explorar las incoherencias entre los estudios y examinar si los efectos difieren entre subgrupos específicos de estudios40.
ConclusionesLa prevalencia de síntomas GI en niños y adolescentes con TEA en el presente metaanálisis osciló entre el 0 y el 69%, con una prevalencia general estimada en un 33% (IC del 95%: 13-57%), cifra que no se vio afectada de forma significativa por la edad media al inicio del estudio, el sexo o el continente, pero resultó ser significativamente mayor al analizar exclusivamente los estudios que emplearon la versión pediátrica del cuestionario ROMA III.
No obstante, la heterogeneidad significativa entre los estudios revelada por la Q de Hedges obliga a interpretar las conclusiones del estudio con cautela.
Para minimizar estas limitaciones metodológicas en el futuro, recomendamos el uso de cuestionarios validados para el diagnóstico de trastornos GI funcionales en esta población, concretamente, los criterios ROMA IV, herramienta aceptada para el diagnóstico y la cuantificación de síntomas GI funcionales por las principales sociedades de Pediatría.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.