Introducción
El infarto arterial perinatal, está adquiriendo mayor protagonismo como causa de parálisis cerebral y otras alteraciones neurológicas incluyendo epilepsia y deterioro cognitivo 1.
La incidencia en el período perinatal, se estima en uno de cada 4.000 recién nacidos a término y año 1-3 aunque es difícil de determinar, ya que algunos son asintomáticos y pueden no ser diagnosticados inicialmente 2.
La patogénesis del infarto cerebral (IC) se debe a la interrupción brusca del flujo de una arteria cerebral. La isquemia es secundaria a embolia o a trombosis. La asociación con el parto instrumental no ha sido claramente demostrada, aunque existen casos descritos en la literatura médica 4,5. El diagnóstico requiere confirmación por imagen 6.
Observación clínica
Paciente 1
Recién nacido varón de 2 días de vida que ingresa por sospecha de infección. La exploración física fue normal salvo ligera irritabilidad. Primer hijo de madre sana de 33 años. Embarazo controlado con ecografías normales. Parto vaginal (fórceps) en la semana 39 + 2 de gestación. Test de Apgar al minuto de 9 y a los 5 min de 10. pH arterial de cordón 7,25. Parámetros antropométricos, dentro de la normalidad.
La bioquímica sanguínea incluidos amonio y lactato, hemograma, pruebas de coagulación, gasometría capilar y la bioquímica y citología del líquido cefalorraquídeo (LCR) realizados al ingreso, fueron normales. Radiología de tórax normal. Hemocultivo, urocultivo, proteína C reactiva (PCR) de enterovirus y cultivo bacteriano en LCR negativos.
A las 50 h de vida, presentó un episodio convulsivo clónico de extremidades superiores de 10 s de duración, con desviación de cabeza a la derecha, que cedió espontáneamente. Se inició tratamiento con fenobarbital intravenoso. En el electroencefalograma (EEG) realizado se observaron descargas de ondas agudas en áreas bifrontales, y la ecografía cerebral objetivó una dilatación de la región parietal del ventrículo lateral derecho.
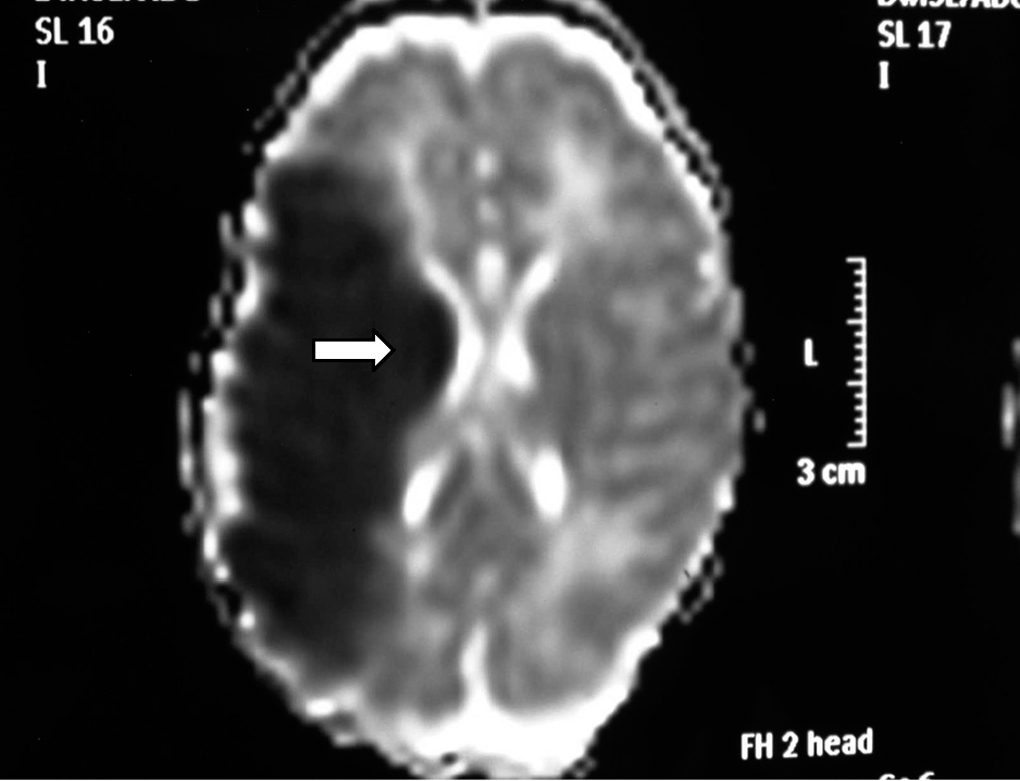
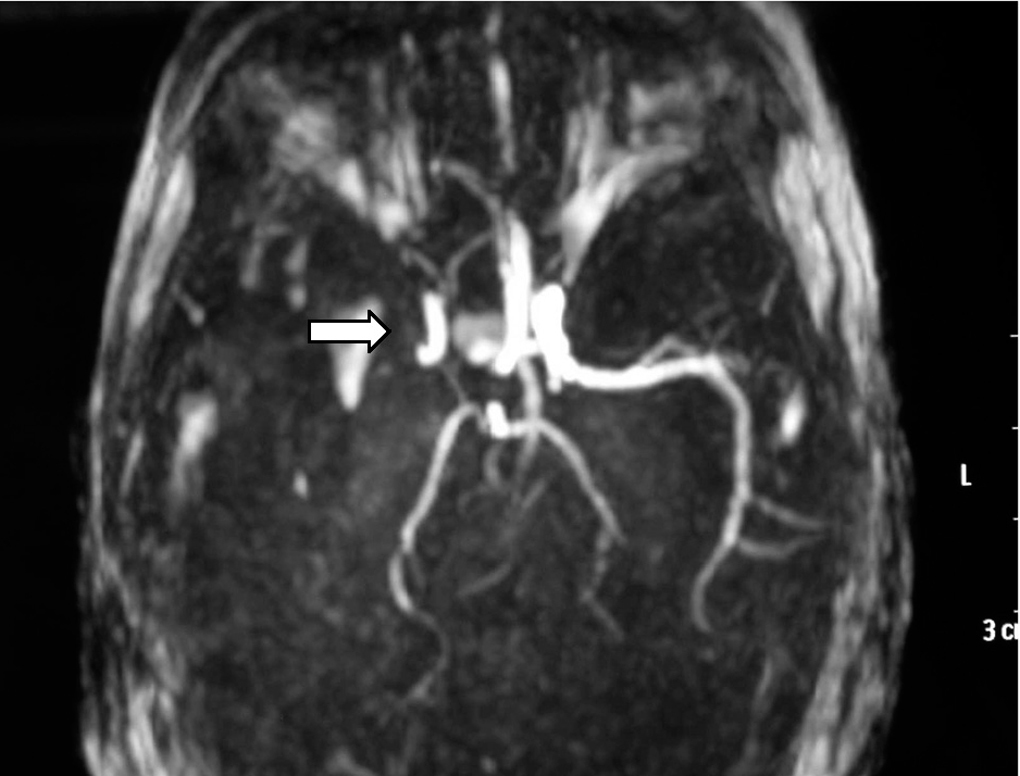
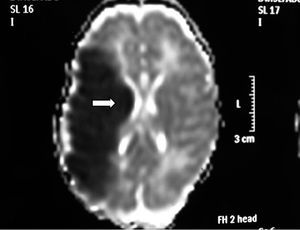
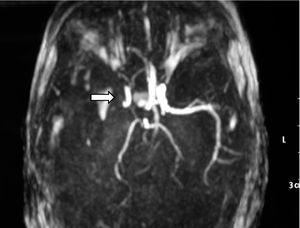
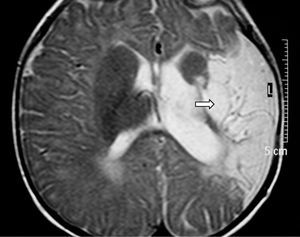
Ante los hallazgos clínicos, a los 3 días de vida se realiza resonancia magnética (RM) cerebral, apreciándose un extenso infarto agudo dependiente de la arteria cerebral media derecha (fig. 1). El EEG y la ecografía cerebral realizadas a los 5 días, mostraron, respectivamente, presencia de ondas agudas frontales derechas ocasionales y un aumento de ecogenicidad en la región parietal, temporal derecha y tálamo derecho. Se completó el estudio con una ecografía Doppler cerebral y una angio-RM (fig. 2) que objetivaron ausencia de flujo en arteria cerebral media derecha confirmando el diagnóstico de infarto cerebral.
Figura 1.RM axial con técnicas de difusión (DWMRI). Ausencia de señal en el lóbulo parietal derecho.
Figura 2. Angio-RM: ausencia de ACM derecha.
El electrocardiograma (ECG) fue normal, en la ecocardiografía presentaba un foramen oval permeable de 2,5 mm con cortocircuito izquierda-derecha siendo el resto normal. El estudio de hipercoagulabilidad demostró normalidad de la coagulación, la mutación G1691A factor V de Leiden y la de la protrombina PTG20210A estaban ausentes, la lipoproteína A (15mg/dl), homocisteína (5,35 μmol/l), antitrombina III (78,1 %), proteína C activada (56 %), proteína S activada (80 %), anticuerpos anticardiolipina (< 3 PLU/ml) en rangos normales para nuestro laboratorio y el anticoagulante lúpico y β2-glucoproteína-1 eran negativos.
La evolución clínica fue favorable por lo que a los 13 días de vida fue dado de alta con fenobarbital oral el cual fue retirado paulatinamente hasta su suspensión a las 2 semanas.
A los 3 meses de vida, presentaba hipotonía axial, con inicio de hipertonía a nivel de la extremidad superior izquierda de predominio en bíceps con inclusión de pulgar izquierdo. El EEG fue normal y la ecografía cerebral mostraba atrofia importante del hemisferio cerebral derecho.
En la actualidad, a los 6 meses de vida, no ha repetido episodios convulsivos. Presenta hemiparesia izquierda con hipertonía moderada del bíceps braquial, puño cerrado e inclusión del pulgar. La sedestación es parcial. Prensión voluntaria con la mano derecha desde los 5 meses y medio, la izquierda la mantiene cerrada e hipertónica. Actitud contemplativa no muy expresiva. En las extremidades inferiores los reflejos osteotendinosos izquierdos son vivos con aumento del área reflexógena.
Paciente 2
Recién nacido varón de 2 h de vida que ingresa por distrés respiratorio. Primer hijo de madre sana de 28 años. Embarazo controlado. Parto instrumental (espátulas) en semana 41 de gestación. Test de Apgar al minuto de 9 y a los 5 min de 10. pH arterial de cordón: 7,18. Parámetros antropométricos, dentro de la normalidad. A la exploración física presentaba un cefalohematoma parietal izquierdo, estado general afectado con mala coloración, test de Silverman 3, tórax hiperinsuflado con buena entrada de aire bilateral, el resto de exploración por aparatos fue normal. A las 12 h de vida, presentó tres episodios de crisis de cianosis con bradicardia e hipotonía generalizada, que precisaron ventilación con mascarilla.
La bioquímica sanguínea, incluyendo amonio, lactato y pirúvico, hemograma, pruebas de coagulación y gasometría capilar, bioquímica y citología de LCR, fueron normales. Radiografía de tórax, normal. Hemocultivo, urocultivo, PCR de enterovirus y cultivo bacteriano en LCR, negativos.
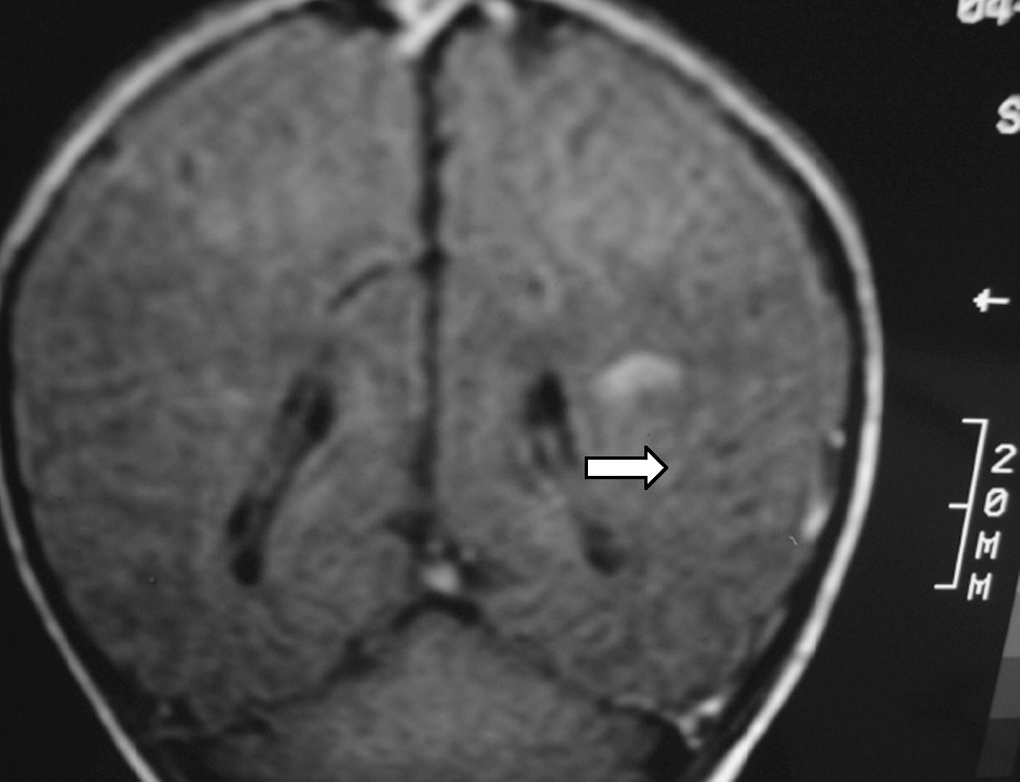
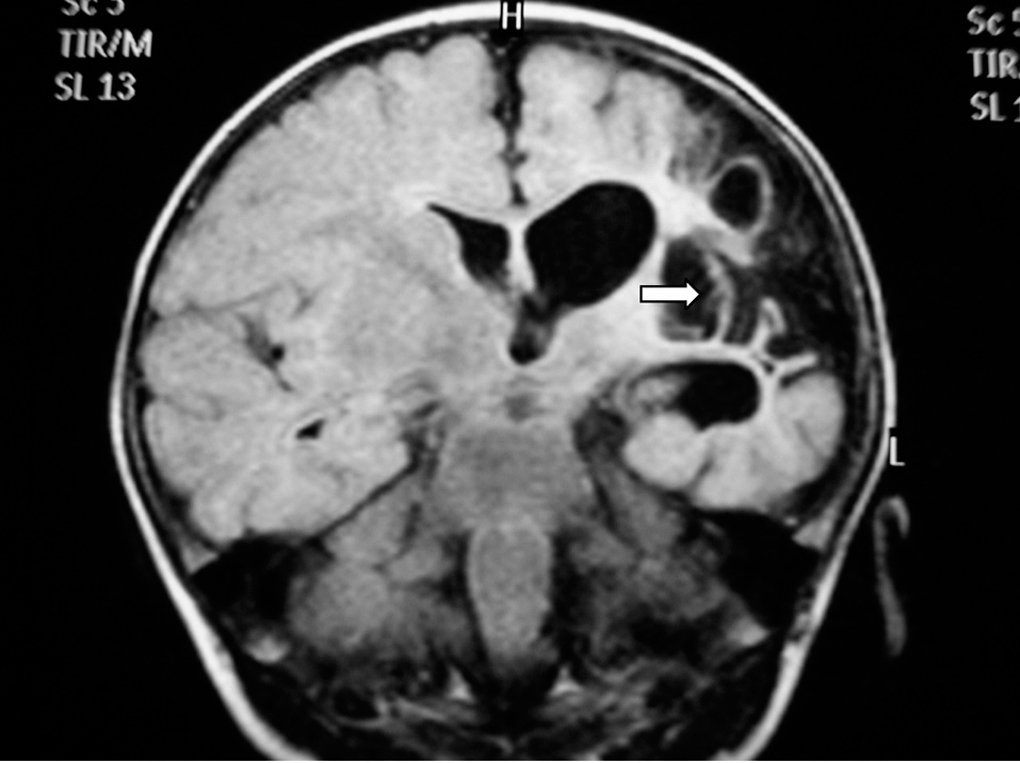
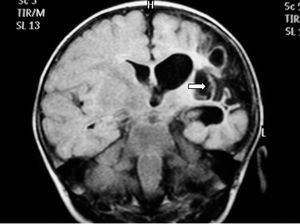
Se realizaron EEG y ecografía cerebral a las 24 h de vida que fueron normales. Ante la persistencia de la hipotonía, se realizó al quinto día de vida RM cerebral que mostró hallazgos compatibles con una lesión isquémica en el territorio arterial de la cerebral media bilateral, asociado a hemorragias subcorticales en dicho territorio, así como a nivel de sustancia blanca periauricular izquierda (fig. 3).
Figura 3.T1 coronal. Zona de infarto en fase hemorrágica en sustancia blanca paraventricular izquierda dependiente del territorio de la ACM izquierda. Áreas hemorrágicas corticosubcorticales del mismo hemisferio.
En el estudio cardiológico realizado al día siguiente de su ingreso, presentaba en el ECG un intervalo QT prolongado secundario a hipoxia, en la ecocardiografía se apreciaba un foramen oval permeable de 1,5 mm y mínimo cortocircuito izquierda-derecha. En el estudio de hipercoagulabilidad se observó coagulación normal, la mutación G1691A factor V de Leiden y la de la protrombina PTG20210A estaban ausentes, los valores de lipoproteína A (14,5 mg/dl), homocisteína (3,31 μmol/l), antitrombina III (118,7 %), proteína C activada (96,5 %), proteína S activada (116 %), anticuerpos anticardiolipina (2 PLU/ml) en rangos normales y el anticoagulante lúpico y los anticuerpos β2-glucoproteína-1 negativos.
No fueron autorizados por la familia otros procedimientos diagnósticos por lo que tampoco se dispone de seguimiento posterior por imagen.
Durante el ingreso recibió tratamiento con fenobarbital oral. A los 16 días de vida fue dado de alta, presentando a la exploración neurológica hipotonía cervicoaxial. Se retiró progresivamente el fenobarbital hasta su suspensión a las 2 semanas.
A los 4 meses presentó una buena evolución clínica con exploración neurológica normal. A lo largo de los 2 años y medio que ha permanecido bajo control, su exploración neurológica ha sido normal en todo momento con un buen desarrollo psicomotor aunque ha presentado dificultades en la adquisición del lenguaje.
Paciente 3
Recién nacido varón de 8 h de vida que ingresa por presentar crisis de palidez con desaturación. Primer hijo vivo (un aborto anterior) de madre sana de 34 años. Gestación conseguida tras técnica de reproducción asistida, embarazo controlado con ecografías normales. Parto vaginal (espátulas) en la semana 39 + 3 de gestación. Test de Apgar al minuto de 9 y a los 5 min de 10. pH arterial de cordón 7,22. Parámetros antropométricos, dentro de la normalidad. La exploración física por aparatos fue normal. A las 24 h de vida, presentó un episodio de hipotonía generalizada con ligera disminución de movilidad de brazo derecho.
La bioquímica sanguínea incluidos amonio y lactato, pruebas de coagulación, gasometría capilar y la bioquímica y citología del LCR, fueron normales. En el hemograma se objetivó leucocitosis con desviación izquierda. Radiología de tórax normal. Hemocultivo, urocultivo, PCR de enterovirus y cultivo bacteriano en LCR negativos.
La ecografía cerebral y el EEG fueron normales.
Presenta una evolución clínica y analítica favorable por lo que es dado de alta a la semana de vida.
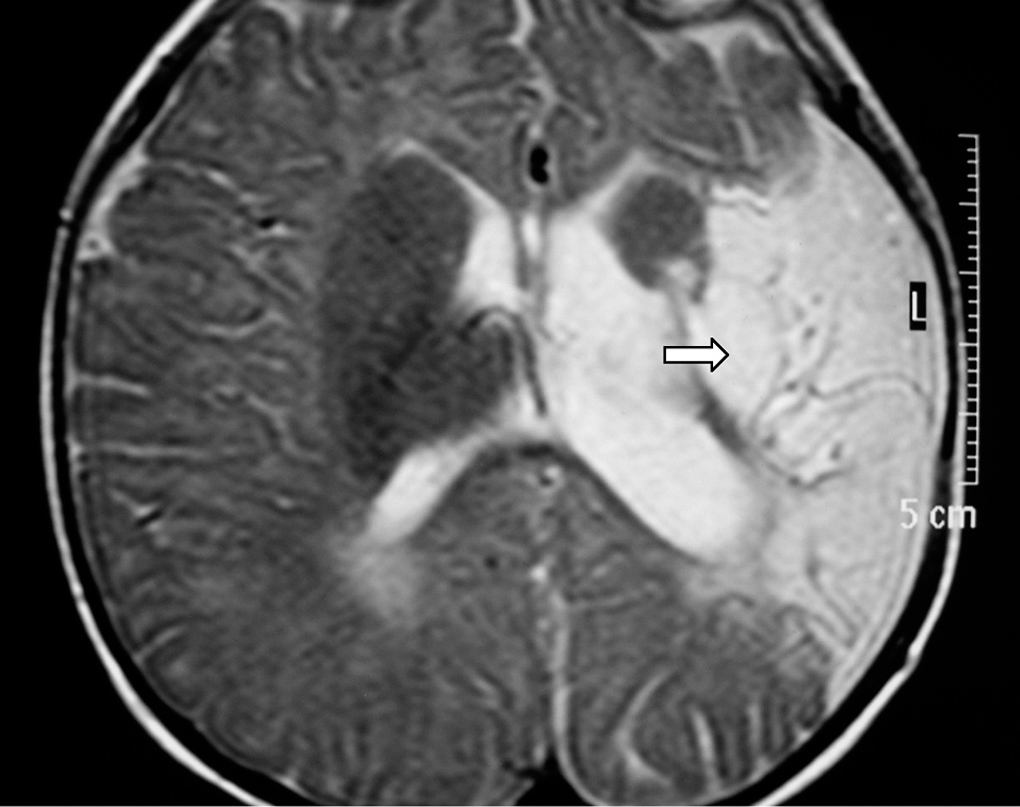
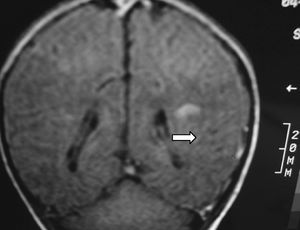
A los 4 meses de vida se constató una hemiparesia derecha por lo que se realizó RM cerebral, presentando atrofia de la mayor parte del lóbulo parietal izquierdo y del tálamo del mismo lado con múltiples cavidades porencefálicas en el territorio de la arteria cerebral media izquierda. Se observaba así mismo un ensanchamiento del ventrículo lateral derecho (figs. 4 y 5). La angio-RM está pendiente de realización.
Figura 4.T2 axial. Atrofia de la mayor parte del lóbulo parietal izquierdo y del tálamo de ese lado.
Figura 5.Flair coronal: hemiatrofia izquierda con múltiples cavidades porencefálicas en el territorio de la ACM izquierda.
El estudio de hipercoagulabilidad demostró coagulación normal, la mutación G1691A factor V de Leiden y la de la protrombina PTG20210A estaban ausentes, la lipoproteína A (16 mg/dl), homocisteína (5 μmol/l), antitrombina III (103 %), proteína C activada (62 %), proteína S activada (66 %), anticuerpos anticardiolipina (9 PLU/ml), estaban en rangos normales para nuestro laboratorio. El anticoagulante lúpico fue negativo. Los anticuerpos IgA, IgG, IgM β2-glucoproteína-1 fueron positivos.
Actualmente a los 6 meses de vida, persiste la hemiparesia derecha, con incapacidad para la sedestación.
Discusión
Desde el avance de técnicas de imagen se ha visto que la incidencia de IC en el período neonatal es mayor de la sospechada por las manifestaciones clínicas.
El período perinatal es una época de aumento de riesgo de fenómenos protrombóticos, siendo el IC 34 veces más frecuente entre 2 días anteriores y un día posterior al parto 2.
La incidencia de IC se incrementa durante el embarazo, en el que además de apreciarse una tendencia a un estado de hipercoagulabilidad fisiológica 7,8, en la mitad de los casos pueden asociarse otros factores de riesgo tales como asfixia perinatal, preeclampsia, corioamnionitis, anomalías cardíacas, policitemia e infecciones sistémicas 9 aunque diversos autores señalan no haber encontrado diferencias significativas en la presencia de estos factores entre sujetos con infarto y controles 1.
Las cardiopatías congénitas o los cortocircuitos transitorios derecha-izquierda favorecen el IC. La relativa elevada incidencia de IC arterial neonatal podría ser consecuencia de un embolismo paradójico dado que el filtro pulmonar es obviado 10. Los primeros 2 pacientes presentaba en el estudio ecocardiográfico un mínimo foramen oval permeable.
El parto instrumental, ha sido descrito como factor de riesgo de trombosis venosa y arterial 4,5. En todos nuestros casos el parto fue instrumental.
En los últimos años está adquiriendo importancia el estudio de los factores protrombóticos que podrían contribuir hasta en el 35-53 % a la aparición de IC 11.
Entre éstos destacan la mutación del factor V de Leiden 12, mutación de la protrombina, el incremento de la lipoproteína A y la hiperhomocisteinemia 13,14. Otros factores conocidos son la deficiencia de proteína C y S, déficit de antitrombina III, resistencia a la proteína C activada 15, la presencia de anticuerpos antifosfolípido (anticoagulante lúpico, anticuerpos anticardiolipina y anticuerpos β2-glucoproteína-1) 2,16-18.
En nuestros primeros 2 pacientes el estudio de hipercoagulabilidad fue rigurosamente normal. El tercer caso presentaba positividad para anticuerpos anti-β2-glucoproteína-1.
Ebeling et al 11 presentaron una serie de 6 niños con infarto isquémico cerebral en edades comprendidas entre un día de vida y 11,5 meses con títulos positivos de dichos anticuerpos y concluían que a pesar de tener que interpretarse los resultados con precaución ya que se desconocía si el aumento era secundario a lesión vascular o daño cerebral asociado o realmente indicaba mecanismo trombogénico molecular, era una determinación que podría ser de utilidad en el diagnóstico de infarto cerebral en niños. Recientemente, los datos presentados en un estudio in vitro realizado por Fischetti et al 19 indican que los anticuerpos anti-B2GPI son capaces de desencadenar la cascada de la coagulación en presencia de factores proinflamatorios como los fosfolípidos.
La manifestación clínica más frecuente de un IC en el recién nacido son las convulsiones 2,4,11 como en el primer paciente. En su ausencia, puede presentarse como hipotonía, letargia e incluso episodios de dificultad respiratoria y/o apnea 4 lo cual puede dificultar la sospecha diagnóstica. En nuestro tercer paciente, los signos clínicos presentes en el período neonatal fueron inespecíficos y no se llegó al diagnóstico hasta los 4 meses de edad tras la realización de una RM por presentar hemiparesia derecha. En el período neonatal inmediato, no suele ser habitual la existencia de focalidad como forma de presentación de IC 2,20.
El diagnóstico de certeza es por imagen siendo la RM por difusión la técnica más habitualmente utilizada por ser en particular sensible para la detección temprana de IC 2,21. La angio-RM es útil para determinar el vaso ocluido 2,22. La ecografía cerebral resulta siempre diagnóstica de IC cuando es realizada al menos 72 h después del inicio de los síntomas, siendo sólo en el 44 % de los pacientes en los que se efectúa previamente 4,23. El EEG tiene significado pronóstico en las primeras 24 h 2. Un trazado anormal unilateral o bilateral está en la mayoría de las ocasiones asociado a un mal pronóstico motor 24.
El IC neonatal es una importante causa de parálisis cerebral y de otras secuelas neurológicas, como epilepsia y retraso cognitivo 1,25-27. Es responsable de al menos el 22-70 % de la parálisis cerebral congénita hemipléjica de la población a la que afecta 1. La incidencia de hemiplejía sin embargo es variable según autores 18,28. Un tercio de los niños con infarto cerebral neonatal, tendrán un desarrollo normal a largo plazo 29. La rápida categorización del pronóstico motor podría permitir identificar a los pacientes que se beneficiarían de una rehabilitación precoz. Se sabe que la topografía de la lesión es crucial para determinar el pronóstico motor, de manera que se desarrolla con más frecuencia una hemiparesia espástica en los IC que afectan al tronco principal de la arteria cerebral media (ACM) (sobre todo lesiones bilaterales o que afecten más del 10 % del volumen intracraneal) que en los que afectan a vasos distales. Del mismo modo, los IC que afectan conjuntamente a los ganglios de la base (GB), cápsula interna (CI) y hemisferios cerebrales (HC), se asocian con hemiparesia; teniendo un mejor pronóstico motor si únicamente afectan a 1 o 2 de las localizaciones mencionadas 19,30,31. El primero y el tercero de los pacientes descritos pueden incluirse respectivamente en los grupos mencionados previamente, habiendo desarrollado ambos hemiparesia. El pronóstico motor del segundo paciente que no presentaba afectación del tronco principal de ACM ni concomitantemente de GB, CI y HC, ha sido mejor.
Como resumen queremos señalar que el IC en el período neonatal se presenta más frecuentemente de lo esperado hasta hace pocos años. Los síntomas pueden ser sutiles y pasar desapercibidos en el momento inicial. El parto instrumental podría considerarse factor de riesgo de desarrollar IC aunque son necesarios más estudios al respecto. El diagnóstico se basará en la sospecha clínica confirmada con técnicas por imagen. Una vez realizado el diagnóstico deberá realizarse un exhaustivo estudio de trombofilia dada la elevada incidencia de trastornos hematológicos relacionados con el IC y la importancia de su conocimiento para la planificación de futuros embarazos.
Correspondencia: Dra. E. Oñate Vergara.
Servicio de Pediatría. Hospital Donostia.
Avda. Dr. Begiristain, s/n. 20080 San Sebastián. España.
Correo electrónico: eonate@chdo.osakidetza.net
Recibido en julio de 2005.
Aceptado para su publicación en enero de 2006.