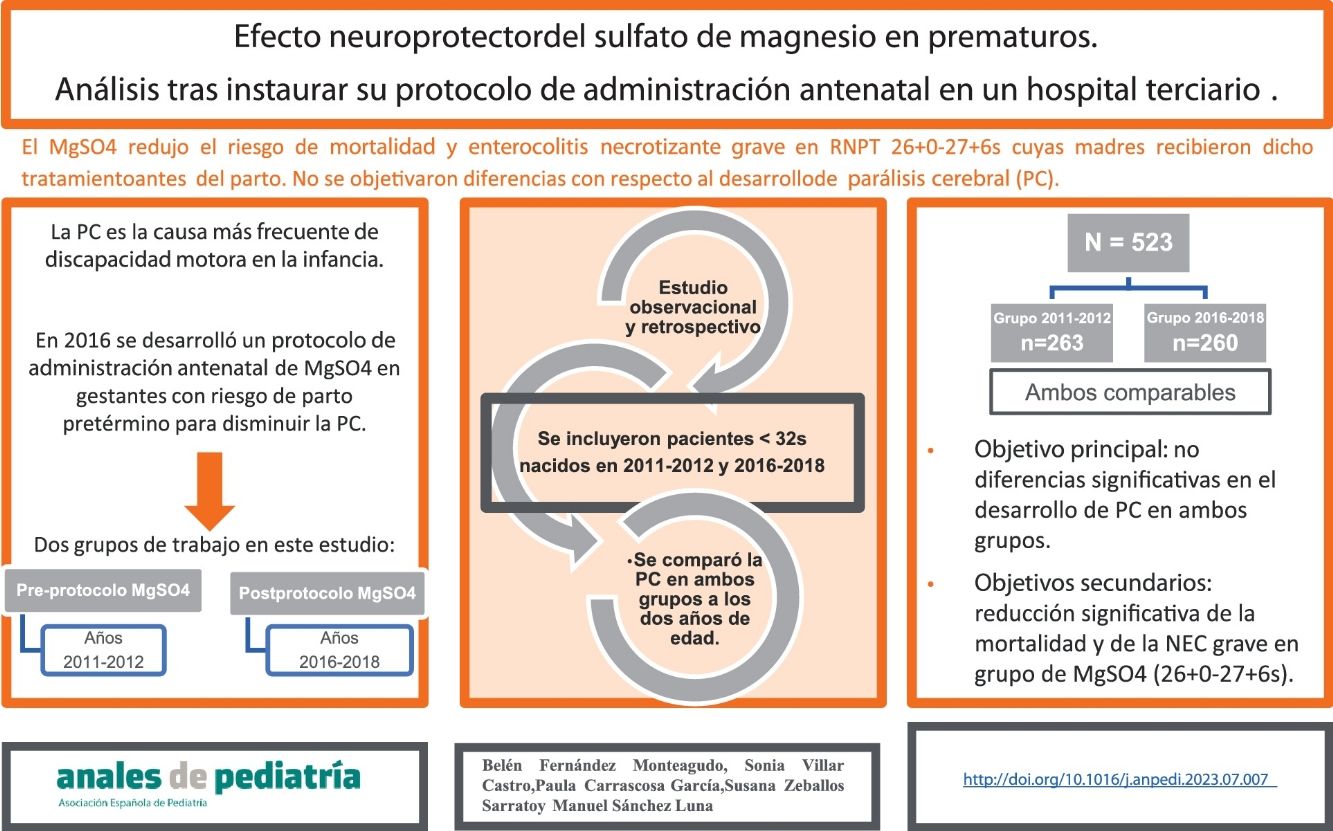
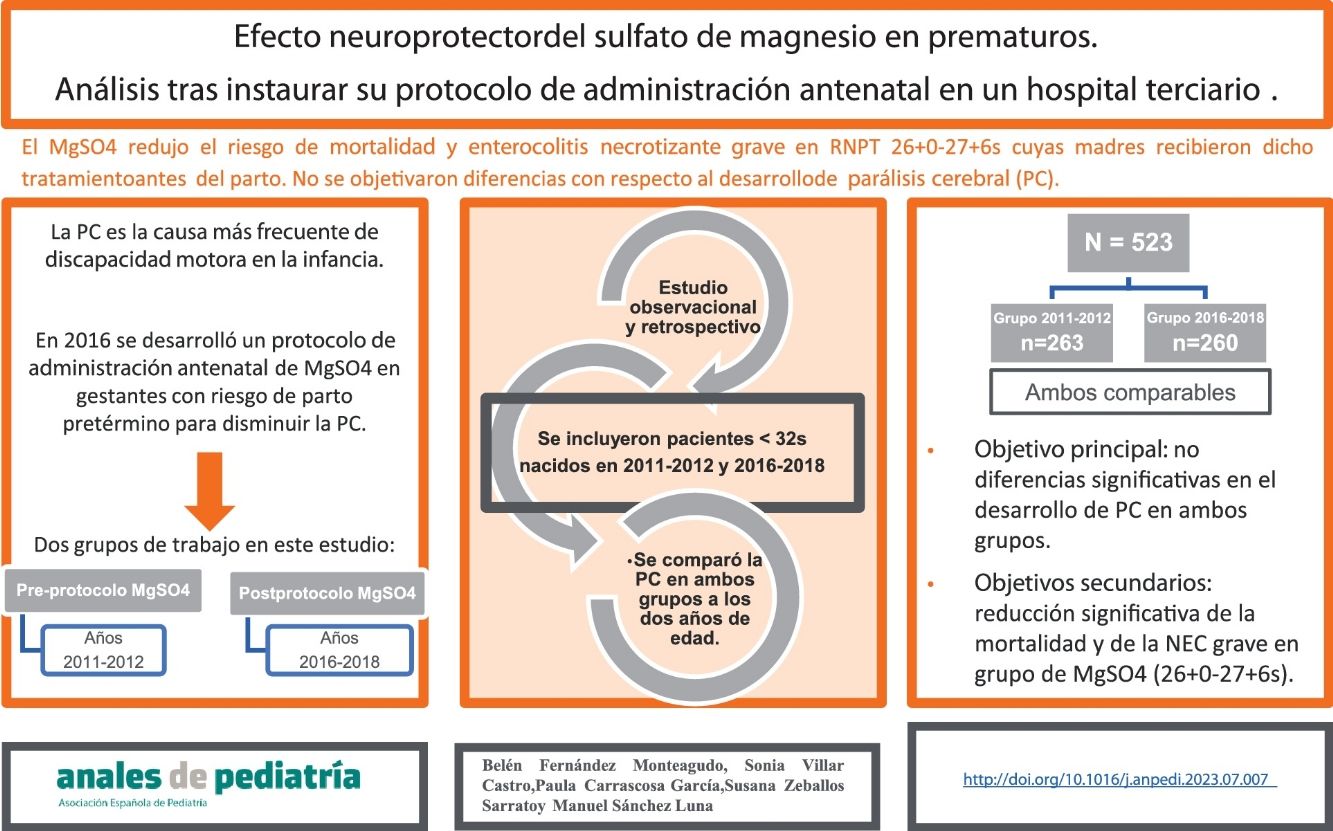
En 2016 se desarrolló en nuestro centro un protocolo de administración antenatal de sulfato de magnesio en gestantes con riesgo de parto pretérmino inminente como método para disminuir el riesgo de parálisis cerebral (PC).
Material y métodosSe realizó un estudio observacional y retrospectivo en un hospital de nivel IIIC con objetivo principal de comparar la incidencia de PC previa y posteriormente a la puesta en marcha de este protocolo. Con respecto a los objetivos secundarios, a destacar la incidencia de déficit cognitivo, enterocolitis necrosante y mortalidad en ambos grupos. Los pacientes incluidos fueron recién nacidos prematuros por debajo de 32 semanas de edad gestacional nacidos en los años 2011-2012 (previo a la instauración del protocolo) y 2016-2018 (posteriormente a la instauración del protocolo, cuyas madres habían recibido sulfato de magnesio como neuroprotector). Las características clínicas y epidemiológicas de ambos grupos fueron comparables entre sí.
ResultadosSe recogieron datos de un total de 523 pacientes, 263 y 260 de cada grupo. Con respecto al objetivo principal, no se encontraron diferencias estadísticamente significativas. Se objetivó, en el grupo de pacientes nacidos entre 2016-2018 y con edad gestacional entre 26+0 y 27+6 semanas, cuyas madres recibieron sulfato de magnesio, una reducción estadísticamente significativa de la mortalidad y del riesgo de enterocolitis necrosante grave.
ConclusionesEn nuestro trabajo, el sulfato de magnesio administrado a madres en riesgo de parto prematuro, no disminuyó el riesgo de desarrollar PC.
In 2016, a protocol was developed in our hospital for the antenatal administration of magnesium sulfate in pregnant women at risk of imminent preterm birth as a method to reduce the risk of cerebral palsy (CP).
Material and methodsWe conducted a retrospective observational study in a level IIIC hospital with the primary objective of comparing the incidence of CP before and after the implementation of this protocol. Among the secondary outcomes, we ought to highlight the incidence of cognitive deficits and necrotizing enterocolitis and the mortality in both groups. The sample consisted of preterm newborns delivered before 32 weeks of gestation in 2011-2012 (prior to the implementation of the protocol) and in 2016-2018 (after the implementation of the protocol, whose mothers had received magnesium sulfate for neuroprotection). The clinical and epidemiological characteristics of both groups were comparable.
ResultsWe collected data for a total of 523 patients, 263 and 260 in each group. As regards the primary outcome, we did not find statistically significant differences between groups. We observed a statistically significant reduction in mortality and the risk of severe necrotizing enterocolitis in the group of patients born in the 2016-2018 period and between 26+0 and 27+6 weeks of gestation, whose mothers had received magnesium sulfate.
ConclusionsIn our study, the administration of magnesium sulfate to mothers at risk of preterm birth did not decrease the risk of developing CP.
El parto pretérmino es la causa más frecuente de mortalidad y morbilidad perinatal, siendo responsable del 75% de las muertes neonatales no vinculadas a malformaciones congénitas. Los recién nacidos pretérmino tienen además un riesgo mayor de deficiencias neurológicas, como parálisis cerebral (PC), ceguera, sordera o disfunción cognitiva (DC), considerada como retraso del desarrollo o deficiencia intelectual.
La PC es la causa más frecuente de discapacidad motora en la infancia, y el principal motivo de discapacidad física grave1. El International Executive Committee for the definition of Cerebral Palsy propuso la siguiente definición: «Un grupo de trastornos permanentes del desarrollo del movimiento y la postura, que causan limitación de la actividad y que se atribuyen a alteraciones no progresivas ocurridas durante el desarrollo cerebral fetal o infantil. Los trastornos motores de la parálisis cerebral son acompañados a menudo por alteraciones sensoriales, perceptivas, de la cognición, comunicación y comportamiento»1. Su prevalencia oscila alrededor de 2/1.000 recién nacidos vivos y entre los principales factores de riesgo se encuentra la prematuridad, aumentando el riesgo de forma proporcional al disminuir la edad gestacional2.
Resulta fundamental considerar estrategias efectivas que tengan un impacto en la reducción de la tasa de PC. Una de estas estrategias es la utilización del sulfato de magnesio (MgSO4) antenatal, que actúa sobre varias vías en el sistema nervioso y previene la excitotoxicidad y la activación de vías apoptóticas3. Se han publicado varios ensayos controlados aleatorizados4-7, que fueron evaluados en metaanálisis8-10 y en varias revisiones Cochrane11-13. Las principales conclusiones fueron que el MgSO4 podría disminuir el riesgo de PC moderada-grave y favorecer un mejor neurodesarrollo en pacientes prematuros sin objetivarse efectos adversos importantes en los pacientes ni en sus madres, por lo que sería una terapia válida a ofrecer a todas las madres con riesgo de parto prematuro.
Ante la evidencia disponible, en 2016 se desarrolló en nuestro centro un protocolo de administración antenatal de MgSO4 en gestantes hasta las 32 semanas de edad gestacional con riesgo de parto pretérmino inminente en las siguientes 24h.
El objetivo principal era determinar si la administración antenatal de MgSO4, siguiendo el protocolo descrito en nuestro hospital, reduce la incidencia de PC a los 2 años de edad postmenstrual estratificado por edad gestacional.
Con respecto a los objetivos secundarios, se fundamentaron en determinar si la administración antenatal de MgSO4 disminuye el riesgo de disfunción cognitiva, lesión moderada/severa en la ecografía transfontanelar (hemorragia intraventricular grado 3 e infarto hemorrágico intraventricular), displasia broncopulmonar, enterocolitis necrosante, retinopatía de la prematuridad y mortalidad.
Material y métodosEstudio observacional retrospectivo analítico y unicéntrico. Se incluyen los recién nacidos prematuros por debajo de 32 semanas de edad gestacional nacidos en nuestro hospital en los años 2011-2012 (previo a la instauración del protocolo de MgSO4) y 2016-2018 (posteriormente a la instauración del protocolo).
Los criterios de selección y exclusión de los pacientes son los siguientes:
- –
Criterios de inclusión: recién nacidos prematuros entre las 24 y las 32 semanas de edad gestacional nacidos entre los años 2011-2012 y 2016-2018.
- –
Criterios de exclusión: niños con malformaciones congénitas mayores o con diagnóstico prenatal de cromosomopatía.
Se detallan a continuación definiciones de términos importantes en este trabajo:
- -
Parálisis cerebral infantil (PCI)
Discapacidad motora permanente, no progresiva, ocurrida por insulto en período fetal/neonatal, limitante para habilidades y actividad.
Se clasifica la gravedad según la escala Gross Motor Function Classification System extendida y revisada (GMFCS E & R)14:
- I.
(Leve): camina sin restricciones, con limitaciones para las actividades motoras más avanzadas.
- II.
(Moderado): andar sin aparatos de ayuda. limitaciones para andar fuera de casa y por la calle.
- III.
(Moderado): anda con la ayuda de aparatos para la movilidad. Limitaciones para andar fuera de casa y por la comunidad.
- IV.
(Grave): propia movilidad con limitaciones, los niños son transportados o utilizan sus aparatos de movilidad fuera de casa y en la comunidad.
- V.
(Grave): propia movilidad muy limitada incluso con sus ayudas tecnológicas.
- I.
- -
Disfunción cognitiva (DC), se define como:
- •
Puntuación <85 en la escala de neurodesarrollo validada Brunet Lézine que se realiza a los pacientes a los 2 años de edad posmenstrual a cargo del servicio de psicología infantil.
- •
Retraso en el desarrollo psicomotor evidenciado en las sucesivas revisiones por parte de su pediatra de atención primaria a través de entrevistas clínicas tanto con los pacientes como con sus familiares.
- -
Lesión moderada-severa en ecografía transfontanelar: se considerará en el estudio aquellos pacientes con hemorragia intraventricular que ocupe más del 50% del volumen ventricular asociada a distensión ventricular aguda (hemorragia grado III) o presencia de infarto hemorrágico en la sustancia blanca periventricular ipsilateral a una hemorragia intraventricular (infarto hemorrágico periventricular)15.
- -
Enterocolitis necrosante (NEC): se considerarán en el estudio aquellos pacientes con enterocolitis que precisen intervención quirúrgica (grado IIIB de Bell).
- -
Displasia broncopulmonar (DBP): se considerarán en el estudio los pacientes con DBP moderada (pacientes con soporte respiratorio de tipo cánulas nasales y FiO2>0,21, pero <0,3 a las 36 semanas de edad posmenstrual) y grave (pacientes con soporte respiratorio de tipo cánulas nasales y FiO2>0,3 o soporte respiratorio con CPAP/ventilación mecánica no invasiva a las 36 semanas de edad posmenstrual).
- -
Retinopatía de la prematuridad (ROP): se considerarán en el estudio los pacientes con ROP en estadío mayor o igual a III en el momento del alta de la unidad de neonatología (estadio III: proliferación de vasos hacia el vítreo, estadio IV: desprendimiento parcial de retina, estadio V: desprendimiento total de retina).
- -
Ciclo completo de corticoides: administración de dos dosis de corticoides, separadas entre sí 24h y al menos 24h antes del parto.
- -
Reanimación avanzada (REA): necesidad de intubación orotraqueal (REA tipo IV) o necesidad de administración de adrenalina intravenosa o intratraqueal (REA tipo V) al nacimiento.
- -
- •
- -
Corioamnionitis:
- •
Diagnóstico de sospecha: fiebre materna documentada (>39°C en cualquier medición o≥38°C durante más de 30min) y al menos una de las siguientes: taquicardia fetal (>160lpm durante 10min o más), leucocitosis materna >15.000mm3 o líquido purulento definido del orificio cervical.
- •
Diagnóstico de confirmación: cumple los criterios anteriores y existen datos de infección probada por amniocentesis (tinción de Gram positiva o cultivo positivo del líquido amniótico) o en el examen anatomopatológico de la placenta16.
- •
Con respecto al modo de administración del MgSO4, destaca la variabilidad entre cada centro. La dosis empleada, se basa en estudios de Pritchard, 197917, que buscaba la dosis óptima para tratamiento de la eclampsia, y en el análisis retrospectivo de los datos del ensayo BEAM5.
En un trabajo llevado a cabo por Alonso et al., se determinó que la dosis de MgSO4 en el niño era lineal a la de la madre y que, incluso recibiendo únicamente el bolo inicial, se alcanzan niveles de MgSO4 en sangre del feto, por lo que recomendaban la administración de MgSO4 en todas las pacientes en riesgo de parto prematuro, aunque fuera solo en forma de bolo inicial18.
Según el protocolo establecido en nuestro centro, está indicada la administración de MgSO4 en gestantes entre las 23 y las 31+6 semanas de edad gestacional que estén en riesgo de parto inminente o si existe planificación de finalizar la gestación por causas maternas o fetales en las siguientes 24h. La posología consiste en un bolo de 4,5g intravenoso administrado en 20min seguido de una dosis de mantenimiento de 1g a la hora/durante 24h o hasta que tenga lugar el parto.
Existen también controversias con respecto a la indicación de retratamiento en caso de que el parto no haya tenido lugar. Las últimas recomendaciones de UptoDate (diciembre 2022) indican no realizar retratamiento de forma sistemática, dado que existen datos limitados para ello en la literatura19.
En el análisis estadístico del trabajo, los resultados de las variables continuas se presentan mediante su media y desviación típica y para las variables categóricas, como frecuencias y porcentajes. Aquellas variables numéricas con distribución no normal se presentan mediante su mediana y rango intercuartílico (percentil 25, percentil 75). El análisis de la normalidad se estudia con la prueba de Kolmogorov-Smirnov.
La asociación de la administración del MgSO4 con otras variables cualitativas se estudia mediante la prueba Chi-cuadrado de Pearson o exacta de Fisher. Para medir la fuerza de la asociación se calculan las odds ratio con sus correspondientes intervalos de confianza. La asociación entre variables cuantitativas se estudia con el coeficiente de correlación de Pearson o Spearman.
Para comparar las medias de 2 o más grupos se utilizan pruebas paramétricas (t de Student o ANOVA) o pruebas no paramétricas (Mann-Whitney, Kruskal-Wallis) utilizando las más adecuadas en función de la normalidad de los datos y el número de pacientes de cada grupo.
El análisis estadístico se realiza con el programa STATA®. Se consideran como estadísticamente significativos aquellos resultados con una p<0,05.
ResultadosSe recogieron datos de un total de 523 pacientes prematuros nacidos en nuestro hospital por debajo de las 32 semanas de edad gestacional. Un total de 263 pacientes nacieron entre los años 2011 y 2012 (grupo pre-instauración de protocolo de MgSO4) y 260 pacientes entre los años 2016 y 2018 (grupo postinstauración de protocolo de MgSO4).
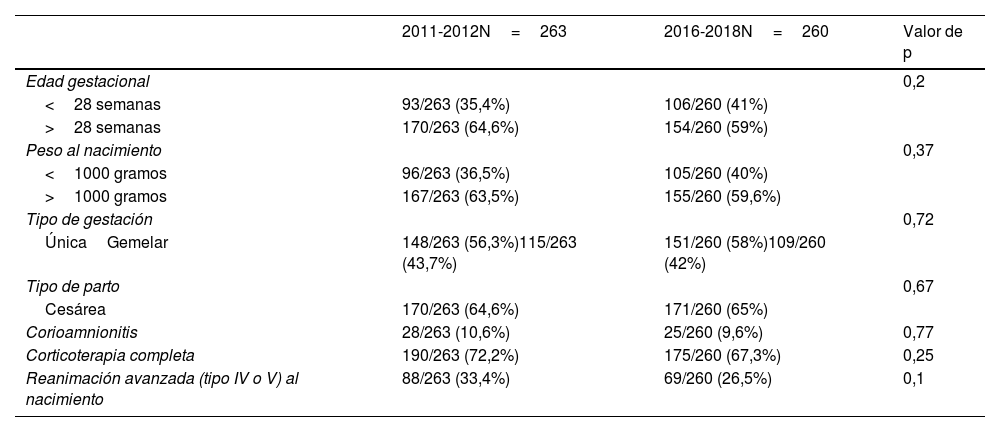
Los grupos fueron comparables desde el inicio entre sí, tal y como se muestra en la tabla 1. De la muestra global, el 56% fueron mujeres y el 46% varones. La mortalidad global fue del 17% (89 pacientes).
Datos de comparación entre ambos grupos
| 2011-2012N=263 | 2016-2018N=260 | Valor de p | |
|---|---|---|---|
| Edad gestacional | 0,2 | ||
| <28 semanas | 93/263 (35,4%) | 106/260 (41%) | |
| >28 semanas | 170/263 (64,6%) | 154/260 (59%) | |
| Peso al nacimiento | 0,37 | ||
| <1000 gramos | 96/263 (36,5%) | 105/260 (40%) | |
| >1000 gramos | 167/263 (63,5%) | 155/260 (59,6%) | |
| Tipo de gestación | 0,72 | ||
| ÚnicaGemelar | 148/263 (56,3%)115/263 (43,7%) | 151/260 (58%)109/260 (42%) | |
| Tipo de parto | 0,67 | ||
| Cesárea | 170/263 (64,6%) | 171/260 (65%) | |
| Corioamnionitis | 28/263 (10,6%) | 25/260 (9,6%) | 0,77 |
| Corticoterapia completa | 190/263 (72,2%) | 175/260 (67,3%) | 0,25 |
| Reanimación avanzada (tipo IV o V) al nacimiento | 88/263 (33,4%) | 69/260 (26,5%) | 0,1 |
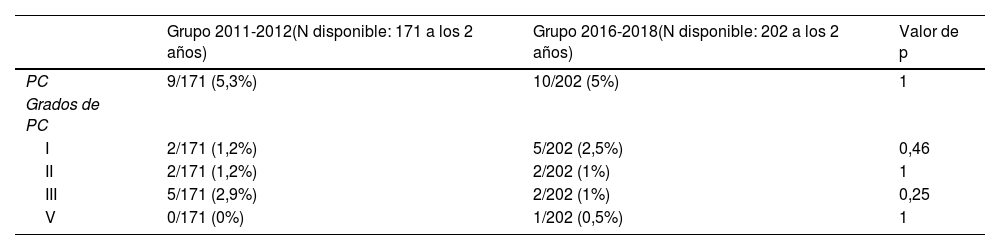
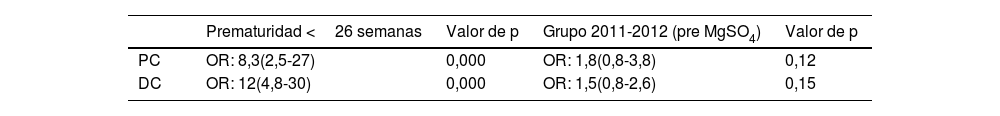
Con respecto al objetivo principal, 19 pacientes (5%) presentaron PCI con respecto a los datos disponibles a los 2 años (N=373). De ellos, el 37% correspondieron a formas leves (grado I) y el 57% a formas moderadas (grados II y III). Tan solo un paciente presentó PC severa (grado V).
Con respecto al grupo de pacientes nacidos entre 2011-2012 (preinstauración del protocolo de administración de MgSO4 antenatal), 9 pacientes de 171 presentaron PC a los 2 años (5,3%) y del grupo de nacidos en los años 2016-2018 (postinstauración de protocolo de administración de MgSO4 antenatal) 10 pacientes de 202 presentaron PC (5%). No se encontraron diferencias en el grado de PC entre ambos grupos (tabla 2).
Comparación de ocurrencia de parálisis cerebral y del grado entre ambos grupos
| Grupo 2011-2012(N disponible: 171 a los 2 años) | Grupo 2016-2018(N disponible: 202 a los 2 años) | Valor de p | |
|---|---|---|---|
| PC | 9/171 (5,3%) | 10/202 (5%) | 1 |
| Grados de PC | |||
| I | 2/171 (1,2%) | 5/202 (2,5%) | 0,46 |
| II | 2/171 (1,2%) | 2/202 (1%) | 1 |
| III | 5/171 (2,9%) | 2/202 (1%) | 0,25 |
| V | 0/171 (0%) | 1/202 (0,5%) | 1 |
PC: parálisis cerebral.
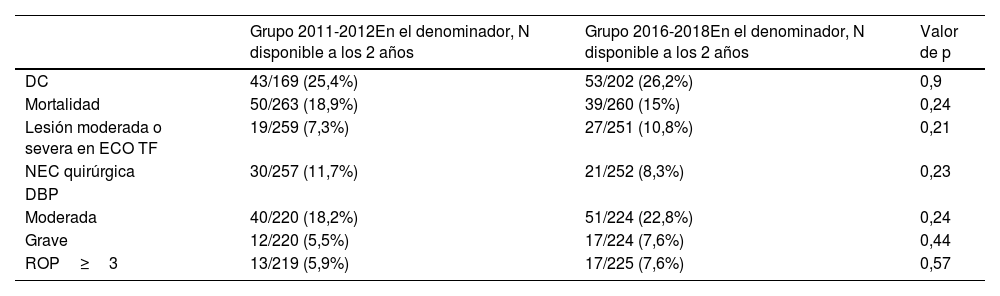
Presentaron disfunción cognitiva (DC) un total de 96 pacientes (25,8%) con respecto a los datos disponibles a los 2 años (N=371). Se objetivó en 43 de 169 pacientes (25,4%) pertenecientes al grupo de 2011-2012 y en 53 de 202 pacientes (26,2%) pertenecientes al grupo 2016-2018. No se objetivaron por tanto diferencias estadísticamente significativas entre ambos grupos. Tampoco se objetivaron diferencias estadísticamente significativas en cuanto a la mortalidad ni con respecto a otros objetivos secundarios (tabla 3).
Comparación de otras variables entre ambos grupos
| Grupo 2011-2012En el denominador, N disponible a los 2 años | Grupo 2016-2018En el denominador, N disponible a los 2 años | Valor de p | |
|---|---|---|---|
| DC | 43/169 (25,4%) | 53/202 (26,2%) | 0,9 |
| Mortalidad | 50/263 (18,9%) | 39/260 (15%) | 0,24 |
| Lesión moderada o severa en ECO TF | 19/259 (7,3%) | 27/251 (10,8%) | 0,21 |
| NEC quirúrgica | 30/257 (11,7%) | 21/252 (8,3%) | 0,23 |
| DBP | |||
| Moderada | 40/220 (18,2%) | 51/224 (22,8%) | 0,24 |
| Grave | 12/220 (5,5%) | 17/224 (7,6%) | 0,44 |
| ROP≥3 | 13/219 (5,9%) | 17/225 (7,6%) | 0,57 |
DBP: displasia broncopulmonar; DC: disfunción cognitiva; ECO TF: ecografía transfontanelar; NEC: enterocolitis necrosante; ROP: retinopatía de la prematuridad.
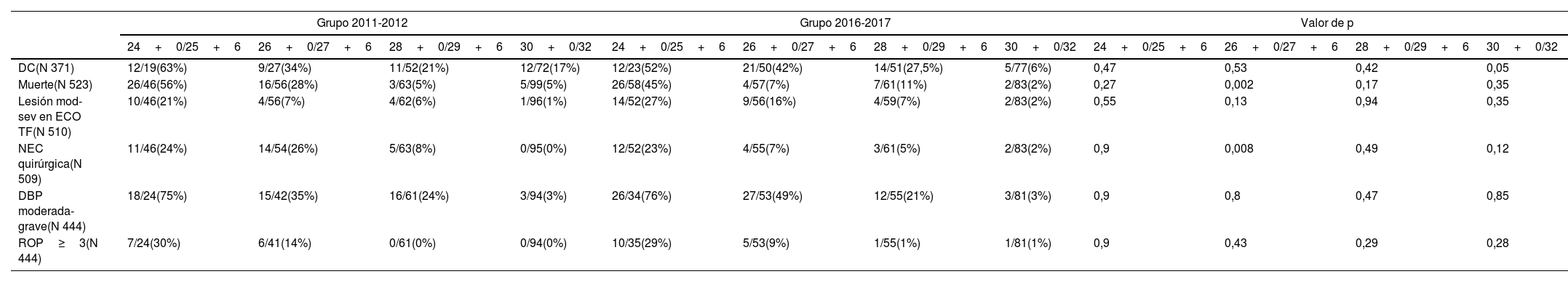
Al estratificar los resultados por edad gestacional (semanas) no se objetivaron diferencias estadísticamente significativas entre ambos grupos en relación al objetivo principal (objetivar si la administración antenatal de MgSO4 disminuye el riesgo de PC) (tabla 4).
Comparación de ocurrencia de PC entre ambos grupos al estratificar por semanas de edad gestacional
| Grupo 2011-2012 | Grupo 2016-2017 | Valor de p | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 24+0/25+6 | 26+0/27+6 | 28+0/29+6 | 30+0/32 | 24+0/25+6 | 26+0/27+6 | 28+0/29+6 | 30+0/32 | 24+0/25+6 | 26+0/27+6 | 28+0/29+6 | 30+0/32 | |
| PC(N 373) | 5/19(26%) | 0/29(0%) | 4/52(7%) | 0/73(0%) | 2/23(8%) | 4/50(8%) | 2/50(4%) | 2/77(2%) | 0,12 | 0,13 | 0,42 | 0,16 |
PC: parálisis cerebral.
Con respecto a los objetivos secundarios, se objetivó una reducción estadísticamente significativa de la mortalidad entre los pacientes del grupo de edad gestacional comprendida entre las 26+0 y las 27+6 semanas que recibieron MgSO4 antenatal (28 vs. 7%, respectivamente; p 0,002), así como un descenso estadísticamente significativo de la incidencia de NEC grave (26 vs. 7%; p 0,008).
En los pacientes con edades comprendidas entre las 30+0−32 semanas de edad gestacional se objetivó un descenso del riesgo de DC (17 vs. 6%; p 0,05) (tabla 5).
Comparación de ocurrencia de DC y otras variables entre ambos grupos al estratificar por semanas edad gestacional
| Grupo 2011-2012 | Grupo 2016-2017 | Valor de p | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 24+0/25+6 | 26+0/27+6 | 28+0/29+6 | 30+0/32 | 24+0/25+6 | 26+0/27+6 | 28+0/29+6 | 30+0/32 | 24+0/25+6 | 26+0/27+6 | 28+0/29+6 | 30+0/32 | |
| DC(N 371) | 12/19(63%) | 9/27(34%) | 11/52(21%) | 12/72(17%) | 12/23(52%) | 21/50(42%) | 14/51(27,5%) | 5/77(6%) | 0,47 | 0,53 | 0,42 | 0,05 |
| Muerte(N 523) | 26/46(56%) | 16/56(28%) | 3/63(5%) | 5/99(5%) | 26/58(45%) | 4/57(7%) | 7/61(11%) | 2/83(2%) | 0,27 | 0,002 | 0,17 | 0,35 |
| Lesión mod-sev en ECO TF(N 510) | 10/46(21%) | 4/56(7%) | 4/62(6%) | 1/96(1%) | 14/52(27%) | 9/56(16%) | 4/59(7%) | 2/83(2%) | 0,55 | 0,13 | 0,94 | 0,35 |
| NEC quirúrgica(N 509) | 11/46(24%) | 14/54(26%) | 5/63(8%) | 0/95(0%) | 12/52(23%) | 4/55(7%) | 3/61(5%) | 2/83(2%) | 0,9 | 0,008 | 0,49 | 0,12 |
| DBP moderada-grave(N 444) | 18/24(75%) | 15/42(35%) | 16/61(24%) | 3/94(3%) | 26/34(76%) | 27/53(49%) | 12/55(21%) | 3/81(3%) | 0,9 | 0,8 | 0,47 | 0,85 |
| ROP≥3(N 444) | 7/24(30%) | 6/41(14%) | 0/61(0%) | 0/94(0%) | 10/35(29%) | 5/53(9%) | 1/55(1%) | 1/81(1%) | 0,9 | 0,43 | 0,29 | 0,28 |
DBP: displasia broncopulmonar; DC: disfunción cognitiva; ECO TF: ecografía transfontanelar; NEC: enterocolitis necrosante; ROP: retinopatía de la prematuridad.
En el análisis multivariante no se objetivaron diferencias estadísticamente significativas en el desarrollo de PC ni de DC en ambos grupos, mientras que la prematuridad fue factor de riesgo independiente en ambos casos (tabla 6).
DiscusiónEl principal factor de riesgo de la PC es el parto prematuro, siendo más frecuente a menor edad gestacional. Se considera que la PC es 70 veces más frecuente en los prematuros nacidos por debajo de las 28 semanas de edad gestacional1. En un trabajo publicado en Francia en 202120, la prevalencia de PC en prematuros por debajo de las 33 semanas fue del 3,4%, siendo en nuestro estudio un porcentaje más elevado (5%). Sin embargo, este porcentaje podría estar sesgado dado que de los 523 pacientes de la muestra inicial solo obtuvimos datos a los 2 años en 373. Los pacientes de los que no se disponía información eran, en su mayoría, procedentes de otra comunidad autónoma o sin seguimiento en centros públicos de nuestra comunidad, lo que imposibilitaba el acceso a la historia clínica electrónica. Así pues, considerando el porcentaje de PC con respecto a la muestra total (523 pacientes) este sería del 3,6%, resultado similar al obtenido en Francia.
En nuestro trabajo, no se ha podido demostrar una reducción de la incidencia de PC en los prematuros cuyas madres recibieron tratamiento antenatal con MgSO4, no obstante, sí se había demostrado previamente. En los años 90, Nelson et al. y Schendel et al., objetivaron de forma incidental un descenso de PC en recién nacidos cuyas madres habían recibido MgSO4 por preeclampsia o tocolisis3,21. En este contexto se llevaron a cabo tres ensayos clínicos entre 1996 y 2004: ACTOM MgSO4, PREMAG Trial y BEAM Trial4-6, y posteriormente 3 metaanálisis8-10, que determinaron que tras la administración antenatal de MgSO4, se reducía el riesgo de PC en niños expuestos intraútero (RR: 0,7; IC 95%: 0,55-0,89). Asimismo, se ha objetivado descenso de la mortalidad en pacientes expuestos18 y descenso de la combinación muerte y alteración en el desarrollo neurológico en pacientes con crecimiento intrauterino retardado menores de 29 semanas22.
Se postula que el MgSO4 es capaz de aumentar la secreción de factores neurotróficos cerebrales23 lo que podría fomentar la maduración cerebral y su resistencia ante insultos asociados con la prematuridad. Asimismo, se relaciona con el tono vascular y con el mantenimiento de la perfusión sistémica reduciendo el consumo de oxígeno cerebral. Este hecho se ha objetivado con monitorización de saturación regional de oxígeno en el estudio de Stark et at realizado en prematuros <30 semanas, en los que la exposición a MgSO4 fue asociada a reducción del consumo de oxígeno cerebral en las primeras 24h de vida24. El MgSO4 es también un antagonista del receptor de N-metil-D-aspartato, por lo que se considera que podría reducir el daño excitotóxico después de un insulto isquémico hipóxico5,6,23.
En nuestra revisión se objetivó un descenso estadísticamente significativo de la mortalidad (p=0,002) en los pacientes con edad gestacional 26+0/27+6 semanas, acorde con el estudio de Alonso et al.18, y un menor grado de déficit cognitivo (p=0,05) en los pacientes de 30+0/32 semanas de edad gestacional que habían recibido MgSO4 antenatal. No se objetivaron diferencias estadísticamente significativas en el desarrollo de PC, ROP ni otras afecciones neurológicas como la afectación moderada-severa en la ecografía transfontanelar en ambos grupos de comparación.
Con respecto a los efectos adversos, en los 3 ensayos clínicos más grandes4-7 y en sucesivas revisiones como un metaanálisis publicado en 201610, no se han esclarecido efectos secundarios graves, siendo considerada una práctica segura tanto para la madre como para el feto. De hecho, en nuestra revisión el porcentaje de NEC grave fue significativamente menor (p=0,008) en los recién nacidos prematuros de 26+0/27+6 semanas, cuyas madres habían recibido MgSO4.
Los autores consideramos que esta reducción de mortalidad y de NEC en el grupo de prematuros 26+0/27+6 nacidos en 2016-2018, puede explicarse por los cambios y las mejoras en el tratamiento de estos pacientes, siendo en nuestro trabajo el cambio fundamental, la administración antenatal de MgSO4 en las madres. Consideramos que esta medida es más importante en este grupo de pacientes que en el resto, dado que, en el grupo de edad gestacional inferior a las 26 semanas, al tratarse de prematuros extremos, su desarrollo y sus complicaciones van a ser marcadas, probablemente más por el grado de prematuridad que por los tratamientos o mejoras en el manejo, ocurriendo al contrario en el grupo mayor de 30 semanas, en el que la edad gestacional y la madurez determinan un punto a favor con respecto a los grupos de menor edad gestacional.
Con respecto a las fortalezas de este trabajo, consideramos que es un estudio realizado en una amplia muestra de pacientes, en dos periodos de tiempo distintos pero con características clínicas y epidemiológicas comparables entre sí, no solo a nivel de datos perinatales, si no a nivel de patologías fundamentales en la prematuridad, como la NEC, la DBP, la lesión cerebral y la ROP, además, con datos recogidos al nacimiento y a los dos años de edad posmenstrual.
Como limitaciones, al tratarse de un estudio retrospectivo, los datos son indirectos pues se recogieron de la historia clínica electrónica de los pacientes. Destaca asimismo la pérdida de pacientes a los 2 años, que pudo reducir la potencia del estudio. Con respecto al grupo de 2011-2012 (preinstauración del protololo) consideramos que un pequeño porcentaje de estos recibieron terapia con MgSO4. Según los datos disponibles, registrados en la historia clínica de las madres, 19/263 (7,2%) de pacientes habían recibido sulfato de magnesio, 14 de ellos como tratamiento para la preeclampsia/eclampsia materna y los restantes para neuroprotección. En este contexto, dado que las dosis administradas de MgSO4 no estaban aún estandarizadas según el protocolo actual, no se han tenido en cuenta a la hora de realizar el recuento global de pacientes que recibieron MgSO4 y se han englobado en grupo preinstauración de protocolo. Asimismo, a destacar que al ser 2 grupos pertenecientes a diferentes periodos en el tiempo, aunque no hay muchos años de diferencia entre ambos, pudieron tener lugar modificaciones en relación a protocolos de actuación, guías clínicas… que podrían haber artefactado los resultados.
Como conclusión, según nuestro trabajo, no se objetivaron diferencias en ambos grupos con respecto al desarrollo de PC. El hecho de que sea un tratamiento tan ampliamente utilizado, pone de manifiesto la necesidad de continuar investigando esta práctica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Trabajo presentado previamente en el Congreso de la Sociedad Española de Neonatología, 25-29 de octubre de 2021.