La encefalitis por autoanticuerpos contra el receptor de N-metil-D-aspartato (anti-NMDAr), es una entidad potencialmente tratable descrita recientemente1. Presentamos el caso de un paciente pediátrico diagnosticado de esta entidad que tuvo buena evolución clínica con tratamiento inmunomodulador, y realizamos una revisión de la literatura.
Varón de 7 años afebril, que ingresó con un cuadro de 2-3 convulsiones generalizadas diarias de varios días de evolución. No asoció otra sintomatología. En el hemograma presentaba leucocitosis con neutrofilia, con bioquímica sanguínea, reactantes de fase aguda y estudio de tóxicos en orina negativos. En el LCR presentó 78 leucocitos (80% linfocitos), con proteinorraquia y glucorraquia normales y el EEG demostró enlentecimiento generalizado. El TAC craneal y la RM cerebral y medular resultaron normales. A pesar del tratamiento anticomicial continuó presentando 2-3 convulsiones diarias alternando episodios de labilidad emocional, somnolencia y alucinaciones con movimientos coreoatetoides continuos de boca y extremidades que evolucionaron rápidamente al mutismo y dificultad para la deambulación, deglución e incontinencia de esfínteres. Se realizó una amplia batería de pruebas diagnósticas para descartar la etiología infecciosa, autoinmune, metabólica y paraneoplásica siendo todas negativas: a) LCR: cultivo; PCR para el VHS, enterovirus, CMV, VVZ, HVH-6 y HVH-7 y PCR universal para bacterias y hongos; b) Sangre: hemocultivos, PCR de VIH, VEB, CMV y VHS; RPR para sífilis, serología de Bartonella, Mycoplasma pneumoniae, arbovirus y quantiferon; c) Nasofaringe: PCR mutliplex de virus respiratorios y Mycoplasma.
Se solicitaron aminoácidos séricos, ácidos orgánicos en orina y perfil de acilcarnitinas, con resultados negativos. En el estudio reumatológico destacó ANA positivo (1:160) y C4 bajo, siendo el resto normal. Ante la posibilidad de etiología paraneoplásica, se solicitaron anti-NMDAr y se realizaron HVA/VMA en orina, TAC toracoabdominal y ecografía testicular que fueron normales.
Con la sospecha de encefalitis autoinmune, se inició tratamiento con inmunoglobulina intravenosa (IGIV; 500mg/kg/día durante 3 días×2 tandas) sin mejoría. A los 15 días del ingreso, ante el resultado positivo de anti-NMDAr en suero y LCR se administraron bolos de metilprednisolona (30mg/kg/día) durante 5 días seguidos de rituximab (16mg/kg/semana) durante 4 semanas con descenso paulatino de los corticoides. Tras finalizar el tratamiento con rituximab el paciente mejoró significativamente encontrándose al 80% de su estado basal. Durante los 3 meses posteriores desarrolló cefaleas y vómitos asociados a la finalización del tratamiento corticoideo por lo que ante la posibilidad de recurrencias, que pueden ocurrir hasta en un 25% de casos inicialmente, se reiniciaron dosis bajas de corticoides y se asoció mofetil micofenolato. A los 7 meses de seguimiento el paciente se encuentra asintomático y sin secuelas.
Estudios recientes sugieren que la encefalitis por anti-NMDAr tiene una incidencia parecida a la secundaria a enterovirus y es hasta 4 veces más frecuente que la herpética en pacientes menores de 30 años2. Aunque los primeros casos descritos se asociaron a teratomas ováricos en mujeres jóvenes, entre el 20-40% de pacientes son niños en los que incidencia de casos paraneoplásicos es mucho menor (tabla 1)3,4.
Estudios publicados en la edad pediátrica incluyendo manejo y evolución a largo plazo
| Artículo | Edad | Tratamiento | Evolución |
|---|---|---|---|
| Florance et al.Annals Neurol 2009 | n=31; ≤18 años (mediana 14) | 30/31: Corticoides±IGIV±plasmaféresisAdemás: 1 CFM, 2 RXB, 4 CFM+RXB,8 cirugía teratoma | 9 recuperación completa14 mejoría sustancial8 mejoría limitada |
| Borlot et al.J Pediatr (Rio J) 2012 | n=3; 2-10 año | 3/3: Corticoides±IGIVAdemás: 1 CFM, 1 CFM+RXB | 2 recuperación completa1 mejoría sustancial |
| Raha et al.Ped Neurol 2012 | n=4; 5-9 años | 1 corticoides, 1 IGIV, 2 corticoides+IGIVAdemás: 2 corticotropina | 3 mejoría sustancial1 fallecimiento |
| Houtrow et al.Am J Phys Med Rehab 2012 | n=6; 2-15 años | 6/6: IGIV±corticoides±plasmaféresisAdemás: 1 CFM, 1 RXB,2 cirugía teratoma | 1 recuperación completa4 mejoría sustancial1 mejoría limitada |
| Bseikri et al.Ped Infect Dis J 2012 | n=3; 9-15 años | 3/3: Corticoides±IGIV±plasmaféresisAdemás: 1 CFM, 1 cirugía teratoma | 1 recuperación completa2 mejoría sustancial |
| Iadisernia et al.Eur J Ped Neurol 2012 | n=2; 3-4 años | 2/2: Corticoides+IGIV | 2 mejoría sustancial |
| Dale et al.Dev Med Child Neurol 2012 | n=2; 4-6 años | 2/2: Corticoides+IGIVAdemás: 1 MM | 1 mejoría sustancial1 recaída+mejoría sustancial posterior |
| Kashyape et al.Eur J Ped Neurol 2012 | n=2; 2 años | 2/2: Corticoides+IGIV+CFMAdemás: 1 plasmaféresis | 2 recuperación completa |
| Armangue et al.J Pediatrics 2013 | n=20; ≤18 años (mediana 13) | 20/20: Corticoides±IGIVAdemás: 1 plasmaféresis, 5 RXB,2 RXB+CFM, 2 MM, | 12 recuperación completa5 mejoría sustancial1 mejoría limitada1 fallecimiento |
| Chakrabarty et al.J Child Neurology 2013 | n=11; ≤18 años (mediana 10) | 11/11: Corticoides+IGIVAdemás: 2 plasmaféresis, 1 RXB+CFM+plasmaféresis | 7 recuperación completa3 mejoría sustancial1 mejoría limitada |
| Baizabal-Carvallo et al.Mov Disord 2013 | n=6; 3-14 años | 6/6: Corticoides±IGIVAdemás: 3 plasmaféresis, 1 RXB, 1 MMF | 3 mejoría sustancial2 recaída+mejoría posterior1 mejoría limitada |
| González-Toro et al.Rev Neurol 2013 | n=2; 5-13 años | 2/2: Corticoides+IGIVAdemás: 1 RXB | 1 mejoría sustancial1 recaída+recuperación completa posterior |
| Bravo-Oro et al.Rev Neurol 2013 | n=6; 10 meses-11 años | 6/6: Corticoides+metotrexatoAdemás: 4 IGIV, 4 RXB, 1 CFM | 6 mejoría sustancial |
| Van de Riet et al.Eur Child Adol Ps 2013 | n=2; 15-17 años | 2/2: Corticoides+IGIVAdemás: 1 RXB, 1 CFM+plasmaféresis | 2 mejoría sustancial |
| DeSena et al.JAMA Neurology 2014 | n=2; 10 meses-20 años | 2/2 Aciclovir, IGIV+plasmaféresisAdemás: 1 CFM | 1 mejoría sustancial1 mejoría pero secuelas de VHS |
Además se han comunicado más de 20 casos clínicos, la mayoría tratados con corticoides e inmunoglobulinas±otros inmunosupresores o plasmaféresis.
CFM: ciclofosfamida; IGIV: inmunoglobulina intravenosa; MMF: mofetil micofenolato; RXB: rituximab.
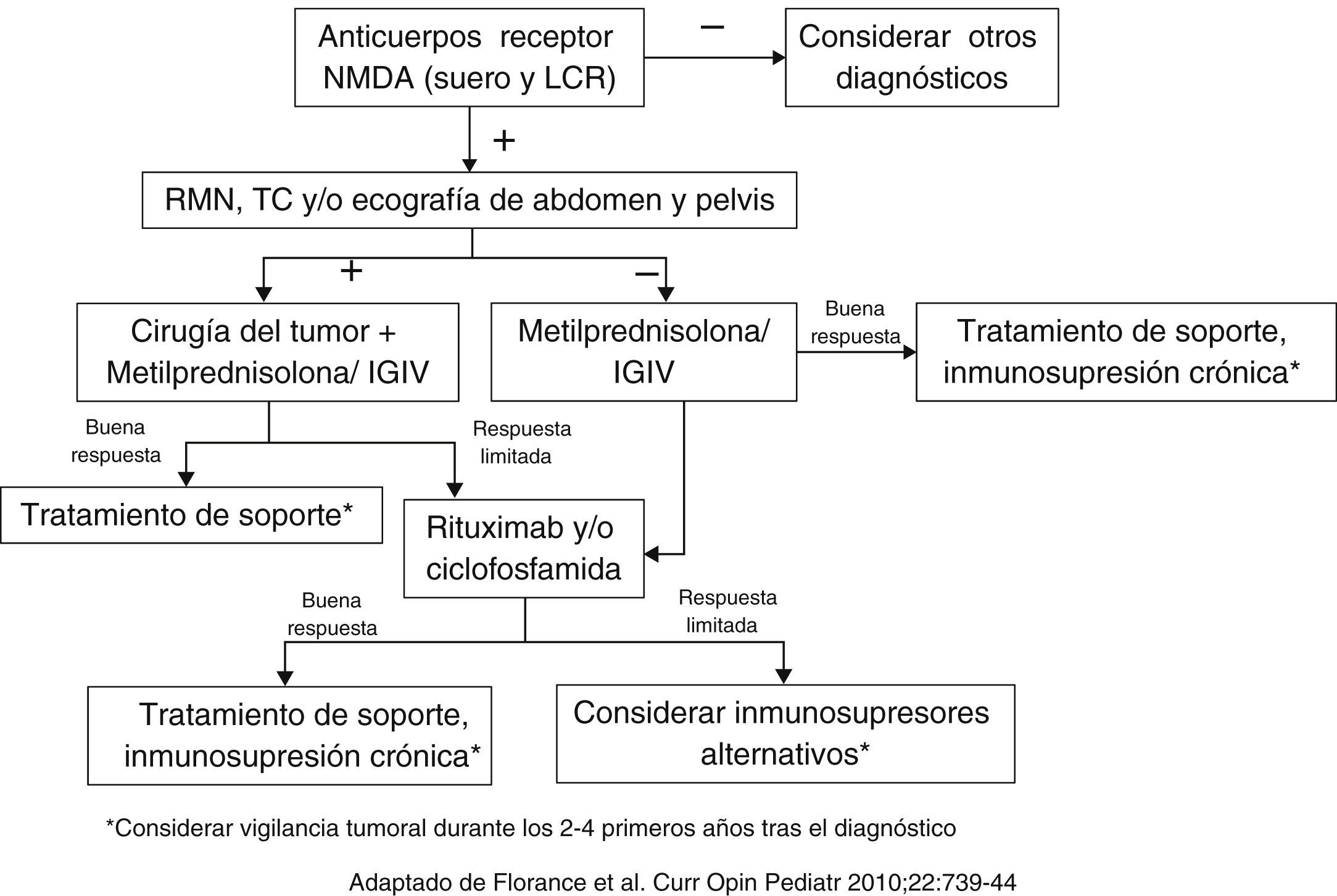
El cuadro clínico se desarrolla de forma predecible con afectación cognitiva, comportamental y autonómica. Los cambios de comportamiento y agitación predominan como síntomas iniciales en adultos y adolescentes, por lo que tienden a diagnosticarse de trastornos psiquiátricos. Posteriormente, tanto niños como adultos suelen presentar convulsiones, movimientos anormales (corea, distonía, disquinesia orofacial), mutismo e insomnio. Aunque la inestabilidad autonómica y la hipoventilación central parecen ser menos frecuentes en niños, son complicaciones graves. El análisis del LCR suele demostrar pleocitosis leve (<200 leucocitos) y en el EEG se observa enlentecimiento generalizado, en ocasiones acompañado de convulsiones eléctricas. La RM cerebral suele ser normal, mientras que en el PET-TAC podrían observarse imágenes compatibles con hipermetabolismo en lóbulos frontales y temporales5. El diagnóstico definitivo se realiza mediante la detección de anticuerpos frente a la subunidad NR1 del receptor de NMDA en suero y/o LCR. El tratamiento suele realizarse con corticoides a dosis altas e IGIV, con/sin plasmaféresis6, utilizando en casos refractarios tratamiento inmunomodulador (fig. 1)3,7. Se ha sugerido la relación entre la encefalitis por VHS o la postinfecciosa con la producción de anticuerpos anti-NMDA, lo que podría explicar que algunos pacientes mejoren con el tratamiento corticoideo8. Alrededor del 70% de pacientes se recupera completamente o tiene secuelas leves, mientras que el resto desarrolla secuelas graves con una mortalidad ∼4%9,10. La tabla 1 resume los casos pediátricos publicados de esta entidad, incluyendo el manejo terapéutico y secuelas a largo plazo.
Algoritmo del manejo de la encefalitis por anticuerpos anti-NMDA.
*A pesar de la menor frecuencia de tumores con respecto a los adultos, estos pueden estar presentes en el momento del diagnóstico o aparecer posteriormente, especialmente en niñas mayores y adolescentes, por lo que parece prudente realizar ecografía o RM abdominal periódicas en los 2 a 4 años siguientes al episodio de encefalitis.
En conclusión, a pesar del desconocimiento relativo de la enfermedad, la encefalitis por anti-NMDAr es una entidad potencialmente tratable a tener en cuenta en el diagnóstico diferencial de encefalitis en pediatría.