El desarrollo de vacunas tetravalentes frente a enfermedad meningocócica invasiva (EMI) ha venido motivado en gran medida por el incremento de serogrupos considerados poco habituales y su expansión geográfica, pero también por la necesidad de contar con vacunas que ofrezcan un amplio espectro de protección en una enfermedad de efectos devastadores como la EMI. Estos cambios en los serogrupos considerados como habituales (B y C) han sido detectados tanto para el serogrupo Y como para el W, lo que ha llevado a que estas vacunas multivalentes sean utilizadas por un buen número de países con diferentes estrategias que serán comentadas. Los datos epidemiológicos en España, por sí solos actualmente no justifican su utilización en los calendarios de vacunación pero hay un riesgo potencial de introducción de clones virulentos de serogrupos poco habituales (fundamentalmente Y y W) y esto nos llevaría a abrir una discusión sobre su potencial de utilización pensando fundamentalmente en población adolescente/preadolescente como grupo diana para la intervención.
The development of tetravalent vaccines against Invasive Meningococcal Disease (IMD) has been driven mainly due to the increase of the prevalence and geographic expansion of several serogroups considered unusual, but also because of the need for vaccines that offer broad spectrum protection in a devastating disease such as IMD. These changes in serogroups considered usual (B and C) have been detected for both serogroup Y and W, which has led to the multivalent vaccines being used by a number of countries with different strategies that will be discussed in the article. Epidemiological data in Spain, currently do not justify its use in immunization schedules, but there is a potential risk for the introduction of virulent clones of those uncommon serogroups (Y and W), and this would lead us to open a discussion of their potential use, particularly in the adolescent/pre-teen population as a target group for intervention.
Las variaciones epidemiológicas de las enfermedades infecciosas y el desarrollo de nuevas vacunas aconsejan un cambio permanente y dinámico en nuestra forma de entender la prevención y el control de muchas enfermedades transmisibles y, muy en particular, esto ocurre y seguirá ocurriendo en el caso de la enfermedad meningocócica invasiva (EMI). Hasta el año 1999, solo contábamos con vacunas de polisacáridos purificados que ofrecían una protección limitada y constituían una herramienta para el control de brotes y epidemias ocasionales. Pero sus grandes limitaciones (edad de utilización, duración limitada de la protección conferida y ausencia de respuesta de memoria) y su asociación con el fenómeno de tolerancia inmunológica1 hicieron que muy pronto el desarrollo de vacunas de polisacárido conjugadas con proteínas transportadoras siguiera los pasos de otro microorganismo capsulado: Haemophilus influenzae.
La necesidad de disponibilidad de una vacuna eficaz frente al serogrupo C fue, sin duda, el origen del desarrollo inicial de vacunas conjugadas monovalentes que protegían frente a este serogrupo. Cepas del serogrupo C de la línea clonal ST-11 fueron asociadas a aumentos significativos en las tasas de incidencia y de mortalidad en un buen número de países en Europa y en Canadá, por lo que ya en 1999 se autorizaron en la Unión Europea las primeras vacunas conjugadas frente al serogrupo C2. El contexto epidemiológico en aquel momento aconsejaba la introducción de las nuevas vacunas monovalentes en los calendarios de inmunización de algunos países de la Unión Europea, que tenían cifras elevadas de incidencia por este serogrupo3,4. En este caso, pues, utilizamos la vacuna para hacer frente a una situación de brote epidémico, por lo que el objetivo de la intervención era más el control del brote y, de forma secundaria, la prevención de un futuro aumento potencial de casos. Y la intervención resultó ser un éxito, sin duda, con un descenso muy significativo en el número de casos5, consiguiendo además aprender una serie de lecciones que no debemos olvidar para el futuro, y de ellas la más importante: las vacunas monovalentes conjugadas frente a serogrupo C tienen un impacto muy significativo en la reducción de portadores asintomáticos de ese mismo serogrupo2. Esta cualidad permite impactar directamente en la colonización y transmisión del microorganismo, lo que tiene un efecto de inmunidad comunitaria que incluye protección en grupos de edad no vacunados que se benefician indirectamente de las intervenciones2. Si bien en España la evidencia de efecto de inmunidad comunitaria tardó en verse, la reducción en las tasas de enfermedad en grupos etarios no receptores de vacunación también se ha puesto de manifiesto5. Esta lección aprendida ha hecho que recientemente se modifiquen en España y Reino Unido las pautas de vacunación con el objetivo de mantener ese impacto en el futuro, manteniendo baja la circulación de las cepas virulentas de grupo C6,7.
Por lo tanto, hemos pasado de utilizar las vacunas monovalentes conjugadas como un arma para hacer frente a una realidad epidemiológica (brote asociado a serogrupo C de finales de los años 90), a utilizarlas, incluso modificando en 2 ocasiones sus pautas de utilización, preventivamente ante hipotéticos aumentos de las tasas de circulación y, por lo tanto, de incidencia5,6. De una y otra forma, las vacunas monovalentes conjugadas frente al serogrupo C pasaron a formar parte de las agendas de armas disponibles habituales en la prevención y control de la EMI.
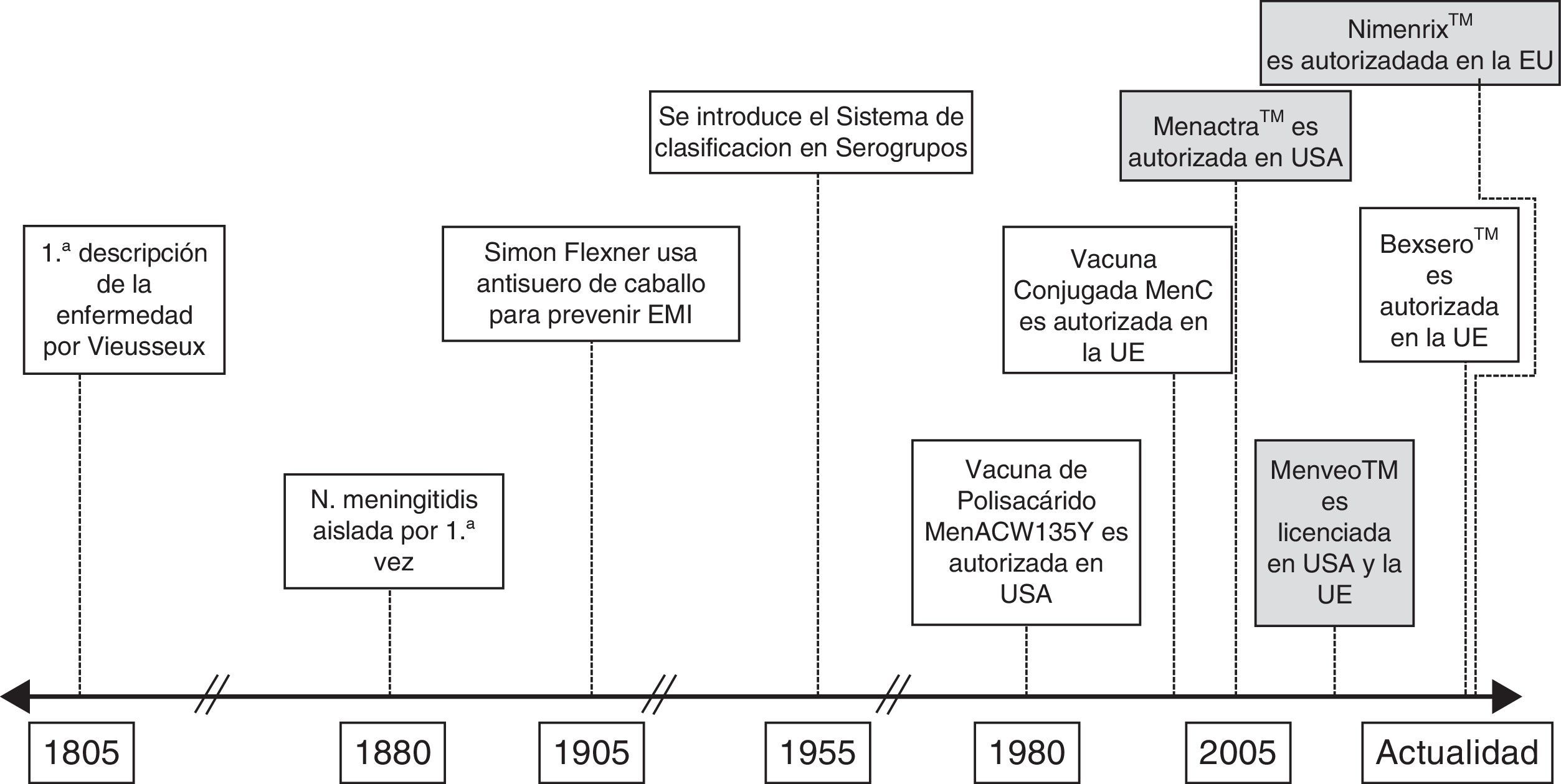
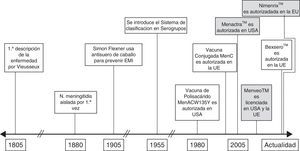
El meningococo presenta de forma natural una epidemiología altamente dinámica y en los últimos 15 años hemos asistido a un buen número de eventos regionales y/o locales con implicaciones globales que hacen que sea casi obligado replantearse nuevas acciones y/o intervenciones8. La figura 1 refleja los esfuerzos que han venido produciéndose en el control y la prevención de la enfermedad meningocócica, resaltándose en particular los hitos más relevantes. Destaca en los últimos tiempos el desarrollo y la autorización de vacunas multivalentes conjugadas, generalmente frente a 4 serogrupos (A, C, Y y W) y que resultan de la conjugación individual de cada uno de ellos a una proteína transportadora y su combinación en un preparado único. En el momento actual, se encuentran autorizadas en Europa 2 vacunas tetravalentes conjugadas: Menveo®, Novartis Vaccines & Diagnostics, y Nimenrix®, GlaxoSmithKline, con indicación de uso a partir de los 2 años de edad en el primer caso y a partir del primer año en el segundo, con una dosis única en ambos preparados. Estas 2 vacunas difieren en la proteína transportadora, CRM 197 en el caso de la primera y toxoide tetánico en el caso de la segunda, aunque aún no hay datos que evidencien una mejor respuesta inmunitaria en uno u otro caso9,10.
Caso aparte lo constituye la reciente autorización en Europa de una vacuna de formulación proteica (Bexsero® Novartis Vaccines & Diagnostics), que puede ser utilizada en la prevención de casos por serogrupo B11. Potencialmente, esta vacuna también podría utilizarse en la prevención de otros serogrupos, ya que los antígenos incluidos en su formulación son compartidos por los diferentes serogrupos12, pero aún no hay evidencia suficiente para esta indicación.
El desarrollo de vacunas tetravalentes ha venido motivado en gran medida por el incremento de serogrupos considerados poco habituales y su expansión geográfica, lo que sin duda evidencia la necesidad de contar con vacunas que ofrezcan un amplio espectro de protección1,8 en una enfermedad de efectos devastadores, como la enfermedad meningocócica invasiva.
Dinámica de la epidemiología de enfermedad meningocócica invasivaEl primero de los incrementos de serogrupos poco habituales del que tengamos buena información tuvo lugar en EE. UU., donde a finales de los años 90 se pone de manifiesto un incremento significativo de casos de enfermedad invasiva asociado a cepas de serogrupo Y. En EE. UU., el serogrupo Y representaba tan solo un 2% en 1990-1991, mientras que en los años 2006 y 2007, esta proporción había ascendido a un 37% y se sitúa en un 41% en la actualidad12. Las cepas responsables de este incremento en EE. UU. pertenecían al complejo clonal ST-23 y, en menor medida, al ST-167. Posteriormente, se observó un incremento en Canadá, aunque sin alcanzar la magnitud vista en EE. UU., y las cepas implicadas resultaron ser de los mismos complejos clonales13. Así, las cepas de serogrupo Y de los complejos clonales mencionados mostraron claramente su potencial epidémico.
El Advisory Committee on Immunization Practices de EE. UU. ha modificado recientemente sus recomendaciones para la utilización rutinaria de vacunas tetravalentes conjugadas en adolescentes y preadolescentes, que vienen a completar las iniciales de 200514. Con respecto al resultado de la intervención con vacuna tetravalente en EE. UU., es de interés destacar que recientes estudios muestran un descenso muy significativo en la tasa de enfermedad prevenible (serogrupos A, C, Y y W) en EE. UU. entre los 11 y los 17 años de edad (de 0,18 a 0,03 por 100.000)15,16, mientras que no se ha visto un descenso similar en otras cohortes17, aun teniendo en cuenta su utilización en un contexto de muy baja tasa de incidencia de la enfermedad, y a unas cifras inicialmente de bajas tasas de cobertura en la población diana de la vacunación (un 41,8% en 2008 y un 74% en 2012)18. De igual forma, en Canadá, en 2011, más de la mitad de las provincias ya incluían la utilización de vacuna conjugada tetravalente en sus programas de vacunación, habitualmente en forma de dosis de recuerdo en adolescentes previamente vacunados con vacuna conjugada monovalente frente a serogrupo C19. Y esto, con una media de casos por año de enfermedad por serogrupo Y de solo 31 casos, y de 10-11 en el caso del serogrupo W20. Nos encontramos pues en un caso, el de EE. UU., que recomienda la utilización de vacuna tetravalente conjugada para controlar una situación de aumento significativo de un serogrupo concreto, el Y, mientras que en Canadá se trataría más bien de prevenir un potencial aumento significativo de casos asociados al serogrupo Y por desplazamiento desde EE. UU.. Posteriormente, y siguiendo lo que parece un patrón de desplazamiento geográfico por proximidad, se detectó un fuerte incremento del serogrupo Y en Colombia y algunos países del área del Caribe, y una vez más las cepas fueron identificadas como ST-23 CC (uno de los 2 complejos clonales responsables de los incrementos en el Norte)21. Este patrón de expansión falla en su necesario paso por América Central (fundamentalmente a través de México), aunque un estudio reciente realizado en la frontera con EE. UU. durante 2005-2008 revela una presencia importante de casos de serogrupo Y, particularmente en el lado mexicano22. Por lo tanto, puede concluirse que el paso necesario hacia América Central se produjo, pero los sistemas de vigilancia no fueron capaces de detectarlo.
Finalmente, el recorrido del serogrupo Y nos lleva a la Unión Europea, donde encontramos un buen número de informes recientes de incrementos del serogrupo Y en algunos países entre 2007 y 201123. Este incremento es especialmente importante en Suecia, donde el porcentaje de casos asociados al serogrupo Y en 2011 fue cercano al 50%23. Los aumentos reportados en general en Europa, y muy especialmente en los países nórdicos, están asociados con unas medias de edad altas y que varían en función del clon predominante24, con media de edad de 20-29 años en casos asociados al llamado clon YI, mientras que la media es de 72 años en los casos asociados a otros clones de serogrupo Y. Esta distribución desigual complica la decisión de intervenciones con vacunas, por las dificultades de alcanzar buenas coberturas en esos grupos etarios. No obstante, revisiones recientes recomiendan elaborar recomendaciones específicas por cada país para la utilización de la vacuna MenACWY, bien en lugar de la vacuna MenC en niños y/o adolescentes o con combinaciones de estas vacunas y grupos de edad25.
En un contexto diferente, quizá el brote transnacional de enfermedad meningocócica más conocido, y relacionado con un serogrupo entonces poco habitual, es el que tuvo lugar en el año 2000, asociado a la peregrinación anual a La Meca (Hajj) y que estuvo provocado por cepas de serogrupo W del complejo clonal ST-11/ET-3726. Posteriormente, a finales del año 2001, y particularmente en el año 2002, se produjo en Burkina Faso una epidemia de grandes proporciones que se asoció a esta misma cepa W27, cepa que probablemente tiene su origen en un fenómeno de «switching capsular» a partir de una cepa de serogrupo C26. Este evento ilustra cómo el meningococo es capaz de cambiar la expresión de su capsula mediante fenómenos de «intercambio genético capsular». Esos cambios constituyen fenómenos «no dirigidos», es decir, que se producen por azar, y que dan como resultado variantes que pueden tener ventajas adaptativas o no y que, en función de este parámetro, sobrevivirán y se expandirán. El principio en que se basan estos fenómenos es relativamente simple: meningococos de diferentes serogrupos conviven potencialmente durante los periodos de colonización nasofaríngea y esta convivencia favorece el intercambio horizontal de ADN, que mediante fenómenos de transformación o recombinación genética resulta en sustituciones que afectan a diferentes fragmentos del ADN de la bacteria, y particularmente a los genes (operón capsular) responsables de la expresión de la cápsula28. Este fenómeno de transferencia genética, según algunos autores, podría haber generado una cepa de serogrupo W con mayor capacidad de transmisión que la cepa de serogrupo C original29, favoreciendo la aparición del brote y su posterior expansión geográfica. Solo unos años después, entre 2005 y 2008, se reportaron incrementos de casos por serogrupo W en el sur de Brasil y en Argentina, desembocando posteriormente en un aumento muy significativo en Chile en 201230. Todo ello en un contexto de proximidad geográfica plagado de diferencias: mientras que en Argentina el incremento de casos por cepas de serogrupo W (en 2012 representaron más del 50% de los casos declarados) no ha sido asociado a cambios en las tasas de incidencia (la tasa ha sido de alrededor de 0,6 por 100.000 de forma más o menos constante desde 2005)31; en Chile, la tasa de incidencia se ha duplicado, pasando de 0,4 en 2011 a 0,8 en 2012, con una tasa de mortalidad en los casos de serogrupo W por encima del 25%32, lo que tampoco parece verse en el caso de Argentina. Estas diferencias significativas llevaron a que Chile definiera la situación como de «alerta sanitaria» y a realizar una intervención con vacuna tetravalente conjugada en todos los niños mayores de 9 meses y menores de 5 años de edad33. La cobertura alcanzada ha sido muy elevada y el programa de inmunización con vacuna tetravalente sigue vigente en la actualidad. No obstante, y aunque no se han reportado casos asociados al serogrupo W entre aquellos que han recibido la vacuna, la situación no parece estar controlada, ya que el número global de casos de enfermedad asociada a este serogrupo en 2013 fue superior al registrado en 201232, y la mortalidad sigue situándose por encima del 25%. Parece lógico pensar que en el futuro próximo deberán evaluarse otros grupos de edad potencialmente receptores de vacunación (es probable que adolescentes y/o preadolescentes), con el objetivo de conseguir una reducción significativa del número de casos globalmente.
Finalmente, el último episodio de incremento de serogrupos poco habituales lo hemos tenido con la aparición de brotes epidémicos de intensidad moderada en algunos países del llamado «cinturón africano de la meningitis» asociados con cepas de serogrupo W, pero también de serogrupo X34. Es demasiado pronto para tener suficiente información sobre si la exitosa vacunación que se está llevando a cabo en estos países con vacuna conjugada monovalente frente a serogrupo A35 podría estar dando como resultado un fenómeno de sustitución de unos serogrupos por otros, tal y como se ha descrito para neumococo. Sin embargo, la vacunación con vacuna monovalente frente a serogrupo C no indicó la existencia de fenómenos similares y probablemente la implicación de serogrupos poco habituales es más un reflejo de la plasticidad evolutiva del microorganismo, antes que la indicación de otro tipo de fenómenos.
Perfil de seguridad y coadministración de vacunas tetravalentesEn lo que se refiere al perfil de seguridad de estas vacunas tetravalentes conjugadas, aunque se sugirió un ligero incremento en el riesgo de aparición de casos de síndrome de Guillain-Barré (GBS) tras la vacunación con MenACWY-D, estudios posteriores no confirmaron esta asociación y ya no se mantiene actualmente la recomendación de que «los sujetos con historia de GBS no deben recibir la vacuna a no ser que presenten un riesgo elevado de contraer enfermedad meningocócica»36. Salvando esta apreciación, el perfil de seguridad de las 2 vacunas tetravalentes que están disponibles en Europa puede definirse como aceptable y comparable al de otras vacunas ya incluidas en calendario.
La mayoría de los datos con respecto a vacunas tetravalentes conjugadas y la administración concomitante con otras vacunas, apoyan la seguridad y la inmunogenicidad de la coadministración. Hay estudios que indican que MenACWY-D administrada de forma concomitante con MMRV (sarampión, paperas, rubéola, varicela) y una cuarta dosis de PCV7 en niños de 12 meses de edad podría producir una respuesta inferior para los serotipos 4, 6B, y 18C incluidos en la vacuna de neumococo. No obstante, se desconoce el significado clínico de esta interferencia, si lo tiene37.
Respecto a la duración de la protección conferida, algunos estudios de casos y controles indican alta eficacia vacunal poco después de la vacunación, pero 2-5 años después de la vacunación, la eficacia de la vacuna disminuiría a un 50-60%37. Un reciente estudio muestra persistencia de anticuerpos protectores en niños de entre 1 y 10 años, al menos 5 años después de la administración de MenACYW-TT38.
Situación de la enfermedad meningocócica invasiva en EspañaEn España, la situación epidemiológica en el momento actual muestra un número de casos muy limitado de enfermedad meningocócica asociados bien a serogrupo W bien al Y, representando menos del 7% de los casos confirmados39, lo que supone entre 5 y 8 casos de cada serogrupo por año. Por lo tanto, la figura epidemiológica en España no indica la necesidad de utilizar vacuna tetravalente para hacer frente a una situación de brote epidémico o de aumento significativo de alguno de los serogrupos, bien del W o del Y. Sin embargo, hay otras razones que bien podrían justificar su utilización o, al menos, dedicar algún tiempo a reflexionar sobre la conveniencia o no de dicha utilización. A la vista de la epidemiología global de la enfermedad meningocócica, analizada a lo largo de este trabajo, hay siempre un riesgo potencial de introducción de cepas W y/o Y de diversas fuentes, lo que puede dar lugar a variaciones importantes que afecten a la incidencia de la enfermedad, mortalidad, etc. Desde nuestro punto de vista, esta observación indica la particular importancia de utilizar vacunas con amplio espectro de cobertura en cuanto a serogrupos. Este aspecto es aún más relevante en la población adolescente, habitualmente el grupo de edad con mayores tasas de portadores y que muestra un mayor número de comportamientos/hábitos sociales que favorecen la transmisión.
Consideraciones para utilización de vacunas tetravalentes conjugadasAlgunos países ya incluyen la vacuna tetravalente bien como dosis de recuerdo en adolescentes (Austria y Grecia40, y varias provincias en Canadá41), bien como primovacunación de adolescentes/preadolescentes (EE. UU.10); otros países la utilizan en el calendario nacional de inmunización, como Arabia Saudí42, o están realizando programas específicos de vacunación, como se ha comentado en el caso de Chile30. Así pues, nos encontramos con una muy amplia experiencia de utilización de este tipo de vacunas «multivalentes» utilizando una amplia variedad de estrategias, lo que sin duda ha generado una importante cantidad de información de soporte y evaluación de su utilización.
Sin embargo, como pasa muchas veces en los análisis científicos, puede haber hechos o evidencias que desempeñen un papel antagónico: uno de los objetivos de definir al grupo de adolescentes como «potencial grupo diana» de intervención es cortar la transmisión de los serogrupos incluidos en la vacuna. Y, sin embargo, un argumento en contra de la utilización de estas vacuna tetravalente es el riesgo hipotético que podría producirse de alteraciones en la flora de nasofaringe como resultado de una eliminación de cepas de serogrupos W e Y. Esta eliminación podría dar como resultado la sustitución por otras cepas de otros serogrupos (fundamentalmente de serogrupo B), cuya colonización podría estar favorecida por la ausencia de cepas W o Y. Esta hipótesis tendría algún fundamento en poblaciones como la analizada en Reino Unido, con prevalencias muy elevadas de cepas de serogrupo Y en población adolescente43. Sin embargo, en España, datos recientes de una encuesta de portadores asintomáticos llevada a cabo en Cantabria indican que ambos serogrupos solo tuvieron una frecuencia de un 6,7% en el caso del serogrupo W y del 2,7% para el serogrupo Y44, por lo que, aun asumiendo un impacto de la vacuna tetravalente en nasofaringe, ese impacto sería bajo desde el punto de vista de una teórica sustitución por otros serogrupos.
El reciente cambio en el esquema utilizado para dispensar la vacuna conjugada frente a serogrupo C6 ofrece teóricamente una buena ocasión para, al menos, abrir la discusión acerca de la posible idoneidad de utilizar vacuna tetravalente en la dosis de recuerdo de la preadolescencia, sustituyendo a la vacuna monovalente, tal y como se ha hecho en otros países de nuestro entorno con similitudes epidemiológicas. No se justificaría la sustitución de la dosis de C en el segundo año de vida, pero podría tener una mayor justificación esa sustitución en preadolescentes. Estimando una duración de la protección en ese grupo de edad, de 5 años al menos para los serogrupos C, Y y W, se conseguiría proteger a este grupo de edad de forma directa. Asumiendo que se consiguiera un efecto de inmunidad comunitaria, quedarían protegidos también otros grupos etarios en los que pudieran aparecer casos, aun sin recibir la vacuna. No obstante, hay muchos aspectos aún a definir. De ellos, quizá el más importante es tener datos de si la utilización de vacuna tetravalente como dosis de recuerdo en niños primovacunados con vacuna monovalente resultaría en una respuesta frente a serogrupo C al menos de la misma intensidad que la obtenida con la utilización solo de vacuna monovalente frente a serogrupo C en dicha dosis de recuerdo. Datos generados por un ensayo clínico en este sentido podrían indicarnos, con criterios de no inferioridad, la posibilidad o no de plantear esa sustitución. Probablemente, habría que plantearse si sería entonces la edad ideal los 12 años o resultaría más conveniente retrasar un par de años la dosis de recuerdo con tetravalente conjugada para cubrir más eficazmente hasta los 20 años de edad. El balance entre periodo de inmunidad conferida y posibilidad de conseguir buenas tasas de cobertura retrasando su utilización deberá ser establecido para resolver esta pregunta. Quizá uno de los aspectos más relevantes en esta discusión es el de la posibilidad de obtener una mejora en el precio para que una decisión en este sentido resultara neutra o casi neutra económicamente. Estos y otros aspectos forman parte de una discusión sobre la utilización de la vacuna tetravalente como arma de prevención o como arma de contención que sería deseable se abriera por parte de los profesionales implicados.
Conflicto de interesesJulio Vázquez ha recibido (y sigue recibiendo) becas de investigación de GSK, Novartis Vaccines, Sanofi Pasteur y Baxter. También ha recibido honorarios por actuar como asesor temporal y/o ponente para GSK, Novartis Vaccines, Sanofi Pasteur y Baxter. Raquel Abad declara no tener conflictos de intereses.