Las guías de práctica clínica son una importante herramienta para la mejora de la atención sanitaria. En los últimos años, se han ido acumulando evidencias sobre el impacto de la suplementación nutricional con probióticos en el recién nacido de muy bajo peso, sin que exista uniformidad en los microorganismos y las cepas utilizadas. Desde la Sociedad Española de Neonatología, a través de su Grupo de Nutrición y Metabolismo de SENeo, se ha acometido la elaboración de unas recomendaciones que sean útiles para orientar al neonatólogo en este campo.
Clinical practice guidelines are an important tool for improving healthcare. In recent years there has been accumulating evidence on the impact of nutritional supplementation with probiotics in the very low birth weight infants. With no uniformity in microorganisms and strains used. The Spanish Neonatology Society (SENeo), through its Nutrition and Metabolism Group has undertaken to develop recommendations that will be useful as a guide for the neonatologist in this field.
La primera definición de probiótico se debe a Lilly y Stillwell1, quienes en 1965 utilizaron el término «probiótico» para describir cualquier organismo que contribuyese a mantener el equilibrio microbiano intestinal. Posteriormente, se definieron sus características: un organismo probiótico es aquel que reúne una serie de características como ser habitante normal del intestino humano, no ser patógeno ni toxigénico, sobrevivir al medio ácido del estómago y al efecto de la bilis en el duodeno, con capacidad de adhesión a células epiteliales, adaptarse a la microbiota intestinal sin desplazar la microbiota nativa ya existente, producir sustancias antimicrobianas y tener capacidad para aumentar de modo positivo las funciones inmunes y las actividades metabólicas2. De un modo esquemático, la Organización Mundial de la Salud define a los probióticos como, «microorganismos vivos que cuando se administran en cantidades adecuadas confieren un beneficio a la salud del huésped».
Se ha estimado que la población en general alberga de 300 a 400 especies bacterianas en su intestino, de las que solo 30-40 especies son comunes para el 99% de la población. La microflora intestinal puede ser responsable de la conversión de ciertos componentes no tóxicos de la dieta en toxinas activas. Algunas enzimas, como β-glucoronidasa nitrato reductasa, azoreductasa, nitroreductasa, aminoácido decarboxilasa, aminoácido deaminasa, sulfamatasa y 7-α-hidroxilasa, producidas por algunas cepas bacterianas pueden dar productos finales tóxicos3, de ahí la importancia de seleccionar las cepas bacterianas.
En condiciones normales, tras el parto, la flora de la madre se establece de forma predominante sobre la flora ambiental. La flora normal adquirida durante el parto probablemente sea necesaria para el desarrollo de la inmunidad sistémica y mucosa del recién nacido. Las bacterias con un metabolismo oxidativo como enterobacterias, estreptococos y estafilococos son las primeras en proliferar en el tracto intestinal. Los anaerobios estrictos, al poseer un potencial óxido reductor negativo, no pueden competir durante la fase inicial de la colonización intestinal. Por tanto, las bacterias facultativas y aeróbicas alcanzan proporciones de hasta 1010 y 1011 por gramo de heces4,5.
En situaciones especiales, como los recién nacidos ingresados en Unidades de Cuidados Intensivos, puede haber bajos niveles de colonización por bifidobacterias; en estos recién nacidos su microflora intestinal puede verse modificada por el empleo de antibióticos, que originan supresión de la flora anaeróbica y aumento de Klebsiela, Enterobacter, Citrobacter y Pseudomonas6.
La estabilidad del ecosistema del intestino del recién nacido depende de la cooperación interbacteriana y la disponibilidad de una fuente de nutrientes constante en composición y cantidad. Los miembros bacterianos de la microflora autóctona existente pueden ser modulados por la diferente composición de los nutrientes ingeridos. La administración de antibióticos a los recién nacidos trastorna el equilibrio de la flora intestinal y puede predisponer a episodios de enfermedades infecciosas. En estos casos, las evidencias disponibles7,8, demuestran que la administración de probióticos puede reestablecer el equilibrio de la flora intestinal.
Las bifidobacterias mantienen las siguientes funciones: inhiben el potencial de crecimiento de los patógenos, reducen el amonio en sangre, contribuyen al descenso del colesterol, actúan como inmunomoduladores, producen vitaminas del grupo B y ácido fólico, y restauran la flora durante el empleo de antibióticos. La diferencia en la flora intestinal de niños nigerianos, con predominio de bifidobacterias, con los de Londres con predominio de enterobacterias y bacteroides ha sido comunicada por Simhon9, estos autores han demostrado la existencia de diferencias geográficas en cuanto a la flora que pueden depender de la carga bacteriana ambiental en el momento del nacimiento, de la dieta y de la posible contaminación de la misma.
Podemos decir que los humanos tenemos nuestras propias cepas bacterianas y que existe una gran variabilidad de una persona a otra y que la estabilidad del ecosistema bacteriano intestinal se afecta por factores locales, como la motilidad intestinal, las secreciones luminales, el aporte dietético, la inoculación de bacterias exógenas y la renovación del epitelio intestinal10.
La suplementación con probióticos es una alternativa muy prometedora para tratar de simular a la leche materna y conseguir los efectos beneficiosos que de ello se derivan. En este sentido, deben existir evidencias científicas del efecto beneficioso específico en estudios clínicos correctamente diseñados. La clave reside en una correcta selección de la cepa, la dosis y la vía de administración para cada diana terapéutica.
La leche materna como un simbiótico naturalLa leche materna constituye la primera opción de alimentación en los recién nacidos y lactantes, incluidos los prematuros. Es un alimento completo desde el punto de vista nutritivo e inmunológico, y también microbiológico, al ser una fuente de bacterias comensales o probióticas para el intestino infantil.
Las bacterias de la leche materna se encuentran entre las primeras que colonizan el intestino del neonato, impidiendo el asentamiento y la proliferación de bacterias patógenas y, por lo tanto, disminuyendo el riesgo de presentar enfermedades infecciosas. Además, las bacterias de la leche materna podrían desempeñar un papel protector frente a procesos alérgicos y también podrían explicar, al menos parcialmente, la abundancia de ciertas sustancias biológicamente activas en dicho fluido, ya que algunas de ellas tienen un gran potencial para sintetizar oligosacáridos, antioxidantes (glutatión), poliaminas, diversas vitaminas, etc.
El intestino de los niños de muy bajo peso se coloniza lentamente y con pocas especies bacterianas. La lactancia materna y la disminución de la exposición a los antibióticos son medidas críticas para lograr la diversidad y el aumento de la flora fecal11. El género Lactobacillus es una población dominante o subdominante en el intestino delgado, mientras que el género Bifidobacterium lo es en el colon. En la mucosa intestinal, las defensas cuentan con 2 componentes principales, uno de ellos es la respuesta inmunitaria del huésped, y el otro la función de barrera de la flora intestinal.
Probióticos, características microbiológicasUn producto probiótico debe reunir las siguientes características:
- –
Debe ser preferentemente de origen humano, generalmente aisladas de cepas presentes en el tracto gastrointestinal de humanos en buena salud.
- –
Las cepas utilizadas en los probióticos deben haber demostrado ausencia de patogenicidad, especialmente en personas inmunocomprometidas.
- –
No ser sensibles a las enzimas proteolíticas intestinales y deben poder sobrevivir tras su tránsito gástrico. Deben ser estables frente a ácidos y bilis, y no deben conjugarse con las sales biliares.
- –
Tener capacidad para adherirse a las superficies epiteliales del intestino humano.
- –
Sobrevivir en el ecosistema intestinal.
- –
Ser capaces de producir componentes antimicrobianos.
- –
Permanecer vivas y estables durante su uso.
- –
Ser capaces de un crecimiento rápido en las condiciones del intestino.
- –
Ser inmunoestimuladoras pero sin efectos proinflamatorios.
El pH tiene un efecto fundamental en la actividad de la flora intestinal; todas las enzimas tienen un pH óptimo de actividad, de hecho, distintas bacterias producen distintos niveles de actividad enzimática y un cambio en la composición de la flora cambia también la actividad enzimática intestinal. La existencia de pH intestinales muy bajos favorece el crecimiento de las bacterias ácido tolerantes y es mal tolerado por otros microorganismos. Los probióticos favorecen el descenso del pH a través de los ácidos grasos de cadena corta producidos. Las cepas adhesivas de lactobacilos condicionan una barrera mucosa efectiva que podría proteger frente a la infección por algunos virus12 y en modelos experimentales estas cepas compiten con diversos patógenos por su adhesión al epitelio13. Se ha comprobado que in vitro los probióticos actúan sobre las células epiteliales intestinales favoreciendo la expresión de ARNm para 2 mucinas, la MUC2 y MUC3, que son glucoproteínas con acción protectora frente a infecciones intestinales no productoras de mucinasas14.
Son varios los microorganismos reconocidos como probióticos. Los principales probióticos, en cuanto a género y especie, utilizados en estudios clínicos en prematuros son:
- –
Lactobacillus: L. acidophilus, L. reuteri, L. casei, L. rhamnosus, L. sporogenes.
- –
Bifidibacterium: B. bifidum, B. breve, B. lactis, B. longum y B. infantis.
- –
Cocos grampositivos: Streptococcus thermophilus (S. thermophilus).
- –
Otros microorganismos: Saccharomyces boulardii.
No todos tienen los mismos efectos y mecanismos de acción. L. plantarum y L. rhamnosus GG inhiben la adherencia de Escherichia coli (E. coli) enteropatógena, eliminando patógenos de las células epiteliales del intestino por aumento de la mucina intestinal MUC 2 y MUC 32. L. acidophilus LB inhibe la adhesión de Salmonella typhimurium SL1344 en cultivo de células humanas (Caco-2/TC-7) induciendo la producción de citocina 8 (IL-8)2. También se ha encontrado que B. breve y B. infantis, dependiendo de la dosis, inhiben la invasión de cepas de E. coli enteropatógena, Yersinia pseudotuberculosis y S. typhimurium2. L. acidophilus LB, L. rhamnosus GG parecen más efectivos frente a la candidiasis, encontrándose que no la previenen completamente pero reducen la incidencia y severidad de la colonización7,15.
Los cambios que se puedan producir en la composición de la microflora tras la utilización de un probiótico van a depender del número crítico de microorganismos del probiótico, así para el L. casei GG la mínima dosis requerida para la colonización es de 1,2×1010UFC16.
METODOLOGÍALa búsqueda de la literatura se realizó a través de sitios específicos para guías de práctica clínica (TRIP database), la base de datos de la biblioteca Cochrane y PubMed; así como bases de datos de literatura gris. Se trabajó con los documentos completos. La tabla 1 muestra los niveles de evidencia y los grados de recomendación. Se recopilaron artículos referentes a: «Probióticos en el recién nacido de muy bajo peso al nacer». En primer lugar, se dio prioridad a los ensayos clínicos controlados aleatorizados, de no contar con ellos, a los estudios de cohorte, y luego a al resto de las publicaciones. Se realizaron aportaciones del panel cuando los documentos seleccionados se consideraron relevantes. Los artículos se agruparon para su revisión según las siguientes categorías: probióticos y morbilidad, probióticos y seguridad.
Nivel de evidencia
| 1++ | Metaanálisis de alta calidad, revisiones sistemáticas de ensayos clínicos controlados y aleatorizados |
| 1+ | Metaanálisis bien realizados, ensayos clínicos aleatorizados y controlados con bajo riesgo de sesgo |
| 1- | Metaanálisis y revisiones sistemáticas, ensayos clínicos aleatorizados y controlados con alto riesgo de sesgo |
| 2++ | Revisiones sistemáticas de alta calidad de estudios de cohorte y caso controlEstudios de cohorte y caso control con muy bajo riesgo de sesgo y alta probabilidad de que la asociación sea causal |
| 2+ | Estudios de cohorte y caso control con bajo riesgo de sesgo y moderada probabilidad de que la asociación sea causal. |
| 2- | Estudios de cohorte y caso control con alto riesgo de sesgo |
| 3 | Estudios analíticos. Series de casos |
| 4 | Opinión de expertos |
- –
Documentos escritos en idioma inglés o español.
- –
Publicados en los últimos 10 años.
- –
Enfocados a diagnóstico o tratamiento.
- –
Documentos escritos en idiomas distintos a inglés o español.
Se utilizó el siguiente algoritmo de búsqueda: «Infant, Premature» [Mesh] AND («Infant, Very Low Birth Weight» [Mesh] OR «Infant, Premature/classification» [Mesh] OR «Infant, Premature/growth and development» [Mesh] OR «Infant, Premature/mortality» [Mesh] OR «Infant, Premature/nursing» [Mesh] OR «Infant, Premature/prevention and control» [Mesh] OR «Infant, Premature/therapy» [Mesh]) AND «Humans» [Mesh] AND 2003 [PDAT]: 2013 [PDAT] AND (English [lang] OR Spanish [lang]) AND (Clinical Trial [ptyp] OR Meta-Analysis [ptyp] OR Practice Guideline [ptyp] OR Randomized Controlled Trial [ptyp] OR Review [ptyp]) AND «Infant» [Mesh] AND «Probiotics» [Mesh].
Se recuperaron 23 artículos, de los que 11 resultaron ser ensayos clínicos y 5 metaanálisis y revisiones sistemáticas.
Efectos de los probióticos en recién nacido de muy bajo pesoValoración riesgo-beneficioAl tratarse de microorganismos vivos, el riesgo cero no existe. En cualquier caso, la cuestión del índice riesgo-beneficio debe ser claramente establecida. Información relativa a la eficacia, posibles efectos colaterales y la seguridad del probiótico deben estar disponibles antes de su utilización rutinaria en recién nacidos.
La seguridad de los probióticos es una cuestión muy importante. El empleo de lactobacilos y bifidobacterias no ocasiona preocupación, dado que normalmente estos gérmenes residen en el tracto gastrointestinal de la población sana. En 2004, la ESPGHAN recomendó la utilización de los productos probióticos en la suplementación dietética de los niños, pero hasta hace algunos años existían dudas sobre la seguridad de este tipo de suplementos nutricionales en recién nacidos de muy bajo peso, ello a pesar de que en los estudios experimentales se mostraban eficaces tanto en la reducción de la mortalidad, como de la incidencia de enterocolitis necrótica17,18. Las evidencias disponibles en los últimos años indican que estos productos pueden considerarse seguros en este grupo de población7,19.
Partty et al.20 evaluaron el impacto de la administración de Lactobacillus rhamnosus GG vs. placebo en 94 recién nacidos de 32 a 36 semanas de edad gestacional sobre el crecimiento, las crisis de llanto y la programación microbiológica. Los autores concluyen que la suplementación con probióticos en recién nacidos de muy bajo peso puede mejorar los síntomas relacionados con crisis de llanto y la sensación de bienestar del recién nacido.
Manzoni et al.21, en un estudio de cohortes en 743 recién nacidos de muy bajo peso, observan que L. rhamnosus GG a una dosis diaria de 3×109UFC en las primeras 4-6 semanas de vida es seguro y bien tolerado.
Rouge et al.22 realizan un ensayo clínico en 94 recién nacidos de muy bajo peso, recibiendo un suplemento diario de B. longum BB536 y L. rhamnosus GG (BB536-LGG) o ningún suplemento; los autores observan un aumento de la tolerancia intestinal entre los recién nacidos de más 1.000g, no observando efectos significativos en los recién nacidos de extremado bajo peso. La adición de Bifidobacterium como suplemento en la alimentación del recién nacido tiene efectos significativos en la disminución de la permeabilidad intestinal23.
El grupo de recién nacidos con menos de 1.000g serían los más beneficiados con la suplementación con probióticos. Estos recién nacidos son los que poseen mayor riesgo de desarrollar enterocolitis y poseen además un sistema inmunológico más inmaduro. Aunque los datos en su conjunto son aún insuficientes, los ensayos clínicos y metaanálisis realizados van aportando suficientes evidencias sobre su utilidad y seguridad24,25.
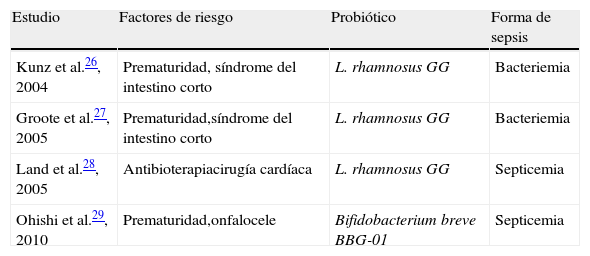
Solo de forma aislada se han documentado episodios de sepsis o bacteriemia relacionadas con las cepas de probióticos administrados; en la tabla 2 se recogen los casos comunicados hasta el presente. Un riesgo potencial, al que se han referido algunos autores, está el derivado del intercambio de material genético entre diferentes especies bacterianas. La introducción de especies bacterianas vivas en un entorno en constante reposición puede llevar a que sean el soporte durante toda la vida para ese organismo, teniendo en cuenta además el papel primordial que tales bacterias pueden influir en la expresión genética del huésped30.
Bacteriemias/sepsis comunicadas por cepas relacionadas con el uso de probióticos
| Estudio | Factores de riesgo | Probiótico | Forma de sepsis |
| Kunz et al.26, 2004 | Prematuridad, síndrome del intestino corto | L. rhamnosus GG | Bacteriemia |
| Groote et al.27, 2005 | Prematuridad,síndrome del intestino corto | L. rhamnosus GG | Bacteriemia |
| Land et al.28, 2005 | Antibioterapiacirugía cardíaca | L. rhamnosus GG | Septicemia |
| Ohishi et al.29, 2010 | Prematuridad,onfalocele | Bifidobacterium breve BBG-01 | Septicemia |
Sabemos, con respecto a los antibióticos, que el efecto de una bacteria es específico de la cepa a la que pertenece y no puede ser extrapolado a otras cepas de la misma especie. Cada cepa de probióticos de una misma especie puede tener propiedades únicas, como también diferentes funciones fisiológicas. Es decir, cuando se adscribe un efecto beneficioso a una cepa, no se puede extrapolar esa propiedad a las restantes cepas de la misma especie. Incluso la adscripción de un efecto beneficioso a una cepa depende de las condiciones de su empleo y, muy particularmente, de la dosis31.
La selección de la cepa o cepas adecuadas va a permitir evitar posibles efectos colaterales que se podrían centrar sobre la prevención de los siguientes aspectos32: actividades metabólicas perjudiciales, infecciones sistémicas, efectos desfavorables sobre la inmunomodulación y transferencia génica. La actividad metabólica bacteriana perjudicial deriva del riesgo potencial de la excesiva desconjugación o de hidroxilación de las sales biliares en el intestino delgado (sobrecrecimiento bacteriano), así como del efecto de los probióticos con alta actividad hidrolasa sobre las sales biliares (desconjugación) y la excesiva degradación de la capa de mucina del intestino.
B. lactis Bb12ha mostrado utilidad para incrementar el recuento de bifidobacterias fecales y disminuir los recuentos de enterobacterias y Clostridium. También ha demostrado utilidad en la disminución del pH fecal y la concentración de calprotectina en heces7.
La dosificación de probióticos es variable según los estudios, entre las dosificaciones sobre las que existe mayor consenso figuran Lactobacilus GG, que se administra 108UFC 2 veces al día durante 14 días, o 6×109UFC una vez al día, durante 6 semanas, Lactobacillus acidophilus+B. infantis se administran 106UFC desde el séptimo día de vida hasta el alta, B. lactis 1.2×1010UFC/kg se administra una vez al día durante 6 semanas24.
La Academia Americana de Pediatría y la ESGHAN, en referencia a la utilización de probióticos en el recién nacido de muy bajo peso, hacen la siguiente recomendación: «Hay evidencia en el uso de los probióticos para prevenir la enterocolitis necrótica en niños con peso entre 1.000-1.500g al nacer pero son necesarios más estudios»19,33.
Probióticos y enterocolitis necróticaLos estudios sobre probióticos en prematuros y recién nacidos de muy bajo peso se basan hasta el momento actual fundamentalmente en su papel en la prevención de la enterocolitis necrótica y la subsecuente mortalidad de estos niños.
La enterocolitis necrótica del prematuro es 6-10 veces más frecuente en lactantes que reciben lactancia con fórmula y es más frecuente por debajo de 30 semanas de gestación. Se ha observado una frecuencia del 2 al 22% en recién nacidos de muy bajo peso24. Su incidencia desde el punto de vista epidemiológico se relaciona con la prematuridad (está inversamente relacionada con la edad gestacional), la nutrición enteral (valorándose el volumen diario de alimentación enteral, la comparación leche materna con fórmula y la osmolaridad del primer alimento) y la colonización intestinal por flora patógena (E. coli, Klebsiella, Clostridium perfringens, Staphylococcus epidermidis y Rotavirus). La colonización de la luz intestinal parece ser un prerrequisito para el desarrollo de enterocolitis necrótica, el factor activador de las plaquetas, que es un potente mediador fosfolipídico, parece tener un papel clave en la fisiopatología de este síndrome.
Se han propuesto varios mecanismos para explicar la efectividad de los probióticos en la prevención de la enterocolitis del prematuro:
- 1.
Producen sustancias antimicrobianas como ácido láctico y otros ácidos de cadena corta, metabolitos como peróxido de hidrógeno, diacetilo y bacteriocinas. Estos compuestos afectan al metabolismo bacteriano o la producción de toxinas34.
- 2.
Disminuyen el pH intestinal, favoreciendo el crecimiento de organismos no patógenos2.
- 3.
Aumentan la resistencia a la colonización bacteriana, al competir con patógenos para unirse a los sitios de adhesión en el epitelio intestinal35.
- 4.
Compiten por los nutrientes utilizados por organismos patógenos35.
- 5.
Parecen tener un papel estimulante de la inmunidad innata y adquirida15.
Bernardo et al.24, en una revisión sistemática, evalúan los beneficios de la utilización de probióticos como preventivos de enterocolitis necrótica y otras morbilidades asociadas a la prematuridad. Analizan 11 ensayos clínicos que suponen 2.887 pacientes. Aunque la revisión reúne estudios muy heterogéneos en lo referente al tipo de probiótico utilizado, se observa una reducción del riesgo de enterocolitis necrótica (NNT 25), de muerte por cualquier causa (NNT 34) y sepsis (NNT 34). Los recién nacidos que reciben probióticos tienen un acortamiento del periodo requerido para conseguir la alimentación enteral completa (IC del 95%, 2,78-3,69 días); además, el periodo de hospitalización también fue menor.
Fernández-Carrocera et al.36 aleatorizan a 150 recién nacidos de bajo peso para recibir un suplemento de una mezcla de probiótico multiespecie (L. acidophilus, L. rhamnosus, L. casei, L. plantarum, B. infantis, S. thermophilus) o ningún suplemento. Los autores no observan una disminución del riesgo de enterocolitis en el grupo tratado (RR = 0,54, IC del 95%, 0,21 a 1,39).
Wang et al.37, en un metaanálisis sobre 20 ensayos clínicos aleatorizados y un total de 3.816 recién nacidos prematuros de muy bajo peso, observa una disminución del riesgo de enterocolitis necrótica en los tratados con probióticos (RR=0,33; IC del 95%, 0,24-0,46) y una disminución del riesgo de muerte (RR=0,56; IC del 95%, 0,43-0,73). Los autores no observan que el tratamiento con probióticos modifique el riesgo de sepsis (RR=0,90; IC del 95%, 0,71-1,15). En esta revisión sistemática, aunque existe heterogeneidad en los probióticos utilizados en los distintos ensayos, la mayoría utiliza una combinación de Lactobacilus y bifidobacterias; continúan apreciándose diferencias importantes en dosis entre los diferentes artículos.
Alfaleh et al.38, en una revisión sistemática siguiendo la metodología de la revisión Cochrane sobre 16 ensayos clínicos aleatorizados y un total de 2.842 recién nacidos prematuros con menos de 37 semanas de edad gestacional, observan que la administración de probióticos enterales reduce el riesgo de presentar enterocolitis grave (RR=0,35; IC del 95%, 0,24-0,52), se reduce igualmente la mortalidad (RR=0,40; IC del 95%, 0,27-0,60) y, al igual que Wang et al.37, no observan disminución del riesgo de sepsis (RR=0,90; IC del 95%, 0,96-1,07). En este metaanálisis, los autores concluyen que no fue posible extrapolar los datos obtenidos a los recién nacidos de menos de 1.000 g, al no existir datos suficientes con respecto a los beneficios y los efectos adversos potenciales en neonatos con menos de 1.000 g al nacer. Esta conclusión de los autores no parece clara, sobre todo tras comprobar que el 25% de los recién nacidos incluidos en el metaanálisis tenían menos de 1.000 g y solo un 3% de la población tenía un peso al nacer mayor de 1.500 g. No queda claro por qué una intervención que reduce el riesgo de mortalidad en un 57% no puede ser recomendada en los menores de 1.000 g, que aportan un 25% de la muestra al estudio.
En otro ensayo clínico conducido por Sari et al.39, realizado en 268 recién nacidos de muy bajo peso que reciben 3,5×107UFC de L. sporogenes para comprobar su eficacia en la prevención de enterocolitis necrótica, los autores no observan ningún efecto favorable en su prevención ni en la disminución de su severidad, tampoco parece disminuir la mortalidad, aunque si observan alguna mejoría en la tolerancia enteral.
Braga et al.25, en un ensayo clínico aleatorizado y doble ciego realizado sobre 231 recién nacidos de muy bajo peso que reciben una suplementación diaria de B. breve y L. casei, a una dosis de 3,5×107 y 3,5×109, respectivamente, en la lecha materna, frente a ninguna suplementación, observan que esta combinación de probióticos reduce la incidencia de enterocolitis y mejora la motilidad intestinal en esta población.
Rouge et al.22 realizan un ensayo clínico en 94 recién nacidos de muy bajo peso, recibiendo un suplemento diaria de B. longum BB536 y L. rhamnosus GG; BB536-LGG o ningún suplemento, los autores observan un aumento de tolerancia intestinal entre los recién nacidos de más 1.000g, no observando efectos significativos en los recién nacidos de extremado bajo peso.
Lin et al.40, en un ensayo clínico realizado en 434 recién nacidos de muy bajo peso, comprueban que la combinación de B. bifidum y L. acidophilus utilizados diariamente durante las 6 primeras semanas de vida reducen la incidencia de muerte y enterocolitis necrótica.
Jacobs et al.41, en un estudio multicéntrico doble ciego, comparan el uso diario de B. infantis, S. thermophilus y B. lactis con placebo en niños menores de 32 semanas y < 1.500g de peso. Estudian a 1.099 recién nacidos, concluyendo que se reducen significativamente la enterocolitis necrótica (NEC) grave (grado 2 de Bell o superior), pero no observan un efecto en la sepsis tardía o en la mortalidad.
Las evidencias más destacables y las recomendaciones para el uso de probióticos en recién nacidos de muy bajo peso quedan recogidas en la tabla 3.
Evidencias y recomendaciones con su grado evidencia para el uso de probióticos en recién nacidos de muy bajo peso
| Evidencia/recomendación | Nivel/grado | |
| La suplementación oral con probióticos es segura en recién nacidos de muy bajo peso | 2+7,21 | |
| Los recién nacidos de muy bajo peso que reciben suplemento nutricional con probióticos alcanzan nutrición enteral completa en un periodo menor | 1+22 | |
| En situaciones con alta incidencia local de enterocolitis, la suplementación con probióticos puede ser recomendada | 2+42 | |
| La suplementación dietética con probióticos en los recién nacidos de muy bajo peso se asocia con una disminución del riesgo de enterocolitis y de muerte | 1++24,37 | |
| La suplementación con probióticos en recién nacidos de muy bajo peso no se asocia a mejores resultados neurológicos a los 3 años | 2+43 | |
| La suplementación con probióticos en recién nacidos de muy bajo peso aumenta la sensación de bienestar y disminuye la permeabilidad intestinal y los episodios de cólicos del lactante | 1–20,23 | |
| La suplementación con probióticos (Bifidobacterium breve y Lactobacillus casei) aumentan la motilidad intestinal en recién nacidos de muy bajo peso alimentados con leche materna | 1+25 | |
| El uso de probióticos debería considerarse en el cuidado del prematuro ≤ 32 semanas de gestación y/o<1.500 g, incluidos los menores de 1.000 g | Punto de buena práctica | |
| El uso rutinario de probióticos implica una estrecha monitorización | Punto de buena práctica | |
| Las evidencias existentes nos hacen preferir, en cuanto a tipo de género, una combinación de Bifidobacterium y Lactobacillus, ya que disminuyen la incidencia de enterocolitis, si bien se debe plantear cuál o cuáles son los probióticos más adecuados para cada situación, su dosis y la duración óptima de su administración | Punto de buena práctica | |
| Comenzar lo antes posible su administración y mantenerla al menos 6 semanas o hasta el alta | Punto de buena práctica | |
| No se deberían administrar probióticos en presencia de enterocolitis necrótica o patología intestinal | Punto de buena práctica |
En el momento actual, los ensayos clínicos y los metaanálisis van aportando suficientes evidencias sobre la utilidad y la seguridad de los probióticos en los recién nacidos de muy bajo peso. Si bien los datos son aún limitados en los recién nacidos con menos de 1.000g, estos neonatos serían los más beneficiados tras la suplementación con probióticos, al presentar mayor prevalencia de enterocolitis necrosante. El Grupo de Nutrición y Metabolismo Neonatal de la SENeo considera que el uso de probióticos debería tenerse en cuenta en el prematuro ≤ 32 semanas de gestación y/o<1.500 g, incluidos los menores de 1.000 g, si bien su uso, en especial en los recién nacidos con menos de 1.000g, debe someterse a una estrecha monitorización.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.