la oxigenación por membrana extracorpórea (ECMO) proporciona soporte vital a pacientes con insuficiencia respiratoria y/o cardíaca potencialmente reversible, en los que previamente han fallado las técnicas de soporte convencionales.
Objetivosrevisar los criterios utilizados en nuestro centro para someter a pacientes pediátricos a ECMO, comparar su evolución según la enfermedad de base (insuficiencia respiratoria, cardiopatía congénita o sepsis) e identificar las secuelas atribuibles a la técnica.
Material y métodorevisión retrospectiva de las historias clínicas de los pacientes sometidos a ECMO en nuestro centro, excluidas las enfermedades propiamente perinatales.
Resultadosentre junio de 2001 y enero de 2007 fueron sometidos a ECMO 16 pacientes pediátricos. El 50% eran varones. La mediana (intervalo) de edad fue 7 meses (21 días-11 años). Once pacientes entraron en ECMO por insuficiencia respiratoria (con índices de oxigenación > 40 y/o diferencias alveoloarteriales de oxígeno > 605), 2 tras cirugía cardiovascular y 3 por sepsis (con inestabilidad hemodinámica refractaria al soporte inotrópico). La ECMO se inició con una mediana (intervalo) de 3,58 días (12 h-9 días) desde el ingreso en la UCI-P. La canulación inicial fue venoarterial en 8 casos y venovenosa en 8 (5 pasaron posteriormente a venoarterial). La mediana de duración de la técnica fue de 8 (1-28) días. La complicación principal fue el aislamiento de gérmenes en los cultivos seriados (8 pacientes). La supervivencia fue del 50% (6 pacientes con insuficiencia respiratoria y los 2 postoperados cardíacos). Se retiró el soporte a 7 pacientes por imposibilidad para revertir la situación que motivó la entrada en ECMO. Un octavo paciente falleció a los 7 días de la descanulación por nuevo empeoramiento clínico. Entre los supervivientes no se han detectado durante el seguimiento secuelas graves atribuibles a la técnica.
Conclusionesla supervivencia total de los niños sometidos a ECMO en nuestro centro es similar a la recogida por la ELSO en 2004, aunque el pronóstico difiere según la afección que motive la entrada en ECMO. Los criterios para iniciar la técnica varían según se trate de una enfermedad respiratoria (índices respiratorios de mal pronóstico), infecciosa (inestabilidad hemodinámica) o cardíaca (disfunción miocárdica). Entre los supervivientes no se han detectado durante el seguimiento secuelas graves atribuibles a la técnica.
ECMO (Extracorporeal Membrane Oxygenation) provides a vital support to patients with supposed reversible respiratory and/or cardiac failure, in whom conventional support techniques have been previously unsuccessful.
ObjectivesTo determinate the criteria used in our hospital to put paediatric patients on ECMO, compare their clinical course depending on their pathology (respiratory failure, congenital heart disease or sepsis) and identify the sequelae attributable to this technique.
Material and methodA retrospective review of clinical records of all patients on ECMO support in our centre, excluding those presenting typically in neonatal period.
ResultsECMO was used on 16 patients from June 2001 to January 2007, of which 50% were males. The median age was 7 months (from 21 days to 11 years). The reason for starting ECMO was respiratory failure in 11 cases (oxygenation index >40 and/or alveolar-arterial oxygen gradient >605), congenital heart disease in 2 and sepsis in 3 (due to shock unresponsive to adequate resuscitation). The median time to starting ECMO from PICU admission was 3.58 days (from 12h to 9 days). Venovenous cannulation was used initially in 8 patients, but 5 of them needed venoarterial ECMO later. The technique was used for a mean of 8 days (from 1 to 28 days). The main complication was the isolation of bacteria in different cultures (8 patients). The overall survival was 50% (6 patients with respiratory failure and both patients submitted to cardiac surgery). Extracorporeal support was withdrawed in 7 children because their clinical situation was irreversible. Another patient died seven days after successful decannulation. We have not found any serious sequel among survivors that could be attributable to this technique.
ConclusionsSurvival among children supported with ECMO in our hospital is similar to that recorded by the ELSO in 2004, although the prognosis depends on the initial pathology. There are different criteria for starting this technique depending on the underlying diseases: respiratory index of poor prognosis in patients with respiratory failure, haemodynamic instability in those with sepsis or cardiac failure after cardiovascular surgery. We have not found any serious sequel among the survivors which could be attributable to this technique.
La oxigenación por membrana extracorpórea (ECMO) es una técnica que proporciona oxígeno a los tejidos en pacientes con insuficiencia respiratoria y/o cardíaca.
Se trata de una modificación del sistema de circulación extracorpórea (CEC) utilizado durante la cirugía cardiovascular, que permite proporcionar soporte cardiopulmonar durante un periodo más prolongado (días o semanas) en lugar de unas pocas horas. Es importante tener en cuenta que la ECMO no es un tratamiento en sí mismo, sino meramente un sistema de soporte vital que se ofrece al paciente mientras se optimizan todas las terapias que conducen a una mejoría de la función cardiopulmonar. En general resulta una técnica cara, invasiva y compleja que requiere un equipo sofisticado y un personal específicamente entrenado, por lo que se aplica a pacientes en los que haya fallado el tratamiento convencional y en los que la insuficiencia cardíaca y/o respiratoria sea potencialmente reversible.
Desde que en 1972 Hill llevara a cabo la primera ECMO en un ser humano hasta julio de 2004, la Extracorporeal Life Support Organization (ELSO) ha registrado casi 29.000 ECMO, 6.000 de las cuales han sido en pacientes pediátricos1.
Se plantean tres objetivos principales en esta revisión: revisar los criterios de entrada en ECMO en edad pediátrica en nuestro hospital; comparar la evolución de los diferentes grupos fisiopatológicos (insuficiencia respiratoria o inestabilidad hemodinámica) entre sí y con el registro de la ELSO, e identificar la incidencia de secuelas graves debidas a la técnica.
Material y métodoSe realiza una revisión retrospectiva de todas las historias clínicas de los pacientes sometidos a ECMO en nuestro centro entre junio de 2001 y enero de 2007. Se excluye a todos los pacientes con enfermedad propiamente perinatal (síndrome de aspiración de meconio, hipertensión pulmonar persistente del recién nacido, hernia diafragmática congénita). Se realiza un análisis descriptivo.
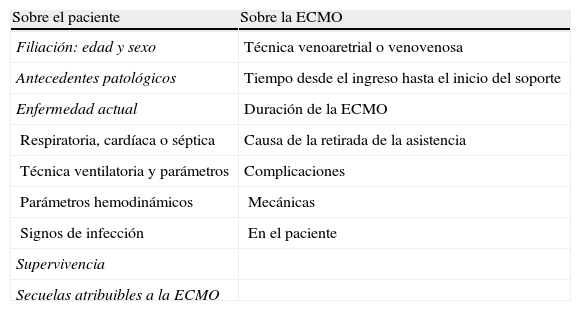
La tabla 1 recoge los criterios de inclusión para el inicio de ECMO en la edad pediátrica2. En general, la entrada en ECMO queda justificada siempre que el equipo médico responsable considere que han fracasado las medidas de soporte convencionales (incluido el uso de ventilación de alta frecuencia, óxido nítrico y prono)3. Aun así, se aceptan como criterios de exclusión los detallados en la misma tabla. En la tabla 2 se detallan los parámetros (tanto de los pacientes como de la ECMO) valorados en este estudio.
Criterios de inclusión y exclusión para inicio de ECMO en edad pediátrica2
| Criterios de inclusión | Criterios de exclusión |
| IO > 40 o DAaO2 > 605-620mmHg o hipercarbia con pH<7,1 durante más de 6h pese a optimizar soporte ventilatorio (VAFO y NO) | Ventilación mecánica > 14 días (relativo) |
| Afección neurológica severa | |
| Hemorragia incontrollable | |
| Fallo multiorgánico (más de 3 órganos, entre ellos pulmones o corazón) | |
| Inestabilidad hemodinámica refractaria al soporte inotrópico y volumétrico |
DAaO2: diferencia alveoloarterial de oxígeno; IO: índice de oxigenación; VAFO: ventilación de alta frecuencia; NO: óxido nitrico.
Parámetros valorados por el estudio
| Sobre el paciente | Sobre la ECMO |
| Filiación: edad y sexo | Técnica venoaretrial o venovenosa |
| Antecedentes patológicos | Tiempo desde el ingreso hasta el inicio del soporte |
| Enfermedad actual | Duración de la ECMO |
| Respiratoria, cardíaca o séptica | Causa de la retirada de la asistencia |
| Técnica ventilatoria y parámetros | Complicaciones |
| Parámetros hemodinámicos | Mecánicas |
| Signos de infección | En el paciente |
| Supervivencia | |
| Secuelas atribuibles a la ECMO |
En el periodo de estudio se realizaron en total 16 ECMO pediátricas (8 niños y 8 niñas). La media de edad de los pacientes fue de 21 meses (intervalo, 21 días-11 años; mediana, 7 meses). 7 de ellos eran niños previamente sanos; los demás presentaban alguno de los siguientes antecedentes: 3 casos de displasia broncopulmonar en prematuros extremos, 5 cardiopatías congénitas (2 tetralogías de Fallot, 2 coartaciones de aorta y 1 comunicación interventricular con persistencia del ductus arterioso), y 1 paciente que desarrolló una peritonitis tras ser intervenido de un divertículo de Meckel.
La tabla 3 recoge la enfermedad que motivó la entrada en ECMO en cada caso.
Enfermedad que motivó la entrada en ECMO en los 16 pacientes pediátricos
| Insuficiencia respiratoria (8 casos) | Sepsis (3 casos) | Postoperatorio CCV (2 casos) |
| 3 neumonías (1 neumocócica, 1 por citomegalovirus, 1 neumonía típica sin germen identificado) | 3 sepsis neumocócicas | 2 tetralogías de Fallot |
| 5 bronquiolitis (4 VRS +, 1 VRS −) | ||
| 2 tos ferina | ||
| 1 SDRA |
CCV: cirugía cardiovascular; SDRA: síndrome de distrés respiratorio agudo; VRS: virus respiratorio sincitial.
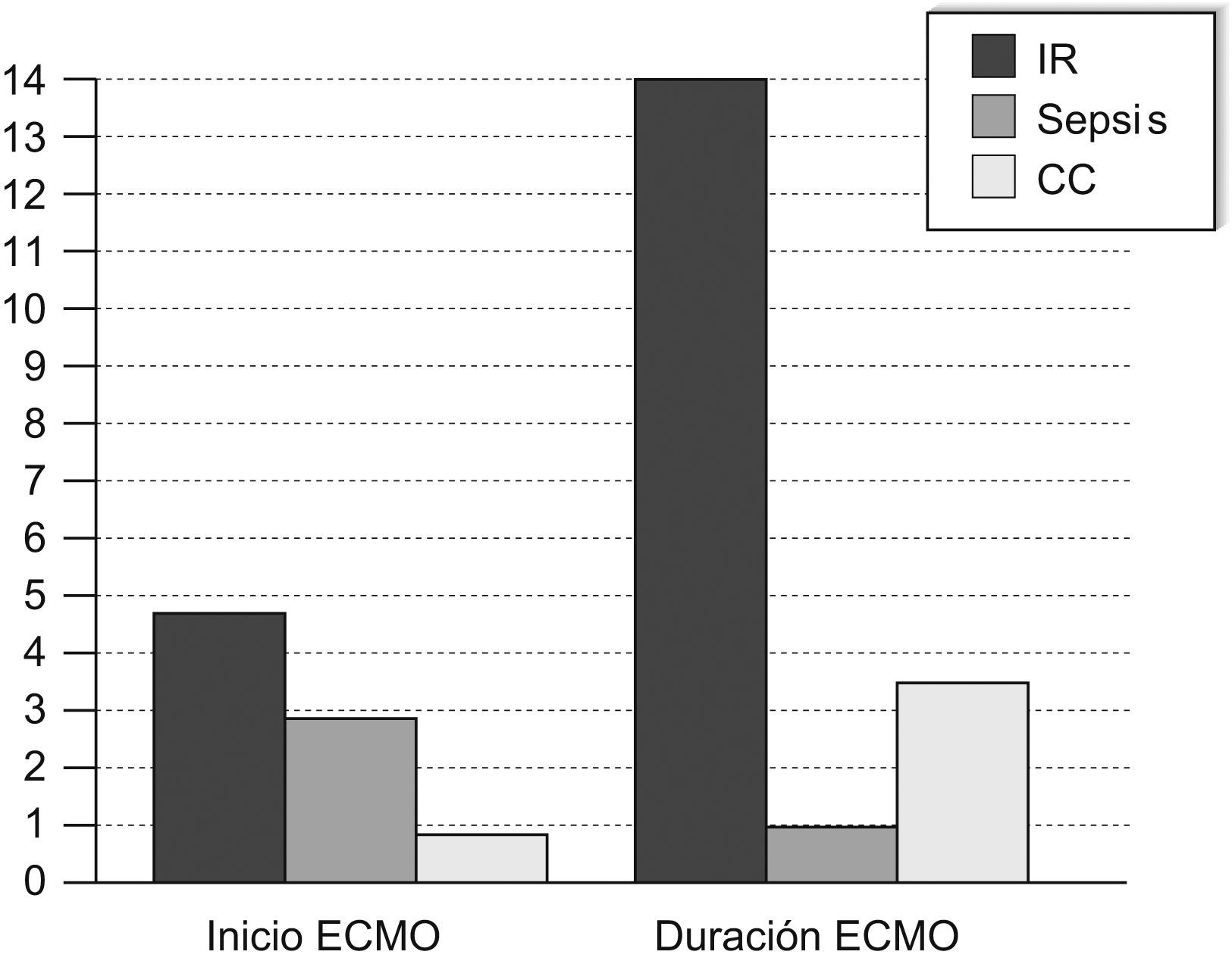
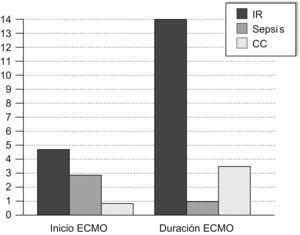
La mediana (intervalo) de inicio de la ECMO desde el ingreso hospitalario fue de 3,58 días (12h-9 días) (fig. 1). Este dato varía mucho en función de la enfermedad de base, como se detalla más adelante.
La canulación inicial fue venoarterial en 8 pacientes y venovenosa en los otros 8 (todos ellos con insuficiencia respiratoria), aunque 5 de ellos tuvieron que pasarse en las siguientes horas a venoarterial para conseguir una asistencia adecuada.
La complicación más frecuente fue el aislamiento de gérmenes en los cultivos seriados, tomados tanto del paciente como del circuito (14 cultivos positivos en 8 niños), y fue más frecuente cuanto más prolongada era la ECMO (tabla 4). El 57,1% de los gérmenes se aislaron en cultivos de vías respiratorias (aspirados traqueales o lavados broncoalveolares), y el 21,4% en hemocultivos. El germen aislado con mayor frecuencia fue Candida albicans (el 46,2% de los cultivos positivos). La segunda complicación más frecuente la constituyen las alteraciones neurológicas (8 casos): 7 pacientes presentaron alteraciones en el EEG (3 con trazado hipoactivo y arreactivo a estímulos, 1 con trazado compatible con muerte encefálica y 3 con paroxismos sin traducción clínica); 1 niña presentó una convulsión sin demostrarse alteración electroencefalográfica. En tercer lugar se sitúan los derrames serosos (5 casos): 3 pacientes con derrame pleural y 2 con derrame pericárdico. Por último, 4 pacientes presentaron hemorragias activas durante la asistencia en ECMO: 1 hemorragia digestiva, 1 hemotórax y 2 hemorragias pulmonares (una de ellas tras realizar una biopsia pulmonar).
Cultivos positivos durante la ECMO
| Fallot (11 meses) | Neumonía neumocócica (36 meses) | VRS+ (2 meses) | Tos ferina (2 meses) | SDRA (2 meses) | VRS− (36 meses) | VRS+ (33 meses) | VRS+ (3 meses) | |
| Duración ECMO (días) | 3 | 10 | 20 | 28 | 14 | 19 | 17 | 11 |
| BAL | Candida+BLEA | |||||||
| AT | BLEA | Candida | Candida | 1. H. influenzae+M. catharralis. 2. S. aureus | Aspergillus | Candida | ||
| UC | Candida | Candida | ||||||
| HC | S. simulans | S. epidermidis | S. epidermidis | |||||
| Catéter central | E. cloacae |
AT: aspirado traqueal; BAL: lavado broncoalveolar; BLEA: bacteria productora de beta-lactamasas de amplio espectro; HC: hemocultivo; UC: urocultivo; VRS: virus respiratorio sincitial.
Se limitó el tratamiento en 7 pacientes, todos ellos por irreversibilidad de la enfermedad de base: 2 pacientes (ambos con sepsis) por fallo multiorgánico refractario a la ECMO con síndrome de pérdida capilar masiva; 3 pacientes (1 con sepsis, 1 con tos ferina y 1 con bronquiolitis VRS positiva y coartación de aorta que entró en ECMO tras parada cardiorrespiratoria de 15min) por afección neurológica grave corroborada por el electroencefalograma; 2 pacientes (1 con tos ferina y 1 con neumonía por citomegalovirus en el postoperatorio de cirugía cardiovascular) por necrosis pulmonar masiva demostrada por biopsia pulmonar. Un paciente falleció a los 7 días de salir de ECMO por nuevo empeoramiento clínico. La mediana (intervalo) de la duración de la técnica fue de 8 (1-28) días, con variando también en función de la enfermedad de base (fig. 1).
La supervivencia global fue del 50% (8/16). Tras un seguimiento medio de 32 meses (6 meses-6 años), no se han detectado entre los supervivientes secuelas neurológicas atribuibles a la ECMO (destaca que todos los lactantes han presentado un desarrollo psicomotor normal; sin embargo, en los niños de más edad no se han realizado hasta el momento estudios cognitivos). Tres pacientes fueron dados de alta hospitalaria con oxigenoterapia (los 3 con displasia broncopulmonar previa); 2 de estos niños precisaron traqueostomía por precisar soporte ventilatorio prolongado (1 fue dado de alta con oxigenoterapia en flujo por la traqueostomía, que se cerró con éxito a los 6 meses, y el otro precisó ventilación domiciliaria nocturna).
A continuación se analizan los resultados según la enfermedad de base.
Todos los pacientes que entraron en ECMO por insuficiencia respiratoria tenían índices de oxigenación (IO) >40 o diferencias aleveoloarteriales de oxígeno (DAaO2) >605mmHg. La mediana de entrada en ECMO desde el ingreso hospitalario fue de 4,75 días (35h-9 días). La canulación fue inicialmente venoarterial en 3 casos y venovenosa en 8, aunque en 5 de ellos tuvo que pasarse posteriomente a venoarterial por oxigenación insuficiente. La mediana de duración de la ECMO fue de 14 (2-28) días. Se limitó el soporte en 4 niños por resistencia al tratamiento de la enfermedad que motivó el inicio de la técnica. Se descanuló con éxito a 9 pacientes, aunque 1 de ellos falleció a los 7 días de salir de ECMO por su enfermedad malformativa (displasia fibromuscular de la arteria mesentérica).
Los 3 pacientes que entraron en ECMO por sepsis presentaban previamente al inicio de la técnica IO<30. Sólo 1 de ellos estuvo ventilado en VAFO, y ninguno precisó óxido nítrico (NO). Por el contrario, presentaban inestabilidad hemodinámica refractaria la optimización de la precarga con volumen y/o soporte inotrópico/vasoactivo (dopamina, dobutamina, adrenalina, noradrenalina, hidrocortisona y/o terlipresina), lo que motivó la entrada en ECMO venoarterial de todos ellos, con una mediana de 2,79 días (12h-4 días) desde el ingreso. En todos los casos se tuvo que limitar el soporte a la imposibilidad para mantener un gasto cardíaco adecuado a pesar del soporte extracorpóreo. Destaca en estos casos la extraordinaria respuesta inflamatoria sistémica, con gran pérdida capilar de líquido e imposibilidad de mantener la estabilidad hemodinámica a pesar de administrarse líquidos y soporte inotrópico apropiado.
Los 2 pacientes intervenidos de tétrada de Fallot entraron en ECMO en las primeras 24h del postoperatorio por disfunción ventricular derecha, lo que condicionaba inestabilidad hemodinámica con escasa respuesta a inotrópicos. Uno de ellos presentaba un flujo sanguíneo preferencial hacia un pulmón (por hipoplasia de una de las ramas pulmonares) que requería unos parámetros ventilatorios que empeoraban la disfunción ventricular derecha. La técnica elegida de inicio fue la venoarterial. Permanecieron en ECMO 3 y 4 días respectivamente y ambos fueron descanulados con éxito.
La tabla 5 resume los datos de los 16 pacientes pediátricos sometidos a ECMO en nuestro centro.
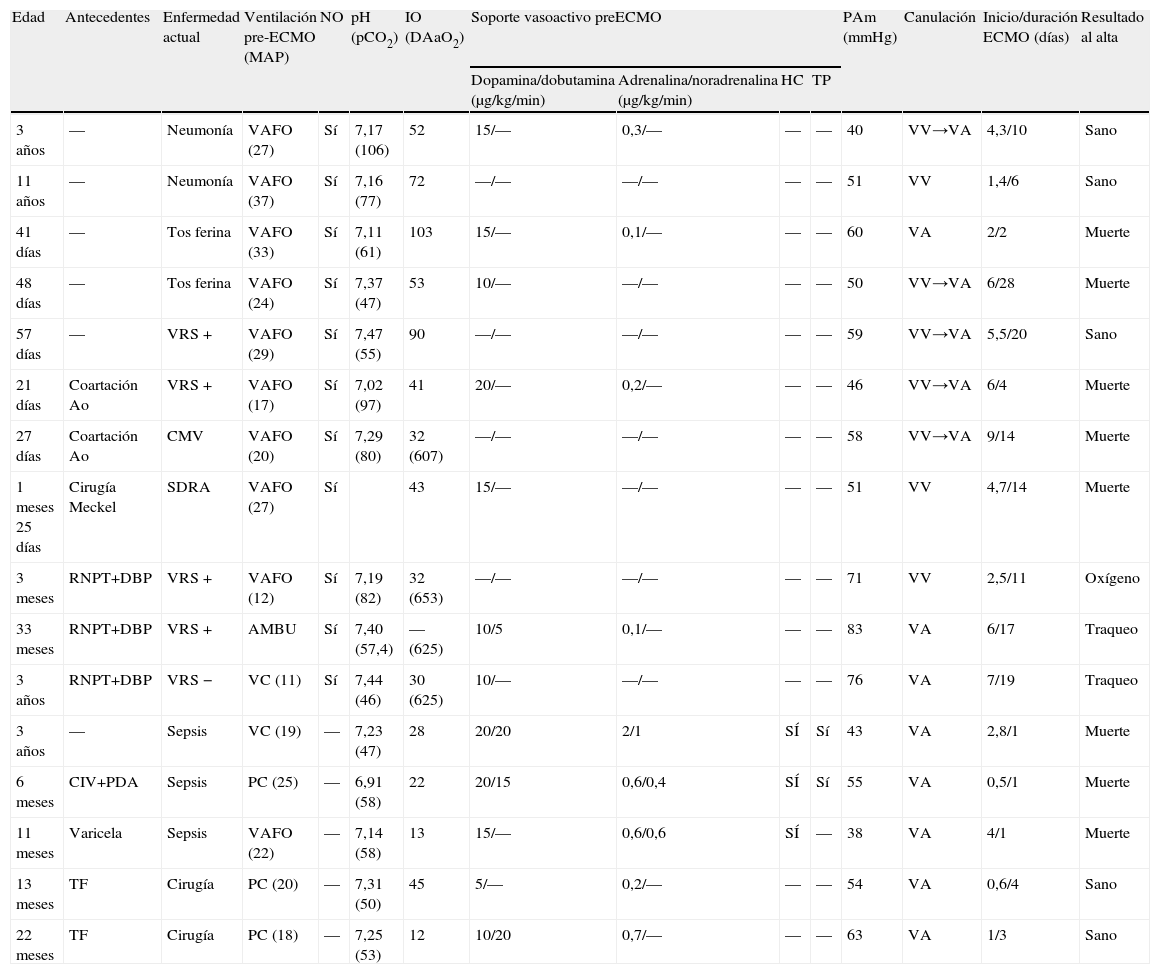
Resumen de los datos de los 16 pacientes sometidos a ECMO en nuestro centro en el momento en que se indica el soporte ECMO
| Edad | Antecedentes | Enfermedad actual | Ventilación pre-ECMO (MAP) | NO | pH (pCO2) | IO (DAaO2) | Soporte vasoactivo preECMO | PAm (mmHg) | Canulación | Inicio/duración ECMO (días) | Resultado al alta | |||
| Dopamina/dobutamina (μg/kg/min) | Adrenalina/noradrenalina (μg/kg/min) | HC | TP | |||||||||||
| 3 años | — | Neumonía | VAFO (27) | Sí | 7,17 (106) | 52 | 15/— | 0,3/— | — | — | 40 | VV→VA | 4,3/10 | Sano |
| 11 años | — | Neumonía | VAFO (37) | Sí | 7,16 (77) | 72 | —/— | —/— | — | — | 51 | VV | 1,4/6 | Sano |
| 41 días | — | Tos ferina | VAFO (33) | Sí | 7,11 (61) | 103 | 15/— | 0,1/— | — | — | 60 | VA | 2/2 | Muerte |
| 48 días | — | Tos ferina | VAFO (24) | Sí | 7,37 (47) | 53 | 10/— | —/— | — | — | 50 | VV→VA | 6/28 | Muerte |
| 57 días | — | VRS + | VAFO (29) | Sí | 7,47 (55) | 90 | —/— | —/— | — | — | 59 | VV→VA | 5,5/20 | Sano |
| 21 días | Coartación Ao | VRS + | VAFO (17) | Sí | 7,02 (97) | 41 | 20/— | 0,2/— | — | — | 46 | VV→VA | 6/4 | Muerte |
| 27 días | Coartación Ao | CMV | VAFO (20) | Sí | 7,29 (80) | 32 (607) | —/— | —/— | — | — | 58 | VV→VA | 9/14 | Muerte |
| 1 meses 25 días | Cirugía Meckel | SDRA | VAFO (27) | Sí | 43 | 15/— | —/— | — | — | 51 | VV | 4,7/14 | Muerte | |
| 3 meses | RNPT+DBP | VRS + | VAFO (12) | Sí | 7,19 (82) | 32 (653) | —/— | —/— | — | — | 71 | VV | 2,5/11 | Oxígeno |
| 33 meses | RNPT+DBP | VRS + | AMBU | Sí | 7,40 (57,4) | — (625) | 10/5 | 0,1/— | — | — | 83 | VA | 6/17 | Traqueo |
| 3 años | RNPT+DBP | VRS − | VC (11) | Sí | 7,44 (46) | 30 (625) | 10/— | —/— | — | — | 76 | VA | 7/19 | Traqueo |
| 3 años | — | Sepsis | VC (19) | — | 7,23 (47) | 28 | 20/20 | 2/1 | SÍ | Sí | 43 | VA | 2,8/1 | Muerte |
| 6 meses | CIV+PDA | Sepsis | PC (25) | — | 6,91 (58) | 22 | 20/15 | 0,6/0,4 | SÍ | Sí | 55 | VA | 0,5/1 | Muerte |
| 11 meses | Varicela | Sepsis | VAFO (22) | — | 7,14 (58) | 13 | 15/— | 0,6/0,6 | SÍ | — | 38 | VA | 4/1 | Muerte |
| 13 meses | TF | Cirugía | PC (20) | — | 7,31 (50) | 45 | 5/— | 0,2/— | — | — | 54 | VA | 0,6/4 | Sano |
| 22 meses | TF | Cirugía | PC (18) | — | 7,25 (53) | 12 | 10/20 | 0,7/— | — | — | 63 | VA | 1/3 | Sano |
Ao: aorta; CIV: comunicación interventricular; CMV: citomegalovirus; DAaO2: diferencia alveoloarterial de oxígeno; HC: hidrocortisona; IO: índice de oxigenación; MAP: presión media de vías aéreas; PAm: persión arterial media; PC: presión control; PDA: persistencia de ductus arterioso; RNPT+DBP: recién nacido pretérmino con displasia broncopulmonar; SDRA: síndrome de distrés respiratorio agudo; TF: tetralogía de Fallot; TP: terlipresina; VA: venoarterial; VAFO: ventilación alta frecuencia oscilatoria; VC: volumen control; VRS: virus respiratorio sincitial; VV: venovenosa.
La ECMO es una técnica agresiva y de coste elevado, por lo que su uso debe quedar restringido a los pacientes con una enfermedad de base potencialmente reversible en los que se haya optimizado previamente el soporte ventilatorio y/o hemodinámico sin éxito.
A pesar de tener pacientes de una amplia gama de edades (de 21 días a 11 años), la mayoría son lactantes de menos de 1 año de vida (9/16). No hay diferencias entre sexos. En cuanto a los antecedentes patológicos, destacan las cardiopatías congénitas, no sólo en los pacientes postoperados de cirugía cardiovascular (2 tetralogías de Fallot), sino también en aquellos con insuficiencia respiratoria (2 de estos pacientes presentaban una cardiopatía que pudo influir en la evolución del cuadro). Últimamente ha cobrado especial importancia la descompensación de neumopatías crónicas (displasias broncopulmonares) en el contexto de bronquiolitis (3 casos en el último invierno). A pesar de ser el segundo antecedente patológico en frecuencia en nuestra serie, dada la mayor supervivencia actual de grandes prematuros, es posible que esta afección tenga más peso entre las causas de inicio de ECMO en los próximos años.
La mayoría de los pacientes de nuestra serie (11 de 16) entraron en ECMO por imposibilidad para conseguir una oxigenación y/o ventilación adecuadas con las medidas convencionales. Sólo en 5 casos el soporte extracorpóreo se inició por inestabilidad hemodinámica pertinaz. A pesar de que la ELSO recoge la parada cardiorrespiratoria como motivo de inicio de ECMO1,4, por problemas de infraestructura nuestro centro no incluye esta posibilidad (sólo 1 paciente con bronquiolitis VRS positiva entró en ECMO tras parada cardiorrespiratoria de 15min cuando previamente ya se había decidido la indicación del soporte extracorpóreo por IO>40).
La canulación inicial fue venoarterial en 8 de los 16 casos. Dadas la mayor simplicidad técnica y la menor morbilidad (se conserva la arteria carótida), hemos iniciado la asistencia con canulación venovenosa en la mayoría de los pacientes con estabilidad hemodinámica (8 de los 11 niños con insuficiencia respiratoria), aunque 5 de ellos tuvieron que pasar a venoarterial en los primeros días, por lo que finalmente 13 pacientes recibieron asistencia cardiopulmonar. La ELSO recoge un porcentaje de canulación venoarterial del 75% para todas las ECMO pediátricas (incluidas las neonatales)1,5.
Los pacientes con insuficiencia respiratoria demoran su entrada en ECMO, ya que se intenta optimizar al máximo las medidas ventilatorias (VAFO, NO, decúbito prono). Por el contrario, en los pacientes con inestabilidad hemodinámica pertinaz (ya sea por shock vasogénico o cardiogénico), el soporte extracorpóreo se inicia antes. Esta diferencia queda bien reflejada en una serie publicada por Luyt et al6, de 9 pacientes con sepsis meningocócica que requirieron ECMO, en la que evaluaron su evolución según si el motivo de iniciar la técnica fue un fallo multiorgánico o un SDRA secundario a la sepsis. La ECMO se inició con una media de 8,5h en el primer grupo de pacientes, mientras que en el segundo el inicio del soporte extracorpóreo se demoró una media de 4 días (similar a los casos respiratorios de nuestra serie), lo que no empeoraba el pronóstico.
Es relativamente frecuente el aislamiento de gérmenes en los cultivos seriados (por protocolo cada 48h se toman muestras del niño y del circuito). La mitad de los pacientes tuvieron algún cultivo positivo, lo que fue más frecuente cuanto más prolongada era la ECMO (de los 8 niños que presentaron algún cultivo positivo, 7 estuvieron en circulación extracorpórea más de 10 días). La incidencia de hemocultivos positivos recogida en la literatura es de un 3,4-30% en neonatos (10 por cada 1.000 días de ECMO)7,8 y del 45% en adultos (19 cada 1.000 días de ECMO)7; en nuestra serie ha sido del 12,5%. Hay que hacer énfasis en la dificultad existente durante la ECMO para diferenciar entre colonización e infección. Parámetros clínicos (como una mala regulación de la temperatura, una mayor inestabilidad hemodinámica, el aumento de las necesidades de oxígeno) y analíticos (mayor consumo de hemoderivados, desviación izquierda) pueden ser orientativos, pero ante un cultivo positivo la conducta más habitual es realizar una cobertura antibiótica congruente con el germen aislado. Sin embargo, la ELSO recoge el sangrado como la complicación más frecuente (36% de hemorragias gastrointestinales y/o sangrados alrededor de la cánula o de la herida quirúrgica)1, mientras que en nuestra serie ha supuesto el 11% de las complicaciones aparecidas (4 de los 16 pacientes, ninguno con hemorragia intracraneal). Por otro lado, la ELSO registra un porcentaje de complicaciones neurológicas similar al hallado en nuestra serie (6,6% de muertes encefálicas y el 8,6% de convulsiones clínicas)1.
La supervivencia global ha sido del 50% (8 pacientes), similar a la recogida por la ELSO para pacientes pediátricos1. En el grupo de pacientes con insuficiencia respiratoria, también obtenemos tasas de supervivencia comparables a las del registro internacional. Sin embargo, dentro de este grupo de pacientes hay que destacar el mal pronóstico que tienen los niños con tos ferina por la grave hipertensión pulmonar que puede acompañarla (mortalidad del 70,5% en 61 niños tratados con ECMO por este motivo entre 1990 y 2002, que asciende al 84% en niños menores de 6 semanas9). En cuanto a los pacientes pediátricos postoperados de una cardiopatía congénita que entran en ECMO, la ELSO recoge una supervivencia del 41% de un total de 2.058 niños entre 30 días y 15 años1. Nuestra experiencia en este grupo se limita sólo a 2 pacientes (ambos sobrevivieron). El registro de la ELSO, sin embargo, es poco útil en el caso de las sepsis pediátricas (no neonatales), porque no las clasifica como indicación primaria de ECMO, sino que las recoge dentro del grupo de insuficiencia respiratoria o inestabilidad hemodinámica según produzcan SDRA o fallo multiorgánico (teniendo los de este último grupo peor pronóstico). Los 3 pacientes sépticos de nuestra serie entraron en ECMO por fallo multiorgánico resistente a otros soportes convencionales, y todos ellos murieron (se limitó el soporte extracorpóreo en los 3 casos a las 24h de su inicio). En la serie de 9 casos de sepsis meningocócicas recogida por Luyt et al6, los 5 pacientes que entraron en ECMO por SDRA sobrevivieron, mientras que de los 6 pacientes que presentaban fallo multiorgánico sólo sobrevivió 1. Meyer et al10 publican del mismo modo una serie de 655 niños entre 2 semanas y 17 años que entraron en ECMO por insuficiencia respiratoria, y los divide en dos grupos según si presentan sepsis (n=76) o no (n=579). La supervivencia fue claramente menor en el primer grupo (el 36,8 frente al 51,6%). Aun así, no consideran que la sepsis influya como factor independiente en la supervivencia, por lo que en la actualidad no se la debe considerar un criterio de exclusión de ECMO, pues esta técnica forma parte del algoritmo de tratamiento de los pacientes con fallo multiorgánico en el contexto de sepsis cuando fallan las demás medidas11–14. Dentro del grupo de inestabilidad hemodinámica, vale la pena destacar la diferente evolución que presentan los pacientes con shock cardiogénico15–17 (en nuestra serie, tras recuperarse del aturdimiento miocárdico, se pudo descanular con éxito a los 2 pacientes postoperados de cirugía cardiovascular) y aquellos con shock vasogénico (en nuestro caso, los 3 pacientes con sepsis, en los que la ECMO se muestra insuficiente para mejorar la función hemodinámica).
Las secuelas neurológicas que pueden aparecer entre los supervivientes pueden deberse tanto a la técnica (canulación y ligadura de la vena yugular y/o la arteria carótida, heparinización sistemática, duración del soporte) como a la situación clínica del paciente previa a la entrada en ECMO (grado de hipoxemia y su duración, hipotensión e hipoperfusión cerebral). La mayoría de los estudios relacionados con la morbilidad y el pronóstico a largo plazo se refieren a ECMO neonatales18–22 y concluyen que, tras 1 año de seguimiento, un 75-80% de los supervivientes no tienen ninguna secuela23. Glass22 registró el coeficiente intelectual de 150 supervivientes de ECMO en edad escolar (5 años) y comprobaron que era significativamente menor que el de los niños controles de la misma edad (96±20 frente a 115±16; p<0,001). La incidencia de retraso mental (coeficiente intelectual<70) era del 10% entre los casos frente a 0 entre los controles. Concluyeron que el más importante factor predictivo de secuelas neurocognitivas y neuromotrices era la magnitud de las alteraciones en la neuroimagen. Sin embargo, hay pocos estudios sobre el pronóstico a largo plazo de pacientes sometidos a ECMO en edad pediátrica, aunque parece que está claramente influido por la morbilidad de base antes del inicio de la técnica4. Esta afirmación concuerda con los resultados de nuestra serie: de los 8 supervivientes, 5 fueron dados de alta sin secuelas clínicas; los otros 3 pacientes (que presentaban una displasia broncopulmonar de base) requirieron oxigenoterapia domiciliaria (2 de ellos con traqueostomía). Una de estas pacientes, que tenía un retraso psicomotor leve asociado a leucomalacia periventricular por prematuridad extrema, presentó en los controles sucesivos (durante 6 meses) una progresión satisfactoria en la adquisición de habilidades psicomotrices, y en la resonancia magnética cerebral no se demostraron cambios significativos respecto a los controles previos a la ECMO. Por lo tanto, todos nuestros pacientes han presentado durante el seguimiento un desarrollo psicomotor adecuado (aunque no está protocolizada la realización de estudios cognitivos en estos pacientes).
Hay que destacar que, pese a la agresividad de la técnica y que la mortalidad es elevada, la ECMO se realiza como única medida de rescate existente en pacientes en los que han fallado los demás tratamientos de soporte. Teniendo en cuenta el escaso porcentaje de secuelas graves entre los supervivientes y que éstas no son atribuibles exclusivamente al soporte extracorpóreo, los beneficios de esta técnica son esperanzadores.
ConclusionesLa supervivencia total de los niños sometidos a ECMO en nuestro centro es similar a la recogida por la ELSO en 2004, aunque el pronóstico varía según la enfermedad que motivó el inicio de la técnica. Los criterios para iniciar este soporte y difieren según se trate de una enfermedad respiratoria (IO>40 y/o DAaO2>605mmHg a pesar de optimizar medidas ventilatorias convencionales), infecciosa (inestabilidad hemodinámica que no responde al soporte inotrópico) o cardíaca (disfunción miocárdica). La complicación más frecuente aparecida durante el soporte es el aislamiento de gérmenes en los cultivos seriados, que es más frecuente cuanto más prolongada es la ECMO (es decir, en los casos de insuficiencia respiratoria). Entre los supervivientes no se han detectado secuelas neurológicas graves atribuibles a la técnica tras un mínimo de 6 meses de seguimiento, lo que avala el uso de esta técnica a pesar de su agresividad y elevada mortalidad.
Presentado como póster en la III Reunión Nacional de la Sociedad Española de Cuidados Intensivos Pediátricos de la AEP. Madrid, 17 y 18 de octubre de 2006.