La ileítis infecciosa es una causa infrecuente de dolor abdominal en pediatría. Cursa con abdominalgia difusa o localizada en la fosa iliaca derecha (FID) con o sin diarrea; pudiendo simular otras causas de abdomen agudo, como apendicitis, invaginación o patología ovárica.
Su hallazgo ecográfico característico es el engrosamiento mural simétrico del íleon terminal1. Dependiendo del agente etiológico, los cambios inflamatorios de la mucosa pueden extenderse al ciego, apéndice y colon derecho. En los casos de afectación exclusiva del íleon y apéndice, los hallazgos clínicos y analíticos no permiten establecer el diagnóstico diferencial con la apendicitis aguda.
Realizamos un estudio retrospectivo de todos los pacientes diagnosticados con ileítis en urgencias entre 2014 y 2019 (84 casos). Únicamente se incluyeron aquellos en los que se obtuvo muestra de heces para estudio microbiológico (41/84; 48,8%). Las ecografías fueron realizadas por especialistas en radiología pediátrica y revisadas a posteriori por un único radiólogo. Se consideró patológico un grosor ecográfico de pared ileal > 2 mm2. Empleamos los test de X2 y t de Student para los correspondientes contrastes de hipótesis.
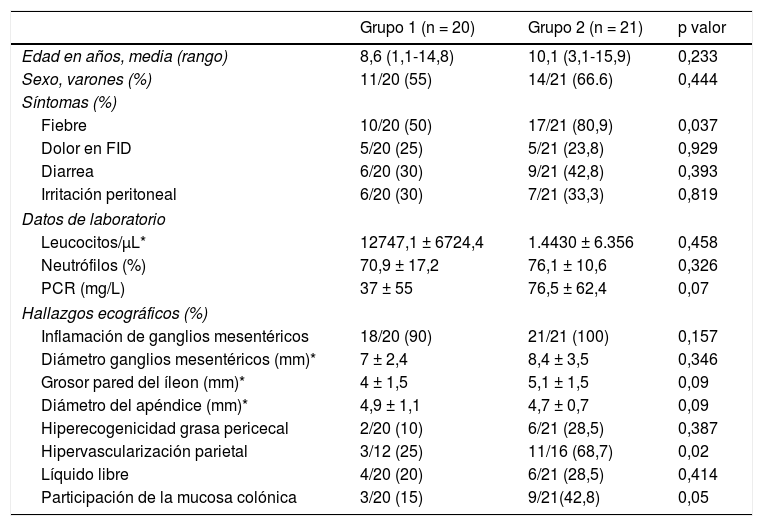
En el 51,2% (21/41) el coprocultivo fue patológico, confirmando el diagnóstico de ileítis infecciosa. Campylobacter jejuni fue el enteropatógeno identificado con mayor frecuencia (tabla 1). La fiebre fue más frecuente entre los pacientes con coprocultivo patológico (80,9% vs. 50%, p = 0,037). El resto de las manifestaciones clínicas y analíticas analizadas, no mostraron diferencias significativas (tabla 2).
Enteropatógenos aislados en el grupo de casos con coprocultivo patológico (n = 21)
| n (%) | |
|---|---|
| Bacterias | |
| Campylobacter jejuni | 8 (38) |
| Yersinia enterocolítica | 4 (19) |
| Stenotrophomonas maltophilia | 1 (4.7) |
| Virus | |
| Rotavirus | 1 (4.7) |
| Adenovirus | 1 (4.7) |
| Parásitos | |
| Endolimax nana | 1 (4.7) |
| Coinfecciones | |
| Blastocystis hominis/ Dientamoeba fragilis | 2 (9.5) |
| Cryptosporidium/ Dientamoeba fragilis | 1 (4.7) |
| Campylobacter jejuni/ Dientamoeba fragilis | 1 (4.7) |
| Campylobacter jejuni/ Dientamoeba fragilis/ Giardia lamblia | 1 (4.7) |
Pacientes diagnosticados de ileítis aguda en urgencias (2014-2019)
| Grupo 1 (n = 20) | Grupo 2 (n = 21) | p valor | |
|---|---|---|---|
| Edad en años, media (rango) | 8,6 (1,1-14,8) | 10,1 (3,1-15,9) | 0,233 |
| Sexo, varones (%) | 11/20 (55) | 14/21 (66.6) | 0,444 |
| Síntomas (%) | |||
| Fiebre | 10/20 (50) | 17/21 (80,9) | 0,037 |
| Dolor en FID | 5/20 (25) | 5/21 (23,8) | 0,929 |
| Diarrea | 6/20 (30) | 9/21 (42,8) | 0,393 |
| Irritación peritoneal | 6/20 (30) | 7/21 (33,3) | 0,819 |
| Datos de laboratorio | |||
| Leucocitos/μL* | 12747,1 ± 6724,4 | 1.4430 ± 6.356 | 0,458 |
| Neutrófilos (%) | 70,9 ± 17,2 | 76,1 ± 10,6 | 0,326 |
| PCR (mg/L) | 37 ± 55 | 76,5 ± 62,4 | 0,07 |
| Hallazgos ecográficos (%) | |||
| Inflamación de ganglios mesentéricos | 18/20 (90) | 21/21 (100) | 0,157 |
| Diámetro ganglios mesentéricos (mm)* | 7 ± 2,4 | 8,4 ± 3,5 | 0,346 |
| Grosor pared del íleon (mm)* | 4 ± 1,5 | 5,1 ± 1,5 | 0,09 |
| Diámetro del apéndice (mm)* | 4,9 ± 1,1 | 4,7 ± 0,7 | 0,09 |
| Hiperecogenicidad grasa pericecal | 2/20 (10) | 6/21 (28,5) | 0,387 |
| Hipervascularización parietal | 3/12 (25) | 11/16 (68,7) | 0,02 |
| Líquido libre | 4/20 (20) | 6/21 (28,5) | 0,414 |
| Participación de la mucosa colónica | 3/20 (15) | 9/21(42,8) | 0,05 |
Grupo 1: pacientes con coprocultivo negativo. Grupo 2: pacientes con coprocultivo patológico. FID: fosa iliaca derecha. PCR: proteína C reactiva.
Ecográficamente todos los pacientes presentaron engrosamiento parietal del íleon terminal (grosor medio 4,5 ± 1,6 mm, mediana 4 mm, rango: 2,3–9). La presencia de hipertrofia de los ganglios linfáticos mesentéricos, hiperecogenicidad de la grasa pericecal, hipervascularización parietal, líquido libre y participación de la mucosa colónica, fueron observados con mayor frecuencia en el grupo de pacientes con coprocultivo patológico (tabla 2). Solo un paciente asoció un diámetro apendicular patológico (> 6 mm), acompañado de inflamación del ciego y colon derecho, leucocitosis (24 × 103/μL) y elevación de reactantes de fase aguda (PCR 188 mg/L, fibrinógeno > 740 mg/dL). El paciente fue hospitalizado para observación y control del dolor; finalmente su coprocultivo fue positivo para Campylobacter jejuni.
El 51,2% de los pacientes fueron hospitalizados, y en todos los casos el motivo del ingreso fue el control de la evolución del dolor abdominal. Nueve pacientes fueron derivados para seguimiento a consultas externas de gastroenterología, realizándose colonoscopia en tres casos. En ninguno se confirmó el diagnóstico de enfermedad inflamatoria intestinal (EII).
En ocasiones, en nuestra serie más de la mitad de los casos, se olvida la obtención de una muestra de heces en el niño con ileítis aguda. Esto podría justificarse por dos motivos, en primer lugar, la diarrea no siempre está presente y en segundo porque el pediatra de urgencias no puede disponer del resultado del coprocultivo de manera rápida y por tanto no modifica su actitud, al menos de manera inmediata.
En este sentido, la ecografía abdominal puede proporcionar información relevante a la hora de orientar el diagnóstico etiológico inicial. No obstante, debe tenerse en cuenta que el engrosamiento de la pared ileal no es un dato patognomónico de origen infeccioso. Existen otras muchas causas que pueden dar lugar a la inflamación del último tramo del intestino delgado, como son la púrpura de Schönlein-Henoch, el linfoma intestinal o la EII3.
Con base en nuestros resultados, no podemos afirmar que el grosor parietal permita diferenciar el origen infeccioso de la ileítis aguda. En este sentido, nuestro grosor medio en el grupo de casos con coprocultivo positivo (5,1 ± 1,5 mm) fue muy similar al encontrado por otros autores en niños con EII4.
Aproximadamente una cuarta parte de nuestros pacientes se presentaron en urgencias refiriendo un dolor focalizado en FID. Este hecho justificó la realización de la ecografía abdominal con el propósito de descartar apendicitis aguda. En la mayoría de los casos el diámetro apendicular fue cercano al rango patológico de 6 mm. Debe tenerse en cuanta que la mera presencia de una ileítis terminal no descarta la posibilidad de una apendicitis aguda asociada. Por tanto, la presencia de otros signos ecográficos que apoyen el diagnóstico infeccioso de sospecha podría evitar laparotomías innecesarias. Así, por ejemplo, la extensión del proceso inflamatorio más allá del íleon terminal es un dato sugestivo de origen infeccioso; la ceoileítis y la ileocolitis derecha son características de la infección producida por Salmonella y Campylobacter5.
Nuestra principal limitación radica en el hecho de la ecografía es un procedimiento operador dependiente. En nuestro caso, la definición de hipervascularización parietal varía según los autores, para algunos es anormal cualquier señal doppler en la pared, para otros es necesario un cierto número de señales por centímetro cuadrado6.