El dolor abdominal crónico (DAC) en la infancia es un motivo de consulta frecuente que afecta a la vida familiar, y en ocasiones precisa realización de pruebas complementarias. El objetivo fue realizar el análisis cualitativo, cuantitativo y económico de las pruebas que se solicitan.
Pacientes y métodosEstudio observacional, prospectivo y multicéntrico, incluyendo pacientes entre 4-15 años con DAC. Se diferenciaron 2 grupos: orgánico y funcional. Se recogieron las siguientes variables: clínicas, pruebas complementarias y su coste.
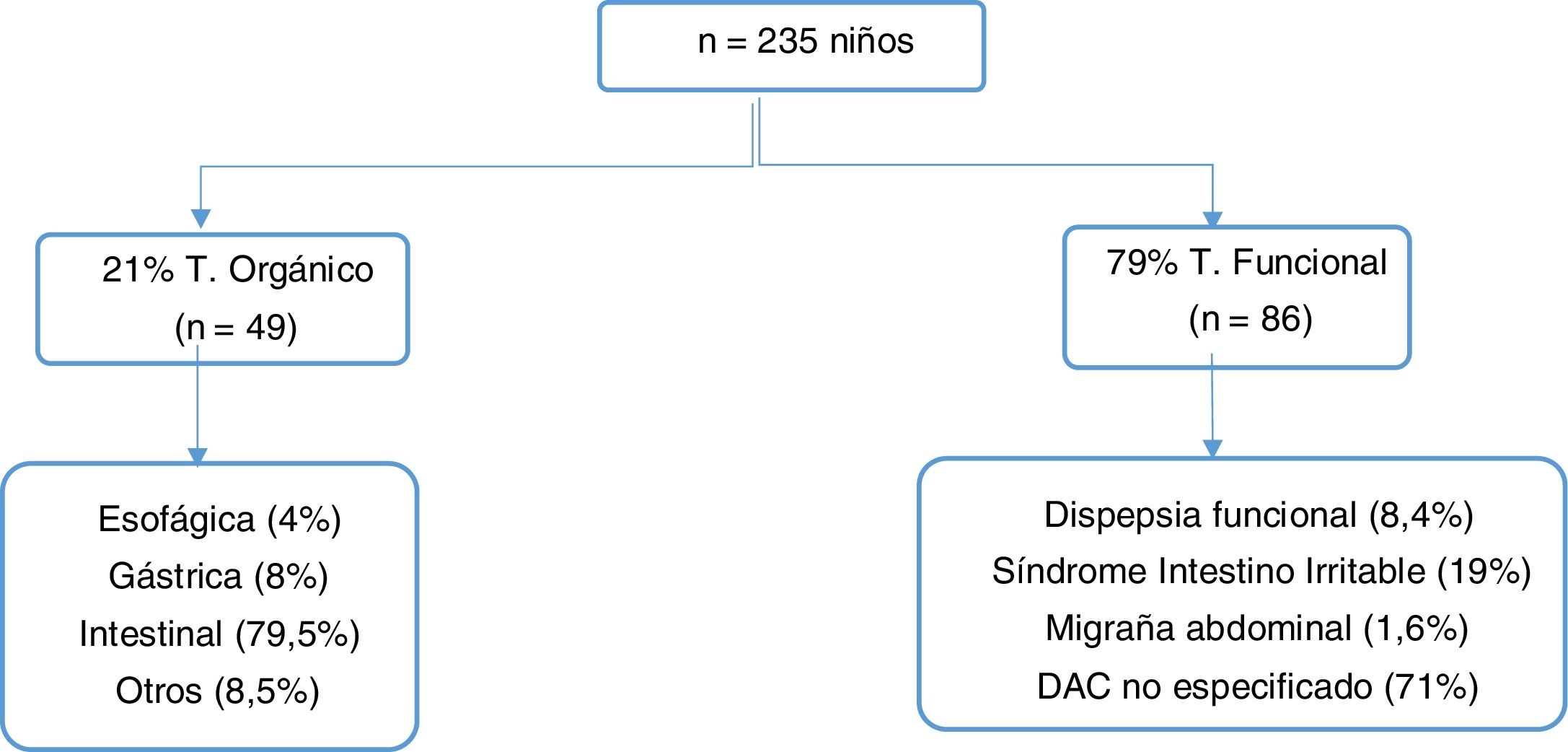
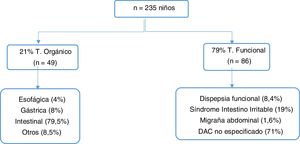
ResultadosSe incluyeron 235 niños con DAC (edad media 9,7±2,7 años). Un 79% resultaron trastornos funcionales y un 21% orgánicos. Casi la mitad de los pacientes presentaba algún tipo de síntoma o signo de alarma, pero solo la clínica miccional se asoció con organicidad. La ecografía abdominal, estudio de parásitos en heces, test de hidrógeno espirado y gastroscopia son las que más se asociaron con enfermedad orgánica. Existía una diferencia apreciable entre el coste de las pruebas según cada centro. El gasto económico total fue de 52.490,8euros, siendo 195euros por paciente para los funcionales y 306euros para los orgánicos.
ConclusionesLos síntomas y signos de alarma en el DAC son frecuentes, pero poco específicos. La ecografía abdominal y el estudio de parásitos podrían ser pruebas útiles de primer nivel por su inocuidad para diferenciar TO de TDAF. La gastroscopia y el test de hidrógeno espirado fueron las pruebas más discriminativas de organicidad. El coste económico invertido en pruebas para la orientación diagnóstica del DAC de origen funcional es elevado.
Chronic abdominal pain (CAP) in children is a symptom that frequently leads to a visit to the paediatrician, which affects family life and occasionally requires the need to perform diagnostic studies (DS). The objective was to carry out a qualitative, quantitative, and economic analysis on the tests requested.
Patients and methodsAn observational, prospective and multicentre study was conducted that included children between 4-15 years old affected by CAP. The difference between organic and functional disorders was taken into account. The following variables were collected: history, warning signs and symptoms, DS, and the cost of these.
ResultsThe study included 235 children with CAP (Age; mean 9.7±2.7 SD). The large majority (79%) were functional disorders and 21% organic disorders. Almost half of the patients had some warning sign or symptom, but urinary symptoms were only associated with organic disorders. The abdominal ultrasound, faecal parasites, breath test, and endoscopy were the most associated with organic disorders. There was a difference between the costs of the DS according to each centre. The total economic cost was 52,490.80 euros, with 195 euros per patient for functional disorders and 306 euros for organic disorders.
ConclusionSigns and symptoms of alarm in CAP were very frequent, but had low discriminative capacity. The abdominal ultrasound and faecal parasites are innocuous DS, and could be useful as a first level study. The endoscopy and the breath test were the most discriminative of organic disease. The economic cost of DS arising from the diagnosis of exclusion in CAP was high.
El dolor abdominal crónico (DAC) en la infancia y la adolescencia es un motivo de consulta muy frecuente en todos los niveles asistenciales, suponiendo del 18% al 24% de las consultas en atención primaria (particularmente entre los 4-12 años de edad). La mayoría poseen características funcionales, estimándose que tan solo un 10% presentan causa orgánica subyacente1–3. La patogenia de los trastornos digestivos abdominales funcionales (TDAF) es poco conocida, aunque parece deberse a una interacción entre factores genéticos, ambientales y psicosociales. Estos factores favorecen una reactividad anormal entre el sistema nervioso entérico, el neural autónomo y el central a la hora de adaptarse a cambios fisiológicos o de estrés2,4–6.
El reconocimiento de signos y síntomas de alarma, junto con una exploración clínica minuciosa y el tiempo de evolución, siguen siendo el patrón oro para diferenciar los posibles casos de dolor abdominal orgánico de los de origen funcional2,4,7. La necesidad de realizar pruebas complementarias (PC) continúa sin estar clara en estos trastornos. A su vez, la ausencia de marcadores bioquímicos y estructurales específicos en los TDAF dificulta aún más el diagnóstico de estos pacientes1,8. Esto, junto con la intensidad y la recurrencia de los síntomas y la preocupación de las familias, hace que estos niños se vean sometidos a numerosas PC, suponiendo un coste sanitario importante8–10. A esto habría que sumar el gasto derivado del absentismo laboral de los padres y el absentismo escolar de los niños hasta en un 85% de los casos (media de 17,6 días al año)11, la alteración de la calidad de vida de los niños y sus familias y el importe de múltiples fármacos o productos de parafarmacia2,9,12,13.
Los últimos criterios de Roma IV suponen un gran avance en este aspecto, ya que permiten al clínico establecer el diagnóstico TDAF sin realizar PC, o realizarlas solo para confirmar el diagnóstico. Además, contemplan la posibilidad de que un paciente con una enfermedad orgánica (por ejemplo, enfermedad celiaca o enfermedad inflamatoria intestinal) tenga un TDAF asociado. En muchas ocasiones la elevada preocupación de los pacientes y/o familiares puede justificar la realización de PC, sobre todo en los casos en los que el dolor abdominal influye significativamente en la calidad de vida del paciente8,9,14,15.
Dado que los TDAF son muy prevalentes en la edad pediátrica, y que conducen en muchas ocasiones a la realización de numerosas PC para descartar organicidad, el objetivo principal del presente trabajo fue realizar un análisis cuantitativo y cualitativo de los estudios complementarios que se solicitan. El objetivo secundario fue comprobar el coste económico de las PC realizadas.
Pacientes y métodosEstudio prospectivo, observacional y multicéntrico realizado en 8 hospitales españoles de la Comunidad Valenciana, Castilla-La Mancha y Murcia (4 centros de tercer nivel y 4 comarcales). Se reclutaron todos los niños de 4 a 15 años que acudían por primera vez a la consulta de gastroenterología infantil por DAC. Se incluyeron aquellos que habían padecido al menos un episodio de dolor abdominal a la semana en los últimos 2 meses4. Se llevó a cabo la recogida de datos a través del programa informático específico de DAC en niños «DOABDO» (n.° de registro 09/2014/736), previo consentimiento informado de los padres. Cada facultativo registró en el programa los datos del paciente: edad, género, presencia de antecedentes personales y familiares de enfermedad gastrointestinal, características del dolor abdominal, presencia de síntomas de alarma en la anamnesis (dolor alejado del ombligo, dolor cuadrante superior o inferior derecho, cambio en las deposiciones, presencia de sangre en las heces, náuseas o vómitos, disfagia, diarrea nocturna, dolor que despierta por la noche, fiebre, síndrome miccional y pérdida de peso o detención de la talla) y signos de alarma en la exploración (evidencia de pérdida de peso, dolor a la palpación en el hipocondrio derecho o la fosa iliaca derecha, presencia de hepatomegalia o anomalías en el ano)1,4. Se recopilaron las PC realizadas en atención primaria y posteriormente se incluyeron las pruebas solicitadas desde atención especializada. Entre las PC se registraron análisis de sangre (hemograma, perfiles hepático, lipídico, renal y férrico; serología de celiaquía; velocidad de sedimentación globular y proteína C reactiva), estudios en heces (sangre oculta, cultivo, parásitos y calprotectina), sistemático de orina, ecografía abdominal, test de hidrógeno espirado y estudios endoscópicos. Por último, se consultó en el departamento de contabilidad de cada hospital el coste económico de las PC efectuadas, realizando la media ponderada de todas ellas. Se realizó el análisis estadístico mediante el programa SPSS® versión 18.0, dividiendo la muestra en 2 grupos: trastornos orgánicos (TO) y TDAF, según criterios Roma III vigentes en ese momento. Se compararon todas las variables mediante tablas de contingencia y se realizó un análisis de Chi-cuadrado para determinar la asociación entre estas y la presencia de organicidad. El estudio fue aceptado por el Comité de Ética del Hospital Clínico Universitario de Valencia.
ResultadosSe incluyeron 235 niños con DAC, 59% mujeres, media de edad de 9,7±2,7 años, mediana de 10 años. El 85% fueron derivados desde su centro de atención primaria y el resto desde planta de hospitalización, urgencias u otras consultas. Según el diagnóstico final el 79% de los casos fueron TDAF y el 21% TO. En la figura 1 se desglosan los diagnósticos de cada grupo.
Respecto al estado nutricional, aplicando los criterios de la OMS, un 74,5% de los niños estaban normonutridos, un 3% desnutridos y un 22,5% con sobrepeso y obesidad, sin diferencias entre los grupos de TDAF y TO. En relación con los antecedentes personales y familiares de enfermedad gastrointestinal que se recogen en la tabla 1, se observó una mayor frecuencia de estos en los TDAF sin ser estadísticamente significativos (tabla 1).
Presencia de antecedentes personales y familiares de enfermedad gastrointestinal en relación con el diagnóstico
| Antecedentes personalesn (%) | Antecedentes familiaresn (%) | |
|---|---|---|
| Trastornos funcionales | 27 (15) | 43 (24,7) |
| Trastornos orgánicos | 10 (4,2) | 12 (5) |
| E. esofágica | 0 (0) | 0 (0) |
| E. gástrica | 2 (25) | 3 (37,5) |
| E. intestinal | 7 (14,6) | 9 (18,8) |
| Otras | 1 (25) | 0 (0) |
* Prueba Chi cuadrado; antecedentes personales y familiares (p=0,525 y p=0,336, respectivamente).
En relación con la presencia de síntomas o signos de alarma casi la mitad de los pacientes (43,8%) los presentaba, sin diferencia estadísticamente significativa entre el grupo de TO (61%) y el de TDAF (39%). La presencia de dolor en el cuadrante inferior derecho, alejado del ombligo o dolor a la palpación en el hipocondrio o fosa iliaca derecha se vio relacionado con resultado de ecografía abdominal alterado, aunque este no fue significativo. Un 11,5% de la muestra presentó diarrea. De ellos, detectamos un caso de salmonelosis, pero la calprotectina fecal fue normal en todos excepto en 2 casos, con valores de 287 y 760mg/g con normalización en el control posterior. Tras el análisis de Chi-cuadrado solo la clínica miccional presentó asociación significativa con organicidad (p<0,001).
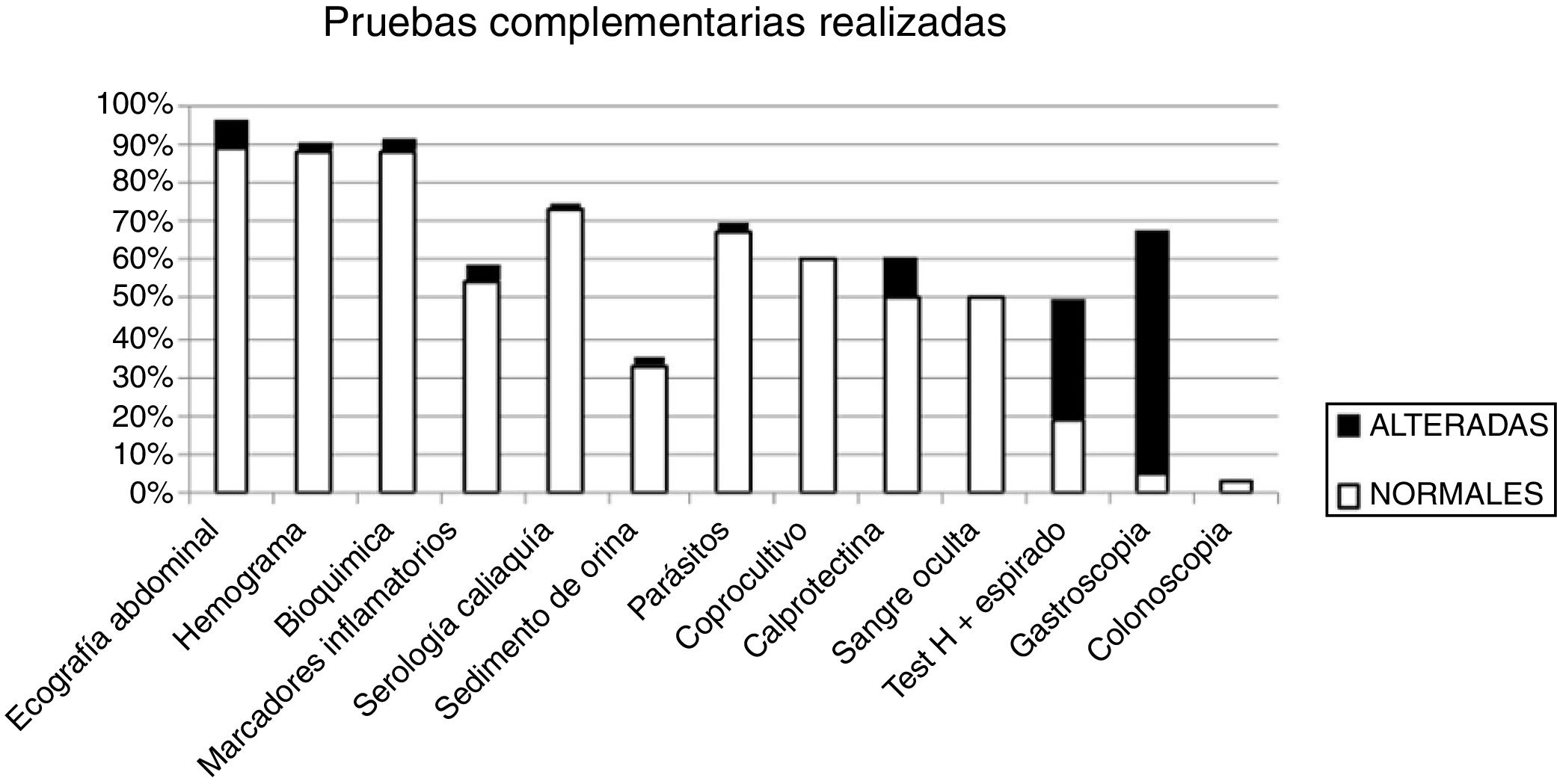
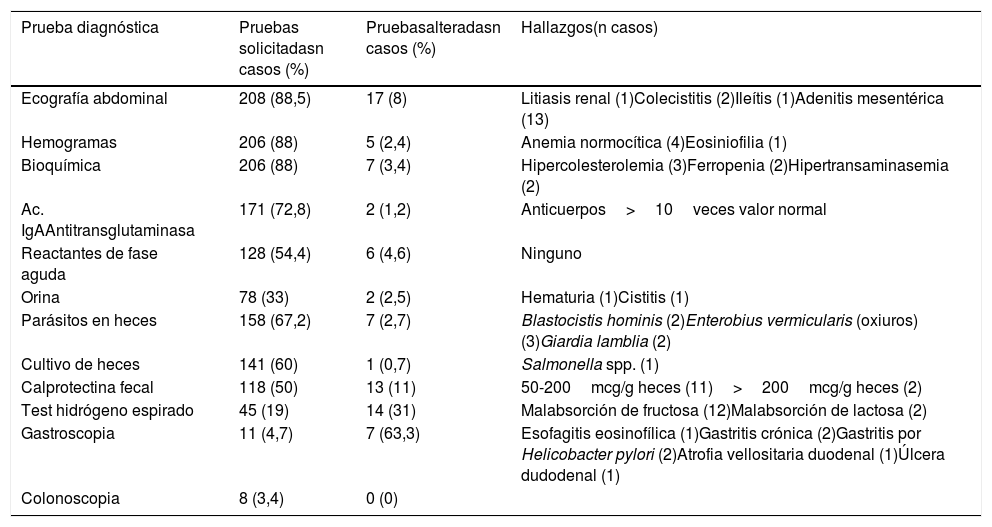
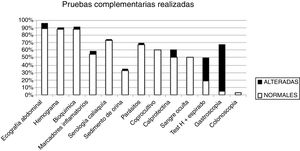
Analizando las PC realizadas observamos que al 88% de los niños se les solicitó análisis de sangre, al 88,5% ecografía abdominal, al 67% algún tipo de estudio en heces, al 33% sistemático de orina y al 8% estudio endoscópico. En la tabla 2 se detallan los resultados. Las PC más solicitadas en el grupo de TO respecto al grupo TDAF fueron los parásitos en heces, la calprotectina fecal, el test de hidrógeno espirado y el estudio endoscópico. En la figura 2 se aprecia la distribución de las PC según su resultado. De totas las PC analizadas solo el test de hidrógeno espirado y la gastroscopia mostraron asociación significativa con la presencia de organicidad, según el análisis de Chi-cuadrado (p=0,009 para el primero y p<0,001 para la gastroscopia).
Relación de pruebas complementarias solicitadas a niños con dolor abdominal crónico según su resultado
| Prueba diagnóstica | Pruebas solicitadasn casos (%) | Pruebasalteradasn casos (%) | Hallazgos(n casos) |
|---|---|---|---|
| Ecografía abdominal | 208 (88,5) | 17 (8) | Litiasis renal (1)Colecistitis (2)Ileítis (1)Adenitis mesentérica (13) |
| Hemogramas | 206 (88) | 5 (2,4) | Anemia normocítica (4)Eosiniofilia (1) |
| Bioquímica | 206 (88) | 7 (3,4) | Hipercolesterolemia (3)Ferropenia (2)Hipertransaminasemia (2) |
| Ac. IgAAntitransglutaminasa | 171 (72,8) | 2 (1,2) | Anticuerpos>10veces valor normal |
| Reactantes de fase aguda | 128 (54,4) | 6 (4,6) | Ninguno |
| Orina | 78 (33) | 2 (2,5) | Hematuria (1)Cistitis (1) |
| Parásitos en heces | 158 (67,2) | 7 (2,7) | Blastocistis hominis (2)Enterobius vermicularis (oxiuros)(3)Giardia lamblia (2) |
| Cultivo de heces | 141 (60) | 1 (0,7) | Salmonella spp. (1) |
| Calprotectina fecal | 118 (50) | 13 (11) | 50-200mcg/g heces (11)>200mcg/g heces (2) |
| Test hidrógeno espirado | 45 (19) | 14 (31) | Malabsorción de fructosa (12)Malabsorción de lactosa (2) |
| Gastroscopia | 11 (4,7) | 7 (63,3) | Esofagitis eosinofílica (1)Gastritis crónica (2)Gastritis por Helicobacter pylori (2)Atrofia vellositaria duodenal (1)Úlcera dudodenal (1) |
| Colonoscopia | 8 (3,4) | 0 (0) |
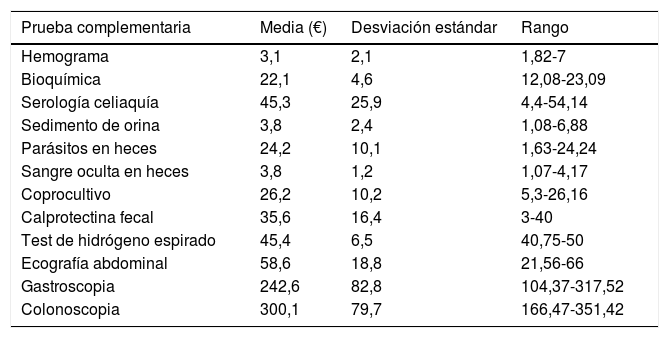
El coste promedio de cada PC se expone en la tabla 3, apreciándose una diferencia de coste en una misma prueba de hasta 200euros entre los diferentes centros del estudio, dependiendo de la comunidad autónoma. El gasto económico total, definido únicamente por la realización de las PC a todos los pacientes de la muestra, fue de 52.490,8euros; el 64,5% (33.840euros) se empleó en los TDAF y el resto (18.651euros) en los estudios de los pacientes con TO. El gasto económico derivado por cada paciente con DAC fue de 195euros en el caso de los pacientes diagnosticados de TDAF, frente a 306euros por cada paciente en el que se halló organicidad. No se ha incluido el coste secundario de los recursos humanos y de tiempo.
Coste promedio (euros) de las pruebas complementarias en todos los centros
| Prueba complementaria | Media (€) | Desviación estándar | Rango |
|---|---|---|---|
| Hemograma | 3,1 | 2,1 | 1,82-7 |
| Bioquímica | 22,1 | 4,6 | 12,08-23,09 |
| Serología celiaquía | 45,3 | 25,9 | 4,4-54,14 |
| Sedimento de orina | 3,8 | 2,4 | 1,08-6,88 |
| Parásitos en heces | 24,2 | 10,1 | 1,63-24,24 |
| Sangre oculta en heces | 3,8 | 1,2 | 1,07-4,17 |
| Coprocultivo | 26,2 | 10,2 | 5,3-26,16 |
| Calprotectina fecal | 35,6 | 16,4 | 3-40 |
| Test de hidrógeno espirado | 45,4 | 6,5 | 40,75-50 |
| Ecografía abdominal | 58,6 | 18,8 | 21,56-66 |
| Gastroscopia | 242,6 | 82,8 | 104,37-317,52 |
| Colonoscopia | 300,1 | 79,7 | 166,47-351,42 |
El DAC en el niño es un problema que condiciona una gran demanda asistencial, tanto en atención primaria como especializada. El presente estudio es de interés, dada la elevada frecuencia del DAC y los TDAF en nuestro medio. Un metaanálisis reciente que incluye 58 estudios con 200.0000 pacientes refiere una prevalencia de TDAF del 13,5% en la población infantil16, ascendiendo esta cifra hasta al 20,7% si únicamente valoramos los menores de 10 años y hasta un 26,6% si analizamos el rango de 10 a 18 años, según la serie europea publicada en 201817.
La falta de marcadores que definan los TDAF es una de las razones que justifica la necesidad de basar el diagnóstico en los síntomas. Esto conlleva en muchas ocasiones la realización de numerosas PC para llegar al diagnóstico mediante exclusión2,4,7,10.
En nuestra serie observamos un porcentaje de DAC secundario a TO del 21%, superior a las cifras descritas en la literatura, que se encuentran entre el 10-16%1,2,15,18. Probablemente esta cifra esté sobreestimada debido a que se trata de niños que ya han sido derivados a atención especializada, bien por la intensidad de los síntomas bien por la presencia de signos de alarma. El DAC en los trastornos funcionales se resuelve en la mayoría de los niños, aunque persiste hasta en 30% tras 5 años de seguimiento, siendo los factores predictivos más influyentes los familiares, como la presencia de enfermedad digestiva en alguno de los padres (en nuestra cohorte hasta una cuarta parte de los pacientes los presentaban, lo cual refleja su alta prevalencia) y la relación de factores genéticos o ambientales3,8,19. Además, la presencia de antecedentes familiares (sobre todo de gastritis por Helicobacter pylori) puede condicionar enfermedad por posible contagio. La preocupación de los padres por la persistencia de los síntomas puede ser otro factor que justifique la demanda asistencial1,14, de ahí la importancia de establecer una relación de confianza médico-paciente-familia, así como ofrecer métodos sencillos de apoyo psicológico y de modificaciones de la conducta para el mejor manejo de los TDAF.
Con respecto a la presencia de signos y síntomas de alarma en niños con DAC es muy frecuente, llegando en algunas series hasta un 80%. Su alta frecuencia, junto al escaso valor discriminativo de organicidad, ha sido discutido por expertos1,2,4, no encontrando niveles de evidencia que los respalden. La ausencia de signos y síntomas de alarma tiene una alta especificidad para el diagnóstico de TDAF, pero una baja sensibilidad1,18,21. De la misma manera, en nuestra muestra los síntomas y signos de alarma no predijeron la presencia de organicidad, salvo la presencia de clínica miccional que sí resultó significativa.
Centrándonos en las PC, el hemograma y los reactantes de fase aguda son parámetros muy inespecíficos, y en nuestra muestra no han demostrado ser útiles como estudio de primer nivel para despistaje de organicidad, al igual que lo publicado por otros autores8,10,18. En cuanto al cribado de celiaquía, al igual que refiere la literatura, no es eficaz solicitarlo en el estudio de primer nivel del DAC salvo si existe diarrea1,18,21,22. Cabe resaltar que en nuestra muestra hemos obtenido 2 casos de serología de celiaquía positivos (2/171), una incidencia similar a la mostrada en el cribado poblacional que se sitúa entre el 1-2%.
Respecto a la solicitud de ecografía abdominal, un tema no clarificado hasta la fecha, en nuestra cohorte encontramos hasta un 8,1% de estudios ecográficos alterados, a diferencia de otras series que detectan menos del 1%. Aunque la comparación es complicada, al tratarse de una técnica observador-dependiente, se sabe que esta cifra asciende a un 10% si se asocian síntomas de alarma como síndrome miccional, dolor de espalda, vómitos, etc.1,23. Son muchos los autores que discuten la pertinencia o la rentabilidad del empleo de la ecografía abdominal. En nuestra opinión consideramos que se trata de una técnica útil. En relación con los estudios de heces, en nuestra cohorte resultaron patológicas un 2,7% del total de muestras de parásitos solicitadas. Las infestaciones producidas por protozoos, como Giardia lamblia y Blastocystis hominis, se consideran por sí solas como causantes de DAC entre otras manifestaciones. La oxiuriasis (Enterobius vermicularis) puede también causar dolor, generalmente asociado a manifestaciones locales. Debido a los cambios sociodemográficos y epidemiológicos de nuestro país están cambiando los tipos de parasitación y aumentando el número de casos24. Dados los resultados planteamos que estas, junto con la ecografía abdominal, pueden formar parte del estudio de primer nivel en el DAC, ya que se trata de pruebas no invasivas y de bajo coste8,23. La calprotectina fecal supone una prueba sencilla que puede tener una gran utilidad en el despistaje de organicidad. Tal y como se ha descrito en la literatura, se trata de un marcador sensible, pero no específico, que permite seleccionar pacientes que pueden requerir estudio endoscópico para descartar enfermedad inflamatoria intestinal, y así evitar su realización en pacientes con TDAF23,25,26. En nuestro estudio solo encontramos 2 determinaciones con cifras superiores a 200mg/g de heces que posteriormente se normalizaron. El Subcomité de DAC de la Academia Americana de Pediatría (2005) recomendaba realizar determinación de sangre oculta en heces a los niños con DAC que carecían de signos o síntomas de alarma con una exploración clínica normal1,8. Esta recomendación ha caído en desuso a lo largo de la evolución de los criterios Roma por el mejor rendimiento de la calprotectina. Nuestros resultados lo respaldan, ya que todas las determinaciones solicitadas de sangre oculta resultaron negativas. Finalmente, la gastroscopia y los test de hidrógeno espirado fueron las pruebas más específicas para detectar organicidad en nuestro estudio, ya que en aquellos casos en que la clínica era sugestiva, con presencia de signos y síntomas de alarma, se realizó el diagnóstico.
Es importante analizar el gasto económico derivado de la atención a niños con DAC, pues supone el 13,7% del total del presupuesto sanitario español per cápita (datos correspondientes a 2015)27. Esto es debido a la elevada prevalencia, la gran demanda asistencial y al gran número de PC realizadas. Es llamativa la variabilidad de coste de las PC dentro del mismo territorio español, dependiendo de la comunidad autónoma, encontrando diferencias de coste de hasta 200euros en una misma prueba. De forma global, las PC solicitadas en los TDAF suponen casi el doble del gasto económico que los TO (33.840 frente a 18.651 euros), debido principalmente a la mayor prevalencia de los primeros. En cambio, tras analizar el gasto económico derivado por cada paciente resultó superior en el grupo de organicidad (306 vs. 195 euros en TDAF). Ello posiblemente sea debido a que el tipo de pruebas solicitadas en el grupo de organicidad, como por ejemplo la endoscopia, tienen un coste muy superior al resto de pruebas. Una de las limitaciones de este estudio es que únicamente se ha establecido el coste de las PC, sin tener en cuenta los recursos personales y de tiempo16. En este sentido, en un estudio realizado en los Países Bajos se evaluó la carga económica derivada del absentismo laboral familiar y los gastos de atención médica excluyendo las PC, estimando un gasto de 2.512euros/año por niño con dolor abdominal funcional o intestino irritable28. En el sistema sanitario público español es complicado determinar estos gastos indirectos, sobre todo en comparación con los estudios americanos, en los que es más factible debido al sistema operativo-económico privado que tienen29. Un estudio en una muestra de 243 niños americanos con DAC estimó un gasto de 6.104,30dólares por paciente y de 744.726dólares en global, cifras muy superiores a las de nuestro estudio10. Según un estudio de Lane29, que comparaba el coste derivado del diagnóstico de 89 niños con TDAF, dependiendo si estos habían sido manejados por gastroenterólogos infantiles o por médicos de atención primaria, el gasto en el primer grupo fue entre 5 y 9 veces más que en los centros de salud. Sin embargo, nuestros resultados mostraron que los costes por paciente con enfermedad orgánica fueron únicamente 1,5 veces más elevados que los derivados de los TDAF. Probablemente esto sea debido a la alta frecuencia de los TDAF, que a nivel global son casi 20 veces más frecuentes que los TO. Un reciente estudio del gasto derivado en pacientes con enfermedad funcional estima un gasto de hasta 16 billones de dólares en adultos13,20. Longstreth et al. determinan la inversión sanitaria según la intensidad de los síntomas; si estos son leves, moderados o severos el gasto económico aumenta en un 35%, 52% y un 59% respectivamente30. Habría que plantearse qué debilidades y qué fortalezas tenemos en nuestras respectivas áreas para hacer un manejo más eficiente de los recursos para estos pacientes.
Para concluir, el DAC en la edad pediátrica es un motivo de consulta muy frecuente en atención primaria y especializada. Como se ha observado, los antecedentes familiares de enfermedad funcional son muy frecuentes en los TDAF, probablemente debido a los factores psicosociales y genéticos implicados en su patogenia. Además, los síntomas y signos de alarma están muy presentes en pacientes con DAC, pero estos poseen una baja capacidad discriminativa de organicidad, siendo más importante la ausencia de los mismos. Respecto a las PC, ante los resultados de nuestro estudio consideramos que la ecografía abdominal y el estudio de parásitos podrían ser pruebas útiles de primer nivel por su inocuidad para diferenciar TO de TDAF. La ecografía permite descartar de forma incruenta múltiples entidades orgánicas, aunque sería conveniente corroborar estos resultados en muestras más amplias. La gastroscopia y el test de hidrógeno espirado fueron las pruebas más específicas. El coste de las PC derivadas del diagnóstico de exclusión en los TDAF es elevado, por lo que debemos ser conscientes del importante gasto económico que suponen e intentar solicitarlas de forma dirigida según la sospecha diagnóstica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentación previa en:- XXIII Congreso Nacional de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica. Gijón, 12-14 de mayo de 2016.
- 50th Annual Meeting of the European Society for Paediatric Gastroenterology, Hepatology and Nutrition. Praga, 10-13 mayo de 2017.
- XXV Congreso Nacional de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica. Granada, 17-19 de mayo de 2018.