La enfermedad celíaca es una patología frecuente y cuyo único tratamiento en el momento actual es la dieta sin gluten. El seguimiento de esta dieta no siempre es fácil e implica limitaciones en la calidad de vida del paciente y su familia. La no adherencia se asociaría a complicaciones de distinta gravedad. La falta de control de estos pacientes en consultas en un alto porcentaje de casos plantea la necesidad de mejorar los protocolos de seguimiento y de abordarlos de forma coordinada entre las Unidades de Gastroenterología Pediátrica y los pediatras de Atención Primaria. Con ese objetivo se han consensuado en este documento, basándose en las recomendaciones recientemente publicadas por la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN), un conjunto de recomendaciones adaptadas a nuestro entorno y contando con la participación de las sociedades científicas implicadas, incluyendo a las sociedades de adultos para el abordaje del seguimiento del adolescente y de la transición de cuidados a los profesionales de adultos.
Coeliac disease is a common condition for which the only current treatment is a gluten-free diet. Adherence to this diet is not always easy and is associated with a reduction in quality of life for the patient and their family. Non-adherence is associated with complications of varying severity. The lack of control at the outpatient care level in a high percentage of these patients evinces the need to improve follow-up protocols and the approach to care delivery with coordination of paediatric gastroenterology units (and primary care paediatricians. With this aim in mind, the present document was developed by consensus to offer a set of recommendations adapted to our region, based on the recent recommendations published by the European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN), and with participation of the pertinent scientific societies, including those concerning the adult population, for the management and followup of adolescents and the transition to adult care.
La enfermedad celíaca (EC) es una enfermedad sistémica de carácter inmunológico desencadenada por el gluten en sujetos genéticamente predispuestos y que cursa con una combinación variable de síntomas clínicos, marcadores serológicos de EC, haplotipo HLA-DQ2 o DQ8 y enteropatía1.
La sospecha y el estudio inicial es realizado principalmente por el pediatra de Atención Primaria (AP), confirmando el diagnóstico el pediatra gastroenterólogo2. El único tratamiento es la dieta sin gluten (DSG)3, consiguiéndose con ello la normalización clínica y la recuperación de la mucosa intestinal. Aunque su cumplimiento limita la calidad de vida del paciente y de su familia, la falta de adherencia a la dieta conlleva un riesgo de complicaciones de distinta gravedad.
Existe evidencia de que un seguimiento inconsistente o nulo se asocia con una mala adherencia a la DSG, por lo que es fundamental un control clínico de calidad a lo largo de la vida del paciente. No se recomienda el autocuidado sin controles médicos y/o asesoramiento4.
A pesar de ello, hasta un 35% de los casos no acude a los controles programados5,6, incluso con protocolos proactivos en Unidades de Gastroenterología Pediátrica (UGP). Se plantea para mejorarlo abordar el seguimiento de forma coordinada con AP.
El objetivo del presente documento es, partiendo de las recomendaciones de seguimiento recientemente publicadas por la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN)4, consensuar un conjunto de recomendaciones adaptado a la realidad y diversidad de nuestro entorno.
Metodología- 1.
Grupo de trabajo y estructura general del documento
El grupo de trabajo se formó con 29 expertos, representantes de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica (SEGHNP), Asociación Española de Pediatría de Atención Primaria (AEPap), Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP), Sociedad Española de Enfermedad Celíaca (SEEC), Asociación Española de Gastroenterología (AEG), Sociedad Española de Patología Digestiva (SEPD), Sociedad Española de Medicina de Familia y Comunitaria (SEMFYC), Sociedad Española de Médicos Generales y de Familia (SEMG) y Sociedad Española de Médicos de Atención Primaria (SEMERGEN). Se contó también con la colaboración de las Asociaciones de pacientes: Federación de Asociaciones de Celíacos de España (FACE), Asociación Celíacos de Cataluña y Asociación de Celíacos y Sensibles al Gluten de Madrid.
Se consensuaron 15 preguntas distribuidas en 3 apartados: seguimiento inmediato tras el diagnóstico (EC activa), seguimiento a largo plazo (EC en remisión) y seguimiento en adolescentes (14-18 años, incluyendo la transición a atención a adultos). Estas preguntas se distribuyeron entre los miembros del grupo de trabajo para su revisión en función de su experiencia y ámbito laboral.
- 2.
Búsqueda bibliográfica
Se tomó como bibliografía de partida la revisión bibliográfica realizada por el grupo de expertos de ESPGHAN hasta marzo de 20204. Se completó con las publicaciones posteriores más relevantes hasta octubre de 2023 sobre «coeliac & follow up» y «coeliac & transition» (Pubmed/Medline) y las de posicionamientos de sociedades científicas relacionadas.
- 3.
Elaboración del documento
Las revisiones efectuadas para cada pregunta se concretaron en una serie de fundamentos y recomendaciones que posteriormente fueron discutidas y consensuadas entre todo el grupo. Cada recomendación fue sometida a votación anónima determinándose el grado de conformidad en base a tres supuestos: A: acuerdo; Abs: abstención; D: desacuerdo. Se consideraron como aceptadas aquellas con un acuerdo del 85% de los participantes.
ResultadosTras la revisión ESPGHAN 2022, se identificaron 196 publicaciones relacionadas con el seguimiento de la enfermedad y 59 con la transición de cuidados, seleccionándose 57 y 21 respectivamente e incluyéndose las 40 más relevantes.
Apartado 1. Seguimiento inmediato tras el diagnóstico (EC activa)Pregunta 1. ¿Qué profesionales deberían estar implicados?El manejo inicial tras el diagnóstico debe realizarlo, como profesional con experiencia en el manejo de la EC, el pediatra gastroenterólogo4. Siempre que sea posible, se recomienda el asesoramiento por parte de un dietista-nutricionista.
Pregunta 2. ¿Cómo realizarlo?Frecuencia de las visitasA falta de evidencia, se recomienda una primera visita a los 3-6 meses de instaurar la DSG o antes si la situación clínica lo aconseja. Las siguientes se programarían cada 6-12 meses según la evolución clínica4.
Métodos para el seguimientoValoración clínica:
Las visitas de seguimiento deberían incluir una evaluación de los signos y síntomas presentes al diagnóstico para comprobar su resolución4. La aparición de nuevos síntomas puede estar en relación con enfermedades asociadas a la EC.
Es importante vigilar el estado nutricional y el crecimiento, especialmente si hay retraso de crecimiento al diagnóstico. La recuperación se suele producir en los primeros seis meses tras el inicio de la DSG. Deben descartarse otras causas de talla baja si esta no se recupera al año de una estricta adherencia a la dieta, especialmente en los pacientes prepúberes.
Exploraciones complementarias:
- -
Los anticuerpos antitransglutaminasa IgA (AATG-IgA) son los más indicados para el seguimiento serológico. Su negativización ocurre en la mitad de los casos pediátricos tras un año con DSG4,7 tardando en general más los pacientes con títulos más altos de anticuerpos al diagnóstico y cuando se emplean técnicas de quimioluminiscencia7. Es recomendable comprobar la negativización de anticuerpos a partir del año de DSG, reevaluando los casos con persistencia de la serología positiva más de 2 años.
- -
Al diagnóstico puede haber déficits de micronutrientes como hierro, folato, vitamina B12 y vitamina D, que deberían monitorizarse hasta su normalización, valorando suplementación en caso de anemia o déficit significativo4. Por ello, la valoración de micronutrientes a lo largo de la evolución se realizará en casos seleccionados8,9.
- -
Puede existir una elevación leve de las transaminasas al diagnóstico, en especial en los pacientes de menor edad, resolviéndose la mayor parte tras un año con DSG10,11. Hay que considerar la posibilidad de hepatopatía autoinmune dentro del diagnóstico diferencial de hipertransaminasemia persistente12.
- -
La EC incrementa el riesgo de enfermedad tiroidea autoinmune4. Aunque no hay evidencia sobre la necesidad de monitorizar la función tiroidea durante el seguimiento, parece razonable la determinación seriada de la TSH si se asocian otras enfermedades autoinmunes, especialmente diabetes mellitus 1 (DM1), durante la pubertad (sobre todo en mujeres) y si persiste serología de EC positiva13.
- -
En pacientes pediátricos se ha comprobado una disminución de la densidad mineral ósea (DMO) al diagnóstico14, que mejora con la DSG. No obstante, los estudios en población pediátrica respecto al riesgo de fracturas muestran resultados contradictorios, por lo que no hay evidencia para recomendar de manera rutinaria la evaluación de DMO al diagnóstico o en el seguimiento15. Se valorará realizar densitometría en situaciones de riesgo como sospecha de enfermedad ósea (más de 2-3 fracturas de huesos largos o fractura vertebral en ausencia de enfermedad local o traumatismo de elevada energía), síndrome malabsortivo persistente, EC potencial (ECP) con dieta normal o falta de adherencia a la DSG.
La vigilancia clínica y evolución de los síntomas tienen un papel limitado para valorar la adherencia a la DSG, ya que cada vez hay más casos pauci-sintomáticos. Las entrevistas dietéticas sistematizadas por parte de dietistas-nutricionistas o los cuestionarios dietéticos han demostrado ser más sensibles para detectar transgresiones4. Existen cuestionarios breves y fáciles de realizar16 que pueden ser útiles en la práctica clínica, no validados para el paciente pediátrico, salvo el CDAT para mayores de 12 años17.
Pruebas de laboratorioLa monitorización del título de AATG hasta su normalización es un marcador indirecto de curación mucosa. Su elevación posterior puede indicar transgresiones significativas, mientras que valores negativos no garantizan el cumplimiento de una dieta estricta4.
Papel de los péptidos GIPTras la ingesta de gluten, los péptidos inmunogénicos de gluten (GIP) son detectables de 3 a 24 h (orina) y hasta 7 días (heces), con buena sensibilidad y especificidad. Las determinaciones seriadas mejoran su rentabilidad en monitorizar la adherencia a largo plazo y no solo en la detección de transgresiones puntuales. La interpretación de los resultados todavía no está sistematizada, por lo que se recomienda su uso combinado con los métodos citados previamente4,18–20.
Pregunta 4. Problemas frecuentes y/o específicos en el seguimientoPersistencia de síntomasAunque la desaparición de síntomas suele producirse en el primer año, más de la mitad de los pacientes puede mantener algún síntoma al año a pesar de la DSG21. La causa más frecuente son las transgresiones dietéticas, aunque también existe la posibilidad de patología concomitante como trastornos funcionales gastrointestinales2,22.
Necesidad de realizar biopsiasLa recuperación de la mucosa intestinal y negativización de los AATG se suele producir tras dos años de DSG. Se recomienda realizar biopsia intestinal (BI) si persiste serología positiva más de dos años con buena adherencia a la DSG o si el diagnóstico inicial no se hizo de forma adecuada2,4.
Posibilidad de celíaca refractariaAnte la sospecha de EC refractaria (persistencia de malabsorción con atrofia vellositaria) deberían descartarse ingesta de gluten y otras enteropatías concomitantes, ya que esta entidad es excepcional en pediatría4.
Pregunta 5. ¿Cómo valorar la calidad de vida?La calidad de vida (CV) del niño celíaco puede verse afectada por esta enfermedad crónica que obliga a realizar una dieta de por vida4. Para valorarla correctamente deben utilizarse cuestionarios específicos para niños celíacos. Los dos cuestionarios disponibles (CDDUX y CDPQOL) han sido adaptados transculturalmente al español y validados en nuestro país23.(Anexos 1 y 2). En la práctica clínica se recomienda valorar los resultados de cada pregunta para incidir en aquellas con mala puntuación (caritas tristes en CDDUX y puntuación mayor de 2 o casi nunca en CDPQOL).
Pregunta 6. Seguimiento en situaciones especialesDiagnóstico inciertoSi se ha retirado el gluten antes de la confirmación diagnóstica o tras un diagnóstico inadecuado por no cumplir criterios2, debe realizarse una provocación oral (PO) con gluten para llegar a un diagnóstico de certeza. El estudio genético HLA ayudará a predecir quiénes tienen posibilidad de EC. Si existe riesgo genético, se recomienda el primer control clínico y analítico a los 1-3 meses tras inicio de PO, para minimizar la exposición al gluten, con controles sucesivos cada 3-6 meses hasta el año. La PO se realizará de forma reglada, intentando evitar periodos críticos de desarrollo (menores de 5 años o pubertad), con una ingesta controlada el primer año de 10-15g (1 rebanada de pan=3-5g) y dieta libre después. Si tras 2 años de exposición los AATG se mantienen negativos y el paciente está asintomático, la probabilidad de desarrollar EC es escasa4, aunque debe mantenerse el seguimiento e incluso la posibilidad de realizar BI, por haberse descrito diagnósticos tardíos.
EC y DM1En pacientes con DM1 y EC, la presentación asintomática es la más frecuente y suele ser menor la adherencia a la DSG. No obstante, se recomiendan los mismos controles que en un paciente celíaco sin DM1, incidiendo en el cumplimiento de la DSG24 y en el despistaje de la patología tiroidea4.
Déficit de IgANo hay evidencia para realizar un seguimiento diferente respecto a inmunocompetentes, salvo emplear serología tipo IgG y repetir el estudio de IgA a partir de los 4 años para descartar un déficit transitorio. La evolución de anticuerpos IgG es diferente a los de clase IgA en inmunocompetentes, ya que se negativizan en menos de la mitad de los pacientes a los 2 años del diagnóstico y pueden permanecer positivos o fluctuantes durante años a pesar de la recuperación intestinal25. Se plantea repetir BI si los anticuerpos persisten positivos más de 2-3 años, especialmente si existen dudas con el cumplimiento terapéutico26.
Enfermedad celíaca potencialSe define por la presencia de AATG y HLA compatible, en ausencia de lesión intestinal (Marsh 0-1) con o sin síntomas4. Para un diagnóstico correcto hay que asegurar que la ingesta de gluten, el número de biopsias y orientación sean adecuados27. En ECP asintomática, se valorará con la familia/paciente mantener la dieta con gluten, monitorizando cada 6-12 meses la evolución clínica y analítica, ya que más del 50% no desarrollará la enfermedad 4, con estrecho seguimiento del crecimiento y salud mineral ósea. Se recomienda repetir BI si aparecen síntomas, si aumenta el nivel de anticuerpos o si persisten positivos a los dos años de seguimiento. En ECP sintomática se valorará DSG4,28.
Pregunta 7. ¿Es necesario adaptar el calendario vacunal?Los pacientes celíacos que no realizan de forma estricta la DSG, o que no han negativizado los AATG, presentan una situación de «hipoesplenismo funcional» que los hace susceptibles de infecciones bacterianas por microorganismos capsulados (neumococo y meningococo). Con buen control de la enfermedad su respuesta a las inmunizaciones a largo plazo es similar a la población general, con las mismas recomendaciones de vacunación e incluyendo vacuna antigripal29. (Anexo 3: tabla vacunación).
Respecto al virus de la hepatitis B (VHB), los pacientes con EC presentan una menor respuesta de anticuerpos frente a la vacuna, en posible relación al HLA-DQ230, pero no una mayor incidencia de infección por VHB31, lo que sugiere que la memoria inmunológica se mantiene a través de la inmunidad celular32. Por ello, según el Comité Asesor de Vacunas de la AEP no deben realizarse recomendaciones distintas a las de población general. En caso de necesitar revacunación por ser pacientes de riesgo de infección por VHB se recomienda garantizar una correcta DSG previamente29.
La adecuación de la vacunación la realizará el pediatra de AP.
De todo lo anterior se derivan las recomendaciones expuestas en la tabla 1.
Recomendaciones al inicio del seguimiento (EC activa)
| Pregunta 1. ¿Qué profesionales deberían estar implicados en el seguimiento? |
| - Seguimiento inicial: pediatra gastroenterólogo, con participación de dietista-nutricionista siempre que sea posible |
| Acuerdo: 100% |
| Pregunta 2. ¿Cómo realizarlo? |
| Primera visita: a los 3-6 meses del diagnóstico. Visitas posteriores: cada 6-12 meses |
| Vigilar: estado nutricional (peso, talla, velocidad de crecimiento), desarrollo puberal y evolución de signos y síntomas |
| Determinar AATG, preferiblemente con el mismo método empleado al diagnóstico |
| Monitorizar micronutrientes (hierro, ácido fólico, vitaminas D y B12) y pruebas de función hepática si alterados al diagnóstico. Si existe anemia ferropénica se valorará la suplementación con hierro oral, especialmente en periodos críticos de crecimiento, no siendo necesario si existe ferropenia sin anemia |
| Valorar monitorizar función tiroidea, especialmente si se asocian factores de riesgo: DM1, pubertad en niñas y persistencia de serología positiva |
| Considerar densitometría ósea en situaciones de riesgo: sospecha de enfermedad ósea, mala adherencia a la dieta o enfermedad celíaca potencial siguiendo dieta con gluten |
| Acuerdo: 100% |
| Pregunta 3. ¿Cómo detectar transgresiones en la dieta sin gluten?: |
| - Valorar: síntomas, entrevista dietética, cuestionarios breves de adherencia y pruebas de laboratorio. Considerar la determinación de GIP para detectar transgresiones dietéticas recientes |
| Acuerdo: 100% |
| Pregunta 4. Problemas frecuentes y específicos en el seguimiento |
| - Si persisten síntomas tras DSG: descartar transgresiones dietéticas e investigar otras posibles causas |
| - Considerar biopsia intestinal si persisten AATG positivos más de 2 años con buena adherencia a la DSG o si dudas respecto al diagnóstico inicial |
| Acuerdo: 93%. Abstención: 7% |
| Pregunta 5. Valoración de la calidad de vida |
| Utilizar cuestionarios de CV específicos para niños celíacos (CDDUX o CDPQOL) |
| Acuerdo: 96%. Abstención: 4% |
| Pregunta 6. Seguimiento en situaciones especiales |
| - Considerar prueba de provocación con gluten de forma reglada y bajo control médico si se han aplicado criterios diagnósticos inadecuados |
| - DM1 asociada a EC: realizar controles recomendados en EC, incidiendo en el despistaje de la patología tiroidea autoinmune |
| - Déficit de IgA: realizar control serológico con anticuerpos tipo IgG |
| - ECP asintomática: si dieta normal (con gluten) monitorizar evolución clínica y analítica cada 6-12 meses. Repetir BI si aparición de síntomas compatibles, aumento de AATG y/o persistencia de niveles elevados |
| - ECP sintomática: valorar retirar el gluten de la dieta y seguimiento correspondiente |
| Acuerdo: 100% |
| Pregunta 7. ¿Es necesario adaptar el calendario vacunal? |
| - En pacientes con buena adherencia a la DSG las recomendaciones son las de la población general, incluyendo vacuna antigripal. En los que no realizan de forma estricta la DSG hay que asegurar la vacunación antineumocócica y antimeningocócica correcta. No se recomienda la evaluación rutinaria de la respuesta vacunal al VHB, salvo si existen factores de riesgo de infección por VHB |
| - La adaptación del calendario vacunal será realizada por el pediatra de AP |
| Acuerdo: 89%. Abstención: 7%. Desacuerdo: 4% |
El seguimiento del paciente celíaco, una vez controlado, debe ser multidisciplinar: pediatra gastroenterólogo, pediatra de AP, nutricionista y/o enfermería especializada.
Ante la escasez de datos sobre cuál mejoraría la adherencia a la DSG, la mayoría de las revisiones de expertos concluyen que el seguimiento lo hagan profesionales con experiencia en la enfermedad y recursos para hacerlo4,33,34.
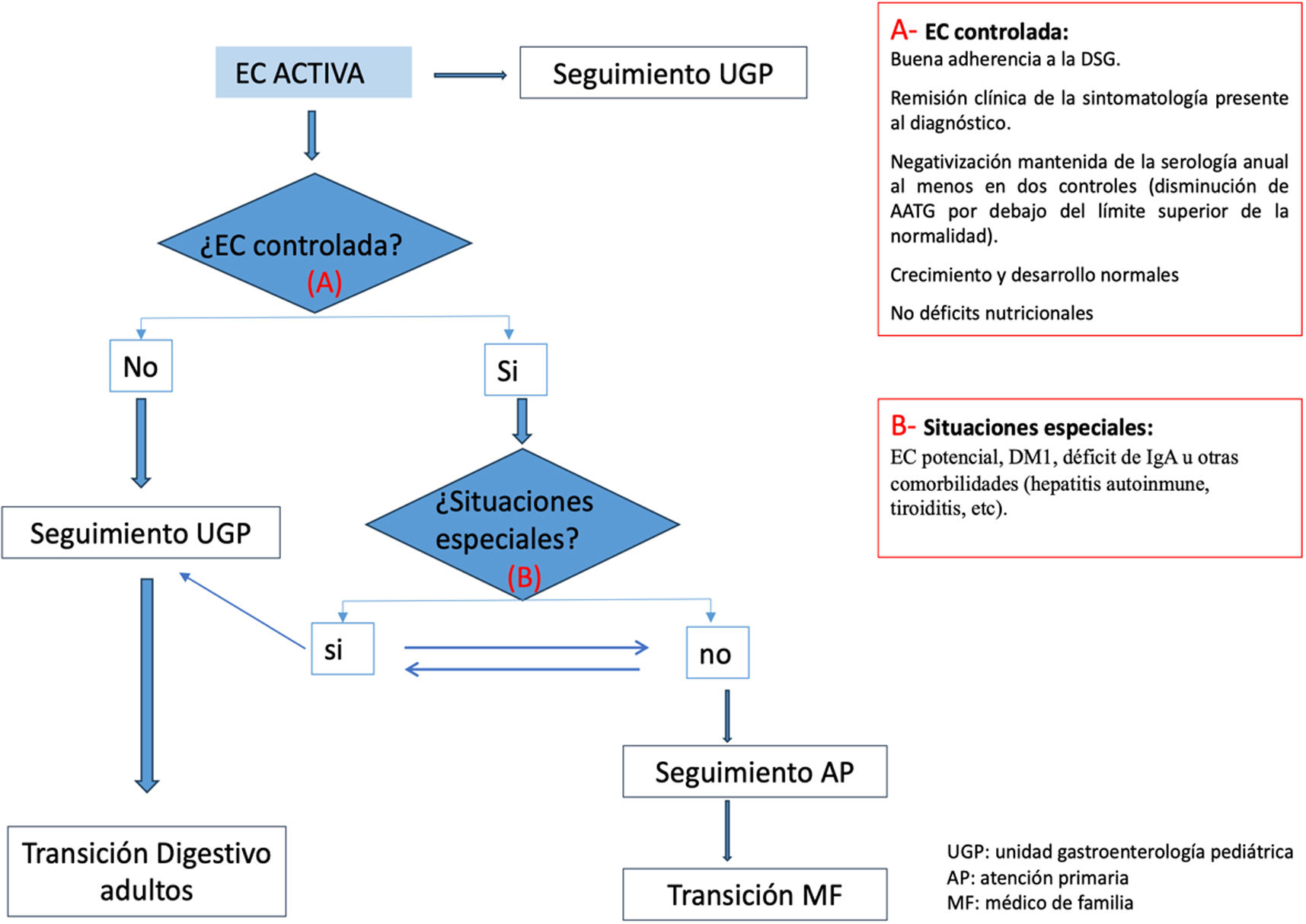
Pregunta 9. ¿Cuándo considerar el seguimiento por AP?Cuando el pediatra gastroenterólogo considere que la enfermedad está bien controlada, siguiendo los siguientes criterios:
- •
Buena adherencia a la DSG.
- •
Remisión clínica de la sintomatología presente al diagnóstico.
- •
Negativización mantenida de la serología anual al menos en dos controles.
- •
Crecimiento y desarrollo normales.
- •
No déficits nutricionales.
Se consideran como criterios para seguimiento en AP los expuestos en la tabla 2.
Criterios de derivación bidireccional Atención Hospitalaria-Atención Primaria
| Derivación a Atención Primaria | Derivación a Atención Hospitalaria |
|---|---|
| - Enfermedad controlada y no incluida en las situaciones consideradas especiales- Informe clínico del pediatra gastroenterólogo en el que conste debut enfermedad, serología y/o endoscopia, despistaje en familiares, adherencia a la dieta, estado vacunal, comorbilidades y situación clínica y serológica actual- Conocimiento por parte del equipo de AP (pediatra, enfermería) de las recomendaciones de seguimiento y de la DSG- Accesibilidad a unidad de gastroenterología pediátrica- Consensuado con el paciente y su familia | - Problemas con la dieta: incumplimiento de causa psicosocial, falta de adherencia a la dieta o dieta nutricionalmente inadecuada, necesidad de asesoramiento por una Unidad de Nutrición y/o dietista- Desarrollo de comorbilidades: DM1, patología tiroidea o hepatitis autoinmune- Reaparición de sintomatología del debut, nuevos síntomas o retraso del crecimiento y/o desarrollo- Positivización de la serología, sin evidencia clara de transgresión dietética |
Existen pacientes con EC y situaciones especiales que, por sus características, precisan un seguimiento por el pediatra gastroenterólogo, aunque la enfermedad se considere estable, como es la ECP5, pacientes con DM1, pacientes con déficit de IgA u otras comorbilidades (hepatitis autoinmune, tiroiditis, etc).
Pregunta 10. ¿Cómo realizarlo?Frecuencia de las visitasA partir del año del inicio de DSG, con enfermedad controlada, el seguimiento puede hacerse cada 1-2 años.
En determinadas situaciones (tabla 2) se valorará derivar a Atención Hospitalaria (AH) y, a su vez, si hay seguimiento en AH se podría considerar derivar a AP si se dan las circunstancias adecuadas (fig. 1).
Métodos para el seguimientoSe contemplarían los comentados para la enfermedad activa, especificados en la tabla 3.
Recomendaciones seguimiento EC en remisión
| Pregunta 8. ¿Qué profesionales deberían estar implicados en el seguimiento? |
| - Seguimiento multidisciplinar: pediatra gastroenterólogo, pediatra de AP, nutricionista y/o enfermería especializada |
| Acuerdo: 94%. Abstención: 6% |
| Pregunta 9. ¿Cuándo considerar seguimiento por AP? |
| - Paciente en remisión clínica, con buen crecimiento y desarrollo, negativización de la serología, buena adherencia a la DSG y ausencia de situaciones especiales* |
| Acuerdo: 100% |
| Pregunta 10. ¿Cómo realizarlo? |
| - Frecuencia cada 1-2 años, salvo datos de mala adherencia a la dieta |
| -Evaluar: signos y síntomas, antropometría y desarrollo puberal, serología específica de EC y control de adherencia a la dieta |
| - Realizar en casos seleccionados estudio de micronutrientes, función hepática y/o tiroidea y DMO |
| - Valorar estudio de calidad de vida |
| - Si seguimiento en AP, considerar remitir a UGP ante: reaparición de los síntomas o nueva sintomatología, problemas con la dieta, aparición de comorbilidades o serología positiva sin evidencia de transgresiones conocidas |
| Acuerdo: 93%. Abstención: 7% |
| Pregunta 11: ¿Cómo abordar el seguimiento desde AP de pacientes que han dejado de asistir a control en gastroenterología pediátrica? |
| - Valorar en estos casos datos de riesgo que harían necesario seguimiento hospitalario o si los controles se pueden realizar en AP |
| Acuerdo: 89%. Abstención: 7%. Desacuerdo:4% |
En pacientes que por distintos motivos no han acudido a la cita de UGP, valorar si es necesario seguimiento hospitalario según lo planteado previamente o si esos controles se pueden realizar en AP. La actitud será variable en función del grado de conocimientos y recursos del equipo de AP, pudiendo optarse por derivar nuevamente al paciente a UGP. Los esfuerzos deben dirigirse a situaciones especiales que requieran seguimiento experto en UGP o a pacientes con falta de asistencia reiterada a consultas, en los que puede ser conveniente informar de la situación a servicios sociales.
De todo lo anterior se derivan las recomendaciones expuestas en la tabla 3.
Apartado 3. Seguimiento en adolescentes (14-18 años)Pregunta 12. ¿Quién debería realizarlo?En la adolescencia el individuo explora su identidad y busca una mayor independencia. El hecho de que la EC sea una enfermedad crónica controlada solo con dieta, que no precisa medicación y en la que frecuentemente no hay síntomas con las transgresiones, hace difícil el correcto seguimiento de la enfermedad en este periodo. A esto se une el cambio en los profesionales sanitarios que controlan dicho seguimiento.
En la mayoría de las Comunidades Autónomas en AP la atención médica pasa a los 14 años a médicos de familia. A nivel hospitalario el paso a atención de adultos se suele hacer más tardíamente (16-18 años). Por ello el seguimiento sería multidisciplinar (apartado 2), pero incluyendo también a los médicos de familia y a los gastroenterólogos de adultos4,33–35.
Pregunta 13. ¿Cómo realizarlo?Se utilizarán las mismas recomendaciones que en apartados anteriores.
Pregunta 14. ¿Cómo realizar la transición a atención de adultos?El proceso de transición tiene como objetivo conseguir que los cuidados de la enfermedad pasen de estar centrados en la familia a depender de forma progresiva del paciente.
Menos de una tercera parte de los adolescentes celíacos mantienen el seguimiento en los Servicios de Aparato Digestivo de adultos36,37, aunque gran parte pueden ser controlados exclusivamente en AP37. Por otra parte, al menos un tercio de los pediatras gastroenterólogos europeos carecen de estrategias de transición en su institución38, lo que evidencia que la transición en la EC debe ser mejorada.
Edad a la que se debería realizarSegún los expertos, el pediatra debería comenzar a hablar de la transición a los 12-13 años, desarrollar el plan de transición a los 14-15 años y efectuarlo a los 18, aunque no parece que la edad influya en la adherencia posterior a la DSG36. Este plan puede estar sujeto a variaciones en función de la organización sanitaria de cada zona, el nivel de actividad de la enfermedad, el grado de adherencia a la dieta y la autonomía del paciente. Se recomienda que los niños con retraso puberal no realicen la transición hasta que este se haya completado. En nuestro medio, probablemente la transición se efectuará de forma más precoz si el paciente realiza el seguimiento en pediatría de AP que si lo realiza en la UGP.
Factores que podrían influir en el procesoSe consideran factores de buen pronóstico mantener una buena adherencia a la DSG a largo plazo, el diagnóstico antes de los 12 años, un seguimiento regular, la resolución de los síntomas y la serología negativa antes de los 18 años. La peor adherencia a la dieta se ha asociado a la falta de seguimiento, a padecer DM1 y a dificultades económicas relacionadas con la DSG. La orientación actual es efectuar la transición y el seguimiento en la vida adulta de forma más personalizada, considerando los factores previamente mencionados39.
Aunque el uso de las nuevas tecnologías, e-medicina y telemedicina, en el seguimiento es infrecuente en el momento actual, los pediatras las consideran una buena alternativa a las consultas presenciales en pacientes con EC en remisión37,40.
Pregunta 15. ¿En qué ámbito debe realizarse la transición?Los pacientes en seguimiento en la consulta de pediatría de AP realizarán la transición al médico de familia. Los adolescentes que han precisado seguimiento en una UGP se derivarían a una consulta de Digestivo de adultos. Todos los profesionales implicados deberían tener en cuenta las sugerencias que se indican en la tabla 4 para conseguir una adecuada transición.
Pautas orientativas para la transición del adolescente celíaco a la atención en consulta de adultos
| 1. El pediatra de atención primaria o el pediatra gastroenterólogo debería: |
| - Asegurar que el diagnóstico de la enfermedad se ha efectuado correctamente |
| - Asegurar que el paciente conoce la enfermedad, sabe realizar una correcta DSG y las posibles complicaciones si no se efectúa el tratamiento (enfermedad ósea, infertilidad, riesgo de cáncer etc.) |
| - Preparar al paciente para el proceso de transición, que no debería efectuarse de forma abrupta |
| - Efectuar una derivación formal con cita a la consulta de adultos, bien sea al médico de familia o al de digestivo de adultos, efectuando previamente una analítica de control |
| - Realizar un informe que contenga todos los datos necesarios para que el médico de adultos conozca la trayectoria del paciente previamente a la transición y su situación clínica actual |
| 2.- Los pediatras de AP, pediatras gastroenterólogos, los médicos de familia y gastroenterólogos de adultos deberían: |
| - Facilitar la realización de consultas de transición: consultas conjuntas con el paciente y su familia o reuniones de los profesionales implicados para la presentación del paciente |
| 3. El médico de familia y el gastroenterólogo de adultos deberían: |
| - Considerar la EC como una enfermedad de similar entidad a otras enfermedades crónicas graves, dando una atención adecuada al cumplimento de la dieta y a la valoración de las complicaciones |
| - Crear una buena relación con el paciente para prevenir que el adolescente se sienta juzgado si revela posibles transgresiones de la dieta |
| -Facilitar la discusión de problemas no relacionados con la EC (sexualidad, fertilidad, anticoncepción, alcohol, drogas y aspectos psicológicos) |
Es especialmente importante que, bien el pediatra de AP o el pediatra gastroenterólogo, hagan un informe clínico donde se describan las características del paciente desde el diagnóstico hasta el momento de la transición (tabla 5), para que el médico de adultos que recibe al paciente conozca de forma rápida y clara toda su evolución.
Datos que debe incluir el informe de transición
| 1. Características demográficas del paciente |
| 2. Fecha y edad del diagnóstico |
| 3. Síntomas clínicos al diagnóstico/estudio en grupo de riesgo |
| 4. Nivel de IgA y serología al diagnóstico |
| 5. Resultados de la biopsia intestinal (si efectuada) |
| 6. Estudio genético (si realizado) |
| 7. Estudio DMO (si realizado) |
| 8. Enfermedades asociadas o comorbilidades (si existen) |
| 9. Fecha del inicio de la dieta sin gluten |
| 10. Adherencia a la dieta sin gluten |
| 11. Evolución del desarrollo, peso y talla |
| 11. Datos de la serología a lo largo del seguimiento |
| 11. Datos de la biopsia intestinal en el seguimiento (si se ha efectuado) |
| 14. Síntomas en el momento de la transición |
| 15. Serología en el momento de la transición |
| 16. Estudio familiar (si realizado) |
De todo lo anterior se derivan las recomendaciones expuestas en la tabla 6.
Recomendaciones de seguimiento en adolescentes (14-18 años)
| Pregunta 12. ¿Quién debería realizarlo? |
| -Seguimiento multidisciplinar: pediatra gastroenterólogo, pediatra de AP, médico de familia, gastroenterólogo de adultos, nutricionista y/o enfermería especializada |
| Acuerdo: 96%. Abstención: 4% |
| Pregunta 13. ¿Cómo realizarlo? |
| - Según lo recomendado en la enfermedad en remisión (tabla 2) |
| Acuerdo: 100% |
| Pregunta 14. ¿Cómo realizar la transición a adultos? |
| - Valorar comenzar la preparación de la transición a los 12-13 años y hacerla efectiva a los 15-18 años, según ámbito previo de seguimiento y circunstancias de cada caso |
| - Realizarla de forma personalizada, considerando los factores que dificultarían una buena transición* |
| - Valorar como posible alternativa el uso de nuevas tecnologías para adolescentes y jóvenes adultos con EC estable |
| Acuerdo: 89%. Abstención: 11% |
| Pregunta 15. ¿En qué ámbito debe realizarse la transición? |
| -Los pacientes en seguimiento por el pediatra de AP realizarían la transición al médico de familia y los que han precisado seguimiento por el pediatra gastroenterólogo pasarían a la consulta de digestivo de adultos |
| Acuerdo: 85%. Abstención: 11%. Desacuerdo: 4% |
Los autores declaran no tener ningún conflicto de intereses.
Miriam Blanco. Servicio de Pediatría, Hospital Universitario Fundación Jiménez Díaz, Madrid, España.
Carmen Miranda. Gastroenterología Pediátrica, Hospital General Universitario Gregorio Marañón, Madrid, España.
Raquel Vecino. Unidad de Gastroenterología y Nutrición Pediátrica, Hospital Clínico San Carlos, Madrid, España.
Javier Eizaguirre. Gastroenterología Pediátrica, Hospital Universitario de Donostia, Donostia, España.
Salvador García Calatayud. Gastroenterología Pediátrica, Hospital Universitario Marqués de Valdecilla, Santander, España.
Mercedes Juste. Gastroenterología Pediátrica, Hospital Vistahermosa HLA, Alicante; España.
Felix Sánchez Valverde. Servicio de Pediatría, Hospital Universitario de Navarra, Navarrabiomed, Pamplona, España.
Antonio Guardiola. Servicio de Aparato Digestivo, Hospital Universitario de Fuenlabrada, Fuenlabrada, Madrid, España.
Xavier Díaz; Consultorio Collbató-El Bruc, Esparraguer, Barcelona, España.
Carmen Ribes. Unidad de Enfermedad Celíaca e Inmunopatología Digestiva, Instituto de Investigación Sanitaria La Fe, Valencia, España (Revisora).
Isabel Polanco. Facultad de Medicina, Universidad Autónoma de Madrid, Hospital Universitario Infantil La Paz, Madrid, España (Revisora).
El resto de los autores de este manuscrito que pertenecen a la Sociedad de Gastroenterología, Hepatología y Nutrición Pediátrica (SEGHNP), Sociedades de Pediatría de Atención Primaria (AEPap y SEPEAP), Sociedad Española de Enfermedad Celíaca (SEEC), Sociedades de Digestivo de Adultos (AEG y SEPD) y Sociedades de Atención Primaria de adultos (SEMFYC, SEMG y SEMERGEN) se presentan en el Anexo 1.