Concepto
El tromboembolismo pulmonar (TEP) es la obstrucción parcial o total del lecho vascular de la arteria pulmonar con repercusiones derivadas del grado de obstrucción anatómica y de la liberación de sustancias vasoactivas.
Aunque en adultos el TEP es una de las principales causas de muerte1-4, se desconoce la incidencia de TEP en niños ya que rara vez pensamos en su diagnóstico y muchos casos sólo son diagnosticados al realizar la necropsia5. Estudios retrospectivos de necropsias infantiles calculan una incidencia de embolia pulmonar en el 3,7 % de los niños fallecidos, contribuyendo la embolia pulmonar a la muerte del paciente en el 31 % de los casos6. En los casos de TEP masivo o submasivo (obstrucción vascular mayor al 50 %, que suelen cursar con síncope, shock o parada cardíaca) un diagnóstico y tratamiento precoz podrían evitar el 30 % de los fallecimientos. Las formas no letales de TEP probablemente sean mucho más frecuentes en niños con factores de riesgo (sobre todo hospitalizados en Unidades de Cuidados Intensivos y Servicios de Traumatología) que no son diagnosticados por cursar signos y síntomas anodinos, con frecuencia autolimitados o que son atribuidos a la enfermedad de base7.
Fisiopatología
En el TEP los principales órganos afectados son el pulmón y el corazón.
Repercusión pulmonar del TEP
La disminución o ausencia de la perfusión pulmonar produce aumento del espacio muerto alveolar, broncoconstricción refleja y atelectasias. La hipoventilación alveolar producida, la existencia de zonas de infarto pulmonar y alteraciones en el surfactante pulmonar producen hipoxemia y retención de anhídrido carbónico (CO2).
No obstante, la principal causa de hipoxemia en el TEP está producida por la existencia de zonas pulmonares que tienen mala perfusión y buena ventilación (desigualdad ventilación/perfusión) lo cual produce aumento del gradiente de tensión alveoloarterial de oxígeno [P(A-a)O2], cortocircuito intrapulmonar de sangre venosa mixta, hipoventilación alveolar y disminución en la eliminación de CO2. En pacientes sin enfermedad cardiopulmonar previa, se observa una relación inversa entre el porcentaje de obstrucción de los vasos pulmonares y la presión parcial arterial de anhídrido carbónico (PaO2) medida, manteniendo inicialmente una alcalosis respiratoria como consecuencia de la hiperventilación compensadora. Cuando la tromboembolia es tan grave que produce hipercapnia, la hipertensión pulmonar suele ocasionar insuficiencia ventricular derecha aguda que con frecuencia evoluciona al fallecimiento del paciente.
Repercusión cardíaca del TEP
En pacientes sin enfermedad cardiopulmonar previa existe relación entre el grado de obstrucción de la arteria pulmonar y la gravedad del TEP8,9. La reducción del lecho arterial pulmonar en aproximadamente el 40-50 % produce elevación significativa de la presión en la arteria pulmonar, aumenta la poscarga del ventrículo derecho y los volúmenes telesistólicos y telediastólicos.
Sobrepasada la capacidad de adaptación cardíaca, se produce aumento de la presión intraventricular, miocárdica y dilatación del ventrículo derecho, disminución del gradiente de presión arteriovenoso coronario, interferencia mecánica con la función del ventrículo izquierdo (afectando su distensibilidad, llenado y función ventricular) con disminución del gasto cardíaco.
Factores de riesgo
En la edad pediátrica los principales factores de riesgo de embolia pulmonar son: presencia de catéter venoso central, inmovilización, cardiopatía y cirugía mayor (en especial traumatológica) y las alteraciones de la coagulación7,10-18 (tabla 1).
Aunque un prerrequisito previo para el diagnóstico de embolia pulmonar es la sospecha clínica, la falta de evidencia de factores de riesgo no descarta un TEP. Sin embargo, la probabilidad de que éste ocurra aumenta de manera proporcional con el número de factores predisponentes presentes; así, la tromboembolia pulmonar es a veces la causa de una muerte repentina e inesperada en pacientes pediátricos con diversas enfermedades crónicas (tabla 2).
Manifestaciones clínicas
Los síntomas más frecuentes del TEP son disnea y tos de aparición súbita e inexplicados, dolor pleurítico y ansiedad7,12,13,19,20. En ocasiones aparecen esputos hemoptoicos o hemoptisis. En la exploración destacan taquipnea y taquicardia. Cuando el TEP tiene repercusión cardíaca aparece un cuarto tono cardíaco (R4) y refuerzo pulmonar de segundo tono (P2). Si el infarto pulmonar es lo suficientemente grande puede existir matidez, estertores húmedos o roce pleural, manifestándose el TEP por la tríada clásica: dolor torácico pleurítico, hemoptisis e infiltrado pulmonar. Las embolias pulmonares extensas pueden ocasionar síntomas de insuficiencia cardíaca.
Según la forma de presentación del TEP se describen diferentes formas sindrómicas: a) colapso circulatorio (síncope y shock); b) infarto pulmonar/hemorragia pulmonar (atelectasia congestiva); c) insuficiencia cardíaca derecha aguda e insuficiencia respiratoria grave, y d) otros: fiebre, insuficiencia cardíaca refractaria y arritmias.
Diagnóstico
En el diagnóstico del TEP son útiles las siguientes pruebas complementarias (tabla 3):
Gasometría arterial
El análisis de los gases sanguíneos arteriales valora el impacto de la embolia sobre el intercambio pulmonar de oxígeno. Suele existir hipoxemia con hipocapnia y alcalosis respiratoria. Aunque la PaO2 puede ser normal hasta en el 50 % de los casos de TEP, y una PaO2 baja no es un dato patognomónico, su hallazgo en pacientes sin enfermedad cardiovascular previa apoya el diagnóstico de TEP. El gradiente alveoloarterial puede ser muy útil en el diagnóstico y seguimiento de la embolia pulmonar, encontrándose un gradiente P(A-a)O2 aumentado en el 95 % de los pacientes o una PaCO2 baja en el 98 % de los pacientes con embolia pulmonar. La gasometría arterial es necesaria para establecer la indicación de oxigenoterapia, y en sujetos sin antecedentes de patología cardiopulmonar pueden orientar sobre el grado de obstrucción del lecho vascular pulmonar21.
Electrocardiograma
Es de interés, sobre todo para descartar otras entidades que pueden manifestarse con un cuadro clínico semejante al de embolia pulmonar (pericarditis, arritmia cardíaca, infarto agudo de miocardio). En pacientes sin enfermedad pulmonar o cardíaca previa y con sospecha de TEP, un cambio en el electrocardiograma (ECG) actual refuerza el diagnóstico.
Hasta en el 65 % de pacientes con TEP pueden aparecer alteraciones inespecíficas en el ECG (tabla 3): a) cambios inespecíficos en el segmento ST o en la onda T (muy frecuentes); b) taquicardia sinusal, fibrilación auricular con respuesta ventricular rápida y otras arritmias supraventriculares; c) desviación del eje cardíaco a la derecha; d) bloqueo de rama derecha; e) P pulmonar, y f) patrón de McQuinn y White: S1Q3T3 (onda S en la derivación I, onda Q con inversión de la onda T en la derivación III), sobre todo en cuadros de TEP masivo. Sin embargo, un ECG normal no descarta el TEP.
Radiografía de tórax
Lo más frecuente es que la radiografía de tórax sea normal, pero debe realizarse para descartar otras patologías y para la evaluación y clasificación de los defectos de perfusión que se produzcan en la gammagrafía de perfusión.
Son signos radiográficos del TEP los siguientes14: a) signo de Westermark: área de "enfisema" local (hiperclaridad) por una zona avascular o defecto en la perfusión en una zona pulmonar; b) atelectasias basales laminares con elevación del diafragma; c) derrame pleural hasta en el 35 % de los casos, que puede consistir sólo en pinzamiento del seno costofrénico; d) ensanchamiento de la silueta cardíaca o de hilios pulmonares (uni o bilateral); e) si existe infarto pulmonar aparece en la radiografía de tórax infiltrado alveolar localizado en forma piramidal (en cuña), generalmente basal, con el vértice dirigido hacia el hilio y el borde inferior convexo (joraba de Hampton), y f) engrosamiento (signo del nudillo) o afilamiento (cola de ratón) de imágenes vasculares.
Ecocardiografía
En los pacientes sin enfermedad cardiopulmonar previa el grado de obstrucción embólica se relaciona con la presión arterial pulmonar media9. La obstrucción arterial del 25-40 % produce incremento de la presión arterial pulmonar de 20-30 mmHg. A partir de entonces puede producirse dilatación del ventrículo derecho (presión de la arteria pulmonar de 40-45 mmHg, que suele coincidir con una obstrucción vascular del 70-75 % del lecho vascular) insuficiencia tricuspídea aguda, dilatación ventricular derecha con desviación del tabique interventricular hacia la izquierda y reducción de la distensibilidad del ventrículo izquierdo22.
La existencia de sobrecarga o disfunción de ventrículo derecho y la disfunción ventricular izquierda son signos de mal pronóstico del TEP9; su presencia recomienda iniciar tratamiento fibrinolítico y su ausencia tratamiento profiláctico con heparina8,23.
Dímero D
El dímero D superior a 500 mg/l determinado por técnica de enzimoinmunoanálisis (ELISA) aparece en el 98-100 % de los pacientes con TEP, y aunque su especificidad es del 40-50 %, su alto valor predictivo negativo (> 96 %) permite prácticamente excluir el TEP en los centros cuya determinación es fiable, no siendo preciso efectuar exploraciones adicionales en los pacientes con baja probabilidad de TEP (valor predictivo negativo 99,5 %)23-25. Deben existir precauciones en su interpretación en pacientes traumatizados, en los que puede producirse inicialmente elevación del dímero D con descenso gradual a valores normales al tercer día de sufrir el traumatismo26. Su detección mediante test rápido de látex no es tan precisa como mediante ELISA.
Gammagrafía pulmonar de ventilación/perfusión (V/Q)
La gammagrafía V/Q es un método no invasivo, rápido y útil para el diagnóstico de TEP, aunque su normalidad no excluye la presencia de embolia pulmonar.
Los estudios de perfusión utilizan macroagregados de albúmina marcados con tecnecio radiactivo (99mTc) en la inyección intravenosa que se mezclan de forma homogénea en la sangre, llegando al pulmón por la arteria pulmonar y se impactan temporalmente en los lechos capilares durante su primer paso a través de la circulación capilar pulmonar, obteniéndose mediante gammacámara diversas imágenes en diferentes proyecciones, siendo la radiación en cada región pulmonar proporcional a su perfusión. Cuando existe una obstrucción de un vaso pulmonar, no hay progresión distal de las micropartículas, lo que provoca una ausencia de radiactividad en todo el territorio perfundido por el mismo.
En los pacientes con anomalías de la perfusión, debe efectuarse un estudio de imagen de ventilación con gases radiactivos o aerosoles con partículas radioactivas (xenón o kriptón), siendo necesario previamente una buena radiografía de tórax para descartar otras patologías que pueden condicionar el resultado de la gammagrafía de ventilación (falsos positivos).
A pesar de la alta sensibilidad de esta exploración (próxima al 100 %), su baja especificidad ha sido motivo de grandes controversias sobre su aportación a la hora de establecer recomendaciones terapéuticas. El estudio Prospective Investigation of Pulmonary Embolism Diagnosis (PIOPED)27,28 describe los resultados de la gammagrafía V/Q en cinco categorías: alta probabilidad, probabilidad intermedia, probabilidad baja, probabilidad muy baja y exploración normal. Este estudio informó que la gammagrafía V/Q de alta probabilidad tiene un valor predictivo positivo del 88 % en el diagnóstico de TEP (utilizando como patrón oro la angiografía convencional). Los valores predictivos positivos para las gammagrafías de probabilidad intermedia, baja y muy baja fueron del 33, 16 y 9 %, respectivamente. Con esta técnica la seguridad diagnóstica de TEP (probabilidad alta o muy baja) es del 30 %27.
TC helicoidal y RM
La tomografía computarizada (TC) helicoidal y la resonancia magnética (RM) son técnicas de gran importancia en el diagnóstico de TEP22,29-33.
El grado de obstrucción arterial observado mediante TC helicoidal en pacientes con TEP tiene alta correlación con el grado de obstrucción detectado mediante gammagrafía V/Q (r = 0,87) con excelente concordancia interobservadores22. Puede realizarse de urgencia, permite visualizar émbolos en las arterias pulmonares principales, lobulares y con frecuencia ramas segmentarias; dependiendo del grado de sospecha clínica de TEP tiene una sensibilidad diagnóstica global del 75-90 % y una especificidad del 86-98 %32,33.
También existe gran concordancia (Kappa = 0,75) entre la RM pulmonar y la angiografía pulmonar convencional en el diagnóstico de TEP30, con una sensibilidad diagnóstica del 40 % para las formas subsegmentarias, 84 % para el TEP segmentario y 100 % en el TEP lobular31.
Angiografía pulmonar
Es la única prueba que asegura el diagnóstico de TEP mediante la demostración directa del trombo. La angiografía pulmonar es poco utilizada en niños; en centros experimentados sus complicaciones son: mortalidad del 0,3 %, perforación cardíaca (1 %) y lesión subendocárdica (< 0,2 %), aumentando su frecuencia cuando existe hipertensión pulmonar y presión diastólica terminal del ventrículo derecho mayor de 20 mmHg.
Con la incorporación de la TC helicoidal y la RM al estudio del TEP, son escasas la indicación de angiografía pulmonar convencional, quedando ésta limitada a pacientes con alta sospecha de TEP o con alto riesgo de complicaciones hemorrágicas en los que los estudios de imagen son negativos (gammagrafía V/Q, TC helicoidal o RM)32-35.
Otras exploraciones
1. Hemograma con fórmula y recuento leucocitario. Puede existir leucocitosis leve.
2. Bioquímica sanguínea. Pueden detectarse hiperbilirrubinemia con transaminasas normales.
3. La pletismografía, la flebografía isotópica y la ultrasonografía (Doppler) de miembros inferiores son útiles para localizar una posible trombosis venosa profunda.
Diagnóstico diferencial
En función de los síntomas o signos de presentación clínica, habrá que establecer el diagnóstico diferencial con los procesos siguientes:
1. Dolor torácico. Dolor mecánico osteomuscular, dolor coronario, neumotórax, pericarditis, pleuritis, neumonía, disección de aorta, dolor esofágico.
2. Disnea. Obstrucción bronquial, neumonía, neumotórax, atelectasia, etc.
3. Hemoptisis. Proceso otorrinolaringológico, bronquitis aguda, neumonía, tuberculosis, etc.
4. Shock. Sepsis, hipovolemia, neumotórax a tensión, taponamiento pericárdico.
Profilaxis del tromboembolismo pulmonar
Como ya hemos comentado, el TEP aparece con mayor frecuencia en pacientes con factores de riesgo (tabla 1), debiéndose realizar quimioprofilaxis con heparinas de bajo peso molecular a pacientes con catéter venoso central e inmovilizados, sobre todo los afectados de cardiopatía o tras cirugía traumatológica (de especial relevancia las fracturas de extremidad proximal del fémur y cadera).
En la profilaxis de TEP las heparinas de bajo peso molecular se administran cada 24 h por vía subcutánea (tabla 4). En cirugía ortopédica la primera dosis de heparina de bajo peso molecular puede iniciarse 12 h antes de la intervención y mantenerse durante 7-10 días.
El ácido acetilsalicílico, los antiinflamatorios no esteroideos, los corticoides, antagonistas de la vitamina K y dextrano, pueden potenciar el efecto anticoagulante de las heparinas de bajo peso molecular. La sobredosis con heparinas de bajo peso molecular puede revertirse con protamina; 1 mg o 100 U de protamina neutralizan 1 mg de enoxaparina sódica o dalteparina sódica, no obstante sólo neutralizan el 50-60 % de la actividad anti-Xa.
Tratamiento
El 10 % de los pacientes con embolia pulmonar aguda fallecen durante la primera hora, por lo que una adecuada monitorización del paciente facilitará un diagnóstico y tratamiento precoces.
Medidas generales
Ante la sospecha de TEP debe existir monitorización de las constantes hemodinámicas y respiratorias.
1. Administrar oxígeno para mantener una PO2 > 60 mmHg y saturación transcutánea de oxígeno (StcO2) > 92 %. Valorar intubación endotraqueal e ingreso en unidad de cuidados intensivos si con fracción inspiratoria de O2 de 0,5 no se consigue PaO2 > 60 mmHg.
2. Tratamiento sedante-analgésico. El cloruro mórfico es el fármaco de elección. Dado su efecto hipotensor, en los casos de colapso cardiovascular podría ser apropiada la utilización de antiinflamatorios no esteroideos ya que alivian el dolor pleurítico y su administración es por lo general segura a pesar de la anticoagulación concomitante23. El cloruro mórfico se administra: bolo 0,1-0,2 mg/kg (máximo 15 mg) cada 2-4 h (ritmo: 2 mg/min). Mantenimiento: 0,02 mg/kg/h. Pueden administrarse otros opiáceos tipo fentanilo.
3. Estabilización hemodinámica. Reexpansión de volumen con la precaución de que la sobrecarga de volumen aumenta el trabajo ventricular y las demandas de oxígeno, con empeoramiento del flujo sanguíneo miocárdico del ventrículo derecho (que pueden ocasionar descompensación e insuficiencia ventricular derecha).
El fármaco ionotrópico de elección es la dobutamina, ya que además de sus efectos ionotrópicos positivos tiene un efecto vasodilatador pulmonar disminuyendo la presión pulmonar23. La dopamina puede aumentar la presión pulmonar en cuña hasta en un 50 % y aumentar la acumulación de líquido alveolar. Los diuréticos y vasodilatadores sistémicos no están indicados.
Tratamiento específico
1. Tratamiento anticoagulante36-38. Ante la sospecha clínica de TEP debe administrarse heparina sódica de forma precoz (tabla 4). Es preferible mediante bomba de perfusión continua (menor incidencia de hemorragias, menor recurrencia de trombosis, menor dosis total administrada y mejor control de las complicaciones). La heparina se monitoriza ajustando el tiempo de tromboplastina parcial activado 2-2,5 veces el control. El tratamiento con heparina se mantendrá entre 5-10 días, siendo conveniente al menos 72 h antes de suspender la heparina iniciar tratamiento con anticoagulantes orales (dicumarínicos), los cuales se mantendrán durante 3-6 meses y su dosis se reajustará para conseguir un índice normalizado internacional de 2,5 (entre 2 y 3).
Contraindicaciones de la heparinización: a) absolutas: hemorragia activa y accidente cerebrovascular en los últimos 2 meses, y b) relativas: hemopatías con alteraciones de la coagulación, rectocolitis hemorrágica, hepatopatía crónica, hipertensión arterial grave, endocarditis bacteriana o pericarditis, tuberculosis cavitaria activa, intervención neuroquirúrgica u oftalmológica en los 7 días previos o nefropatía grave.
2. Tratamiento fibrinolítico. Es el tratamiento de primera línea en el TEP masivo, en especial indicado en pacientes con inestabilidad hemodinámica (fig. 1).
El fibrinolítico de elección es el activador tisular del plasminógeno recombinado: activador tisular del plasminógeno (rt-PA) (Actylisi®) pudiéndose también utilizar la urocinasa. En la tabla 4 se describen los fibrinolíticos y dosis con mayor frecuencia utilizadas en el TEP39.
Contraindicaciones absolutas del tratamiento antifibrinolítico: alergia previa al agente trombolítico (nula para urocinasa y rt-PA), hemorragia interna activa, accidente cerebrovascular en los últimos 2 meses y otros procesos intracraneales. Son contraindicaciones relativas: operaciones mayores, traumatismo grave reciente, hipertensión arterial grave (presión arterial sistólica o diastólica > p95), pericarditis, alteración de la consciencia, traumatismo craneoencefálico en el último mes, neoplasia intracraneal o malformación arteriovenosa, traumatismo o cirugía en las últimas 2 semanas, recuperación cardiopulmonar durante más de 10 min, fenómenos hemorrágicos oftalmológicos, canalización de venas subclavias o yugular interna, úlcera péptica activa.
3. Implantación de un filtro en sistema venoso. Se debe considerar en caso documentado y tratado de TEP cuando: la anticoagulación está contraindicada, recurre el TEP a pesar de un nivel adecuado de anticoagulación, y en pacientes de alto riesgo (hipertensión pulmonar severa, cor pulmonale crónico, etc.), en los que un nuevo episodio de TEP podría ser fatal.
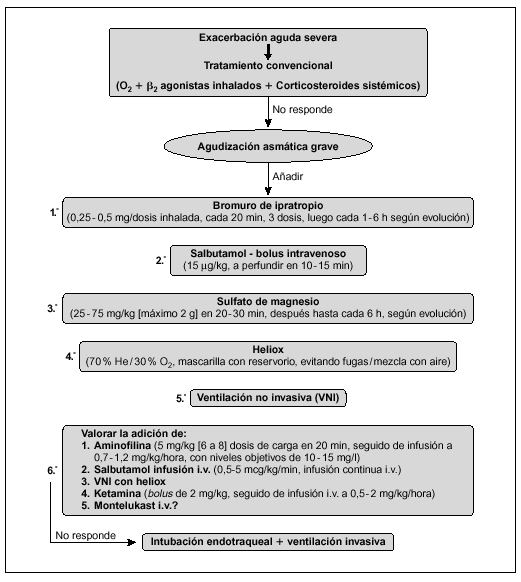
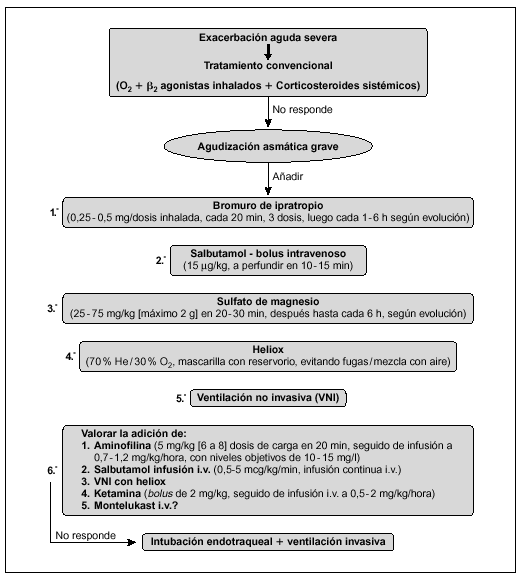
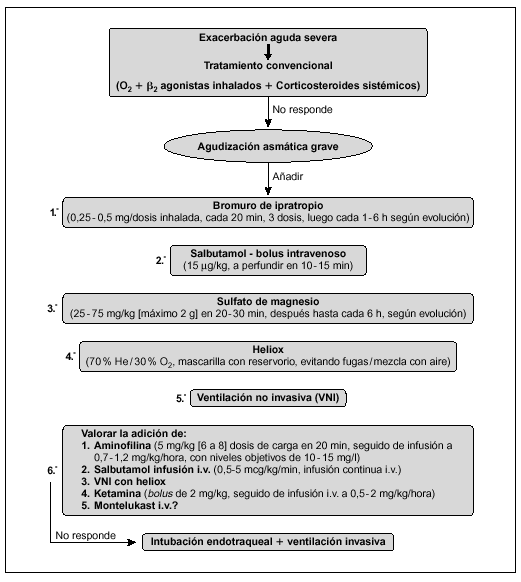
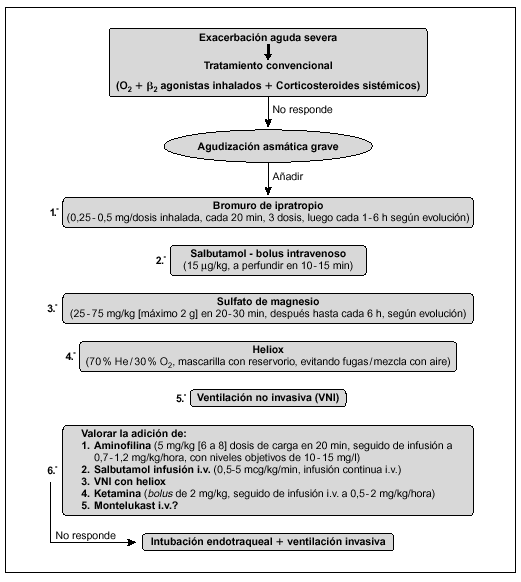
Algoritmo de actuación en el TEP (fig. 1)32-40
Figura 1. Algoritmo de actuación en el TEP. AP: alta probabilidad de TEP; BP: baja probabilidad de TEP; PI: intermedia probabilidad de TEP; *Prueba de imagen dependiente de la disponibilidad de Gammagrafía V/Q y de la experiencia del radiólogo.
Ante la sospecha clínica de TEP se iniciará tratamiento anticoagulante urgente (salvo contraindicaciones). En la mayoría de los pacientes el diagnóstico o exclusión de TEP puede ser realizado con los siguientes exámenes complementarios: radiografía de tórax, dímero D, TC pulmonar helicoidal o RM y ecocardiografía32,33,39,40, dejando la angiografía V/Q para los casos en los que la TC o la RM (en función de la experiencia del radiólogo) no sean concluyentes y exista mediana o alta probabilidad de TEP34,35.
En los casos de alta sospecha de TEP (hipoxia grave no explicable de aparición súbita, elevación del dímero D y factores de riesgo) e inestabilidad hemodinámica (hipotensión y/o shock) se solicitará ecocardiografía urgente. La existencia de hipertensión pulmonar con disfunción de ventrículo derecho y/o bajo gasto cardíaco (signos de mal pronóstico del TEP) se iniciará tratamiento fibrinolítico lo más precoz posible (en ausencia de contraindicaciones)40. En caso que la situación del paciente no sea de extrema gravedad solicitar gammagrafía V/Q, TC helicoidal o RM, siendo indicación de tratamiento fibrinolítico la existencia de oclusión de la arteria pulmonar mayor al 50 % u oclusión de 2 o más arterias lobulares.
En los pacientes con perfusión tisular y presión arterial normales, con evidencia clínica o ecocardiográfica de disfunción de ventrículo derecho (TEP submasivo) puede optarse por fibrinólisis (en ausencia de contraindicaciones) o heparina intravenosa.
En pacientes cuyo TEP no es masivo ni submasivo (TEP sin sobrecarga de ventrículo derecho), no deben administrarse fibrinolíticos sino heparina.
Si hay contraindicaciones para la anticoagulación, complicaciones o recidiva del TEP a pesar del tratamiento fibrinolítico hay que valorar la embolectomía urgente percutánea o mediante cirugía abierta, así como empleo de filtro en el sistema venoso responsable del TEP.
Correspondencia: Dr. A. Bonillo Perales. Cable Inglés, bloque 1, 2.º, 2.ª 04007 Almería. España. Correo electrónico: abonillop@telefonica.net.