La disbiosis intestinal subyacente en los pacientes con enfermedad inflamatoria intestinal (EII) ha dirigido en parte las opciones terapéuticas. El trasplante de microbiota fecal (TMF), que consiste en la infusión de suspensión fecal procedente de un donante sano al tracto intestinal de un paciente receptor con idea de tratar una enfermedad específica asociada a la alteración de la microbiota intestinal, ha mostrado ser eficaz en la infección recurrente Clostridium difficile en adultos y pacientes pediátricos. Esta modalidad terapéutica también podría contribuir significativamente al control de la EII. La ileostomía disociada se ha utilizado como medida quirúrgica de carácter temporal en niños con colitis refractaria para inducir estabilidad clínica, mejorar el estado nutricional y reducir o retirar el tratamiento esteroideo1. Se describe el primer caso pediátrico de TMF a través de ileostomía disociada efectuado en España.
Se trata de un niño de 6 años y 7 meses de edad, cuya madre está afecta de enfermedad de Crohn, diagnosticado a los 2 años de edad de enfermedad inflamatoria no clasificada (EIInC) por episodios recurrentes de diarrea sanguinolenta, anemia e hipoalbuminemia. El despistaje de inmunodeficiencias y de enfermedades inflamatorias monogénicas negativas y la investigación de procesos infecciosos ha sido repetidamente negativa para tuberculosis y CMV a excepción de 3 episodios de diarrea sanguinolenta con resultado positivo para toxina de Clostridium difficile. La afectación fue exclusivamente colónica en las 3 exploraciones endoscópicas realizadas y la histología no reveló datos de interés que permitieran su clasificación. El paciente fracasa a la terapia convencional con mesalazina, esteroides sistémicos, tiopurínicos e infliximab (ambos con monitorización de niveles en rango). Se acuerda con la familia no efectuar colectomía optándose por realizar ileostomía disociada programando antes del cierre de la ileostomía, el TMF a través del estoma inferior. Se obtuvo el consentimiento familiar y la aprobación del Comité de Ética Asistencial del hospital para el procedimiento. Las condiciones exigidas al donante fueron rigurosas para reducir o evitar cualquier evento en el receptor relacionado con el donante (tabla 1).
Condiciones del donante
| Edad>18 años |
| IMC en normopeso |
| Sin antecedentes personales ni familiares de enfermedades autoinmunes |
| Ningún dato de enfermedad transmisible actual |
| Ningún dato de trastorno psiquiátrico |
| No haber tomado antibióticos ni inhibidor de bomba de protones en los últimos 3 meses |
| Registro dietético para comprobar dieta sana |
| Heces negativas para bacterias, parásitos, Clostridium difficile, Rotavirus, Adenovirus |
| Calprotectina fecal<50μg/g de heces |
| Antígeno Helicobacter pylori fecal negativo |
| Negatividad para serología infecciosa a hepatitis A, B, C, VIH, sífilis, CMV |
| Bioquímica general normal (hemograma, creatinina, ionograma, transaminasas, colesterol, triglicéridos, ferritina, albúmina, inmunoglobulinas, PCR y vitamina D3) |
| Ausencia de comportamiento sexual de alto riesgo (múltiples parejas, prostitución) |
| No antecedente de viaje a zonas endémicas con alta prevalencia de enfermedades diarreicas |
CMV: citomegalovirus; IMC: índice de masa corporal; PCR: proteína C reactiva; VIH: virus de la inmunodeficiencia humana.
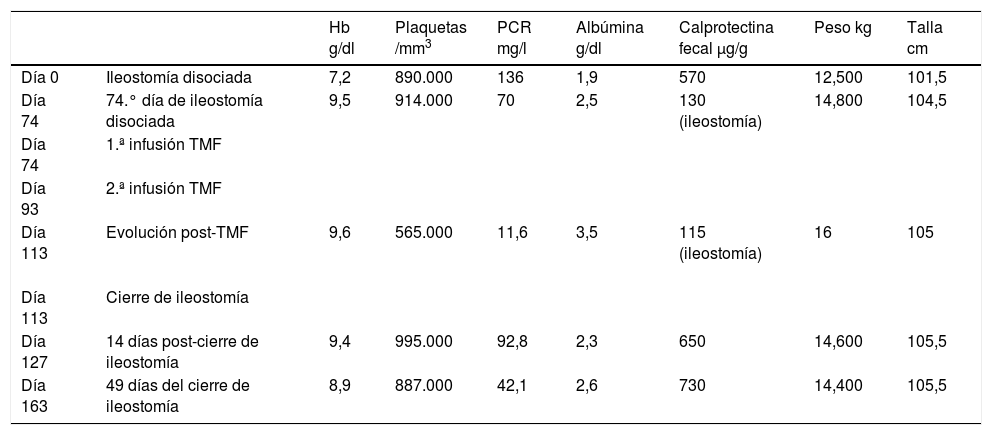
El procedimiento consistió en la preparación de heces frescas del donante emitidas 3h antes, conservadas a temperatura ambiente en contenedor estéril. En el laboratorio se homogeneizó una muestra de 50g de heces frescas con 150ml de suero fisiológico no bacteriostático y tras el filtrado se coleccionó en recipiente estéril. Se administró por sondaje del estoma inferior de la ileostomía 50ml de la suspensión fecal mediante jeringa estéril. El paciente permaneció en decúbito supino durante 2h. Se sometió 20 días después a una segunda infusión de suspensión fecal procedente del mismo donante con igual metodología. El procedimiento fue muy bien tolerado por parte del paciente. La evolución queda recogida en la tabla 2.
Evolución del paciente
| Hb g/dl | Plaquetas /mm3 | PCR mg/l | Albúmina g/dl | Calprotectina fecal μg/g | Peso kg | Talla cm | ||
|---|---|---|---|---|---|---|---|---|
| Día 0 | Ileostomía disociada | 7,2 | 890.000 | 136 | 1,9 | 570 | 12,500 | 101,5 |
| Día 74 | 74.° día de ileostomía disociada | 9,5 | 914.000 | 70 | 2,5 | 130 (ileostomía) | 14,800 | 104,5 |
| Día 74 | 1.ª infusión TMF | |||||||
| Día 93 | 2.ª infusión TMF | |||||||
| Día 113 | Evolución post-TMF | 9,6 | 565.000 | 11,6 | 3,5 | 115 (ileostomía) | 16 | 105 |
| Día 113 | Cierre de ileostomía | |||||||
| Día 127 | 14 días post-cierre de ileostomía | 9,4 | 995.000 | 92,8 | 2,3 | 650 | 14,600 | 105,5 |
| Día 163 | 49 días del cierre de ileostomía | 8,9 | 887.000 | 42,1 | 2,6 | 730 | 14,400 | 105,5 |
PCR: proteína C reactiva; TMF: trasplante de microbiota fecal.
El interés del caso radica por un lado en la realización de ileostomía disociada en un niño afecto de colitis grave refractaria al tratamiento, técnica recientemente publicada por Maxwell et al.1 para este tipo de situación. Realmente se apreció mejoría clínica con significativa recuperación ponderal y moderada disminución en la PCR. Una vez estabilizado el paciente se procedió al TMF con idea de ampliar el beneficio terapéutico. La experiencia del TMF en el campo pediátrico es aún muy limitada y especialmente en situaciones de EII. Por otra parte existen profundas diferencias metodológicas que dificulta la obtención de conclusiones. No tenemos constancia de la administración de suspensión fecal por medio de ileostomía en pacientes pediátricos. Aunque no existe consenso, parece que la vía de infusión por colonoscopia es superior al enema y a la ruta nasogástrica y nasoentérica, no solo por la aceptación por parte del paciente sino por conseguir que el colon entero sea infundido2. Consideramos que en nuestro caso el TMF a través del estoma de la ileostomía reunía las mejores condiciones para depositar la suspensión fecal directamente en íleon terminal garantizando el paso gradual por todo el colon. Tras 2 infusiones la situación clínica mejoró de forma muy satisfactoria, probablemente por adición de efectos beneficiosos (diversión ileal y el TMF). Son escasas las publicaciones pediátricas sobre TMF en niños con colitis por EII con resultados controvertidos. En nuestro caso, a diferencia de las publicaciones pediátricas referidas3–6, la vía de administración fue por infusión directa en íleon distal y no por enema, colonoscopia o por vía nasoduodenal, posiblemente con más garantía para el depósito anterógrado de la infusión a nivel colónico evitando interferencias ocasionadas por el tránsito gastrointestinal. Lamentablemente no podemos describir datos satisfactorios evolutivos en nuestro paciente. Ignoramos el número de infusiones de solución fecal que hubiera necesitado este paciente. Es urgente la ejecución de estudios aleatorizados en niños que ayuden a despejar las numerosas dudas que tenemos en la actualidad.