Los inmunosupresores tiopurínicos han demostrado eficacia en la enfermedad inflamatoria intestinal (EII), siendo los fármacos más utilizados para el mantenimiento de la remisión inducida por nutrición enteral exclusiva o por esteroides en la enfermedad de Crohn (EC) pediátrica. Su uso a largo plazo puede facilitar las infecciones oportunistas por virus como es el caso del virus de Epstein-Barr (VEB). El bloqueo de linfocitos T supresores por tiopurínicos aumenta la citotoxicidad del VEB, provocando una linfoproliferación de células B. En inmunodeprimidos, el VEB puede manifestarse desde una mononucleosis infecciosa hasta una linfohistiocitosis hemofagocítica1.
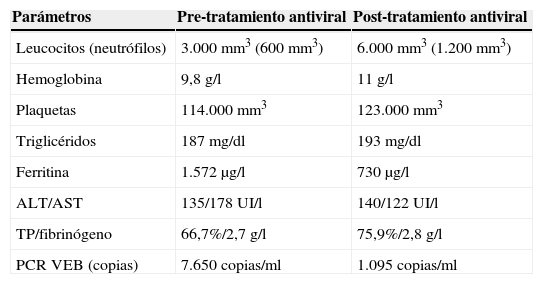
Presentamos el caso de un varón de 14 años con EC, en remisión clínico-analítica tras tratamiento combinado con infliximab (IFX) y azatioprina (AZA) desde el diagnóstico. Con el fin de reducir el riesgo de la doble inmunosupresión, a los 10 meses de su inicio se suspende el tratamiento con IFX, presentando a los 12 meses de monoterapia con AZA fiebre alta, odinofagia, adenopatía submandibular y esplenomegalia. La analítica muestra pancitopenia, elevación de transaminasas, triglicéridos y ferritina (tabla 2). Ante neutropenia febril (500/mm3), inicia antibioterapia empírica endovenosa que se suspende a las 72h por hemocultivo negativo y test de Paul-Bunnell positivo. Se realiza detección de VEB por reacción en cadena de la polimerasa (PCR cuantitativa) detectando 7.650 copias/ml. Ante la sospecha de linfohistiocitosis hemofagocítica incipiente, en relación a primoinfección por VEB (determinación inicial al diagnóstico de EC negativa), se suspende tratamiento con AZA e inicia tratamiento antiviral empírico con ganciclovir. A las 72h se observa mejoría clínica, disminución de la adenopatía, mejoría de la pancitopenia y reducción de las copias virales. Al 5.° día del tratamiento, tras 48h afebril, se suspende el tratamiento con ganciclovir. Tras descartar un síndrome hemofagocítico (ausencia de criterios analíticos completos)2 (tabla 1), es dado de alta tras 7 días de ingreso. De manera ambulatoria, a los 32 días de diagnóstico de la primoinfección por VEB, con carga viral indetectable, se reinicia monoterapia con IFX, manteniéndose en remisión clínico-analítica y sin presentar ninguna complicación derivada de la medicación, actualmente 20 meses después tras la suspensión de AZA.
Criterios diagnósticos de síndrome hemofagocítico
| Adaptados de la Histiocyte Society HLH-2004. |
|---|
| Deben cumplirse 5 de los 8 criterios a continuación: |
| 1. Fiebre ≥ 38.5¿C |
| 2. Eplenomegalia |
| 3. Citopenias (afectando al menos 2 de 3 líneas en sangre periférica) |
| Hemoglobina < 9 g/dL (en lactantes < 4 semanas: hemoglobina < 10 g/dL) |
| Plaquetas < 100 × 103/mL |
| Neutrófilos < 1 × 103/mL |
| 4. Hipertrigliceridemia (ayunas, > 265 mg/dL) y/o hipofibrinogenemia (< 150 mg/dL) |
| 5. Hemofagocitosis en médula ósea, bazo, ganglios linfáticos o hígado |
Parámetros de laboratorio de nuestro paciente
| Parámetros | Pre-tratamiento antiviral | Post-tratamiento antiviral |
|---|---|---|
| Leucocitos (neutrófilos) | 3.000mm3 (600mm3) | 6.000mm3 (1.200mm3) |
| Hemoglobina | 9,8g/l | 11g/l |
| Plaquetas | 114.000mm3 | 123.000mm3 |
| Triglicéridos | 187mg/dl | 193mg/dl |
| Ferritina | 1.572μg/l | 730μg/l |
| ALT/AST | 135/178UI/l | 140/122UI/l |
| TP/fibrinógeno | 66,7%/2,7g/l | 75,9%/2,8g/l |
| PCR VEB (copias) | 7.650copias/ml | 1.095copias/ml |
Es conocido que los niños con EII tienen ciertas características que aumentan el riesgo de infecciones oportunistas (tratamiento inmunosupresor, malnutrición…), lo que puede favorecer las infecciones oportunistas. Existen casos de infección por VEB de evolución fatal en pacientes con EC durante el tratamiento con AZA. Biank et al.3 describen 4 casos de LHH secundaria a primoinfección por VEB en EC. N’Guyen et al.4 reportaron un caso de primoinfección por VEB con desarrollo de mononucleosis infecciosa, LHH y trastorno linfoproliferativo de células B en paciente tratado con AZA por EC. Francolla et al.5 publicaron el primer caso pediátrico de síndrome hemofagocítico secundario a VEB en EC durante tratamiento con IFX y AZA. Si bien no hay evidencia sobre el efecto beneficioso de suspender los inmunosupresores en estos casos, la European Crohn's and Colitis Organization (ECCO), recomienda, ante infección grave por VEB durante terapia con tiopurínicos, asociar a la terapia antiviral la suspensión de tratamientos inmunosupresores, lo que podría, por sí mismo, mejorar espontáneamente el cuadro6. En este consenso, se contempla investigar la situación serológica frente al VEB cuando se considere iniciar terapia inmunomoduladora con tiopurínicos.
En nuestro caso, el diagnóstico y manejo precoz, con terapia antiviral y retirada del tiopurínico permitió probablemente evitar el desarrollo de un síndrome hemofagocítico, que puede llegar a ser fatal.