Introducción
El virus respiratorio sincitial (VRS) es la primera causa de infecciones del tracto respiratorio inferior en niños menores de 2 años de edad 1. Casi todos los niños contraen la infección antes de esa edad y entre el 0,5 y 2 % serán hospitalizados 2. En los grupos considerados de alto riesgo prematuros, niños con enfermedad pulmonar crónica (EPC) o cardiopatía congénita las tasas de hospitalización son mayores, hasta el 20 % en Estados Unidos 3 y el 13 % en España 4.
La infección por VRS en niños de riesgo produce un alto consumo de recursos asistenciales 5. Por ejemplo, la probabilidad de reingreso por afectación respiratoria durante los 2 años siguientes a un ingreso por VRS es hasta ocho veces mayor que en niños no hospitalizados por VRS 6. En España, el 20 % de los prematuros de edad gestacional (EG) 33-35 hospitalizados por VRS, requieren ingreso en la unidad de cuidados intensivos (UCI) 7. Además, la neumonía o bronquiolitis asociada con el VRS en la infancia se considera un factor de riesgo para el desarrollo de sibilancias recurrentes 8,9* que pueden contribuir a disminuir la calidad de vida en épocas posteriores de la vida del niño 10,11.
La prevención de la infección se basa en medidas higiénicas y en la inmunoprofilaxis pasiva, para la cual existen dos productos: la inmunoglobulina intravenosa frente al VRS (ya no se comercializa) y palivizumab, un anticuerpo monoclonal IgG1 humanizado administrado mediante inyección intramuscular. Según su ficha técnica, palivizumab está indicado para la prevención de las enfermedades graves del tracto respiratorio inferior, que requieren hospitalización, producidas por el VRS en niños con alto riesgo de enfermedad por VRS: niños nacidos con EG < 35 semanas y de menos de 6 meses de edad al inicio de la estación VRS; niños menores de 2 años que requieran tratamiento para la displasia broncopulmonar durante los últimos 6 meses, y niños de menos de 2 años con cardiopatía congénita hemodinámicamente significativa 12. En el grupo de EG 32 1-35 0, las recomendaciones de la Sociedad Española de Neonatología (SEN) son más restrictivas, al exigir también la presencia de al menos dos de los siguientes factores de riesgo (FR): edad cronológica inferior a 10 semanas al inicio de la estación, sin lactancia materna o de duración de menos de 2 meses (por indicación médica), al menos un hermano en edad escolar (< 14 años), asistencia a guardería, antecedentes familiares de sibilancias, condiciones de hacinamiento en el hogar (cuatro o más personas adultas) y malformación de la vía aérea o enfermedad neuromuscular 13.
Sobre la eficacia de palivizumab, el estudio IMpact, único ensayo clínico aleatorizado y controlado, señaló una reducción del 78 % en el riesgo relativo de hospitalización por VRS en los prematuros que recibieron palivizumab (1,8 %) frente a los que no tuvieron profilaxis (8,1 %) 14. El metaanálisis de Simoes 15, basado en 5 estudios (2.829 niños con EG de 32-35 semanas), muestra que ingresan el 1,5 % de los niños inmunizados con palivizumab, y el 9,8 % de los niños no inmunizados, una reducción relativa del riesgo del 85 %.
El efecto de la inmunoprofilaxis del VRS sobre la mortalidad no está tan definido. En el estudio de Sampalis, la tasa global de mortalidad tras 2 años de seguimiento en niños con EG de 32-35 semanas, fue del 8,11 % en la cohorte VRS frente a 1,58 % en la cohorte de control, es decir, una mortalidad atribuible la infección por VRS del 6,53 % en 2 años 6. En el estudio IMpact se encontró una tasa de mortalidad del 1 % para placebo y del 0,4 % para palivizumab 14, aunque las diferencias no son estadísticamente significativas, dado que IMpact no fue diseñado para detectar diferencias en mortalidad. En otros estudios se han estimado tasas de mortalidad en niños de alto riesgo ingresados por VRS, con o sin profilaxis, del 1,2 % 16, del 1 % o del 3,5 % (esta última tasa en niños con EPC) 17.
Parece claro que la inmunoprofilaxis con palivizumab es efectiva, pero su elevado precio ha motivado diversos estudios de evaluación económica. La mayoría de esos estudios definen el resultado principal de efectividad como ingresos hospitalarios evitados 16,18,19, aunque algunos citan los episodios de infección evitados 20, días de hospitalización ahorrados 21, costes hospitalarios evitados 22 o años de vida ganados 16. Ninguno de esos estudios tiene en cuenta como medida de la efectividad los años de vida ajustados por calidad (AVAC) ganados, ni han utilizado datos representativos de España. Por otra parte, una revisión sistemática sobre la evaluación económica de la inmunoprofilaxis concluye que existe una amplia variabilidad en los estudios publicados, que oscilan desde ahorros hasta importantes costes incrementales por ingreso evitado, y que estos resultados tan divergentes se pueden explicar por las diferentes metodologías y asunciones utilizadas, y por la pobre calidad de algunos de los análisis económicos. Esta revisión recomienda mejorar la metodología y que los futuros estudios tengan en cuenta los pesos de los niños y las dosis que reciben 23.
En nuestro medio, la SEN publicó en 2005 una actualización de las recomendaciones para la prevención de la infección por VRS en las que se incluía un nuevo grupo de prematuros con EG 32-35, menores de 6 meses al comienzo de la estación, y con dos o más FR. En esta actualización, la recomendación para este grupo de prematuros depende de los recursos económicos disponibles y debe revisarse a medida que se conozcan resultados de estudios farmacoeconómicos 13. Por este motivo, se ha promovido la evaluación de la eficiencia de palivizumab y el desarrollo de un modelo de evaluación económica que permita obtener datos sobre la relación coste-efectividad de la profilaxis en estos niños.
En consecuencia, el propósito del presente estudio es estimar la relación coste-efectividad incremental de palivizumab frente a ninguna profilaxis en una cohorte hipotética de niños con EG 32 1-35 0 y dos o más factores de riesgo en España.
Métodos
Diseño del modelo
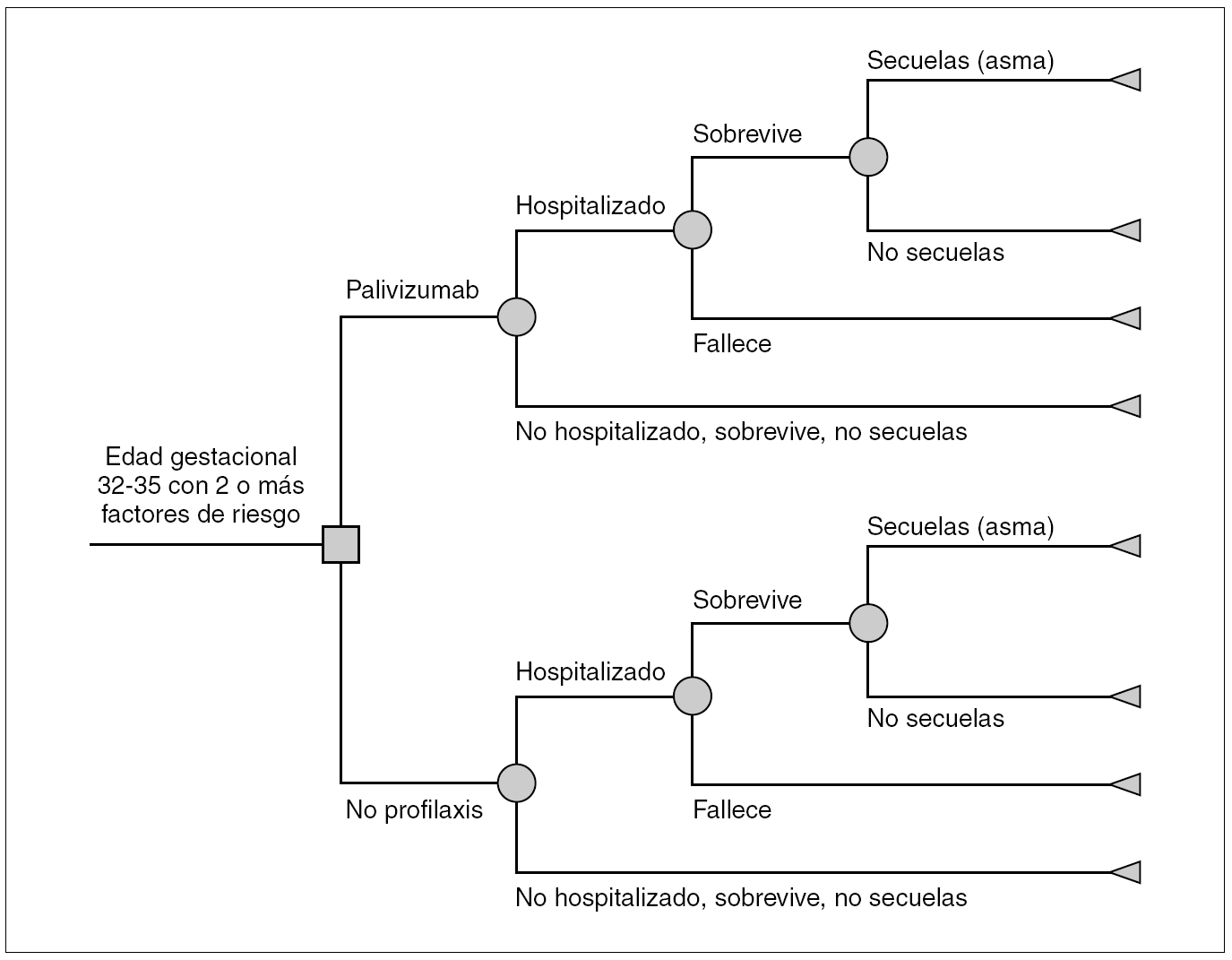
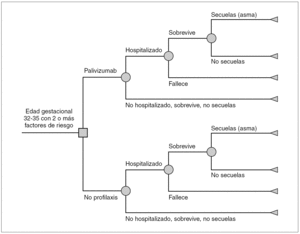
Se diseñó un árbol de decisión que compara los costes y consecuencias de la profilaxis con palivizumab frente a no profilaxis en niños con EG 32 1-35 0 que presentan dos o más de los FR descritos en las recomendaciones de la SEN (fig. 1). El nodo de entrada es un nodo de decisión (cuadrado), representa la decisión de administrar profilaxis con palivizumab o no. Los demás nodos son de azar (círculos) y representan las distintas trayectorias (probabilidades) de que los niños ingresen o no en el hospital, sobrevivan o fallezcan, y si sobreviven tengan o no secuelas. El ámbito del modelo es el de la atención sanitaria en España. El análisis se realiza desde dos perspectivas: la del financiador, el Sistema Nacional de Salud (SNS) que considera sólo los costes directos, y la perspectiva social, que incluye costes directos e indirectos. Como es preferible disponer de resultados clínicos sobre efectividad a largo plazo 24, el horizonte temporal de análisis es un seguimiento de toda la vida. La estimación de la reducción de las infecciones por VRS debida a profilaxis se limita a un solo período estacional de VRS.
Figura 1. Modelo del árbol de decisión para prematuros con edad de gestación de 32-35 semanas: profilaxis con palivizumab frente a no profilaxis.
La medida principal de coste-efectividad es el coste por AVAC ganado. Una medida de coste-efectividad secundaria es el coste por año de vida ganado (AVG). También se calculó el número necesario que tratar (NNT) para evitar un ingreso hospitalario.
Cálculo de la efectividad
Para calcular los AVG, se asume que la esperanza de vida después de sobrevivir un episodio de VRS es la de la población española (al nacer 78,87 años) 25 menos la edad en el momento del episodio, estimada, en promedio, en un año. Los AVG en cada grupo (palivizumab y no profilaxis) son sus años de esperanza de vida multiplicados por la probabilidad de sobrevivir (1-probabilidad de morir). La probabilidad de morir se basa en el estudio de Sampalis 6 (único con potencia estadística suficiente para detectar diferencias significativas en mortalidad). En este estudio, tras un promedio de 2,1 años de seguimiento de 2.415 niños que ingresaron con EG de 32-35 semanas, la mortalidad en la cohorte de VRS fue del 8,11 %, frente al 1,58 % en los niños del grupo control (mortalidad atribuible al VRS: 6,53 %). Como la tasa de mortalidad se refiere a niños ingresados, el modelo asume que toda la mortalidad ocurre en el hospital, y por tanto, la probabilidad de morir esté en función de la probabilidad de ingresar en el hospital. Según esta asunción, la tasa de mortalidad aplicada en el modelo para el caso basal es de 0,53 % (6,53 x 8,1 %*) en el grupo sin profilaxis, y de 0,12 % (6,53 % x 1,8 %*) en el grupo con palivizumab. El modelo también asume que la profilaxis con palivizumab sólo afecta a la probabilidad de ocurrencia y no a la gravedad de la infección por VRS, en un intento conservador de no sobreestimar la reducción de mortalidad con palivizumab.
Para transformar los AVG en AVAC se asumió que la única secuela que disminuye la calidad de vida del niño que sobrevive son las sibilancias recurrentes. La probabilidad de padecer sibilancias recurrentes se obtuvo de una cohorte de niños con y sin infección por VRS seguidos hasta los 13 años de edad 9,26,27. A los niños que padecían sibilancias recurrentes se les asignó la escala de calidad de vida relacionada con la salud del dominio respiratorio del cuestionario TNO AZL Child Quality of Life (TAPQOL), obtenida en niños con sibilancias recurrentes después de una infección por VRS sin EPC, ni cardiopatía, ni inmunodeficiencia.
El NNT para evitar un ingreso hospitalario se calculó como el inverso de la reducción absoluta del riesgo de ingresar con profilaxis y sin profilaxis, a partir de los hallazgos del estudio IMpact en niños prematuros 14 y del metaanálisis de Simoes 15.
Cálculo de los costes directos
Los costes directos son los costes en los que incurre el hospital, de los cuales se han incluido el coste del palivizumab, su coste de administración, y coste del ingreso hospitalario.
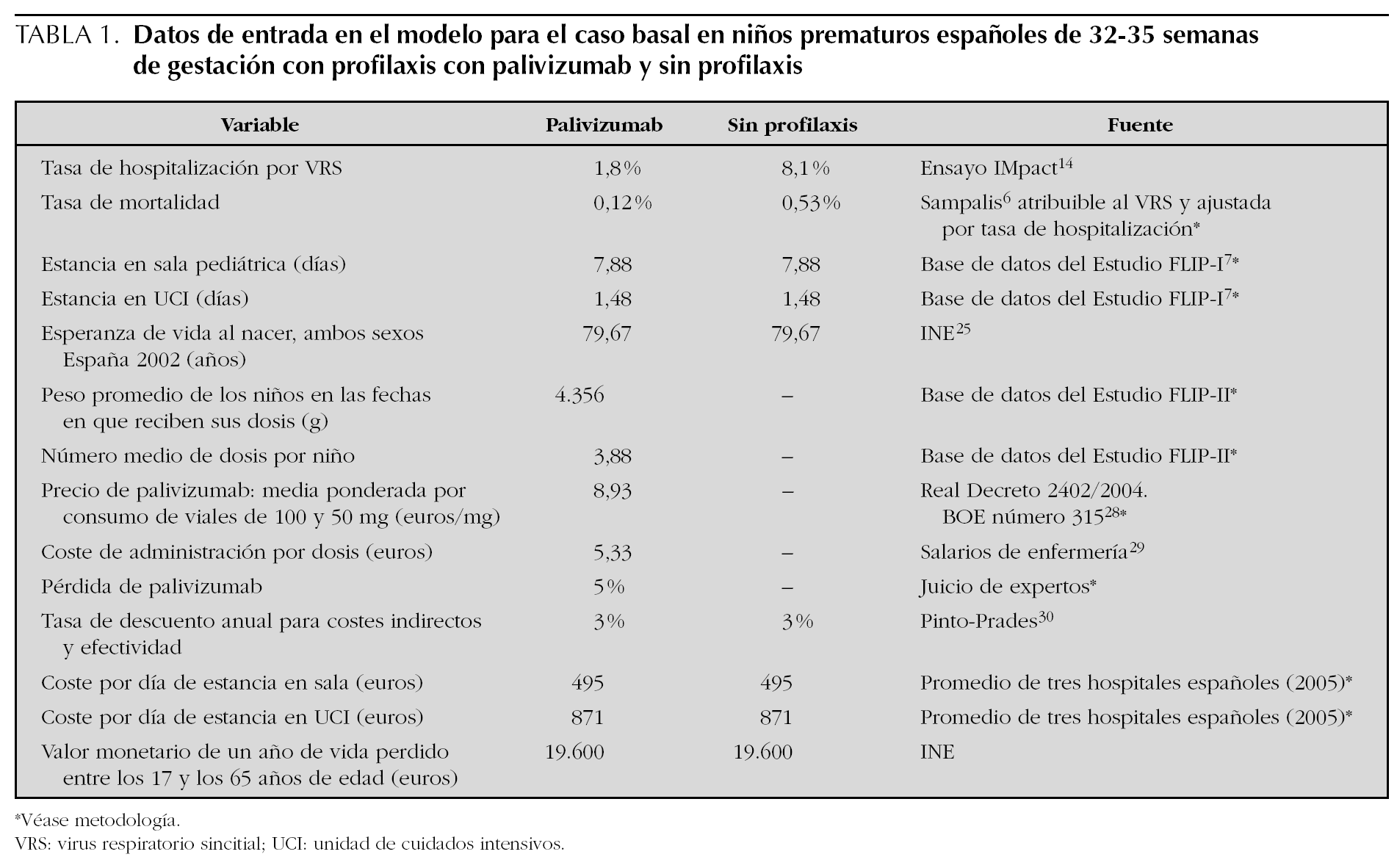
Para calcular el coste de palivizumab, se ha multiplicado el precio de un miligramo del fármaco (8,93 €) por la dosis (15 mg/kg de peso) que se administra a cada niño. El precio de 1 mg de palivizumab se ha calculado como la media ponderada según la proporción de viales de 50 y 100 mg que se usan habitualmente en la profilaxis en los hospitales, estimada en un 5 % de viales de 50 mg y un 95 % de 100 mg, teniendo en cuenta el precio de venta de laboratorio de los viales de 50 y 100 mg (511,66 € y 849,64 €, respectivamente para el año 2006 28) más el 4 % de IVA. Para conocer el peso y el número de dosis de cada niño, se ha utilizado la base de datos del estudio FLIP II (estudio de la SEN, realizado durante la estación VRS 2005/2006, de seguimiento de pacientes con EG 32 1-35 0 y dos o más FR en 37 hospitales españoles con unidad de Neonatología). Esta base de datos contiene 326 niños que recibieron, en promedio 3,88 (intervalo de confianza del 95 % [IC 95 %]: 4,03-3,73) dosis de palivizumab, y con un peso medio en el período de seguimiento de 4,356 kg (IC 95 %: 4,438-4,274). Los hospitales españoles organizan la administración de la dosis citando a varios niños a la vez para que no se desperdicie el fármaco sobrante en los viales. Por tanto, la pérdida de palivizumab en España es despreciable. Sin embargo, se asumió que en el caso basal se pierde un 5 %. El coste de administración de la inyección se estima en 20 min del tiempo de una enfermera (5,33 €), cuyo salario medio, antigüedad, y costes sociales proceden de fuentes oficiales 29. No se consideran costes de efectos adversos, dado que el estudio IMpact no encontró diferencias significativas entre el grupo tratado con palivizumab y el placebo.
Los costes de ingresos hospitalarios fueron calculados como la probabilidad de ingresar de cada niño multiplicada por los días de estancia en planta más los días de ingreso en la UCI, cada una de ellas multiplicadas por su coste. La probabilidad de ingresar aplicada en el caso basal es la del ensayo clínico IMpact en niños prematuros sin EPC: 1,8 % con palivizumab y 8,1 % con placebo (p < 0,001) 14. Los días de estancia aplicados en el modelo, en planta (7,88) y en UCI (1,48), proceden de los datos del estudio FLIP I 7 en ex prematuros de 33-35 semanas ingresados por infección VRS. En este estudio, ingresaron en UCI el 20,5 % de los niños hospitalizados, con una estancia media en la UCI de 7,1 días, siendo la estancia media total de 9,36 días**. Las estancias se aplican a cada niño que ingresa, independientemente de que haya recibido o no profilaxis previa. El coste de un día de estancia en planta (495 €) y en UCI (871 €) fue la media de los costes de 3 hospitales españoles de los autores de este estudio.
Cálculo de los costes indirectos
Para estimar los costes indirectos (pérdidas de productividad laboral del niño cuando llegue a la edad laboral) se asumió que la proporción de los niños que estén activos, inactivos, trabajando y en paro será similar a la actual en España. En consecuencia, el modelo asume que la contribución media de una persona a la riqueza nacional es de 19.600 € (Producto Interior Bruto per cápita en el año 2004) y, por tanto, se asigna ese valor a cada año de vida perdido. Los años de vida laboral perdidos se contabilizan entre la edad de 17 y 65 años.
Descuento
Los costes directos, como ocurren en el primer año, no se han descontado. En el caso basal, los costes indirectos y la efectividad se descuentan a un 3 % anual, que es la tasa actualmente recomendada para España 30.
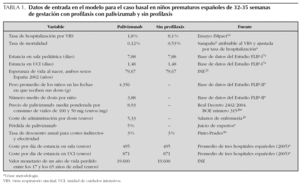
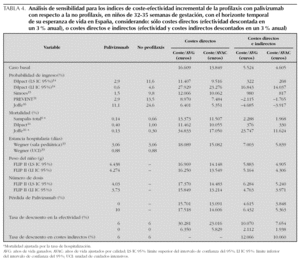
Todas las variables que configuran el escenario basal se muestran en la tabla 1.
Análisis de sensibilidad
Para explorar el efecto de la incertidumbre que subyace en el modelo se realizó un análisis de sensibilidad modificando las variables del caso basal que pueden influir en los costes o en la efectividad: probabilidad de ingreso, mortalidad, estancia hospitalaria (en planta y en UCI), peso del niño, dosis recibidas, proporción de fármaco perdido y diversas tasas de descuento para los costes y la efectividad.
Para la probabilidad de ingreso, se construyeron escenarios utilizando los límites superior e inferior del IC 95 % del estudio IMpact 14, la tasa de ingreso del estudio de Simoes 15, PREVENT 31, IRIS (Infección Respiratoria Infantil por Sincitial) 4,32 y del estudio de Joffe 16. Para tratar la incertidumbre asociada con la mortalidad por VRS, el análisis de sensibilidad se ha realizado utilizando la mortalidad total del estudio de Sampalis 6 y de Joffe 16 (ambas corregidas por la probabilidad de ingreso) y la del IMpact 14. Para la estancia hospitalaria se ha construido otro escenario con las estancias en planta y UCI del estudio de Wegner 33. Para el peso de los niños y las dosis que reciben en la estación VRS, se han utilizado los límites superior e inferior de los IC 95 % de la base de datos del FLIP II. Con la proporción de fármaco perdido se han construido dos escenarios adicionales: asumiendo que no se pierde nada y que se pierde el 10 %. Finalmente, se han construido escenarios adicionales con una tasa de descuento del 0 y del 6 % en la efectividad, y del 6 % en los costes indirectos.
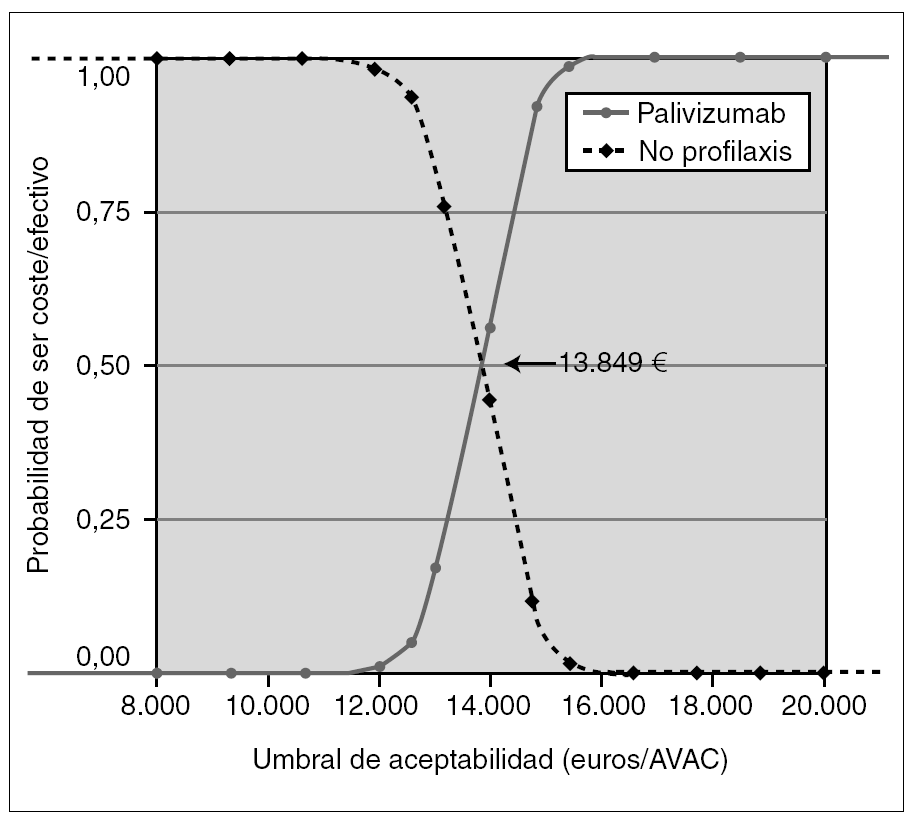
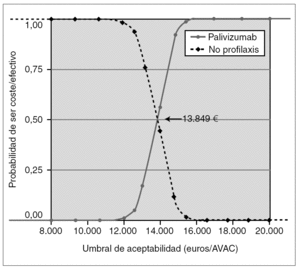
Como análisis de sensibilidad probabilístico, se construyó la curva de aceptabilidad de coste-efectividad (fig. 2), considerando sólo los costes directos (perspectiva del SNS), basada en las asunciones del caso basal y en los IC 95 % de la probabilidad de ingreso del estudio IMpact y con descuento de la efectividad del 3 % anual.
Figura 2.Curva de aceptabilidad. Coste-efectividad incremental de profilaxis con palivizumab frente a no profilaxis, considerando sólo los costes directos, la efectividad según el estudio IMpact, y los costes, dosis, pesos y estancias de niños españoles, con una tasa de descuento en la efectividad del 3 %.
Resultados
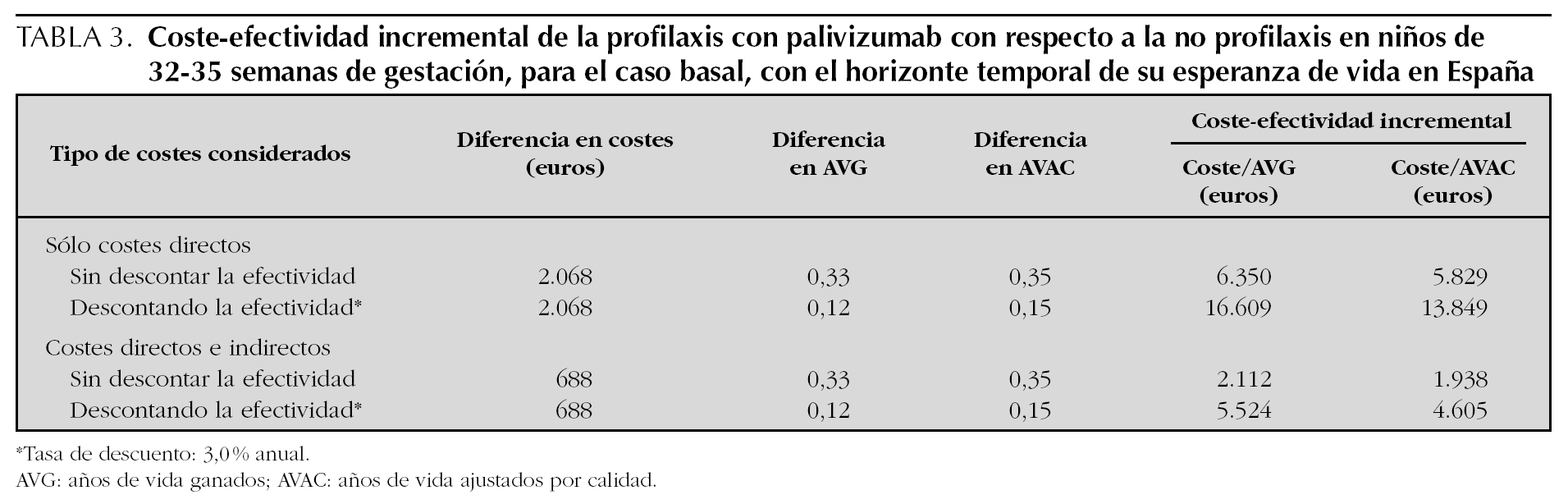
Aplicando los costes españoles a la cohorte hipotética de niños del estudio FLIP II con EG 32 1-35 0, y bajo las asunciones del caso basal, el uso de palivizumab produce un coste sanitario adicional de 2.068 €, que se reduce a 688 € si además se toman en cuenta los costes indirectos (futuras pérdidas de productividad del niño) (tabla 2). Con el uso de palivizumab frente a no profilaxis, se pierden 0,33 años de vida menos, sin descontar la efectividad, y 0,12 años menos después de descontar la efectividad. La inclusión de la calidad de vida produce una ganancia de 0,35 AVAC sin descuento y 0,15 AVAC con descuento de la efectividad.
Basado en la reducción absoluta del riesgo de hospitalización observada en el estudio IMpact 14 (8,1 % con placebo 1,8 % con palivizumab = 6,3 %), habría que tratar a 15,8 niños (NNT = 1/0,063) para evitar una hospitalización por VRS. Si se utilizan los datos del metaanálisis de Simoes 15, el NNT es 12 (1/[0,098-0,015]).
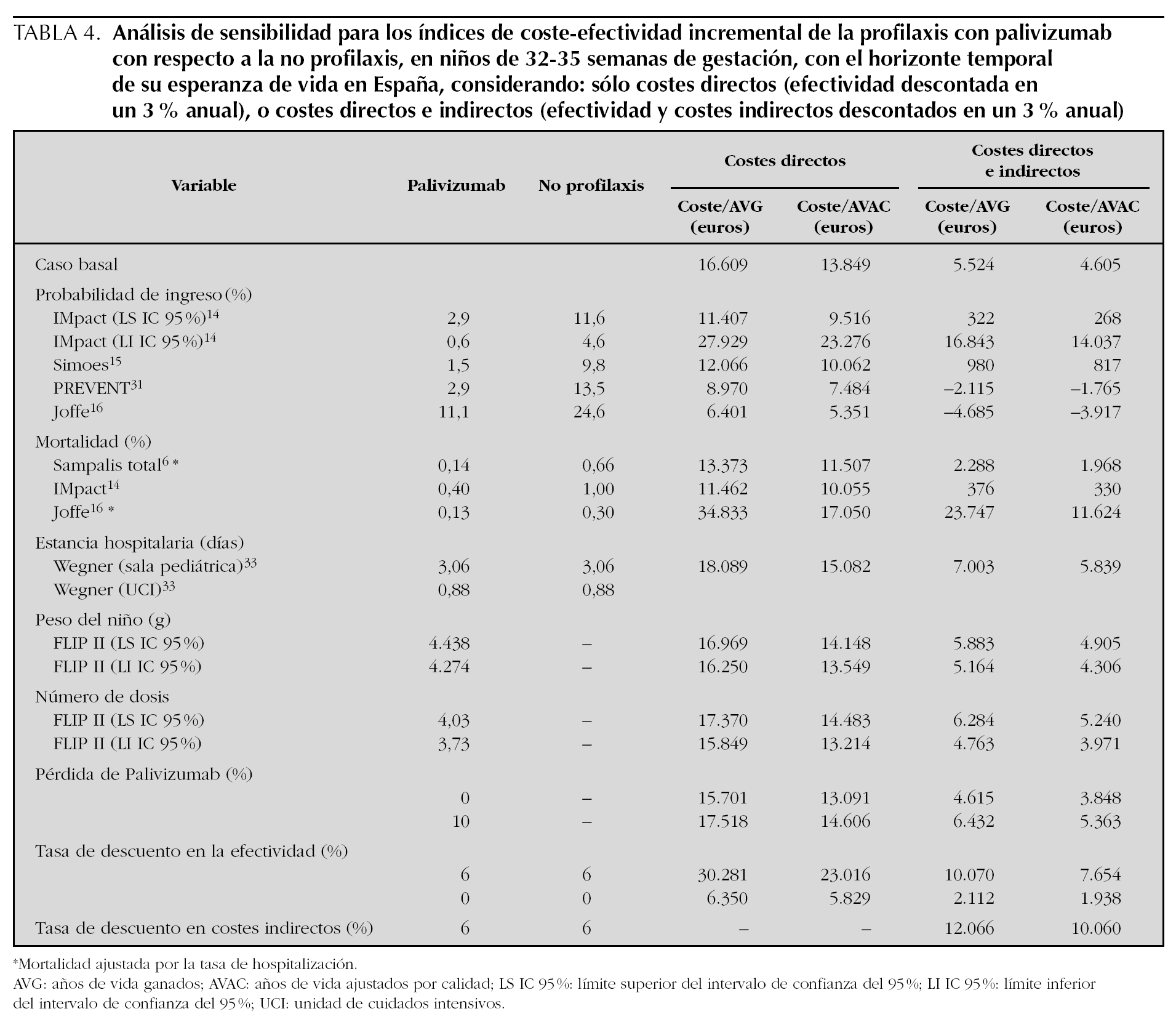
Los resultados sobre el análisis de coste-efectividad incremental (CEI) se presentan en la tabla 3, en la que se observa que para el caso basal considerando sólo los costes directos (perspectiva del SNS), el uso de palivizumab produce un CEI de 5.829 €/AVAC y de 6.350 €/AVG sin descontar la efectividad, y de 13.849 €/AVAC y 16.609 €/ AVG descontando la efectividad. La inclusión de costes indirectos (perspectiva social) produce un CEI de 1.938 y 4.605 €/AVAC antes y después de descontar la efectividad, respectivamente.
En el análisis de sensibilidad, considerando sólo los costes directos (tabla 4), en los 17 escenarios construidos modificando las variables relevantes, se obtienen indicadores de CEI que oscilan entre 5.351 €/AVAC en el caso más favorable (probabilidad de ingreso, según Joffe 16) y 23.276 €/AVAC en el caso más desfavorable (probabilidad de ingreso según el límite inferior (LI) del lC de IMpact 14). En ninguno de los escenarios se supera una relación CEI de 30.000 €/AVAC, que es la cifra considerada como el umbral de eficiencia para las intervenciones sanitarias en Europa y en España 34,35.
Considerando los costes directos e indirectos (tabla 4), en los 18 escenarios construidos con el análisis de sensibilidad, el cociente CEI oscila entre unos ahorros de 3.917 €/AVAC ganado en el caso más favorable (probabilidad de ingreso, según Joffe 16) a 14.037 €/AVAC en el caso más desfavorable (probabilidad de ingreso, según el LI IC 95 % del IMpact 14).
Según la curva de aceptabilidad (fig. 2), si el SNS está dispuesto a pagar más de 13.849 €/AVAC, la probabilidad de que su decisión sea coste-efectiva es mayor que la probabilidad de que no lo sea. Si está dispuesto a pagar 15.245 €, la probabilidad de que su decisión sea coste-efectiva es del 90 %, y por encima de 18.080 €, es del 100 %.
Discusión
En este estudio se ha utilizado un modelo de decisión analítico para evaluar la eficiencia, en términos de coste-efectividad, de administrar palivizumab en niños prematuros de EG 32 1-35 0 en España. Cuando se utiliza la perspectiva del SNS, que incluye el coste de la profilaxis y de la hospitalización para las infecciones por VRS, el uso de palivizumab produce un CEI de 13.849 €/AVAC después de descontar la efectividad en un 3,0 % anual. El análisis de sensibilidad confirma la robustez del modelo dado que, en 11 de los 18 escenarios construidos, la profilaxis con palivizumab es aún más coste-efectiva que en el caso basal. Los escenarios construidos en el análisis de sensibilidad intentan explorar el rango verosímil en el que puede oscilar el índice de CEI. Estos escenarios se han construido modificando las variables según hipótesis favorables y desfavorables en el rango de sus IC 95 %, cuando se disponía de ellos (p. ej., peso de los niños, probabilidad de ingresar) o de asunciones explícitas cuando no se dispone (p. ej., porcentaje de pérdida de palivizumab). El escenario más favorable (5.351 €/AVAC) se produce cuando se asume la mayor diferencia publicada 16 en la probabilidad de ingresar entre el grupo tratado con palivizumab y el grupo no tratado. El escenario más desfavorable (23.276 €/AVAC), se produce cuando se asume la menor diferencia en la probabilidad de ingresar entre el grupo tratado con palivizumab y el grupo no tratado, que en nuestro análisis la ofrece el LI IC 95 % del estudio IMpact 14. En ninguno de los escenarios, se superan los 30.000 €/AVAC que es el umbral de eficiencia recomendado en Europa 34 y en España 35.
Para ayudar a comprender el riesgo de las decisiones en escenarios de incertidumbre para el financiador, se ha construido la curva de aceptabilidad (fig. 2). Según esta curva, si el SNS acepta pagar más de 13.849 €/AVAC, es más probable que la decisión de financiar la inmunoprofilaxis sea rentable que la no financiación. Si acepta pagar 15.245 €/AVAC, la probabilidad de que su decisión sea coste-efectiva es del 90 %, y del 100 % por encima de 18.080 €/AVAC.
Es posible que el modelo infraestime la reducción de costes con palivizumab, dado que no se consideran los costes extrahospitalarios de los niños afectados de VRS, como visitas ambulatorias o los costes derivados de las sibilancias recurrentes, por no existir datos fidedignos sobre los costes de estas secuelas. A este hecho se añade que el coste en el que incurriese el SNS no se produciría por inmunizar a todos los niños con EG 32 1-35 0, sino sólo a aquellos que tienen dos o más FR, estimados entre un 30 y un 50 %.
Cuando se utiliza la perspectiva social, que incluye los costes directos e indirectos (pérdida de productividad futura del niño), se produce un CEI de 4.605 €/AVAC después de descontar la efectividad y de 1.938 €/AVAC sin descontar la efectividad. El análisis de sensibilidad demuestra que incluso, en algunos escenarios, los costes en que incurre el SNS son menores que el beneficio social que produce (costes indirectos evitados) y, por tanto, hay un ahorro social neto. Esto ocurre si se produjese una probabilidad de ingreso como las de los estudios de Joffe 16 o PREVENT 31, en los que el cociente CEI es negativo. Sin embargo, si se produjesen los ingresos estimados según el límite inferior del IC 95 % del ensayo IMpact, el CEI sería de 14.037 €/AVAC. Esto quiere decir que el modelo, para la perspectiva social, es muy sensible a cambios en las asunciones sobre la probabilidad de ingresar, que, con los estudios disponibles, oscilan en rangos amplios de incertidumbre.
Una limitación de este estudio es que no siempre existen datos españoles para alimentar el modelo. Por eso, se han buscado estimadores de variabilidad con los que se ha elaborado un análisis de sensibilidad para conocer el rango en que verosímilmente podría estar situada la realidad española. A su vez, una de las fortalezas del estudio es que ha utilizado una muestra real de 326 prematuros españoles con EG 32 1-35 0, sin EPC, ni cardiopatía, ni problemas inmunológicos, de los que se conoce su peso y el número de dosis que recibe cada uno en una estación de VRS (estudio FLIP II). Esto ha permitido estimar los costes y efectividad de la profilaxis en función del peso y de las dosis que ha recibido cada niño en España. Además, con los intervalos de confianza, se ha podido hacer un análisis de sensibilidad teniendo en cuenta la variabilidad en el peso y en las dosis de los niños. Este hecho resulta clave para mejorar nuestro conocimiento sobre la razón coste-efectividad de palivizumab, dado que hasta ahora apenas se había tenido en cuenta en los análisis. Finalmente, para este análisis económico, se han obtenido los días de estancia en planta y en UCI de una muestra española (estudio FLIP I) y se han utilizado costes españoles.
Aunque el diseño idóneo para este tipo de análisis sería un estudio de cohortes prospectivo con largo período de seguimiento y con evaluación económica, es poco probable que pueda ser realizado. Entre otras razones por motivos éticos, ya que existe la indicación de profilaxis y hay evidencia de beneficio en los pacientes. A falta de este tipo de diseño, el modelo analítico de decisión utilizado en este estudio ha permitido extrapolar los costes y consecuencias más allá de la duración de los ensayos clínicos existentes, y con una población real española.
Puede concluirse que, desde la perspectiva del financiador (el SNS), palivizumab es una alternativa coste-efectiva para la profilaxis de VRS en España en niños prematuros con EG de 32 1-35 0 semanas y dos o más FR, lo cual avala, desde un punto de vista farmacoeconómico, el uso de palivizumab en este grupo de niños tal y como la SEN recomienda.
*En este artículo utilizaremos el término "sibilancias recurrentes" por considerarlo, en este contexto, más apropiado que "asma", independientemente del término usado por los autores de los artículos citados.
*Tasas de ingreso hospitalario en prematuros, según IMpact. En este estudio, la EG no fue un predictor independiente de la hospitalización, por lo que en la EG 32 1-35 0, la reducción relativa del riesgo de ser hospitalizado es la misma que la de los prematuros.
**En el estudio publicado 7, el estimador de centralización para la estancia es la mediana. Para los propósitos de este estudio fue necesario calcular la media para asignar costes. Los cálculos se realizaron a partir de la base de datos de FLIP I (Factores Ligados a la Infección por VRS en Prematuros), analizada por los autores de este trabajo que fueron autores del estudio FLIP I.
Estudio promovido por la Sociedad Española de Neonatología y patrocinado por Abbott Laboratorios sin restricciones. Los autores que han participado son responsables independientes de la exactitud de los datos e integridad del análisis, así como de los juicios y opiniones expresados libremente en el manuscrito.
Correspondencia: Dr. P. Lázaro y de Mercado.
Técnicas Avanzadas de Investigación en Servicios de Salud.
Cambrils, 41-2. 28034 Madrid. España.
Correo electrónico: plazaro@taiss.com
Recibido en julio de 2006.
Aceptado para su publicación en julio de 2006.