la prevalencia de las nuevas infecciones por subtipos distintos de B del VIH-1 y recombinantes entre subtipos del VIH-1 se está incrementando en Europa occidental. Esto se debe principalmente a los movimientos migratorios desde zonas donde estas variantes genéticas son endémicas. Existe una amplia base teórica sobre la probablemente peor respuesta inmunovirológica de los subtipos distintos de B del VIH-1, pero esto no se ha demostrado en la experiencia clínica.
Objetivosidentificar las diferentes variantes genéticas del VIH-1 y su evolución clínica en una serie de niños infectados por VIH-1 de procedencia no española.
Pacientes y métodoestudio retrospectivo de las historias clínicas y caracterización del subtipo del VIH-1 en 12 pacientes infectados entre enero de 1988 y diciembre de 2006, menores de 18 años al diagnóstico y de procedencia no española.
Resultadosse aisló un subtipo del VIH-1 distinto de B en 5 (42%) niños: el recombinante CRF2_AG se aisló en 3 casos (Guinea Ecuatorial), el subtipo C en 1 (Guinea Ecuatorial) y el recombinante CRF13_cpx en 1 (India).
Discusióndebido al aumento creciente de la inmigración y de las adopciones internacionales, es previsible que asistamos a un incremento en el número de infecciones pediátricas por VIH-1 de subtipos distintos de B y recombinaciones del VIH-1. La caracterización del subtipo genético del VIH-1 debería realizarse dentro de la rutina clínica en niños infectados o expuestos al VIH-1 cuyo origen sea de áreas geográficas con alta prevalencia de subtipos distintos del B. Estudios con un mayor número de pacientes permitirían detectar, en caso de que las hubiera, diferencias en la evolución clínica, inmunológica y virológica.
The prevalence of HIV-1 non-B subtypes (HIV-NBS) is increasing in Europe, beause of emigration from countries where genetic variants are endemic. Although HIV-NBS could have a different clinical evolution and could respond differently to antiretrovirals (AR) than B-subtypes, these variant's response remain undocumented.
AimsTo identify HIV-1 genetic variants and to determine clinical evolution in a non-Spaniard children infected with HIV-1.
Patients and methodChildren with HIV-1 infection from endemic countries were tested for HIV-1 subtypes between 1-1-1988 and 31-12-2006. Twelve children less than 18 years old and born abroad were selected.
ResultsHIV-NBS were isolated in 5 children (42%): CRF2_AG recombinant in 3 cases (Equatorial Guinea), Subtyoe C in one (Equatorial Guinea) and CRF13_cpx in last one (India).
DiscussionBecause of the increasing frequency of patients with HIV-NBS and their unknown long-term evolution, all children from endemic countries should be tested for HIV subtypes. We believe new studies with more patients during longer times could reveal differences in these patient's clinical, immunological and virological evolution.
El virus de la inmunodeficiencia humana (VIH) pertenece al género de los lentivirus. Se han identificado dos tipos que infectan a humanos: VIH-1 y VIH-2. El primero es el más extendido y causa el 99% de los casos de infección en el mundo. El segundo, muy poco frecuente, tiene menor capacidad replicativa, es menos transmisible y presenta periodos de latencia clínica más largos1,2.
El VIH-1, según su homología genética, se ha clasificado en tres grandes grupos: M (main o principal), O (outlier) y N (no M no O). Los virus más prevalentes pertenecen al grupo M, y se subdividen en nueve subtipos denominados con letras (A, B, C, D, F, G, H, J y K). Los grupos O y N presentan baja prevalencia, y se encuentran principalmente en África subsahariana occidental1,3.
La secuencia genética en un mismo subtipo varía entre el 2 y el 20% de los 9.800 nucleótidos de cada una de las dos cadenas de ARN que constituyen en genoma viral. Incluso las cepas que infectan a un mismo individuo no son idénticas entre sí. Se ha observado que algunos aislados de VIH-1 no pueden ser considerados subtipos «puros», sino recombinantes entre dos o más subtipos, y pueden ser formas circulantes recombinantes (CRF), de las que hasta el momento se conoce al menos treinta y cuatro4, o formas recombinantes únicas (URF). Cada tipo de CRF presenta puntos comunes de recombinación concretos y se han identificado en más de tres pacientes no relacionados de forma epidemiológica. Los URF presentan puntos de recombinación entre subtipos diferentes de los observados en las CRF y se han encontrado principalmente en uno o dos individuos aislados1,3.
En España5, hasta diciembre de 2007, se han registrado 170 infecciones por VIH-2, 5 infecciones por grupo O y ninguna por grupo N. Por lo tanto, la mayoría de las cepas que circulan en España, al igual que en el resto del mundo, pertenecen al grupo M del VIH-1. El subtipo B continúa siendo el predominante en países industrializados, entre ellos los de Europa occidental y Norteamérica, pero también en África del norte. El resto de lo subtipos distintos del B y los recombinantes son mayoritarios en países en vías de desarrollo, sobre todo en África subsahariana, donde se acumula el mayor porcentaje de los más de 36 millones de infectados6.
La prevalencia de los subtipos distintos del B en países industrializados está aumentando1,7–11 debido a los movimientos migratorios. Se estima que actualmente entre el 5 y el 50% de las nuevas infecciones en Europa occidental están causadas por subtipos distintos del B, incluida la población nativa. Los porcentajes son mayores del 90% si sólo se considera a la población infectada procedente del área subsahariana. La presencia de estas cepas, por lo tanto, favorece el aumento de infecciones mixtas1,7,12 incluso en nuestro país13. En España, las cepas distintas de B más frecuentes son el subtipo G y el recombinante CRF02_AG, la mayoría en pacientes procedentes de África central y occidental14–16. No sólo existen recombinantes entre los subtipos del VIH-1, sino que también se han detectado entre VIH-1 y VIH-2, entre los grupos M y O del VIH-1 e incluso entre distintas CRF. Para el VIH-2 se han descrito ocho subtipos (A, B, C, D, E, F, G y H), de los que el subtipo A es el más frecuente y se encuentra sobre todo en África occidental3.
El subtipo del que se tiene más información es el B, tanto de sus características biológicas como de su respuesta al tratamiento antirretroviral de alta eficacia (TARGA). Los datos sobre los subtipos distintos del B, su transmisibilidad, el curso de la infección o la respuesta a TARGA son aún escasos; incluso los métodos de cuantificación de la viremia actuales podrían presentar falsos negativos a la hora de detectar los subtipos distintos del B o infravalorar los valores de carga viral17,18. Por lo tanto, la presencia de subtipos distintos del B tiene implicaciones no sólo epidemiológicas, sino también clínicas19.
Un punto más añadido al problema de los subtipos distintos del B es la dificultad del diagnóstico a escala molecular, requerido en niños menores de 18 meses, ya que se emplean técnicas de amplificación del material genético que no incluyen todos los primers; es decir, oligonucleótidos que sean capaces de amplificar todos estos subtipos distintos del B y recombinantes. Esto es especialmente importante en el diagnóstico de la infección por transmisión vertical de niños procedentes de zonas endémicas en estas variantes, donde la infección por el VIH-1 puede pasar inadvertida si sólo se utilizan los primers estándar de diagnóstico basados en secuencias que amplifican virus del subtipo B.
La variabilidad genética del VIH-1 podría influir en la respuesta al TARGA por diferentes mecanismos, pero los estudios de su impacto real en la práctica clínica son escasos1,20,21. En general, los estudios realizados en países donde los subtipos distintos del B son mayoritarios muestran una tasa de respuesta equivalente a la que se obtiene en los países desarrollados, al menos durante los primeros 12 meses de tratamiento1,20–24. No se ha encontrado evidencia de una peor respuesta virológica e inmunológica en los subtipos distintos del B, pese a la amplia base teórica que sustenta esta posibilidad. La peor evolución se apoyaría en el hecho de que estas variantes presentan de manera natural polimorfismos naturales o mutaciones en posiciones de la proteasa (PR) y de la retrotranscriptasa (RT) del virus, implicadas en resistencia secundaria a fármacos antirretrovirales utilizados actualmente en el tratamiento1,25–27. Es necesario recordar que polimorfismos naturales en la PR y la RT de virus del grupo O y del VIH-2 han hecho que estas variantes sean resistentes de manera natural a los fármacos antirretrovirales (AR) no análogos de los nucleósidos (NNRTI). Además, el VIH-2 es resistente al inhibidor de la fusión enfuvirtida por la presencia de polimorfismos naturales asociados a resistencia en la glucoproteína viral gp41. No hay evidencia clínica que nos pueda ayudar a determinar si existe un tratamiento óptimo para los distintos subtipos del VIH-1, pero hay numerosos trabajos que demuestran que ciertos polimorfismos naturales en algunos subtipos distintos del B se relacionan con las vías de resistencia seguidas, el tiempo de aparición de las mutaciones de resistencia, la susceptibilidad a fármacos in vitro, la interpretación de algoritmos de resistencia y el fitness o capacidad replicativa viral, entre otros12,28.
Los datos publicados de subtipos del VIH-1 en niños son anecdóticos29. En este documento presentamos la evolución clínica de los niños de procedencia no española que han sido diagnosticados de infección VIH-1 en nuestro centro durante los últimos 20 años, describiendo el curso de la infección y la respuesta virológica e inmunológica al TARGA.
Pacientes y métodoSe han revisado de forma retrospectiva las historias clínicas de todos los pacientes pediátricos diagnosticados de infección por el VIH-1 durante los últimos 20 años en nuestro hospital, centro de referencia en enfermedades infecciosas y medicina tropical de Madrid. En este trabajo se presentan los casos de los niños infectados por el VIH-1, menores de 18 años al diagnóstico y de procedencia no española, que se han seguido en nuestra unidad pediátrica de VIH desde enero de 1988 hasta diciembre de 2007.
Se han recogido los siguientes datos: fecha de diagnóstico, género, vía de transmisión, país de origen, subtipo del VIH-1, estadio de la infección, valores basales de linfocitos CD4 (CD4) y carga viral (CV), peso y talla, clínica asociada, tratamientos recibidos y respuesta virológica e inmunológica. Se han realizado revisiones clínicas y analíticas trimestrales.
Para la determinación de la variante del VIH-1, se procedió a la amplificación de la región codificante de la PR y la RT del gen pol del virus mediante una reacción en cadena de la polimerasa (PCR) nested a partir de muestras de plasma congeladas. La identificación del subtipo o recombinante se realizó por análisis filogenético empleando el método de Neighbor-Joining, tras alinear con el programa ClustalX las secuencias generadas con secuencias de referencia de la misma región viral pertenecientes a todos los subtipos distintos del B y a los principales CRF, y depositadas en la base de datos de secuencias del GenBank. La matriz de distancias fue estimada usando el modelo de Kimura incluido en el programa DNADIST, del paquete informático PHYLIP. La validez estadística del árbol se estimó realizando un análisis Bootstrap (1.000 repeticiones) del alineamiento múltiple.
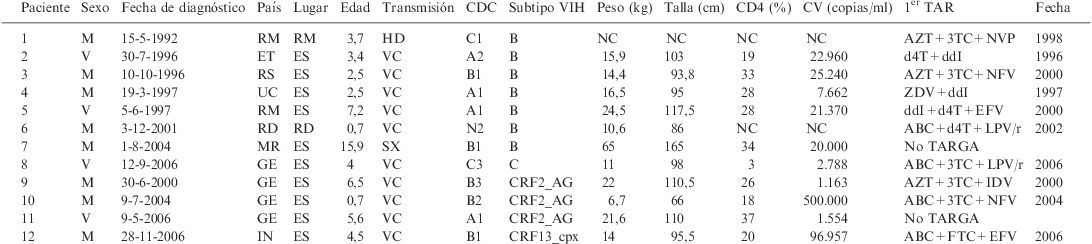
ResultadosUn total de 12 niños infectados por VIH-1 (4 varones y 8 mujeres) fueron incluidos en el estudio, con edades comprendidas entre 8 meses y 16 años. Todos fueron diagnosticados en España, excepto las pacientes 1 y 6, cuya infección por el VIH-1 fue identificada en Rumanía y en República Dominicana respectivamente. La vía de infección fue la transmisión vertical en todos los casos, excepto en 2 (pacientes 1 y 6), en quienes la transmisión fue parenteral y sexual respectivamente. Todos estos datos quedan reflejados en la tabla 1, así como el peso, la talla, el porcentaje de CD4 basal, la carga viral al diagnóstico, la fecha de inicio del tratamiento y los fármacos AR utilizados en el primer régimen.
Características epidemiológicas, clínicas y terapéuticas de los niños no españoles infectados por el VIH
| Paciente | Sexo | Fecha de diagnóstico | País | Lugar | Edad | Transmisión | CDC | Subtipo VIH | Peso (kg) | Talla (cm) | CD4 (%) | CV (copias/ml) | 1er TAR | Fecha |
| 1 | M | 15-5-1992 | RM | RM | 3,7 | HD | C1 | B | NC | NC | NC | NC | AZT+3TC+NVP | 1998 |
| 2 | V | 30-7-1996 | ET | ES | 3,4 | VC | A2 | B | 15,9 | 103 | 19 | 22.960 | d4T+ddI | 1996 |
| 3 | M | 10-10-1996 | RS | ES | 2,5 | VC | B1 | B | 14,4 | 93,8 | 33 | 25.240 | AZT+3TC+NFV | 2000 |
| 4 | M | 19-3-1997 | UC | ES | 2,5 | VC | A1 | B | 16,5 | 95 | 28 | 7.662 | ZDV+ddI | 1997 |
| 5 | V | 5-6-1997 | RM | ES | 7,2 | VC | A1 | B | 24,5 | 117,5 | 28 | 21.370 | ddI+d4T+EFV | 2000 |
| 6 | M | 3-12-2001 | RD | RD | 0,7 | VC | N2 | B | 10,6 | 86 | NC | NC | ABC+d4T+LPV/r | 2002 |
| 7 | M | 1-8-2004 | MR | ES | 15,9 | SX | B1 | B | 65 | 165 | 34 | 20.000 | No TARGA | |
| 8 | V | 12-9-2006 | GE | ES | 4 | VC | C3 | C | 11 | 98 | 3 | 2.788 | ABC+3TC+LPV/r | 2006 |
| 9 | M | 30-6-2000 | GE | ES | 6,5 | VC | B3 | CRF2_AG | 22 | 110,5 | 26 | 1.163 | AZT+3TC+IDV | 2000 |
| 10 | M | 9-7-2004 | GE | ES | 0,7 | VC | B2 | CRF2_AG | 6,7 | 66 | 18 | 500.000 | ABC+3TC+NFV | 2004 |
| 11 | V | 9-5-2006 | GE | ES | 5,6 | VC | A1 | CRF2_AG | 21,6 | 110 | 37 | 1.554 | No TARGA | |
| 12 | M | 28-11-2006 | IN | ES | 4,5 | VC | B1 | CRF13_cpx | 14 | 95,5 | 20 | 96.957 | ABC+FTC+EFV | 2006 |
1er TAR: primer tratamiento antirretroviral y fecha de inicio; CDC: clasificación del VIH según los Centers for Disease Control and Prevention; ET: Estonia; GE: Guinea Ecuatorial; HD: hemoderivados; IN: India; M: mujer; MR: Marruecos; NC: no conocido; RD: República Dominicana; RM: Rumanía; RS: Rusia; SX: sexual; UC: Ucrania; V: varón; VC: vertical.
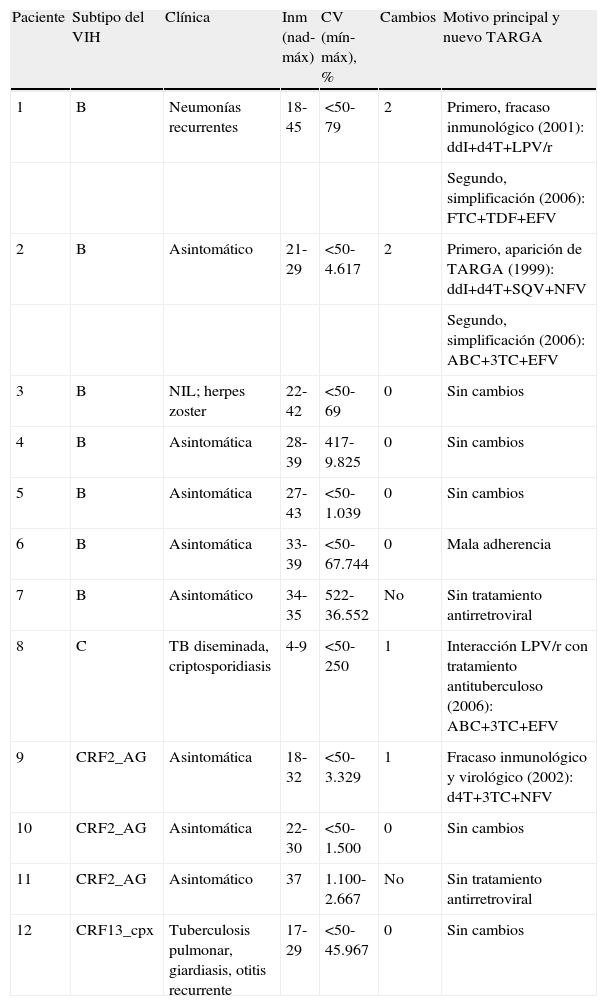
El subtipo B del VIH-1 se aisló en 7 (58%) casos, 5 de ellos nacidos en Europa (pacientes 1-5), 1 en República Dominicana (6) y otro en Marruecos (7). Cuatro niños (8-11) procedían de Guinea Ecuatorial; el primero de ellos estaba infectado por el subtipo C del VIH-1 y los 3 restantes, por el recombinante CRF02_AG. En la paciente 12, originaria de India, se aisló el recombiante CRF13_cpx. En la tabla 2 se recoge la evolución clínica, inmunológica (porcentajes de CD4 nadir y de CD4 máximos) y virológica (cargas virales mínimas y máximas) de los pacientes, así como los cambios terapéuticos desde el primer régimen AR.
Evolución clínica, inmunológica y virológica de los niños y las modificaciones terapéuticas
| Paciente | Subtipo del VIH | Clínica | Inm (nad-máx) | CV (mín-máx), % | Cambios | Motivo principal y nuevo TARGA |
| 1 | B | Neumonías recurrentes | 18-45 | <50-79 | 2 | Primero, fracaso inmunológico (2001): ddI+d4T+LPV/r |
| Segundo, simplificación (2006): FTC+TDF+EFV | ||||||
| 2 | B | Asintomático | 21-29 | <50-4.617 | 2 | Primero, aparición de TARGA (1999): ddI+d4T+SQV+NFV |
| Segundo, simplificación (2006): ABC+3TC+EFV | ||||||
| 3 | B | NIL; herpes zoster | 22-42 | <50-69 | 0 | Sin cambios |
| 4 | B | Asintomática | 28-39 | 417-9.825 | 0 | Sin cambios |
| 5 | B | Asintomática | 27-43 | <50-1.039 | 0 | Sin cambios |
| 6 | B | Asintomática | 33-39 | <50-67.744 | 0 | Mala adherencia |
| 7 | B | Asintomático | 34-35 | 522-36.552 | No | Sin tratamiento antirretroviral |
| 8 | C | TB diseminada, criptosporidiasis | 4-9 | <50-250 | 1 | Interacción LPV/r con tratamiento antituberculoso (2006): ABC+3TC+EFV |
| 9 | CRF2_AG | Asintomática | 18-32 | <50-3.329 | 1 | Fracaso inmunológico y virológico (2002): d4T+3TC+NFV |
| 10 | CRF2_AG | Asintomática | 22-30 | <50-1.500 | 0 | Sin cambios |
| 11 | CRF2_AG | Asintomático | 37 | 1.100-2.667 | No | Sin tratamiento antirretroviral |
| 12 | CRF13_cpx | Tuberculosis pulmonar, giardiasis, otitis recurrente | 17-29 | <50-45.967 | 0 | Sin cambios |
Cambios: cambios de terapia antirretroviral, sus motivos y nuevo tratamiento; Clínica: evolución clínica; CV (mín-máx): evolución virológica (carga viral mínima-máxima); Inm (nad-máx): evolución inmunológica (valor CD4 nadir-valor CD4 máximo); NIL: neumonía intesticial linfoide.
La evolución de los niños ha sido la siguiente:
- –
Subtipos B. Paciente 1: a su llegada a España en 2001 cambió TARGA por fracaso inmunológico y neumonías recurrentes. Desde entonces buena respuesta, simplificándose su regimen en 2006. Paciente 2: buena respuesta a la biterapia iniciada en 1996, sin conseguir supresión de la CV. En 1999 inicia TARGA y logra CV indetectable. Simplificación en 2006. Paciente 3: TARGA iniciado en 2000 con buena respuesta. Neumonía intersticial linfoide y herpes zoster diseminado durante los primeros meses, con CD4<25%. Paciente 4: biterapia iniciada en 1997, con buena respuesta. No se ha añadido ningún otro AR ante la buena evolución clínica. Paciente 5: TARGA iniciado en 2000, con buena respuesta. Paciente 6: TARGA iniciado en 2002, con buena respuesta, salvo fluctuaciones de la CV debidas a mala adherencia. No se han generado resistencias. Paciente 7: diagnosticada en 2004 a la edad de 15 años y 11 meses, se decidió no iniciar tratamiento. Se mantiene asintomática e inmunocompetente.
- –
Subtipos distintos del B puros en PR y RT. Paciente 8, subtipo C: al diagnóstico, tuberculosis diseminada y diarrea por Cryptosporidium, con cifras de CD4<10%. TARGA iniciado en 2006, con buena respuesta. A los 3 meses se modifica por interacción de LPV/r con rifampicina.
- –
Recombinantes CRF. Paciente 9, recombinante CRF02_AG: TARGA iniciado en 2000, con buena respuesta. Cambio en 2002 por desarrollo de resistencias y fracaso inmunovirológico sin repercusión clínica. Paciente 10, recombinante CRF02_AG: TARGA iniciado en 2004, con buena respuesta, salvo picos en las CV pese a buena adherencia documentada. Paciente 11, recombinante CRF02_AG: diagnosticado en 2006 a la edad de 5 años y 7 meses, se decidió no iniciar tratamiento. Se mantiene asintomático e inmunocompetente. Paciente 12, recombinante CRF13_cpx: al diagnóstico, tuberculosis pulmonar y otitis medias recurrentes. TARGA iniciado en 2006, con buena respuesta.
La aparición de resistencias al TARGA es un fenómeno frecuente en niños, que hace aún más complicado el manejo de la infección por VIH. Son escasos los trabajos que evalúan las resistencias en pacientes pediátricos y contribuyen a seleccionar los regímenes de AR óptimos30. El subtipo del VIH-1 puede influir en la respuesta al TARGA1,31 y en el posible desarrollo posterior y más rápido de resistencias, incluso por vías distintas6,32,33, sobre todo por la selección de regímenes subóptimos. Las formas en las que la variabilidad genética puede influir en la respuesta al TARGA son múltiples. Sin embargo, los estudios de su impacto real en la práctica clínica son escasos y presentan limitaciones1,20,21, y no hay ninguna evidencia que pueda ayudar a determinar si existe un tratamiento óptimo para los distintos subtipos del VIH-1. Sólo algunos trabajos muestran diferencias en la respuesta inmunológica y/o virológica tras el TARGA en pacientes infectados por subtipos distintos del B34,35.
Los grandes programas de tratamientos AR en países del tercer mundo, especialmente en África, donde los subtipos distintos del B y recombinantes son mayoritarios, muestran tasas de respuesta inmunológica y virológica equivalentes a las de países desarrollados, al menos durante los primeros 12 meses de tratamiento, y no se ha encontrado evidencia de peor respuesta en los subtipos distintos del B1,20,36 ni tampoco entre las diferentes etnias21. Tampoco hay evidencia de que los subtipos distintos del B seleccionen mutaciones primarias distintas de los B20, pero sí es más frecuente la existencia de polimorfismos y mutaciones secundarias en subtipos distintos del B y recombinantes CRF, aunque el papel de estas mutaciones en la respuesta al tratamiento no está del todo claro. Se desconoce si la eficacia del tratamiento AR será la misma a largo plazo en pacientes infectados por subtipos distintos del B, ya que los estudios actualmente publicados suelen valorar la respuesta a 1 o 2 años, pero no en periodos largos.
Entre las mutaciones secundarias, se ha encontrado una mayor frecuencia de polimorfismos naturales en la PR de los subtipos distintos del B y CRF que teóricamente podrían tener impacto en un tratamiento con IDV, NFV, ATV y RTV, mientras que en subtipos B estos polimorfismos influirían más en tratamientos con SQV y LPV/r25. En nuestra serie, la terapia con IDV fracasó en la paciente 9, con genotipo CRF02_AG, pero la respuesta a NFV fue positiva, al igual que en el caso 10, con el mismo genotipo.
De los 2 pacientes con subtipo B que recibieron terapia con LPV/r, el paciente 1 mostró buena respuesta inmunovirológica y en el 6 la respuesta clínica e inmunológica fue buena, pero la CV no se hizo indetectable, probablemente por falta de adherencia. En cuanto a la RT, en el subtipo C también existen de manera natural mutaciones que podrían afectar a la susceptibilidad frente a los NNRTI33. Sin embargo, el paciente 8, infectado por subtipo C en pol, no presentó ninguna incidencia desde 2006, cuando se cambió LPV/r por EFV.
En los estudios de sensibilidad in vitro, la mayoría de las cepas con subtipos distintos del B son igualmente susceptibles a AR que las del subtipo B25,26. Según algunas publicaciones, cepas CRF02_AG podrían tener una susceptibilidad disminuida a NFV y LPV37, mientras otros estudios mostrarían todo lo contrario, un aumento de la susceptibilidad38. En nuestra práctica clínica no hemos objetivado disminución ni aumento de la sensibilidad del subtipo CRF02_AG al NFV. El subtipo C parece generar con mayor rapidez resistencia a nuevos fármacos AR como el TDF32, pero este AR no fue probado en el paciente 9. De momento tampoco hay evidencia de que los posibles cambios de susceptibilidad tengan impacto en la respuesta al tratamiento AR.
En lo que respecta al recombinante CRF13_cpx, se trata de otro ejemplo más de la enorme variabilidad genética y la complejidad del VIH-1. Su estructura es un mosaico derivado de los subtipos A1, G, J y CRF01_AE39 y fue descrito por primera vez en 2002 en Camerún40. Pese a la complejidad de esta CRF y los polimorfismos naturales asociados a resistencia que podría presentar, en nuestro caso 12 la respuesta al tratamiento con ABC, FTC y EFV ha sido excelente.
Con el aumento creciente de la inmigración y de adopciones internacionales, es previsible que asistamos a un incremento en el número de infecciones VIH-1 pediátricas por subtipos distintos del B y recombiantes del VIH-1. Un 42% de los niños infectados por VIH-1 no españoles presentaron subtipo distinto del B o recombinante. Esta cifra aumenta hasta un 80% si sólo consideramos a los niños africanos, en quienes el recombinante CRF2_AG es el más frecuente. Sin embargo, en Europa todos los casos presentaron subtipo B del VIH-1.
Aunque parece que la respuesta al tratamiento AR no se ha visto disminuida por el aumento en la complejidad de las secuencias genéticas del VIH-1, la mayoría de los estudios actuales están enfocados al diagnóstico y el tratamiento de infecciones por el subtipo B. Por ello la sospecha de infección por subtipos distintos del B y recombinantes entre subtipos del VIH-1 debe mantenerse con todos los niños que procedan de zonas endémicas en estas variantes y pertenecientes a colectivos de riesgo o que presenten clínica compatible. Es probable que, con los métodos de diagnóstico genético del VIH-1 disponibles, algunas nuevas cepas recombinantes pasen inadvertidas. La variabilidad genética del VIH-1 no parece que vaya a remitir y seguirán apareciendo nuevos virus recombinantes entre subtipos que hacen muy poco probable el diseño de una vacuna efectiva durante los próximos años. De hecho, la prevalencia de infecciones por virus recombinantes está aumentando en la pandemia, llegando a ser de más del 70% entre todos los subtipos distintos del B caracterizados en adultos en nuestro hospital desde 2000 (datos aún no publicados). Por lo tanto, no sólo deberemos tener un alto índice de sospecha clínica para el diagnóstico de infección por el VIH-1 en los niños procedentes de zonas endémicas en los subtipos distintos del B, sino también plantear un diseño del régimen terapéutico riguroso e individualizado para cada niño. Consideramos que la caracterización del subtipo en niños no españoles infectados por el VIH-1 debería realizarse dentro de la rutina clínica, para valorar la evolución clínica, inmunológica y virológica y la posibilidad de aparición de nuevos patrones de resistencias.