El citomegalovirus (CMV) es principal virus causante de infecciones congénitas y posnatales en la población pediátrica. El objetivo de este estudio es evaluar la utilidad de una PCR cuantitativa en tiempo real en el diagnóstico de estas infecciones utilizando la orina como única muestra.
Pacientes y métodosSe estudiaron todas aquellas muestras de orina de recién nacidos (< 7 días) con sospecha de infección congénita y las orinas de pacientes con sospecha de infección posnatal (orina al nacer negativa). Las orinas se han estudiado de forma simultánea mediante cultivo celular, PCR cualitativa (PCRc) y PCR cuantitativa en tiempo real (PCRq).
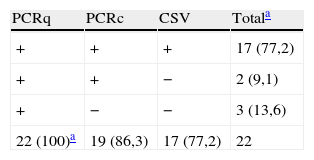
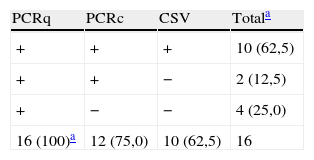
ResultadosSe han analizado 332 orinas (270 para descartar infección congénita y 62 infección posnatal). De las primeras 22, fueron positivas en la PCRq, 19 en la PCRc y 17 en el cultivo. Al comparar el cultivo con el resto de técnicas, la PCRq presentó una sensibilidad del 100%. Si se utiliza la PCRq como referencia, el cultivo presentó una sensibilidad del 77,2% y la PCRc del 86,3%. En los casos de infección posnatal, la PCRq detectó 16 positivas, la PCRc 12 y el cultivo celular 10 orinas como positivas. Las orinas presentaron unas cargas virales que oscilaban entre 2.178 y 116.641 copias/ml.
ConclusionesLa técnica de amplificación genómica PCRq en tiempo real se ha mostrado más sensible que las otras técnicas analizadas. Esta técnica debería ser considerada como de referencia (gold standard), dejando al cultivo celular como técnica secundaria. El bajo coste y la automatización de la PCRq permitirían realizar el cribado de infección por CMV a grandes poblaciones neonatales y posnatales.
Cytomegalovirus (CMV) is the main virus causing congenital and postnatal infections in the pediatric population. The aim of this study is to evaluate the usefulness of a quantitative real-time PCR in the diagnosis of these infections using urine as a single sample.
Patients and methodsWe studied all the urine samples of newborns (< 7 days) with suspected congenital infection, and urine of patients with suspected postnatal infection (urine negative at birth). Urines were simultaneously studied by cell culture, qualitative PCR (PCRc), and quantitative real-time PCR (PCRq).
ResultsWe analyzed 332 urine samples (270 to rule out congenital infection and 62 postnatal infections). Of the first, 22 were positive in the PCRq, 19 in the PCRc, and 17 in the culture. PCRq had a sensitivity of 100%, on comparing the culture with the rest of the techniques. Using the PCRq as a reference method, culture had a sensitivity of 77.2%, and PCRc 86.3%. In cases of postnatal infection, PCRq detected 16 positive urines, the PCRq 12, and the cell culture 10. The urines showed viral loads ranging from 2,178 to 116,641 copies/ml.
ConclusionsThe genomic amplification technique PCRq in real time was more sensitive than the other techniques evaluated. This technique should be considered as a reference (gold standard), leaving the cell culture as a second diagnostic level. The low cost and the automation of PCRq would enable the screening for CMV infection in large neonatal and postnatal populations.
El citomegalovirus (CMV) sigue siendo en la actualidad el principal causante de infecciones congénitas. Su incidencia global oscila entre el 0,2-2% y depende de las condiciones sociosanitarias de cada zona o región1,2. La mayoría de las infecciones congénitas por CMV son asintomáticas al nacer y solo pueden diagnosticarse de forma activa analizando la presencia del virus en la orina de los primeros 7-10 días de vida1,3.
Tras el nacimiento, las primoinfecciones posnatales por CMV se producen generalmente por la transmisión del virus a través de la leche de las madres seropositivas (virolactia) o por las transfusiones sanguíneas no controladas para este virus4,5.
En ambas situaciones, el CMV puede dar lugar a una infección asintomática o bien presentar un cuadro clínico de enfermedad aguda (fiebre, leucopenia, esplenomegalia). Así mismo se ha demostrado que este tipo de infecciones pueden comportar un incremento en el riesgo de desarrollar secuelas neurosensoriales de tipo auditivo y retraso psicomotor4,6-9.
Como consecuencia de ello, se hace preciso realizar el diagnóstico etiológico específico lo antes posible para poder hacer un seguimiento exhaustivo de los pacientes con infección por CMV10. Además, en algunos estudios parece evidenciarse que la carga viral de CMV presente en la orina y/o sangre (plasma) es un marcador del riesgo relativo de desarrollar las secuelas neurológicas11.
Con el objetivo de estudiar la utilidad de 2 técnicas distintas, el cultivo celular, hasta ahora la técnica de referencia, y la amplificación genómica (PCR cualitativa y cuantitativa) se ha realizado un estudio prospectivo en el diagnóstico de infección congénita y postnatal por CMV en recién nacidos.
Pacientes y métodosSe ha realizado un estudio prospectivo sobre la utilidad de una PCR cuantitativa (PCRq) en tiempo real frente a una PCR cualitativa (PCRc) y el cultivo celular tipo shell-vial en el diagnóstico de infección congénita y primoinfección por CMV.
Las muestras para el diagnóstico de infección congénita por CMV fueron enviadas de diferentes hospitales y consistían exclusivamente en orinas. Del mismo modo, para el diagnóstico de primoinfección por CMV se utilizó una muestra de orina.
Se ha considerado como infección congénita por CMV su aislamiento o detección genómica en una orina procesada antes de los 7 días posnacimiento. Las primoinfecciones por CMV se consideraron cuando habiendo tenido una orina previamente negativa a CMV, se remitía otra orina cuando concurrían algunas circunstancias clínicas (fiebre, leucopenia, elevación transaminasas) o epidemiológicas (lactancia materna o transfusión sanguínea) compatibles con este tipo de infección.
Para el cultivo de orina frente al CMV, las muestras fueron inoculadas en 2 viales de la línea celular MRC-5 (Vircell, Granada) e incubadas 24 y 48 h. Tras este tiempo las monocapas fueron fijadas con metanol y teñidas mediante anticuerpos monoclones específicos frente al antígeno p72 del CMV (Biosoft, Irlanda). Fueron consideradas como positivas aquellas que presentaban una fluorescencia específica a nivel nuclear12,13.
Para la amplificación genómica se utilizaron 2 técnicas. La PCRc se realizó con 50μl de la muestra, mediante una técnica de amplificación nested múltiple (Real, Durviz, Granada) y posterior visualización en geles de agarosa. La PCRq se realizó con 700μl de la orina y con un sistema automatizado comercial (Abbott RealTime CMV, Alemania), que permite cuantificar la positividad de la muestra en copias de genoma/ml de muestra. En ambos casos, se siguieron escrupulosamente las exigencias técnicas de los sistemas comerciales.
ResultadosDurante el período de estudio se han analizado 332 muestras de orina. De ellas, 270 (81,3%) se remitieron de diferentes hospitales para descartar infección congénita por CMV y 62 (18,7%) para el diagnóstico de primoinfección por CMV. De las 270 orinas iniciales, 22 (8.1%) fueron positivas en la PCRq, 19 (7,1%) en la PCRc y 17 (6,2%) en el cultivo shell-vial. En los 5 casos de cultivo negativo en la orina, se solicitó una segunda muestra a las 48 h, que fue positiva en todos ellos.
Al comparar el cultivo shell-vial como técnica de referencia con la PCRq, en las muestras para el diagnóstico de infección congénita, esta ha presentado una sensibilidad del 100%, especificidad del 98%, valor predictivo positivo del 77,2% y valor predictivo negativo del 100%. Si se utiliza la PCRq como técnica de referencia, el cultivo shell-vial ha presentado una sensibilidad del 77,2%, especificidad del 100%, valor predictivo positivo del 100% y valor predictivo negativo del 98%. La PCRc, comparada con la PCRq, ha presentado una sensibilidad del 86,3%, especificidad del 100%, valor predictivo positivo del 100% y valor predictivo negativo del 98%. Los valores obtenidos al compararla con el cultivo shell-vial han sido del 100, el 99,2, el 89,4 y el 100%, respectivamente.
En las 62 orinas con sospecha de primoinfección, 16 (25,8%) fueron positivas en la PCRq, 12 (19,3%) en la PCRc y 10 (16,1%) en el cultivo celular. En los 6 casos con cultivo negativo, solo 4 orinas fueron positivas en la segunda muestra y 2 en la tercera muestra. En este tipo de muestras la sensibilidad fue del 100% para la PCRq, 75% para la PCRc y el 62,5% para el cultivo shell-vial.
En ambos tipos de situaciones, ninguna orina fue positiva a CMV y negativa en las PCR. En las tablas 1 y 2 se expresan los resultados comparativos obtenidos en los 2 grupos de muestras procesadas.
Las orinas positivas en la PCRq presentaron unas cargas virales que oscilaron entre 2.178 y 116.641 copias/ml. La carga viral de CMV en las orinas inicialmente negativas oscilaba entre 1.200 y 5.430 copias/ml. La carga viral de las orinas con PCRq positiva y PCRc negativa tenía todas cargas inferiores a 5.000 copias/ml.
DiscusiónLas infecciones congénitas por CMV son una entidad clínica no despreciable que se presenta en cerca del 1% de los recién nacidos sanos (excretores asintomáticos). Esta excreción urinaria es uno de los principales mecanismos de transmisión horizontal del CMV, que permite la pronta adquisición de esta infección1,2,4. A pesar de este porcentaje, la inmensa mayoría de los pacientes no muestran signos ni síntomas a lo largo de su vida; sin embargo, se calcula que entre el 5-15% de ellos podrían desarrollar alteraciones neurosensoriales y psicomotrices a largo plazo1,4.
Por todo ello, el diagnóstico de la infección congénita por CMV debería ser un objetivo básico de salud pública14. Hasta ahora el aislamiento del CMV en orina o saliva de los recién nacidos hasta los 7-10 días de vida era la técnica de referencia para este tipo de diagnóstico. Aunque esta técnica solo se aplica a los niños que nacen con algún tipo de sintomatología o bien presentan criterios de ingreso o mantenimiento hospitalario1,10,15.
En 2012, de Vries et al.16 realizaron un estudio multicéntrico para demostrar que la técnica de amplificación genómica-PCR en tiempo real era mas sensible que el clásico cultivo de orina para la detección del CMV. En este estudio, el cultivo detectó un 7,4% de orinas positivas frente al 8,2% de la PCR en tiempo real. Esto se traduce en 3 casos de infección congénita que no hubieran sido diagnosticados por el método clásico (cultivo celular).
En nuestro estudio, el cultivo celular permitió el diagnóstico de 17 (6,2%) pacientes con infección congénita y las técnicas moleculares de 19 (7,1%) para la PCRc y de 22 (8,1%) para la PCRq. Es decir, con la técnica molecular cuantitativa se diagnosticaron 5 casos más de infección congénita que no se detectaron mediante cultivo de orina. En estos 5 casos, se solicitó una segunda muestra de orina que fue remitida en un plazo de 2-5 días. En todas ellas el cultivo fue positivo, apoyando la positividad previa de la PCR.
A demás de la mayor sensibilidad demostrada de las técnicas moleculares, la orina como muestra presenta algunos problemas en el cultivo celular. En los recién nacidos no es infrecuente encontrar cristales, uratos y fosfatos en las orinas que repercuten negativamente sobre la viabilidad de la línea celular. Es decir, la toxicidad intrínseca de la muestra sobre el cultivo celular es obviada por las técnicas moleculares que realizan inicialmente un proceso de extracción de ácidos nucleicos que, generalmente, no se ve afectada por las características de la muestra12,13,15-17.
Como hemos podido comprobar en este estudio, no todas las técnicas de amplificación genómica muestran la misma sensibilidad analítica. La PCRc que utilizamos rutinariamente se basa en la amplificación y la detección por geles de agarosa. Por lo tanto, el resultado es la visualización de una banda de amplificación. Esta técnica es ligeramente subjetiva y precisa de una carga viral mínima para poder ser observada17,18. Por ello, no es extraño que 2 orinas positivas en la PCRq fueran negativas en la PCR cualitativa, ya que sus cargas virales estaban todas por debajo de 5.000 copias/ml, que podría ser (no tenemos datos demostrativos) el límite inferior de detección de la técnica PCRc en nuestro laboratorio.
Una de las ventajas de la PCRq es la cuantificación de la carga viral presente en la orina procesada. Existen algunos estudios que parecen indicar que su valor podría ser utilizado como marcador de posibles secuelas neurológicas o para identificar a los pacientes con mayor riesgo de enfermedad grave7,11. Aunque no existe todavía un punto de corte a partir del cual podamos identificar a este tipo de pacientes, si se podría realizar un seguimiento cuantitativo de ellos como parámetro evolutivo y de pronóstico. Por lo tanto, la cuantificación, si demostrada en plasma19, puede en el futuro ser una herramienta muy útil en este tipo de pacientes; por ejemplo, podría seleccionar a aquellos pacientes que se beneficiarían de un tratamiento precoz específico frente al CMV1,4. Así, Nijman et al.11 han demostrado que la carga viral de CMV en la orina de las infecciones posnatales (media de 1×105 copias/ml) es significativamente menor que la observada en la orina de los pacientes con infección congénita (media 8,5×106 copias/ml). En nuestro caso, no hemos podido confirmar estas diferencias, probablemente debido al bajo número de pacientes estudiados.
El diagnóstico de las infecciones posnatales por CMV utiliza generalmente la misma metodología que la congénita, es decir, el cultivo de orina como técnica de referencia13,16. Sin embargo, para este tipo de infecciones es preciso disponer del antecedente previo de una orina negativa que descarte una infección congénita asintomática1,4. La detección de CMV en una orina mas allá de los días 10-14 posnacimiento, sin otra negativa previa, no nos permite establecer el momento de la infección por CMV1,6. En nuestro estudio sobre las primoinfecciones posnatales por CMV, solo se analizó a aquellos pacientes que poseían como mínimo una orina negativa antes de los 10 días de vida.
De nuevo el cultivo celular ha mostrado una menor positividad que las técnicas moleculares, ya que solo detectó 10 (16,1%) pacientes con presencia del CMV en esta muestra. La PCRq detectó 16 (25,8%), lo cual implica que el cultivo presentó frente a esta técnica una sensibilidad del 62,5%. En los casos con PCR positiva y cultivo de orina negativo, se solicitó una nueva muestra de orina que permitió el aislamiento de CMV en todos estos casos previamente negativos. Así la no utilización de las técnicas moleculares no hubiera permitido este tipo de diagnóstico, al igual que en las infecciones congénitas, o lo hubiera retrasado si persistían las condiciones clínicas o epidemiológicas que lo sustentaban17.
La mayor sensibilidad de la PCRq utilizada en este estudio (20 copias/ml) permitiría su utilización en los programas de cribado de infección congénita por CMV. Tal y como han demostrado los estudios de Paixao et al.20,21, la utilización de la metodología de pooles de orinas (unas 20/determinación) permite la detección de estas infecciones con una sensibilidad del 100%. La agrupación de orinas disminuiría drásticamente los costes por determinación y el trabajo inherente a la manipulación de un gran número de muestras.
En definitiva, parece evidente que las técnicas de amplificación genómica, y en particular la PCRq, muestran una mayor sensibilidad en la detección de CMV en la orina pediátrica. Es muy posible que debamos empezar a utilizar esta técnica como método de referencia en este tipo de infección (tanto la congénita como la posnatal), dejando el cultivo celular como técnica de segunda línea. El incremento de la sensibilidad diagnóstica y el establecimiento de la carga viral en la orina, junto con un coste más bajo, parecen ser razones suficientes para realizar un amplio estudio definitivo que clarifique el empleo rutinario de esta técnica en las diferentes situaciones en las que queramos detectar la presencia del CMV en muestras pediátricas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.