En los últimos años está incrementándose el uso en niños de la ecografía clínica, entendida como la ecografía a pie de cama realizada por el clínico encargado de un paciente, para el estudio de la patología del pulmón, la pleura y del diafragma (EPPC), de manera análoga a los adultos que llevan más de una década desarrollándola, siendo la semiología ecográfica en pacientes adultos extrapolable de manera segura a la edad pediátrica. La falta de osificación de cartílagos costales y esternón, y la menor capa de tejido adiposo subcutáneo en los niños proporcionan una ventana acústica ideal1,2.
La radiografía de tórax tiene limitaciones, como mala calidad de imagen, artefactos, tiempo hasta su obtención y acúmulo de radiación ionizante. La TAC torácica, gold-standar para el diagnóstico de patología pulmonar, también tiene limitaciones evidentes, por su coste, falta de disponibilidad, mayor radiación y dificultad para el transporte del paciente fuera de la Unidad3. Por ello, la EPPC se perfila como la herramienta diagnóstica ideal en UCIP: rápida, no invasiva, en tiempo real, repetible y no radiante, alcanzando sensibilidades y especificidades muy similares a las de la TAC4,5.
Presentamos 5 casos clínicos de enfermedad común en UCIP en los que la EPPC fue útil como herramienta diagnóstica y modificó la estrategia terapéutica.
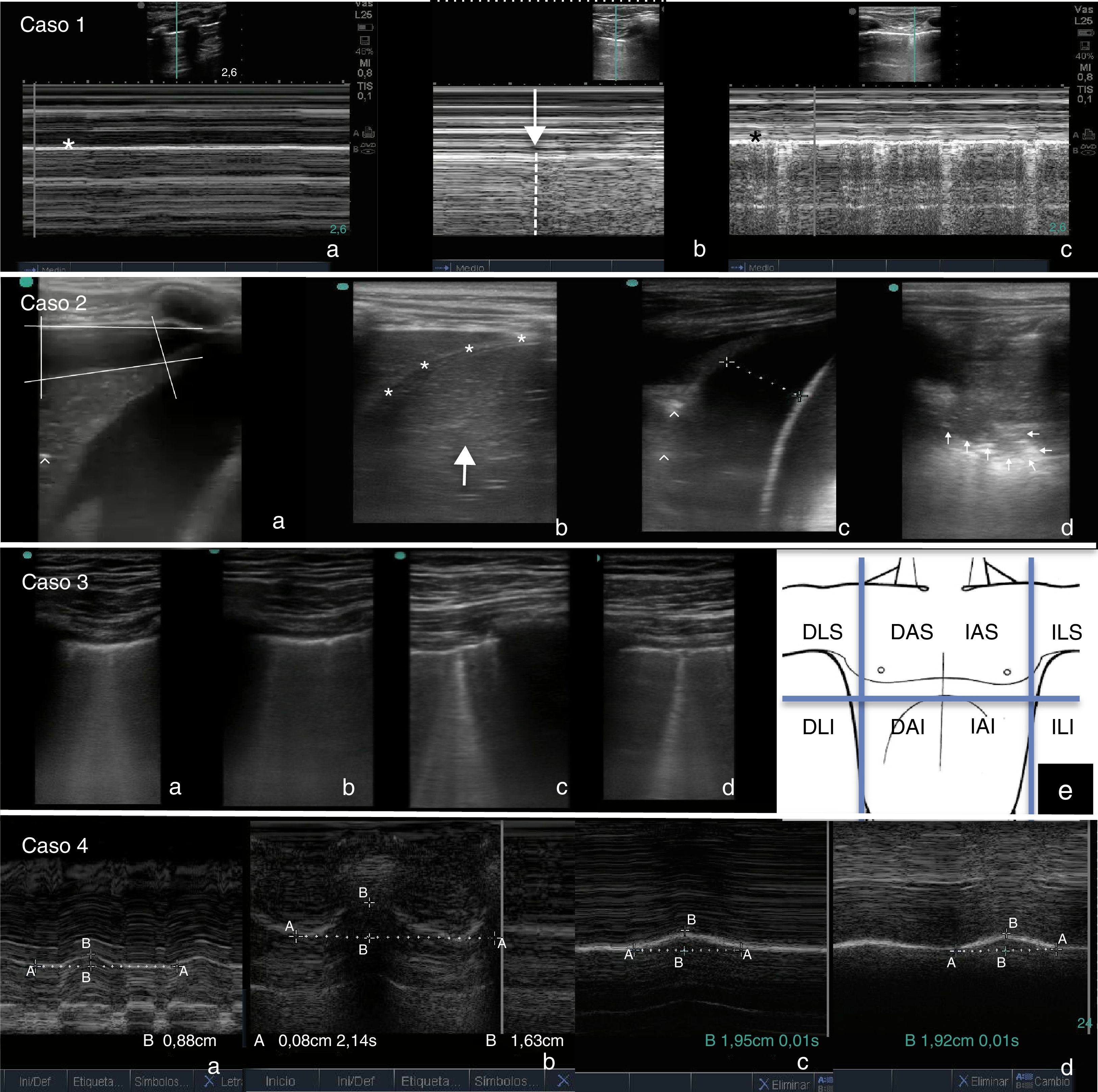
Caso 1Lactante de 2 meses ingresado por bronquiolitis. Tras intubación presenta dificultad para la oxigenación y ventilación, sospechándose un neumotórax secundario. EPPC: signos ecográficos de neumotórax derecho (ausencia de deslizamiento pulmonar, signo de la estratosfera, ausencia de líneas B, localización del punto pulmón). Tras inserción de tubo de drenaje pleural se objetiva resolución ecográfica del neumotórax. La EEPC evitó demoras diagnósticas y terapéuticas (fig. 1).
Caso 1: (a) Modo M. Signo de la estratosfera: patrón lineal a ambos lados de la línea pleural (*), expresión de la ausencia de deslizamiento pulmonar. (b) Modo M. Punto pulmón: transición entre pulmón normal (a la derecha, patrón lineal granular) y pulmón con neumotórax (a la izquierda, patrón lineal). (c) Modo M tras resolución del neumotórax. Signo de la orilla de mar: patrón mixto lineal y granular a cada lado de la línea pleural (*), expresión del deslizamiento pulmonar normal. Caso 2: (a) Derrame pleural derecho (signo del cuadrado) con parénquima pulmonar subyacente consolidado (signo «tissue-like») y con broncograma (focos hiperecogénicos [^]). (b) Resolución del derrame tras colocación de tubo torácico. Pulmón consolidado por encima del diafragma (*), difícilmente distinguible del hígado (flecha). (c) Hemitórax izquierdo: derrame pleural basal y pulmón subyacente consolidado (signo «tissue-like» y broncograma [^]). (d) Hemitórax izquierdo: consolidación del parénquima, objetivándose signo «tissue-like» y signo del desflecamiento (imagen de consolidación con límite inferior irregular expresión de la unión del parénquima consolidado con el pulmón normal [flechas]). Caso 3: líneas B coalescentes en (a) Hemitórax derecho región anterior y superior (AS). (b) Hemitórax derecho región anterior e inferior (AI). (c) Hemitórax izquierdo región AS. (d) Hemitórax izquierdo región AI. Diagnóstico de síndrome intersticial difuso bilateral. (e) Áreas ideales de exploración ecográfica para el diagnóstico de síndrome intersticial difuso. AS, AI, LS: lateral superior, LI: lateral inferior, D: derecho, I: izquierdo. Caso 4: Modo M (a) Diafragma derecho: excursión diafragmática máxima entre inspiración y espiración de 0,88cm (50% con respecto al contralateral). (b) Diafragma izquierdo: 1,63cm. (c y d) Diafragma derecho e izquierdo tras recuperación de la paresia (1,96 vs. 1,92cm).
Niño de 5 años con derrame pleural asociado a neumonía de todo el LID en el 5.° día de tratamiento antibiótico. EPPC: derrame pleural derecho (signo del cuadrado) y consolidación del parénquima pulmonar subyacente (signo «tissue-like» o hepatización y broncograma). Se coloca un tubo de drenaje pleural, saliendo líquido con características no complicadas. Ante estos hallazgos se realiza EPPC contralateral, objetivándose líquido pleural de escasa cuantía y consolidación del parénquima subyacente. Ante el diagnóstico mediante EPPC de neumonía bilateral, se solicita estudio de etiología atípica, siendo positivo para Mycoplasma pneumoniae y adenovirus. La EPPC fue de utilidad para guiar la toracocentesis, orientar la etiología y evidenciar consolidación no diagnosticada en radiología convencional (fig. 1).
Caso 3Varón de 17 años, con antecedente de tetralogía de Fallot intervenida, que ingresa desde planta por dificultad respiratoria y cianosis tras resección de pólipo nasal. Al ingreso presenta taquicardia leve, taquipnea, cianosis, tiraje sub-intercostal y supraesternal, y crepitantes gruesos. EPPC: patrón de líneas B coalescentes en regiones anteriores de ambos pulmones (síndrome intersticial difuso bilateral). Ante estos hallazgos se hace reevaluación de la taquicardia, diagnosticándose un flutter auricular con conducción 2:1. La EPPC permitió el diagnóstico de edema agudo de pulmón secundario a arritmia en enfermo con ventriculotomía previa y ECG de difícil interpretación (fig. 1).
Caso 4Niño de 7 años, con diagnóstico de anomalía de Ebstein severa, que ingresa tras cierre quirúrgico de CIA, plastia tricuspídea y Glenn bidireccional. Postoperatorio complicado con fracaso de extubación, precisando ventilación no invasiva de rescate. EPPC: disminución de la movilidad del diafragma derecho del 50% en comparación con el izquierdo (paresia frénica posquirúrgica). Ante la eventual necesidad de plicatura diafragmática por fisiología de corazón univentricular se realiza EPPC diaria, observándose mejoría progresiva hasta la normalización. La EPPC permitió monitorizar de forma inocua la función diafragmática y establecer una actitud quirúrgica conservadora (fig. 1).
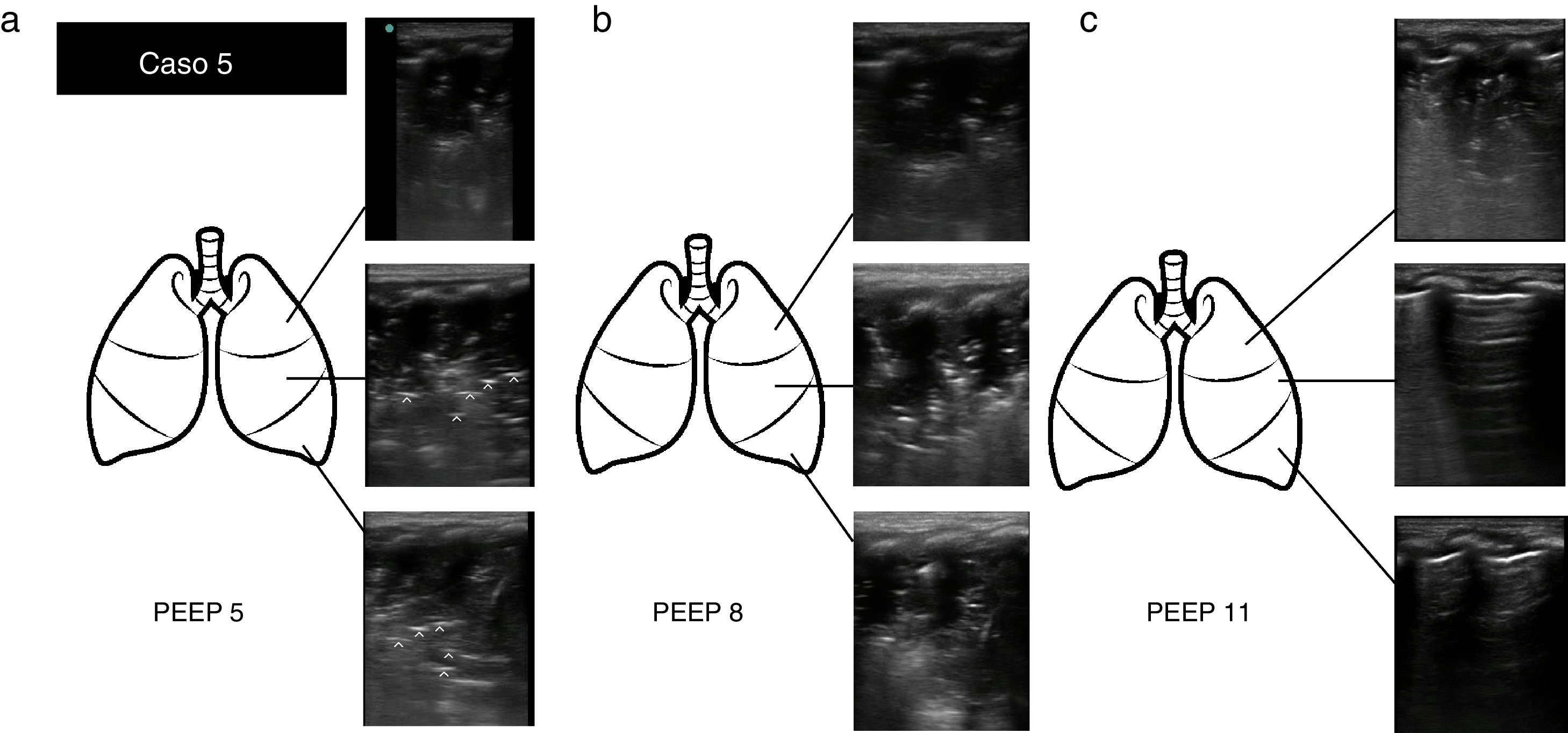
Caso 5Lactante de un mes ingresado por bronquiolitis, en ventilación mecánica. Presenta episodio brusco de desaturación, PIP alta (ventilación en modalidad volumétrica) e hipoventilación en hemitórax izquierdo. EPPC: imagen de consolidación de todo el pulmón izquierdo (parte superior, media y basal), compatible con atelectasia por el contexto clínico, y por la presencia de broncograma regular y paralelo. Se inician medidas de reclutamiento alveolar, con aumento de PEEP de 5 a 8. A la hora presenta mejoría clínica pero no ecográfica. Nuevo aumento de PEEP de 8 a 11. A la hora la EPPC objetiva una práctica resolución de la atelectasia, con signos ecográficos de pulmón normalmente aireado en parte media y basal, persistiendo consolidación solo en región apical. La EPPC permitió el diagnóstico rápido y diferencial de una complicación grave, además de guiar una maniobra complicada como es el reclutamiento alveolar (fig. 2).
Caso 5: (a) Exploración ecográfica con PEEP 5. Consolidación pulmonar, objetivándose signo «tissue-like» y broncograma regular y paralelo (líneas hiperecogénicas[^]) en región superior, media y lateral. (b) Exploración ecográfica con PEEP 8. Iguales hallazgos ecográficos. (c) Exploración ecográfica tras reclutamiento alveolar con PEEP 11. Signo de consolidación en región superior, con pulmón normalmente aireado en región media e inferior (se visualizan líneas A).
Nuestra serie evidencia la utilidad y seguridad de la EPPC realizada por el intensivista pediátrico, presentando un impacto diagnóstico y terapéutico en niños graves, condicionado a un entrenamiento estandarizado adecuado5.



![Caso 1: (a) Modo M. Signo de la estratosfera: patrón lineal a ambos lados de la línea pleural (*), expresión de la ausencia de deslizamiento pulmonar. (b) Modo M. Punto pulmón: transición entre pulmón normal (a la derecha, patrón lineal granular) y pulmón con neumotórax (a la izquierda, patrón lineal). (c) Modo M tras resolución del neumotórax. Signo de la orilla de mar: patrón mixto lineal y granular a cada lado de la línea pleural (*), expresión del deslizamiento pulmonar normal. Caso 2: (a) Derrame pleural derecho (signo del cuadrado) con parénquima pulmonar subyacente consolidado (signo «tissue-like») y con broncograma (focos hiperecogénicos [^]). (b) Resolución del derrame tras colocación de tubo torácico. Pulmón consolidado por encima del diafragma (*), difícilmente distinguible del hígado (flecha). (c) Hemitórax izquierdo: derrame pleural basal y pulmón subyacente consolidado (signo «tissue-like» y broncograma [^]). (d) Hemitórax izquierdo: consolidación del parénquima, objetivándose signo «tissue-like» y signo del desflecamiento (imagen de consolidación con límite inferior irregular expresión de la unión del parénquima consolidado con el pulmón normal [flechas]). Caso 3: líneas B coalescentes en (a) Hemitórax derecho región anterior y superior (AS). (b) Hemitórax derecho región anterior e inferior (AI). (c) Hemitórax izquierdo región AS. (d) Hemitórax izquierdo región AI. Diagnóstico de síndrome intersticial difuso bilateral. (e) Áreas ideales de exploración ecográfica para el diagnóstico de síndrome intersticial difuso. AS, AI, LS: lateral superior, LI: lateral inferior, D: derecho, I: izquierdo. Caso 4: Modo M (a) Diafragma derecho: excursión diafragmática máxima entre inspiración y espiración de 0,88cm (50% con respecto al contralateral). (b) Diafragma izquierdo: 1,63cm. (c y d) Diafragma derecho e izquierdo tras recuperación de la paresia (1,96 vs. 1,92cm). Caso 1: (a) Modo M. Signo de la estratosfera: patrón lineal a ambos lados de la línea pleural (*), expresión de la ausencia de deslizamiento pulmonar. (b) Modo M. Punto pulmón: transición entre pulmón normal (a la derecha, patrón lineal granular) y pulmón con neumotórax (a la izquierda, patrón lineal). (c) Modo M tras resolución del neumotórax. Signo de la orilla de mar: patrón mixto lineal y granular a cada lado de la línea pleural (*), expresión del deslizamiento pulmonar normal. Caso 2: (a) Derrame pleural derecho (signo del cuadrado) con parénquima pulmonar subyacente consolidado (signo «tissue-like») y con broncograma (focos hiperecogénicos [^]). (b) Resolución del derrame tras colocación de tubo torácico. Pulmón consolidado por encima del diafragma (*), difícilmente distinguible del hígado (flecha). (c) Hemitórax izquierdo: derrame pleural basal y pulmón subyacente consolidado (signo «tissue-like» y broncograma [^]). (d) Hemitórax izquierdo: consolidación del parénquima, objetivándose signo «tissue-like» y signo del desflecamiento (imagen de consolidación con límite inferior irregular expresión de la unión del parénquima consolidado con el pulmón normal [flechas]). Caso 3: líneas B coalescentes en (a) Hemitórax derecho región anterior y superior (AS). (b) Hemitórax derecho región anterior e inferior (AI). (c) Hemitórax izquierdo región AS. (d) Hemitórax izquierdo región AI. Diagnóstico de síndrome intersticial difuso bilateral. (e) Áreas ideales de exploración ecográfica para el diagnóstico de síndrome intersticial difuso. AS, AI, LS: lateral superior, LI: lateral inferior, D: derecho, I: izquierdo. Caso 4: Modo M (a) Diafragma derecho: excursión diafragmática máxima entre inspiración y espiración de 0,88cm (50% con respecto al contralateral). (b) Diafragma izquierdo: 1,63cm. (c y d) Diafragma derecho e izquierdo tras recuperación de la paresia (1,96 vs. 1,92cm).](https://static.elsevier.es/multimedia/16954033/0000008400000001/v5_201703300053/S1695403315002246/v5_201703300053/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w95erwEulN6Tmh1xJpRhO+VE=)
![Caso 5: (a) Exploración ecográfica con PEEP 5. Consolidación pulmonar, objetivándose signo «tissue-like» y broncograma regular y paralelo (líneas hiperecogénicas[^]) en región superior, media y lateral. (b) Exploración ecográfica con PEEP 8. Iguales hallazgos ecográficos. (c) Exploración ecográfica tras reclutamiento alveolar con PEEP 11. Signo de consolidación en región superior, con pulmón normalmente aireado en región media e inferior (se visualizan líneas A). Caso 5: (a) Exploración ecográfica con PEEP 5. Consolidación pulmonar, objetivándose signo «tissue-like» y broncograma regular y paralelo (líneas hiperecogénicas[^]) en región superior, media y lateral. (b) Exploración ecográfica con PEEP 8. Iguales hallazgos ecográficos. (c) Exploración ecográfica tras reclutamiento alveolar con PEEP 11. Signo de consolidación en región superior, con pulmón normalmente aireado en región media e inferior (se visualizan líneas A).](https://static.elsevier.es/multimedia/16954033/0000008400000001/v5_201703300053/S1695403315002246/v5_201703300053/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w95erwEulN6Tmh1xJpRhO+VE=)


